İçindekiler
1. Etimoloji ve kavramsal çerçeve
“Antikor” terimi, tarihsel olarak antikorp, anticorps biçimlerinden türemiştir. Fransızca anti (“karşı”) ve corps (“vücut, gövde”) birleşimi anticorps, “vücuda karşı” ya da daha teknik anlamıyla “vücuda zarar veren yapılara karşı oluşan madde” anlamını taşır. Bu terim, Türkçeye antikor olarak, Almancaya Antikörper, İngilizceye ise antibody (anti + body) şeklinde geçmiştir.
“İmmünoglobulin” ise daha betimleyici, biyokimyasal bir addır:
- İmmüno-: Bağışıklık sistemi ile ilişkili,
- Globulin: Serum protein fraksiyonlarından birini oluşturan, küresel yapıdaki (globüler) proteinler.
Dolayısıyla antikor, proteinin işlevine atıf yaparken; immünoglobulin, proteinin yapısal ve biyokimyasal niteliğini vurgular. Klinik pratikte ikisi çoğu zaman eş anlamlı kullanılır; ancak bağışıklık sistemindeki bazı immünoglobulinlerin antijen bağlama işlevi bozulmuş veya “işlevsiz” olabilir. Örneğin bir immünositomada üretilen monoklonal immünoglobulinler, yapısal olarak immünoglobulin olmakla birlikte tam işlevli “antikor” gibi davranmayabilir.
Serum protein elektroforezinde immünoglobulinlerin büyük kısmı γ (gamma) globulin fraksiyonunda yer alır. “Gamma globulin” teriminin kökeni de buradan gelir; immünoglobulinler, elektroforetik hareketliliklerine göre albumin, α, β ve γ globulinler arasında γ fraksiyonunda yoğun olarak bulunur.
2. Tarihsel perspektif: Antikor kavramının doğuşu
- ve 20. yüzyılın başlarında seroloji deneyleri, bazı serumların belirli toksinleri ya da bakterileri nötralize edebildiğini ortaya koydu. Paul Ehrlich’in “yan-zincir (side-chain) teorisi”, hücrelerin yüzeyindeki reseptörlerin (yan zincirlerin) antijenle etkileşime girip, ardından seruma salındığını öne sürerek antikor kavramının teorik temelini attı.
1950’ler ve 1960’larda
- Gerald Edelman ve
- Rodney Porter,
bağımsız çalışmalarla antikor molekülünün temel yapısını çözdüler: iki ağır zincir ve iki hafif zincirden oluşan, disülfit bağlarıyla bir arada tutulan Y-şeklinde bir glikoprotein. Bu yapının aydınlatılması, değişken (V) ve sabit (C) bölgelerin ayrımını ve antijen bağlama bölgelerinin konumunu netleştirdi.
1975’te Köhler ve Milstein, tek bir B hücresinden türetilen, özdeş antikor molekülleri üreten monoklonal antikor teknolojisini geliştirdiler. Bu buluş, antikorların sadece fizyolojik bir savunma aracı değil, aynı zamanda tanı ve tedavide güçlü biyoteknolojik araçlar olduğunu gösterdi.
3. Temel tanım: Antikor nedir?
Antikorlar, ya da biyokimyasal adıyla immünoglobulinler,
- B lenfositlerinden köken alan plazma hücreleri tarafından sentezlenen,
- glikoprotein yapısında,
- özgül olarak antijen adı verilen yabancı moleküllere bağlanabilen,
- adaptif (edinilmiş) bağışıklık sisteminin merkezi efektör molekülleridir.
Bu antijenler; bakteri, virüs, parazit, mantar, toksin ya da vücudun kendi yapıları (otoantijenler) olabilir. Antikorlar, antijene bağlanarak onu doğrudan nötralize eder, fagositozu kolaylaştırır, kompleman sistemini aktive eder ve hücresel efektör mekanizmaları (örneğin NK hücreleri aracılığıyla antikora bağlı hücre aracılı sitotoksisite) tetikler.
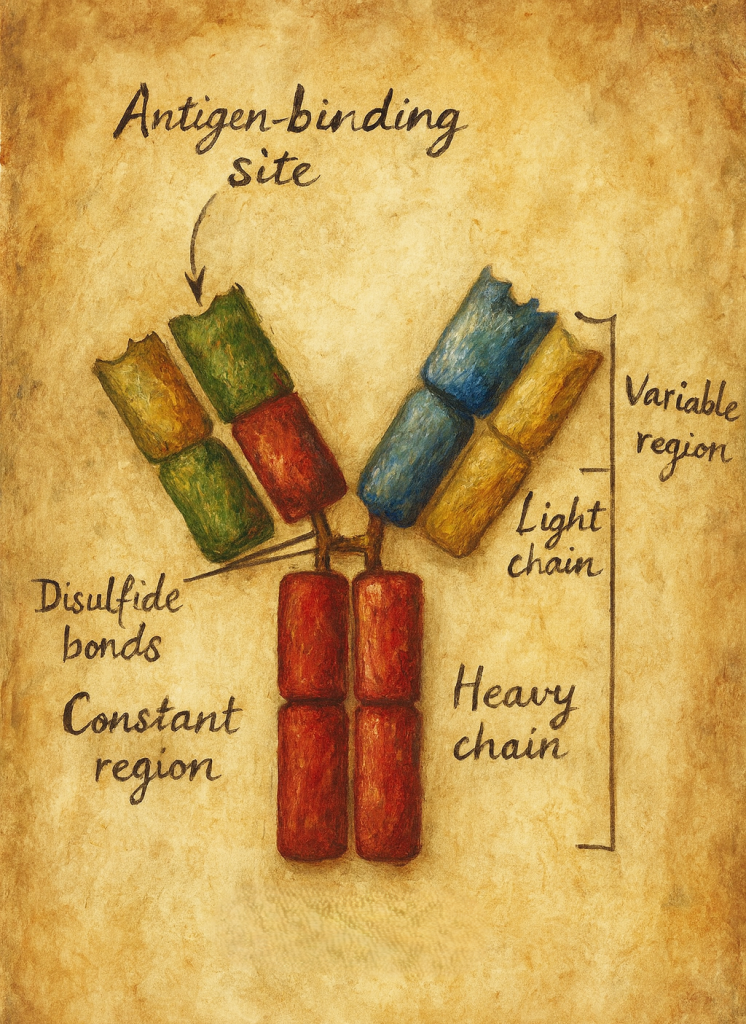
4. Moleküler yapı: Y-şeklindeki glikoprotein
4.1. Ağır ve hafif zincirler
Klasik bir antikor molekülü:
- İki özdeş ağır (heavy, H) zincir
- İki özdeş hafif (light, L) zincir
olmak üzere toplam dört polipeptit zincirinden oluşur. Bu zincirler:
- Disülfit bağları (–S–S–)
- Hidrofobik etkileşimler
- İyonik ve hidrojen bağları
ile bir arada tutulur ve antikora karakteristik Y şeklini kazandırır.
Her zincir:
- Bir değişken (V: variable) bölge,
- Bir veya daha fazla sabit (C: constant) bölge
içerir.
Hafif zincirler:
- 1 değişken (VL) + 1 sabit (CL) bölge
Ağır zincirler: - 1 değişken (VH) + 3 veya 4 sabit (CH1, CH2, CH3, bazı izotiplerde CH4) bölge içerir.
Her bir ağır zincirin değişken bölgesi yaklaşık 110 amino asit kadardır; hafif zincirin değişken ve sabit bölgeleri de benzer uzunluktadır. Ağır zincirin sabit bölgesi ise izotipe bağlı olarak yaklaşık 330–440 amino asit içerir.
4.2. Fab ve Fc bölgeleri
Antikor molekülü fonksiyonel olarak üç ana parçaya ayrılabilir:
- Fab (Fragment antigen-binding):
Y-şeklindeki molekülün “kolları“dır. Her Fab parçası:- Bir VH + bir CH1 (ağır zincirden)
- Bir VL + bir CL (hafif zincirden)
içerir. Antijen bağlama bölgesi (paratop), Fab fragmanının uç kısmında VH–VL çiftinin oluşturduğu bölgede yer alır.
- Fc (Fragment crystallizable):
Y-şeklindeki molekülün “gövdesi“dir. Ağır zincirlerin sabit bölgelerinden (CH2, CH3 ± CH4) oluşur. Fc kısmı,- Kompleman proteinlerine,
- Fç reseptörlerini taşıyan fagositlere, NK hücrelerine ve diğer bağışıklık hücrelerine
- Hinge (menteşe) bölgesi:
Fab ile Fc arasında yer alan, esneklik sağlayan kısa bir peptit segmenttir. Bu bölge sayesinde antikor, antijenlere farklı açılarda bağlanabilecek şekilde “kollarını” oynatabilir.
4.3. Değişken bölge ve özgüllük
Değişken bölgelerde, özellikle Tamamlayıcı Belirleyici Bölgeler (CDR1, CDR2, CDR3) olarak adlandırılan kısa segmentler, antijenin belirli bir epitopu ile yüksek özgüllükte bağlanmayı sağlar. Her antikor klonu için bu bölgelerin aminoasit dizilimi benzersizdir; bu da muazzam bir antikor çeşitliliği doğurur.
5. Hafif zincirler: κ ve λ ve klinik önemi
İnsanlarda iki tür hafif zincir bulunur:
- κ (kappa)
- λ (lambda)
Her antikor molekülü ya iki κ ya da iki λ hafif zincir taşır; aynı antikor içinde κ ve λ birlikte bulunmaz. Normal koşullarda kanda belirli bir κ/λ oranı (yaklaşık 1–2 civarında, laboratuvara göre değişen referans aralığıyla) gözlenir.
5.1. Serbest hafif zincirler ve monoklonal gammopatiler
Plazma hücrelerinin neoplastik çoğalmasına yol açan hastalıklarda:
- Multipl miyelom,
- Waldenström makroglobulinemisi,
- Bazı B hücreli lenfomalar,
tek bir klona ait immünoglobulin ya da hafif zincir aşırı üretilir. Bu durumda:
- Serum ve/veya idrarda serbest hafif zincirler (çoğunlukla “Bence Jones proteinleri” olarak) artar.
- Serum serbest hafif zincir testi, kappa ve lambda serbest hafif zincir düzeylerini ve κ/λ oranını ölçerek monoklonal hafif zincir üretimini ortaya koyar.
Bu artışlar böbreklerde birikerek:
- Hafif zincir birikim hastalığı,
- AL tipi amiloidoz (hafif zincir kaynaklı amiloid birikimi),
gibi durumlara yol açabilir ve böbrek, kalp gibi organlarda fonksiyon bozukluğu meydana getirebilir.
Burada altı çizilmesi gereken nokta şudur:
“Hafif zincir antikoru”, klasik anlamda ayrı bir antikor sınıfı değildir; ancak hafif zincirlerin serbest hale geçmesi, monoklonal proliferasyonun önemli bir biyobelirteci ve patojenik bir faktördür.
6. Nanobody’ler ve tek alanlı antikorlar: Kavram karmaşasını düzeltmek
Metinde geçen “hafif zincir antikorları” ifadesi, modern biyoteknoloji literatüründe sıklıkla tek alanlı antikorlar (single-domain antibodies) ve özellikle nanobody kavramıyla karışır.
Gerçekte:
- Nanobody’ler, devegillerde (lama, alpaka, deve) bulunan, yalnızca ağır zincir taşıyan antikorlardan (heavy-chain only antibodies) türetilen tek değişken alanlı (VHH) antikor fragmanlarıdır.
- Köpekbalıkları gibi bazı kıkırdaklı balıklarda da ağır zincir ağırlıklı özel antikor sınıfları (örneğin IgNAR) vardır.
Bu moleküller:
- Klasik IgG’den çok daha küçük,
- Tek bir değişken domen (tek “bağlanma modülü”) içeren,
- Doku penetrasyonu iyi,
- Rekombinant olarak kolay üretilebilen
özgül bağlanma molekülleridir. Bunlara literatürde “single-domain antibody”, “VHH antibody” veya popüler adıyla “nanobody” denir; ancak bunlar “hafif zincir” değil, ağır zincir kaynaklı domenlerdir.
Dolayısıyla:
- İnsandaki klasik antikorlar iki ağır + iki hafif zincir içerir.
- Nanobody’ler, belirli türlerde bulunan ağır zincirli antikorların tek değişken bölgesidir.
Bu ayrım, kavramsal netlik açısından önemlidir.
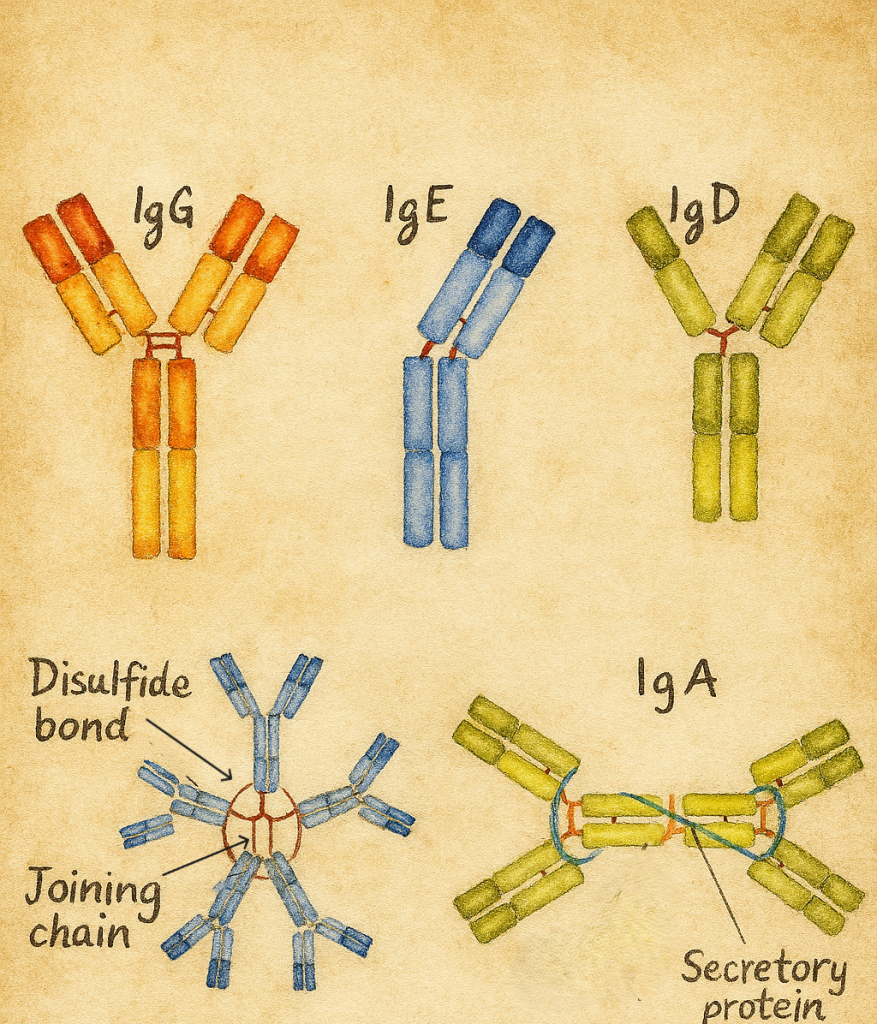
7. İmmünoglobulin sınıfları: IgG, IgA, IgM, IgD, IgE
İnsan immünoglobulinlerinin ağır zincir sabit regiõesundaki yapısal farklılıklar, beş ana izotipi oluşturur:
- IgG (γ ağır zincir)
- IgA (α ağır zincir)
- IgM (µ ağır zincir)
- IgD (δ ağır zincir)
- IgE (ε ağır zincir)
7.1. IgG
- Serumdaki en bol immünoglobulindir.
- Plasentadan aktif transportla fetüse geçen tek antikor sınıfıdır; böylece fetüse ve yenidoğana pasif bağışıklık sağlar.
- Opsonizasyon, nötralizasyon ve kompleman aktivasyonu gibi işlevlerde çok etkilidir.
- Birkaç alt sınıfa ayrılır (IgG1, IgG2, IgG3, IgG4); her birinin kompleman aktivasyonu, reseptör afinitesi ve antijen tipine göre farklı rolleri vardır.
7.2. IgA
- Serumda monomer, mukozal yüzeylerde (solunum, gastrointestinal, genitoüriner mukozalar) ve sekresyonlarda (tükürük, gözyaşı, anne sütü) çoğunlukla dimer formundadır.
- “Sekretuvar IgA”, mukozal epitelden geçerken eklenen sekretuvar bileşen sayesinde proteolitik yıkıma dirençlidir.
- Mukoza bariyerinde patojenlerin adezyonunu engelleyerek ilk savunma hattı rolü oynar.
- Anne sütüyle bebeğe geçen IgA, özellikle yenidoğanın gastrointestinal sistemini korur.
7.3. IgM
- B hücrelerinin yüzeyinde monomer olarak,
- Serumda ise çoğunlukla pentamer olarak bulunur.
- Birincil immün yanıtta ilk üretilen immünoglobulindir.
- Pentamerik yapısı sayesinde kompleman sistemini güçlü biçimde aktive eder.
7.4. IgD
- B hücrelerinin yüzeyinde, IgM ile birlikte reseptör olarak bulunur.
- Serum düzeyleri düşüktür.
- B hücresi aktivasyonunda ve tolerans mekanizmalarında rol oynadığı düşünülmektedir.
7.5. IgE
- Serumda konsantrasyonu düşük olmasına rağmen biyolojik etkisi son derece güçlüdür.
- Mast hücreleri ve bazofiller üzerindeki Fcε reseptörlerine bağlanır; antijenle çapraz bağlandığında bu hücrelerden histamin vb. mediyatörlerin salınmasına yol açar.
- Bu mekanizma,
- Alerjik reaksiyonların (tip I hipersensitivite)
- Helmint gibi makroparazitlere karşı savunmanın
temelini oluşturur.
8. Genetik ve moleküler temel: V(D)J rekombinasyonu ve çeşitlilik
Her antikorun özgüllüğünü belirleyen değişken bölge, somatik gen yeniden düzenlenmesi ile oluşur:
- Hafif zincir genleri: V (variable), J (joining) segmentleri
- Ağır zincir genleri: V, D (diversity), J segmentleri
B lenfosit gelişimi sırasında:
- RAG1 ve RAG2 enzimleri, V, D, J segmentlerini DNA düzeyinde kesip birleştirerek benzersiz bir V(D)J kombinasyonu oluşturur.
- Ek olarak, bağlantı bölgelerinde nükleotid eklenmesi/çıkarılması (junctional diversity) ile çeşitlilik katlanarak artar.
- Antijenle karşılaşma sonrası germinal merkezlerde somatik hipermutasyon ve afinite maturasyonu gerçekleşir; bu sayede antijenine daha sıkı bağlanan B klonları seçilir.
- Aynı V bölgesi, farklı ağır zincir sabit bölgeleri ile eşleşerek sınıf değişimi (class switch recombination) yapabilir (örneğin IgM → IgG, IgA, IgE). Bu süreç, AID (Activation-Induced Cytidine Deaminase) gibi enzimler aracılığıyla yürütülür.
Sonuçta tek bir organizma, teorik olarak milyonlarca farklı antikor özgüllüğü üretebilecek kapasiteye sahip olur.
9. Evrimsel bakış: Antikorların kökeni
Adaptif bağışıklık ve immünoglobulin benzeri reseptörler, özellikle çeneli omurgalılarda (gnathostomata) gelişmiştir.
- Bu grupta klasik V(D)J rekombinasyonuna dayalı immunoglobulin sistemi bulunur.
- Çenesiz omurgalılarda (agnatha) ise, immünoglobulin yerine “variable lymphocyte receptor (VLR)” adı verilen, farklı bir çeşitlilik mekanizmasına dayanan reseptörler geliştirilmiştir.
Devegiller ve kıkırdaklı balıklar gibi bazı türlerde ortaya çıkan:
- Yalnız ağır zincirli antikorlar,
- Özgün ağır zincir izotipleri (örneğin IgNAR),
immunoglobulin süper ailesinin evrimsel esnekliğini ve tekrar tekrar “yeniden keşfedilmiş” özgül antijen tanıma çözümlerini göstermektedir. Buna karşın, temel immunoglobulin domeni (Ig domain) mimarisi son derece korunmuş olup nöronal adezyon molekülleri gibi bağışıklık dışı proteinlerde de kullanılır.
10. B hücresi yanıtı: Üretim ve hafıza
10.1. Antijenle ilk karşılaşma
Bir antijen vücuda girdiğinde:
- Antijen, antijen sunan hücreler (dendritik hücreler, makrofajlar) tarafından işlenir ve MHC molekülleriyle T yardımcı hücrelere sunulur.
- Bu süreçte T bağımlı antijenler için B hücre aktivasyonu, T yardımcı hücrelerden gelen sitokinler ve kostimülasyonla güçlenir.
- Antijenle özgül B hücreleri, lenfoid organlarda (lenf nodu, dalak) aktive olur.
10.2. Plazma hücresi ve bellek B hücresi
Aktive olan B hücreleri:
- Kısa ömürlü veya uzun ömürlü plazma hücrelerine farklılaşarak büyük miktarda antikor üretir,
- Aynı zamanda bellek B hücreleri oluşturarak uzun süreli bağışıklığın temelini atar.
İlk antijen karşılaşmasında IgM ağırlıklı bir yanıt gözlenirken, daha sonraki yanıtlar:
- Daha hızlıdır,
- Afinite olarak daha güçlü antikorlardan oluşur,
- Genellikle IgG, IgA veya IgE izotipleri baskındır.
Bu fark, primer ve sekonder immün yanıt ayrımının temelini oluşturur.
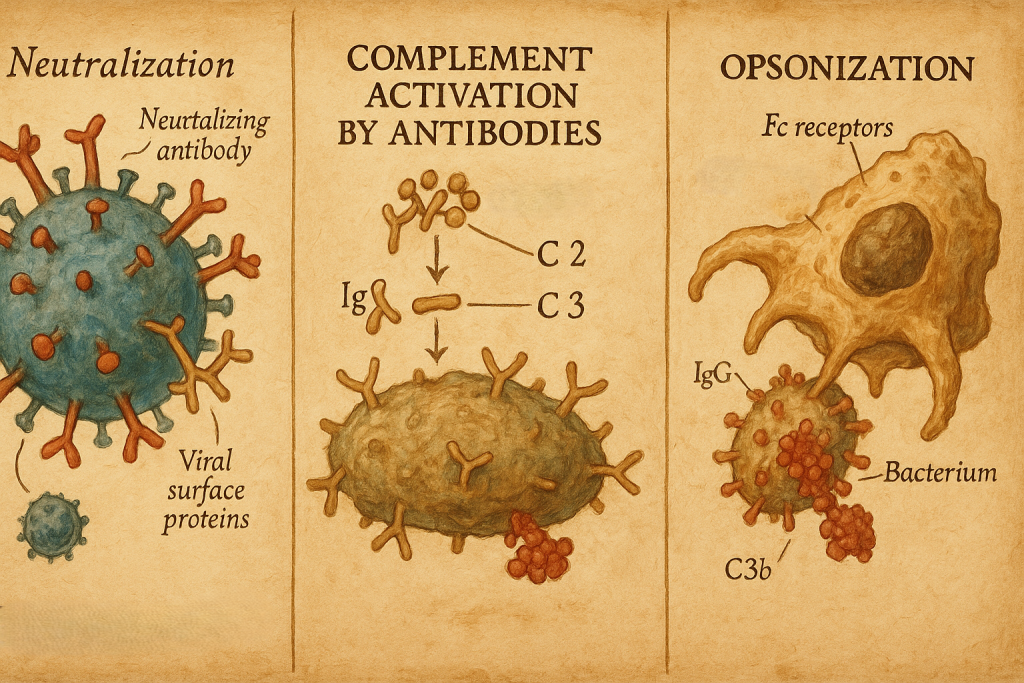
11. Antikorların biyolojik işlevleri
Antikorlar antijenlere bağlanarak bir dizi efektör mekanizmayı tetikler:
- Nötralizasyon
- Virüslerin hücre reseptörlerine bağlanmasını engeller,
- Bakteriyel toksinleri nötralize eder.
- Opsonizasyon
- Antikorla kaplanmış patojenler, makrofaj ve nötrofillerdeki Fc reseptörleri tarafından daha kolay tanınır ve fagosite edilir.
- Kompleman aktivasyonu
- Özellikle IgM ve bazı IgG alt tipleri, klasik kompleman yolunu aktive ederek:
- Patojenlerin lizisini,
- Opsonizasyonu,
- İnflamatuvar hücrelerin çekilmesini sağlar.
- Özellikle IgM ve bazı IgG alt tipleri, klasik kompleman yolunu aktive ederek:
- Antikora bağlı hücresel sitotoksisite (ADCC)
- NK hücreleri ve bazı efektör hücreler, hedef hücre üzerindeki antikora bağlanarak sitotoksik yanıt oluşturur.
- İmmün kompleks oluşumu
- Çözünür antijenlerle kompleks oluşturan antikorlar, antijenlerin uzaklaştırılmasını kolaylaştırır; ancak fazlalığı patolojik kompleks birikimlerine (örneğin bazı vaskülit ve glomerülonefritlerde) yol açabilir.
12. Klinik uygulamalar ve laboratuvar değerlendirmeleri
12.1. Serum protein elektroforezi ve immünoglobulin düzeyleri
- Serum protein elektroforezi, albumin ile α, β, γ globulin fraksiyonlarını ayırt etmeye yarar.
- γ fraksiyonundaki artış genellikle immünoglobulin artışını (poli- veya monoklonal gammopati) düşündürür.
- Toplam IgG, IgA, IgM düzeyleri, bağışıklık fonksiyonu, immün yetmezlikler ve kronik inflamatuvar durumların değerlendirilmesinde kullanılır.
12.2. Monoklonal gammopatiler
- Multipl miyelom,
- MGUS (Monoclonal Gammopathy of Undetermined Significance),
- Waldenström makroglobulinemisi gibi hastalıklarda tek klonal bir immünoglobulin veya hafif zincir artışı söz konusudur.
- Serum ve idrarda immünofiksasyon elektroforezi, serbest hafif zincir analizi ve κ/λ oranı tanı ve takibi yönlendirir.
12.3. İmmün yetmezlikler
Bazı primer immün yetmezliklerde:
- Toplam immünoglobulin düzeyleri düşük olabilir (örneğin X’e bağlı agammaglobulinemi, yaygın değişken immün yetmezlik – CVID).
- Selektif IgA eksikliği, toplumda en sık görülen primer immün yetmezliklerden biridir ve mukozal savunma defektine yol açar.
Bu hastalarda tekrarlayan enfeksiyonlar ve bazı otoimmün ya da allerjik tablolar sık görülür.
12.4. Otoimmün hastalıklar ve otoantikorlar
Antikorlar, bazen vücudun kendi yapılarını hedef alan otoantikorlar haline gelebilir:
- Romatoid faktör, anti-CCP,
- ANA, anti-dsDNA,
- Anti-TPO gibi otoantikorlar,
otoimmün hastalıkların tanısında önemli biyobelirteçlerdir.
12.5. Terapötik immünoglobulin ve monoklonal antikorlar
- İntravenöz immünoglobulin (IVIG) tedavisi, primer ve sekonder immün yetmezliklerde eksik antikor yanıtını desteklemek için kullanılır; ayrıca bazı otoimmün ve inflamatuvar hastalıklarda immün modülasyon amacıyla da uygulanır.
- Rekombinant monoklonal antikorlar, onkoloji (örneğin lenfomalar, solid tümörler), romatoloji (örneğin TNF inhibitörleri), nöroimmün hastalıklar ve enfeksiyon hastalıklarında hedefe yönelik tedavilerin merkezinde yer alır.
- Bispesifik antikorlar ve antikor-parça temelli ilaçlar (Fab fragmanları, nanobody’ler vb.), farmakokinetik ve hedefleme özellikleri açısından giderek daha stratejik araçlara dönüşmüştür.
13. Maternal-fetal ve neonatal bağışıklık
- IgG, plasentadaki Fc reseptörleri aracılığıyla anneden fetüse aktif olarak taşınır. Bu sayede fetüs, anne tarafından karşılaşılmış patojenlere karşı hazır antikorlarla doğar.
- Doğumdan sonra anne sütüyle geçen sekretuvar IgA, özellikle gastrointestinal mukozayı korur ve yenidoğanın enfeksiyonlara karşı savunmasını güçlendirir.
Bu mekanizmalar, bağışıklık sisteminin henüz tam olgunlaşmadığı erken yaşam döneminde pasif bağışıklığı sağlar.
14. Patolojik boyut: Alerji, immün yetmezlik ve amiloidoz
- Alerjik hastalıklarda, IgE aracılı mast hücre degranülasyonu, rinitten astıma ve anafilaksiye kadar geniş bir yelpazede klinik tablolara neden olur.
- İmmün yetmezliklerde, uygun immünoglobulin yanıtının olmaması tekrarlayan enfeksiyonlar ve bazı maligniteler için zemin hazırlar.
- Amiloidozda, özellikle hafif zincir kaynaklı AL amiloidoz, dokularda fibriller birikim oluşturarak kalp, böbrek ve periferik sinir sisteminde ağır hasara yol açabilir.
- İmmün kompleks hastalıkları, antijen–antikor komplekslerinin damar duvarları veya glomerüllerde birikmesi sonucu vaskülit ve glomerülonefrit gibi klinik tablolara yol açabilir.
Bu örnekler, antikorların yalnızca koruyucu değil, aynı zamanda patojenik roller de üstlenebileceğini gösterir.
Keşif
20. yüzyılın başında, Berlin’de çalışan genç bir patolog olan Paul Ehrlich, boyalarla deneyler yaparak hücreleri renklendirmeyi seviyordu. Bir yandan da zihninde giderek netleşen bir fikri vardı: Eğer bazı kimyasal maddeler belirli hücre yapılarına seçici olarak bağlanabiliyorsa, neden aynı prensip enfeksiyon etkenleri için de geçerli olmasın? Bu düşünce onu, daha sonra “antikor” ve “sihirli mermi (magic bullet)” kavramlarına götürecek olan yan-zincir teorisine hazırlıyordu.
Ehrlich, Metchnikoff ve bağışıklık biliminin doğuşu
Ehrlich, difteri ve tetanoz gibi hastalıklara karşı serum tedavileri üzerinde çalışan Emil von Behring ile aynı dönemde çalışıyordu. Behring’in “antitoksin” serumları klinikte hayat kurtarırken, Ehrlich bu antitoksinlerin hücre düzeyinde nasıl ortaya çıktığını anlamaya odaklandı. 1897 civarında formüle ettiği yan-zincir teorisi, hücre yüzeyinde “yan zincir” dediği reseptörlerin bulunduğunu, toksinlerin (antijenlerin) bu reseptörlere bağlandığını, hücrenin de kendini korumak için bu reseptörlerden fazladan üretip seruma saldığını öne sürüyordu. Bu seruma salınan reseptörler, bugün antikor dediğimiz moleküllerin kavramsal karşılığıydı.
Bu sırada, Rus kökenli zoolog Élie Metchnikoff, bütünüyle başka bir cepheden bağışıklık sorununa yaklaşıyordu. O, vücut savunmasının merkezine hücreleri –özellikle fagositleri– yerleştiren fagositik teoriyi savunuyordu. Deniz canlılarından böceklere kadar pek çok tür üzerinde yaptığı karşılaştırmalı çalışmalarla, fagositozun enfeksiyonla savaşta temel bir olay olduğunu gösteriyordu.
Bu iki bakış açısı –Ehrlich’in “humoral” antikor merkezli yaklaşımı ve Metchnikoff’un “hücresel” fagosit teorisi– o dönemde sert tartışmalara yol açmış olsa da, bugün biliyoruz ki her ikisi de doğrudur ve birbirini tamamlar: Hücreler antikor üretir, antikorlar ise sıvı fazda patojenleri nötralize eder ve fagositozu kolaylaştırır. 1908’de Nobel Fizyoloji veya Tıp Ödülünün Metchnikoff ve Ehrlich’e birlikte verilmesi, bağışıklığın bu iki yüzünün de bilimsel meşruiyet kazandığı anı simgeler.
Antikorun görünmeyen molekülden somut yapıya dönüşmesi
20. yüzyılın ilk yarısında antikorlar hâlâ “serumdaki görünmez koruyucu faktörler” olarak algılanıyordu. Karl Landsteiner, küçük kimyasal haptenlerle yaptığı deneylerle antikor özgüllüğünün inanılmaz inceliğini, neredeyse atom düzeyinde farkları seçebildiğini gösterdi. Michael Heidelberger ve Oswald Avery gibi araştırmacılar, antikorların gerçekten protein olduklarını nicel kimyasal analizlerle ortaya koydular.
1940’larda Arne Tiselius ve Elvin Kabat, serum proteinlerini elektroforez ile ayırdıklarında, antikorların büyük ölçüde gamma globulin fraksiyonunda yoğunlaştığını gösterdiler; “γ-globulin” ve “immünoglobulin” kavramlarının klinikte yerleşmesinde bu çalışmaların payı büyüktü.
Asıl büyük sıçrama ise 1950–1960’lı yıllarda geldi. Gerald Edelman ve Rodney Porter, farklı proteolitik enzimler ve kimyasal indirgeme yöntemleri kullanarak antikor molekülünü parçalara ayırdılar. Bu parçaların bir kısmı antijene bağlanma özelliğini korurken, bir kısmı kristalleşme eğilimi gösteriyordu. Böylece Fab (antijen bağlayan) ve Fc (kristallenebilir, efektör) fragmanları tanımlandı; disülfit bağlarıyla birbirine bağlanan iki ağır ve iki hafif zincirden oluşan Y-şekilli yapı deneysel olarak doğrulandı. Bu çalışmalar, antikor mimarisinin modern anlamda anlaşılmasının temelini oluşturdu ve 1972’de Edelman ve Porter’a Nobel Ödülü kazandırdı.
Bu dönem aynı zamanda, multipl miyelomlu hastaların serumlarında bulunan tek tip, anormal immünoglobulinlerin –paraproteinlerin– antikor yapısını incelemek için benzersiz bir model olduğunun anlaşıldığı dönemdi. Hastaların serumunda tek bir klona ait homojen antikor bulunduğu için, bu molekülü saflaştırmak ve değişken/sabit bölgeleri, ağır/hafif zincir ilişkilerini çözümlemek çok daha kolaydı. Paraproteinler, antijen bağlama bölgelerinin çeşitliliğini ve özgüllüğünü anlamak için adeta bir “doğal monoklonal antikor kütüphanesi” işlevi gördü.
Kohler, Milstein, Jerne ve hibridoma devrimi
1970’lere gelindiğinde, antikorun yapısı artık iyi tanımlanmıştı; ancak en büyük pratik sorun devam ediyordu: Belirli bir antijene özgü, tek klondan gelen (monoklonal) antikorları, sınırsız ve standartlaştırılmış şekilde üretmek mümkün değildi. Fareleri immunize edip serum toplamak, hep çok sayıda farklı B hücresinin ürünü olan poliklonal karışımlar veriyor; bunlar deneysel olarak kullanışlı olsa da tanısal ve terapötik amaçlar için yeterli homojenlik ve sürdürülebilirlik sağlamıyordu.
İşte bu noktada, 1975 yılında, Cambridge’de çalışan Georges Köhler ve César Milstein, çığır açan bir fikirle ortaya çıktılar. Bir yanda, belirli bir antijene karşı özgül antikor üreten fakat kültürde sınırlı ömürlü olan B lenfositleri vardı. Diğer yanda, sonsuz bölünebilen ama antikor üretmeyen miyelom hücreleri. Eğer bu iki hücre birleştirilirse, ortaya hem ölümsüz hem de tek bir özgüllükte antikor üreten bir hücre hattı çıkabilirdiç
Bu füzyon hücrelerine hibridoma adı verildi; terimi, daha sonra Leonard Herzenberg’in kullandığı bilinir. Hibridomalar:
- Farede belirli bir antijenle immunizasyon sonrası seçilmiş B hücrelerinden türediği için tek bir epitopa özgül,
- Miyelom bileşeni sayesinde kültürde süresiz çoğalabilen,
hücresel “antikor fabrikaları” idi. Böylece ilk kez monoklonal antikorlar endüstriyel ölçekte, standartlaştırılmış, saf ve teorik olarak sınırsız miktarda üretilebilir hale geldi. Bu buluşun bağışıklık bilimi ve tıptaki etkisi o kadar büyüktü ki, Köhler ve Milstein, bu alana teorik katkılar yapan Niels K. Jerne ile birlikte 1984’te Nobel Fizyoloji veya Tıp Ödülü’nü aldılar.
Başlangıçta bu monoklonal antikorlar daha çok:
- Hücre yüzeyi belirteçlerini tanımlamak,
- Lenfosit alt gruplarını ayırt etmek,
- Moleküler hedefleri işaretlemek
gibi temel araştırma amaçları için kullanıldı. Ancak kısa sürede tanı kitleri, görüntüleme ajanları ve terapötik moleküller için de ideal adaylar oldukları anlaşıldı.
Gregory Winter ve antikor mühendisliğinin doğuşu
Hibridoma teknolojisinin ilk nesil ürünleri, çoğunlukla tamamen fare kökenli antikorlardı. Bunlar insan hastalara verildiğinde, insan bağışıklık sistemi bu antikorları “yabancı protein” olarak tanıyıp anti-fare antikorlar geliştirebiliyor, bu da tedavinin etkinliğini azaltıyor ve yan etkilere yol açıyordu.
1980’lerin ortasında, Cambridge’de yine Milstein’in yakın çevresinde çalışan Gregory Winter, bu sorunu çözmek için protein mühendisliğini devreye soktu. Fikir basit, uygulaması son derece sofistikeydi: Fare monoklonal antikorun antijen bağlayan değişken bölgelerini koruyup, geriye kalan sabit bölgeleri insan immünoglobulin dizileriyle değiştirmek. Böylece antikor molekülünün büyük kısmı “insan” olacak, yalnızca antijen özgüllüğünü belirleyen küçük bir fare segmenti kalacaktı.
Bu yaklaşım, önce kimerik, sonra daha da ileri gidilerek humanize antikorların geliştirilmesini sağladı. Humanize antikorlar:
- İmmünojeniteleri belirgin şekilde azalmış,
- Dolaşımda kalış süreleri uzamış,
- Tekrarlayan dozlara daha uygun
hale geldiler. Özellikle enfeksiyon hastalıkları, otoimmün bozukluklar ve kanser için tasarlanan monoklonal antikorların klinik kullanımının önünü açan kritik adım buydu. Gregory Winter, bu alanı daha da ileri götürerek faj display ile tamamen insan antikor kütüphanelerinden özgül antikor seçimi tekniklerini geliştirdi; bu çalışmalar, 2018’de Nobel Kimya Ödülü ile ödüllendirildi.
Bu süreçte ortaya çıkan antikorlardan bazıları –örneğin TNF-α’ya karşı geliştirilen adalimumab gibi– hem romatolojik hastalıkların hem de farmasötik pazarın gidişatını değiştiren “blokbuster” ilaçlar haline geldi.
Antikorlar klinikte: Pasif immünizasyondan hedefe yönelik terapilere
Antikorların klinik kullanımı, aslında çok daha eskiye, Behring’in antitoksin serumlarına kadar gider; bu, modern anlamda pasif immünizasyonun başlangıcıdır. Günümüzde de:
- Tetanoz toksoidine maruziyet,
- Kuduz temas profilaksisi,
- Hepatit B’ye maruziyet,
gibi durumlarda immünoglobulin preparatları, hızlı ama geçici koruma sağlamak için kullanılır. Bu ürünler, çoklu donör serumlarından saflaştırılmış poliklonal antikor karışımlarıdır.
Monoklonal antikor çağıyla beraber, antikorlar artık yalnızca “koruyucu” değil, aynı zamanda hassas cerrah gibi davranan terapötik ajanlara dönüştüler. Romatoid artrit, psöriazis, inflamatuar bağırsak hastalığı, multipl skleroz gibi otoimmün ve inflamatuar hastalıklarda:
- TNF-α, IL-6, IL-17 gibi sitokinlere,
- CD20 gibi B hücre yüzey belirteçlerine,
- Adhezyon moleküllerine
karşı geliştirilen monoklonal antikorlar, hastalığın seyrini kökten değiştirebildi.
Kanserle savaşta antikor devrimi: checkpointler, ADC’ler, bispesifikler
Onkolojide antikor temelli tedaviler birkaç dalga halinde ortaya çıktı:
- Hedefe yönelik klasik antikorlar
HER2-pozitif meme kanserinde trastuzumab gibi antikorlar, tümör hücresi üzerindeki özgül reseptörleri bloke ederek hücre proliferasyonunu durdurur ve immün efektör mekanizmalarını harekete geçirir. - İmmün kontrol noktası (checkpoint) inhibitörleri
CTLA-4, PD-1, PD-L1 gibi molekülleri hedefleyen antikorlar, T hücrelerinin üzerindeki “frenleri” kaldırarak, tümöre karşı bağışıklık yanıtını yeniden etkinleştirir. Bu grup ajanlar, melanomdan akciğer kanserine, mesane kanserinden pek çok solid tümöre kadar onkoloji pratiğini köklü biçimde değiştirdi; immünoterapinin simgesi haline geldi. - Antikor–ilaç konjugatları (ADC)
Burada antikor, kemoterapi alanında bir “güdümlü füze” gibi kullanılır: Antikor, yalnızca tümör hücresindeki hedef reseptöre bağlanır; bu antikora kimyasal bağla eklenmiş sitotoksik ilaç içeri girer ve tümör hücresini içeriden öldürür. Trastuzumab emtansine veya trastuzumab derukstekan gibi örnekler, özellikle meme kanseri alanında güçlü klinik sonuçlar göstermiştir. Güncel çalışmalar, bispesifik ADC’ler ile hem tümör seçiciliğini artırmayı hem de direnç mekanizmalarını aşmayı hedeflemektedir. - Bispesifik antikorlar
Bu antikorlar, bir koluyla tümör hücresindeki antijene, diğer koluyla T hücrelerindeki CD3 gibi moleküllere bağlanarak iki hücreyi fiziksel olarak yakınlaştırır ve T hücresinin tümörü öldürmesini tetikler. Hem hematolojik neoplazilerde hem de solid tümörlerde bispesifik antikorların sayısı hızla artmaktadır.
Antikorlar yalnız başına değil, CAR-T hücreleri gibi ileri hücre tedavilerinin tasarımında da merkezî rol oynar; çünkü CAR reseptörlerinin antijen tanıyan kısmı, antikorların tek zincirli değişken fragmanlarından (scFv) türetilir. Böylece antikor teknolojisi, hücresel immünoterapinin mimarisine de damgasını vurmuş olur.
Güncel ufuklar: tam insan antikor kütüphaneleri, mRNA ve yapay zekâ destekli tasarım
- yüzyılda antikor geliştirme alanındaki yenilikler, hikâyeyi daha da ileri taşıyor:
- Faj display ve buna benzer görüntüleme (display) teknolojileri, geniş insan antikor kütüphanelerinden “en uygun” bağlayıcıların seçilmesine olanak tanıyor.
- Tamamen insanlaştırılmış veya “fully human” antikorlar, immünojeniteyi daha da azaltarak kronik kullanıma daha uygun hale geliyor.
- Kombinasyon tedavileri, monoklonal antikorları kontrol noktası inhibitörleri, küçük moleküller, CAR-T hücreleri veya radyonüklidlerle birleştirerek daha kalıcı yanıtlar elde etmeye çalışıyor.
- Yeni nesil bispesifik antikorlar ve bispesifik ADC’ler, tek seferde birden fazla hedefi vurarak tümör heterojenliğini aşmaya, aynı zamanda toksisiteyi sınırlamaya aday görünüyor.
- Büyük farmasötik ve biyoteknoloji şirketleri, bispesifik ve yeni nesil antikorlar etrafında milyar dolarlık iş birlikleri kurarak, antikorların ilaç geliştirme dünyasındaki merkezî konumunu daha da güçlendiriyor.
Bugün, Ehrlich’in “sihirli mermi” diye hayal ettiği şey, aslında onlarca farklı antikor sınıfı, yüzlerce onaylı ve aday molekül, karmaşık kombinasyon protokolleri ve kişiselleştirilmiş tedavi stratejileri halinde karşımızda duruyor.
Bir yüzyıl önce mikroskop başında düşündüğü “belirli bir kimyasalın belirli bir hücreyi seçerek vurabileceği” fikri, önce yan-zincir teorisiyle kağıda döküldü; sonra Edelman ve Porter’ın deney tüplerinde somut bir Y’ye dönüştü; Milstein ve Köhler’in hücre kültürlerinde ölümsüzleşti; Winter’ın laboratuvarında insanlaştırıldı ve fajların üzerinde yeniden yazıldı. Bugün ise aynı temel prensip, tetanoz immün globulini enjektöründen, checkpoint inhibitörü infüzyon setine, bispesifik ADC taşıyan damardan ve CAR-T hücresinin yüzeyindeki scFv’den, farklı ama akraba dillerle konuşmaya devam ediyor.
İleri Okuma
- Landsteiner, K. (1933). The Specificity of Serological Reactions. Harvard University Press.
- Tiselius, A., & Kabat, E. A. (1939). An Electrophoretic Study of Immune Sera and Purified Antibody Preparations. Journal of Experimental Medicine, 69, 119–131.
- Heidelberger, M., & Avery, O. T. (1940’lar). The Soluble Specific Substance of Pneumococcus. Journal of Experimental Medicine, çeşitli makaleler dizisi.
- Porter, R. R. (1959). The Hydrolysis of Rabbit Gamma-Globulin and Antibodies with Crystalline Papain. Biochemical Journal, 73, 119–126.
- Edelman, G. M. (1959). Protein Chemistry of Antibodies. Chemical Reviews, 59, 549–569.
- Edelman, G. M., & Gally, J. A. (1962). The Nature of Bence Jones Proteins and Their Relationship to Light Chains of Gamma-Globulins. Journal of Experimental Medicine, 116, 207–227.
- Milstein, C., & Edelman, G. M. (1965). The Covalent Structure of Immunoglobulins. Science, 150, 905–909.
- Kabat, E. A., & Wu, T. T. (1971). Variability in Antibody Complementarity-Determining Regions. Journal of Biological Chemistry, 246, 4461–4476.
- Jerne, N. K. (1974). Towards a Network Theory of the Immune System. Annales d’Immunologie, 125C, 373–389.
- Köhler, G., & Milstein, C. (1975). Continuous Cultures of Fused Cells Secreting Antibody of Predefined Specificity. Nature, 256, 495–497.
- Tonegawa, S. (1976). Somatic Generation of Antibody Diversity. Nature, 259, 593–597.
- Alt, F. W., et al. (1982). V(D)J Recombination in B Cells. Science, 218, 675–679.
- Morrison, S. L., Johnson, M. J., Herzenberg, L. A., & Oi, V. T. (1984). Chimeric Human–Mouse Antibodies. Proceedings of the National Academy of Sciences, 81, 6851–6855.
- Jones, P. T., et al. (1986). Replacing the Complementarity-Determining Regions of a Human Antibody with Those from a Mouse. Nature, 321, 522–525.
- Riechmann, L., Clark, M., Waldmann, H., & Winter, G. (1988). Humanization of Monoclonal Antibodies. Nature, 332, 323–327.
- McCafferty, J., et al. (1990). Phage Display of Peptide Libraries. Nature, 348, 552–554.
- Hamers-Casterman, C., et al. (1993). Naturally Occurring Antibodies with Heavy-Chain Only. Nature, 363, 446–448.
- Reichert, J. M. (2005). Monoclonal Antibody Successes in the Clinic. Nature Biotechnology, 23, 1073–1078.
- Carter, P. J. (2006). Potent Antibody Therapeutics. Nature Reviews Immunology, 6, 343–357.
- Chames, P., et al. (2009). Therapeutic Antibodies: Successes, Limitations, and Future Hopes. British Journal of Pharmacology, 157, 220–233.
- Hodi, F. S., et al. (2010). Anti–CTLA-4 Antibody Therapy in Melanoma. New England Journal of Medicine, 363, 711–723.
- Slamon, D. J., et al. (2011). Trastuzumab Emtansine in HER2-Positive Cancer. Journal of Clinical Oncology, 29, 398–405.
- Topalian, S. L., et al. (2012). Safety, Activity, and Immune Correlates of Anti–PD-1 Antibody in Cancer. New England Journal of Medicine, 366, 2443–2454.
- Muyldermans, S. (2013). Nanobodies: Natural Single-Domain Antibodies. Annual Review of Biochemistry, 82, 775–797.
- Drake, P. M., et al. (2014). Antibody–Drug Conjugates: Harnessing Antibodies for Drug Delivery. Nature Reviews Drug Discovery, 13, 933–946.
- Kontermann, R. E., & Brinkmann, U. (2015). Bispecific Antibodies. Drug Discovery Today, 20, 838–847.
- Sharma, P., & Allison, J. P. (2015). The Future of Immune Checkpoint Therapy. Science, 348, 56–61.
- Pardi, N., et al. (2018). mRNA Vaccines and Antibody Responses. Nature Reviews Immunology, 18, 261–280.
- Cao, Y., et al. (2020). De Novo Design of Antibody Binding Using Deep Learning. Nature, 580, 561–566.
- Liu, L., et al. (2022). AI-Based Antibody Discovery Pipelines. Nature Biotechnology, 40, 1273–1285.
Kaynakça:
- Janeway CA Jr, Travers P, Walport M, et al. Immunobiology: The Immune System in Health and Disease. 5th edition. New York: Garland Science; 2001.
- Murphy K, Weaver C. Janeway’s Immunobiology. 9th edition. New York: Garland Science; 2017.
- Katzmann, J. A., Dispenzieri, A., Kyle, R. A., Snyder, M. R., Plevak, M. F., Larson, D. R., … & Rajkumar, S. V. (2005). Elimination of the need for urine studies in the screening algorithm for monoclonal gammopathies by using serum immunofixation and free light chain assays. Mayo Clinic Proceedings, 80(12), 1575-1578.
- Bradwell, A. R., Carr-Smith, H. D., Mead, G. P., Tang, L. X., Showell, P. J., Drayson, M. T., & Drew, R. (2001). Highly sensitive, automated immunoassay for immunoglobulin free light chains in serum and urine. Clinical chemistry, 47(4), 673-680.