Astrositler, merkezi sinir sisteminin (MSS) en önemli glia hücre tiplerinden biri olup, hem gelişimsel hem de işlevsel düzeyde nöronlarla ayrılmaz bir bütünlük içindedir. Nöral ağları “taşıyan” pasif destek hücreleri olmaktan ziyade, güncel nörobilim anlayışında bilgi işlenmesine aktif katılan, metabolik, iyonik ve sinaptik mikroçevreyi ince ayarla düzenleyen dinamik hücreler olarak kabul edilirler.
İçindekiler
1. Etimoloji ve kavramsal konum
“Astrosit” terimi, Yunanca “astron” (ἄστρον, yıldız) ve “kytos/sitos” (κύτος, hücre, boşluk) sözcüklerinden türetilmiştir; kelime anlamı itibarıyla “yıldız hücre” veya “yıldız biçimli hücre” anlamına gelir. Bu adlandırma, hücre gövdesinden çok sayıda, farklı yönlere uzanan ince ve kalın uzantıların (processus) çıkması sonucu ortaya çıkan tipik yıldızsı morfolojik görünümü yansıtır.
Astrositler, sinir sistemindeki glia hücrelerinin bir alt grubunu oluşturur. Glia, nöronların aksine aksiyon potansiyeli iletimi için özelleşmemiştir, ancak nöral devrelerin yapısal, metabolik ve işlevsel bütünlüğü için vazgeçilmezdir. Astrositler, oligodendrositler, mikroglia ve ependim hücreleri ile birlikte MSS glia spektrumu içinde yer alır.
Önemli bir terminolojik karışıklığa da işaret etmek gerekir: “yıldız hücre” ifadesi karaciğerdeki Kupffer hücreleri veya perisinüzoidal “hepatic stellate cells” ile karıştırılabilmektedir. Kupffer hücreleri, retiküloendotelyal sistemin parçası olan, mononükleer fagosit serisine ait makrofajlardır; embriyolojik kökenleri, fonksiyonları ve doku dağılımları astrositlerden tamamen farklıdır. Astrositler, nöral tüp kökenli glial hücrelerdir ve yalnızca MSS’de bulunurlar.
2. Tarihçe: “sinir yapıştırıcısı”ndan aktif düzenleyiciye
- yüzyıl mikroskopisinin gelişmesiyle birlikte nöronlar ve glialar histolojik olarak ayırt edilebilir hâle gelmiş, özellikle Golgi boyası ve daha sonra geliştirilen selektif glia boyaları (örneğin, gümüş impregnasyon yöntemleri, daha sonra GFAP immünboyamaları) astrositlerin yıldızsı morfolojisini ortaya koymuştur. Başlangıçta glia, adından da anlaşılabileceği gibi (“neuroglia” – sinir yapıştırıcısı) yalnızca “dolgu” ve “mekanik destek” unsuru kabul edilmekteydi.
- yüzyılın ikinci yarısından itibaren, elektron mikroskopisinin, elektrofizyolojinin ve daha sonra kalsiyum görüntüleme tekniklerinin gelişmesiyle, astrositlerin:
- Kan-beyin bariyeri (KBB) oluşumuna katkısı
- Nöronal metabolizmanın sürdürülmesi
- İyon homeostazı (özellikle K⁺ tamponlaması)
- Nörotransmitter geri alımı ve gliotransmisyon
- Nörovasküler eşleşme (neurovascular coupling)
gibi çok daha kompleks işlevleri ortaya çıkarılmıştır. Böylece astrositler, pasif destek hücresi değil, nöral ağın aktif, sinyal işleyen ve bütünlüğünü sağlayan bir bileşeni olarak yeniden konumlandırılmıştır.
3. Gelişimsel ve evrimsel perspektif
Embriyolojik olarak astrositler, nöronlar gibi nöral tüpün radyal glia hücrelerinden türemektedir. Radyal glia, gelişim sırasında hem nöronların hem de olgun glia tiplerinin öncülü olarak görev yapar; nöronal göç için “iskelet” rolü üstlenir ve daha sonra önemli bir kısmı olgun astrositlere farklılaşır.
Evrimsel açıdan bakıldığında:
- Daha basit omurgalıların ve omurgasızların sinir sistemlerinde, nöron-glia ayrımı daha az belirgindir.
- Memelilerde, özellikle primatlarda ve insanda astrositlerin sayısı, hacmi ve morfolojik karmaşıklığı belirgin biçimde artmıştır.
- İnsan korteksindeki protoplazmik astrositler, birçok alt memeli türüne göre daha fazla dallanma, daha geniş hacim (domain) ve daha kompleks sinaptik ilişkiler gösterir. Bu, yüksek bilişsel fonksiyonların desteklenmesinde astroglial karmaşıklığın da rolü olabileceği fikrini güçlendirmiştir.
Böylece astrositler, hem gelişimsel açıdan nöronal ağların şekillenmesine katılan, hem de evrimsel süreçte bilişsel kapasitenin artışıyla birlikte morfolojik ve fonksiyonel yönden özelleşmiş hücreler olarak değerlendirilebilir.
4. Morfoloji ve ultrastrüktür
4.1. Hücre gövdesi ve uzantılar
Astrositler genellikle 10–20 µm çapında nispeten küçük bir hücre gövdesine (soma, perikaryon) sahiptir. Bu gövdeden çok sayıda sitoplazmik uzantı (processus astrocytici) çıkar.
- Bazı astrositler nispeten az dallanan fakat uzun uzantılıdır.
- Bazıları ise çok zengin dallanma gösteren, kısa ama sayıca fazla uzantılara sahiptir.
Bu uzantılar, komşu nöronların soma ve dendrit yüzeylerini, sinapsları ve özellikle kapiller damarların duvarlarını sararak, karmaşık bir mikro-anatomik ağ oluşturur.
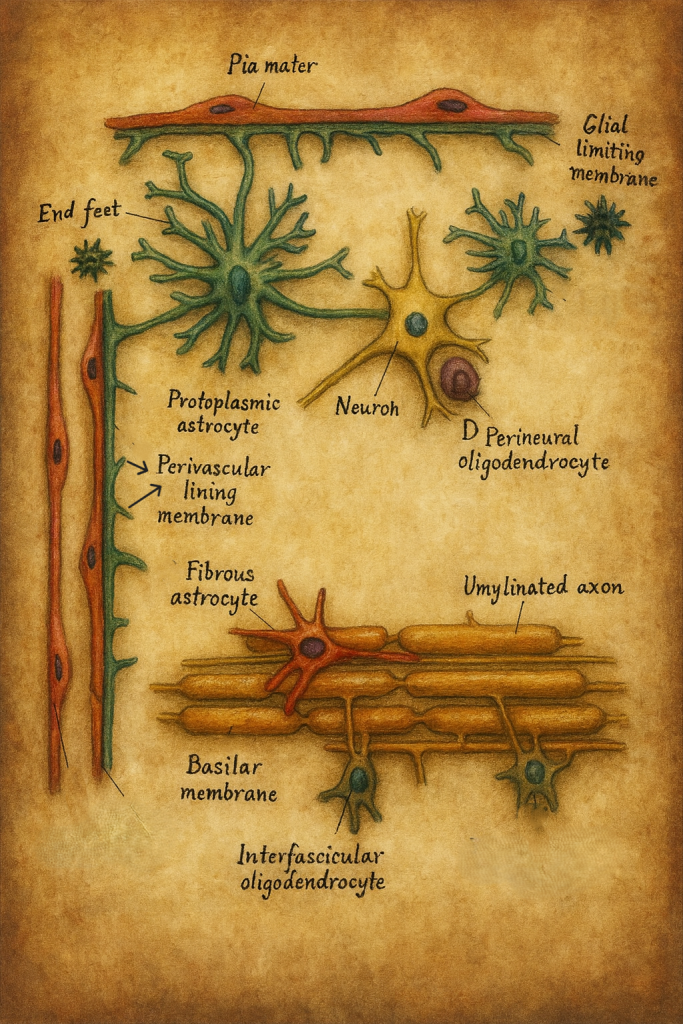
4.2. Membrana limitans gliae
Astrositlerin uzantıları, MSS’nin belirli yüzeylerinde yoğunlaşarak özel glial sınır zarları (membranae limitantes gliae) oluşturur:
- Membrana limitans gliae perivascularis
- Kapiller damarların dış yüzeyini saran astrosit ayakçıklarının (endfeet) oluşturduğu katmandır.
- Kan-beyin bariyerinin glial bileşenini temsil eder.
- Perisitler ve endotelyal hücrelerle birlikte nörovasküler ünitenin önemli bir parçasıdır.
- Membrana limitans gliae superficialis
- Beyin ve omuriliğin pial yüzeyine komşu bölgelerinde, pia mater altında uzanan glial tabakadır.
- MSS parankimi ile subaraknoid aralık arasında morfo-fonksiyonel bir sınır oluşturur.
Bu yapılar, beyin parankimini mekanik travmaya, dış mikroçevre değişikliklerine ve kontrolsüz sıvı geçişine karşı koruyan bir “glial zarf” gibi düşünülebilir.
4.3. Hücreler arası bağlantılar
Astrositler, birbirleriyle ve kısmen diğer glial hücrelerle özel hücresel bağlantılar aracılığıyla elektriksel ve mekanik bağlanma gösterirler:
- Gap junction (boşluk bağlantıları)
- Özellikle konneksin-43 (Cx43) ve konneksin-30 gibi konneksin proteinleriyle kurulur.
- İyonların, küçük metabolitlerin ve ikinci habercilerin (örneğin Ca²⁺ dalgaları, IP₃) hücreler arasında doğrudan geçişini sağlar.
- Bu sayede geniş astrositik “sincityumlar” oluşur; büyük bir astrosit ağı, tek bir fonksiyonel birim gibi davranabilir (elektriksel ve metabolik birleştirme).
- Zonula adhaerens ve diğer adezyon kompleksleri
- Mekanik dayanıklılık ve doku bütünlüğü sağlar.
- Astrositlerin hem birbirine hem de bazal membran bileşenlerine tutunmasını kolaylaştırır.
4.4. Sitoplazma ve glial filamentler
Astrosit sitoplazmasında, özellikle intermediate filamentlerce zengin bir iskelet sistemi bulunur:
- Ara filamentler temel olarak GFAP (Glial Fibrillary Acidic Protein – Asidik glial lif proteini) içerir.
- GFAP, hem normal astrositlerde hem de reaktif astrogliyoz veya glial tümörlerde güçlü bir immünohistokimyasal belirteç olarak kullanılır.
- Vimentin ve nestin gibi diğer intermediate filament proteinleri de gelişimsel veya patolojik süreçlerde ekspresyon gösterebilir.
Bu filamentler, hücre iskeletinin stabilitesini sağlar, hücre uzantılarının şekillenmesinde rol oynar ve glial hücrelerin mekanik strese dayanıklılığını arttırır.
5. Astrositlerin morfolojik sınıflandırılması
MSS’de astrositler, özellikle morfoloji ve lokalizasyona göre birkaç ana tipte incelenir:
- Fibriler astrositler (Astrocytus fibrosus)
- Özellikle beyaz cevherde (substansia alba) yoğunlaşırlar.
- Çok sayıda, ince ve uzun, nispeten az dallanan sitoplazmik süreçlere sahiptirler (“uzun yayıcılar”).
- Uzantılar, akson demetleri arasında uzanarak mekanik destek ve iyon/metabolit düzenlenmesi sağlar.
- Protoplazmik astrositler (Astrocytus protoplasmaticus)
- Gri cevherin (substansia grisea) karakteristik astrosit tipidir.
- Zengin dallanmış, kalın ve kısa süreçlere sahiptirler (“kısa yayıcılar”).
- Her bir astrosit, kendine özgü bir “domain” içinde çok sayıda sinapsı, nöronal somayı ve kılcal damarı sarar.
- Bu yapı, sinaptik iletim ve plastisitenin astrosit düzeyinde modülasyonuna uygun bir mikro-çevre oluşturur.
- Plazmafibriler astrositler
- Beyaz ve gri madde arasındaki geçiş bölgelerinde bulunur.
- Morfolojik özellikleri fibriler ve protoplazmik astrositler arasında bir ara form gösterir.
Ayrıca, belirli beyin bölgelerinde özel astrosit benzeri glial alt tipler tanımlanmıştır:
- Bergmann gliaları (serebellar Purkinje hücreleri ile ilişkilidir)
- Müller gliaları (retinada)
- Tanyasitler (hipotalamik periventriküler bölgede)
Bu alt tipler, morfolojik olarak astrositlerle akraba olup, bölgeye özgü fonksiyonlar üstlenirler.
6. Moleküler belirteçler ve fonksiyonel donanım
Astrositler, belirli protein ve taşıyıcıların ekspresyonu ile nöronlardan ve diğer glialardan ayırt edilebilir:
- GFAP: Klasik astrosit ara filament proteini ve histopatolojik tümör marker’ı.
- S100β: Kalsiyum bağlayıcı bir protein; çoğunlukla astrositlerde eksprese edilir.
- Aquaporin-4 (AQP4): Özellikle astroglial endfeet’lerde yoğunlaşmış su kanalı; su homeostazı ve ödem dinamiğinde kritik rol oynar.
- Kir4.1 gibi inward-rectifier K⁺ kanalları: K⁺ tamponlaması ve ekstrasellüler potasyum regülasyonunda önemlidir.
- Glutamat taşıyıcıları (EAAT1/GLAST, EAAT2/GLT-1): Glutamatın sinaptik aralıktan temizlenmesi için temel mekanizmayı sağlar.
- Monokarboksilat taşıyıcıları (MCT1, MCT4 vs.): Laktat ve diğer metabolitlerin nöron-glia arasında taşınmasında görev alırlar.
- Apolipoprotein E (ApoE): Beyinde kolesterol ve lipid transportunun ana moleküllerinden biridir; astrositler ApoE’nin başlıca üreticisidir.
Bu moleküler donanım, astrositlerin hem iyonik hem metabolik hem de sinaptik düzeyde çok yönlü bir regülasyon kapasitesine sahip olmasını mümkün kılar.
7. Astrositlerin temel fonksiyonları
7.1. Mekanik ve metabolik destek
Astrositler, MSS’de nöronlar için bir tür “iskele” ve tampon ortam sağlar:
- Ekstrasellüler sıvının bileşimini düzenler
- Bazal membran ile temas noktalarında dokunun mekanik dayanıklılığını arttırır
- Nöronların enerji gereksinimini karşılamaya yardımcı olacak metabolik yolları (örneğin glikoliz ve laktat üretimi) destekler
Özellikle astroglia-nöron laktat şantı (astrocyte–neuron lactate shuttle) kavramına göre, astrositler glikozu alıp glikolizle laktata dönüştürür; laktat daha sonra nöronlara taşınarak oksidatif fosforilasyonda kullanılabilir. Böylece astrositler, nöronların enerji metabolizmasında dolaylı ama kritik bir ara halka görevi görür.
7.2. Kan-beyin bariyeri ve nörovasküler ünite
Astrosit uzantılarının kapiller duvarlarını sarması sonucu oluşan perivasküler endfeet yapıları, KBB’nin glial bileşenini oluşturur. KBB, üç ana yapı bileşeniyle işlev görür:
- Endotel hücreleri (sıkı bağlantılar – tight junction)
- Perisitler ve bazal membran
- Astrositik endfeet tabakası (membrana limitans gliae perivascularis)
Astrositler:
- Endotelyal hücre fonksiyonlarını modüle eden sinyaller (örneğin büyüme faktörleri, vazoaktif maddeler) üretir.
- Nöronal aktiviteye yanıt olarak serebral kan akımını lokal olarak artıran veya azaltan nörovasküler eşleşme (neurovascular coupling) mekanizmalarına katılır. Özellikle glutamaterjik sinyal artışı, astrositlerin Ca²⁺ yanıtlarını tetikleyerek, damar düz kası ve endoteli etkileyen prostaglandinler, nitrik oksit ve diğer medyatörlerin salımına yol açabilir.
Böylece astrositler, “nöronal aktivite – enerji gereksinimi – kan akımı” üçgeninde aktif bir çevirmen olarak işlev görür.
7.3. Ekstrasellüler potasyum ve hacim homeostazı
Nöronal aktivite sırasında aksiyon potansiyelleri ve postsinaptik potansiyellerle birlikte ekstrasellüler alana önemli miktarda K⁺ iyonu salınır. Bu iyonların birikmesi, membran potansiyellerinin bozulmasına ve aşırı uyarılabilirliğe yol açabilir. Astrositler:
- Kir4.1 gibi K⁺ kanalları ve Na⁺/K⁺ pompaları aracılığıyla K⁺ tamponlaması yapar.
- Gap junction ağı sayesinde K⁺ iyonları geniş astrosit sincitiyumu boyunca “mekansal tamponlama” (spatial buffering) ile dağıtılır.
Ayrıca aquaporin-4 üzerinden su geçişini düzenleyerek beyin dokusunun hacim homeostazına da katkı sağlarlar. Nöronal aktivitenin arttığı bölgelerde oluşan ozmotik değişiklikler, astrositlerin büzüşmesi veya şişmesi ile dengelenebilir. İn vitro çalışmalar, nöral aktivitedeki değişimlere bağlı olarak astrosit soma ve süreçlerinde hacim değişiklikleri (şişme-büzüşme) olduğunu göstermiş; bu biçimsel adaptasyon bazı yazarlar tarafından “infotropizm” olarak adlandırılmıştır.
7.4. Nörotransmitter geri alımı ve gliotransmisyon
Astrositler, sinaptik iletimin sonlanmasında ve yeniden şekillenmesinde kritik rol oynar:
- Glutamat, GABA ve diğer nörotransmitterlerin sinaptik aralıktan temizlenmesi için taşıyıcı sistemler (EAAT1/2, GAT vb.) eksprese eder.
- Glutamat geri alımını takiben astrosit içi glutamat, glutamin sentetaz enzimiyle glutamine çevrilir; glutamin daha sonra nöronlara taşınarak yeniden nörotransmitter sentezinde kullanılır (glutamat–glutamin döngüsü).
Bununla birlikte astrositler, kendi başlarına da sinaptik çevreye sinyal molekülleri salabilir; bu süreç gliotransmisyon olarak adlandırılır:
- Glutamat
- D-serin
- ATP/adenozin
- GABA ve diğer modülatörler
Özellikle D-serin, birçok glutamaterjik sinapsta N-metil-D-aspartat (NMDA) reseptörlerinin koagonisti olarak görev yapar. Bazı sinaptik bağlantılarda, NMDA reseptörünün etkinleşebilmesi için hem glutamat hem de D-serin gereklidir; D-serin’in önemli bir kısmı astrosit kaynaklıdır. Bu mekanizma, sinaptik plastisite (örneğin uzun süreli potansiyasyon, LTP) süreçlerinde astrositlerin doğrudan rol almasına zemin hazırlar.
7.5. Sinaps sarılması ve “tripartit sinaps” kavramı
Astrosit uzantıları, sinaptik kontakların çevresini neredeyse tamamen sarabilir. Böylece:
- Nörotransmitterlerin sinaptik aralıktan çevre dokulara yayılmasını sınırlar (sinaptik izolasyon).
- Nörotransmitter konsantrasyonlarının çok ince düzeyde ayarlanmasına imkân tanır.
- Sinaptik iyon değişimlerini ve metabolik ortamı düzenler.
Bu bağlamda sinaps artık sadece “presinaptik nöron – postsinaptik nöron” ikilisinden oluşan ikili bir yapı değil, astrosit sürecinin de aktif katıldığı üçlü bir yapı, yani “tripartit sinaps” olarak tasvir edilir. Astrositler, tripartit sinapsta hem “okuyucu” hem “yazıcı” rol üstlenir: nöronal aktiviteyi algılar, buna göre Ca²⁺ sinyalleri üretir ve ardından nöromodülatörler salarak sinaptik iletimi ve plastisiteyi şekillendirir.
7.6. Lipid ve kolesterol metabolizması, ApoE ve sinaptik bakım
Beyinde kolesterol sentezi büyük ölçüde glial hücrelerde, özellikle astrositlerde gerçekleşir. Astrositler:
- Apolipoprotein E (ApoE) içeren lipoprotein partikülleri üretir.
- Bu partiküller, sinaptik membranların, miyelin ve diğer nöronal membran yapıların lipid ihtiyaçlarını karşılamak üzere nöronlara ve oligodendrositlere taşınır.
Kolesterol ve lipid temini, sinaptik membranların yenilenmesi, reseptör ve kanal kümelenmesi, sinaptogenez ve sinaptik stabilite için gereklidir. Ayrıca astrositler, nöronlara BDNF (Brain-Derived Neurotrophic Factor) ve GDNF (Glial cell line-Derived Neurotrophic Factor) gibi trofik faktörler sağlayarak sinaps oluşumunu, bakımını ve nöronal sağkalımı destekler.
7.7. Nöronal aktivitenin “değerlendirilmesi” ve infotropizm
Astrositler, çevrelerindeki nöral aktiviteyi “okuyan” ve bu aktiviteye bağlı olarak biçimsel ve fonksiyonel özelliklerini uyarlayan hücrelerdir. Deneysel çalışmalar:
- Nöronal aktivite arttığında astrositlerin Ca²⁺ dalgaları ve hücre içi sinyal yollarının aktive olduğunu,
- Buna bağlı olarak hücre gövdesi ve uzantılarda hacim değişiklikleri (şişme/büzüşme),
- Yeni ince süreçlerin (filopodia benzeri uzantıların) oluşabileceğini göstermiştir.
Bu aktiviteye bağlı morfolojik yönelim ve süreç oluşumu, literatürde bazı yazarlar tarafından “infotropizm” olarak adlandırılmaktadır. Bu kavram, astrositlerin yalnızca pasif bir ortam değil, nöral aktivite desenlerini “takip eden” ve onlara göre yeniden şekillenen dinamik bir hücresel ağ olduğunu vurgular.
8. Kök hücre özelliği ve nörogenez potansiyeli
Beynin belirli bölgelerindeki astrositler, özellikle erişkin nörogenezin sürdüğü alanlarda (örneğin subventriküler bölge, dentat girus) kök hücre veya progenitör hücre özellikleri gösterebilir. Bu astrosit benzeri kök hücreler:
- Bölünebilir,
- Nöronal ya da diğer glial soy hatlarına farklılaşabilir,
- Doku hasarı sonrasında rejeneratif yanıtların bir parçası olabilir.
Deneysel olarak, örneğin Neurogenin-2 (Ngn2) gibi nörogenezi yönlendiren transkripsiyon faktörleri kültürdeki astrositlere aktarıldığında, bu hücrelerin kısa süre içinde nöron benzeri morfoloji kazandıkları ve fonksiyonel sinapslar oluşturabildikleri gösterilmiştir. Bu bulgular, astrositlerin belirli koşullarda “yeniden programlanabilir” ve nöronal fenotipe yönlendirilebilir hücreler olduğunu düşündürmektedir.
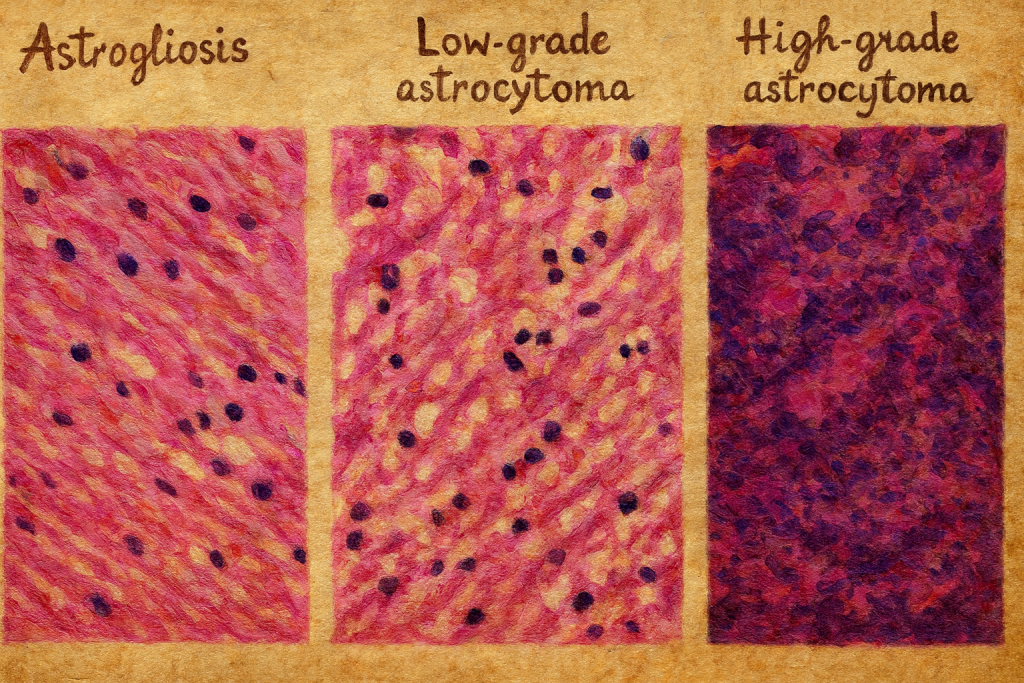
9. Reaktif astrositler ve astrogliyoz
MSS’de çeşitli patolojik süreçler (iskemi, travma, enfeksiyon, inflamasyon, demiyelinizasyon, nörodejeneratif hastalıklar) karşısında astrositler reaktif bir fenotipe geçebilir. Bu süreç astrogliyoz (astrogliozis) olarak adlandırılır ve şu özelliklerle karakterizedir:
- Hücre gövdesinde hipertrofi
- Uzantı sayısı ve kalınlığında artış
- GFAP ekspresyonunda belirgin yükselme
- Proliferasyon (özellikle ağır hasar durumlarında)
Astrogliyoz, başlangıçta doku bütünlüğünü koruyucu, zararlı molekülleri sınırlayıcı, ödemi azaltıcı, metabolik tamponlayıcı bir yanıt olarak değerlendirilebilir. Ancak kronik veya aşırı astrogliyoz, sinaptik bağlantıların ve aksonal büyümenin engellenmesine, “glial skar” oluşumuna ve fonksiyonel iyileşmenin kısıtlanmasına yol açabilir. Bu nedenle astrogliyoz, hem koruyucu hem de potansiyel olarak zararlı ikili bir fenomendir.
Reaktif astrositlerin bir alt formu olan gemistositik astrositler, eozinofilik ve geniş bir sitoplazmaya, belirgin bir çekirdeğe sahip, şişmiş görünümlü hücrelerdir. Bu hücreler:
- Demiyelinizan hastalıklar
- İskemik hasar alanları
- Tümör dokusu çevresi gibi durumlarda sıklıkla gözlenir.
10. Astrosit kaynaklı tümörler ve diğer klinik ilişkiler
10.1. Astrositomlar ve glioblastomlar
Histolojik olarak astrositlerden türediği düşünülen beyin tümörlerinin genel adı astrositomdur. Dünya Sağlık Örgütü (WHO) sınıflamasına göre:
- Düşük dereceli (Grade I–II) astrositomlar
- Anaplastik astrositom (Grade III)
- Glioblastoma (glioblastoma multiforme, Grade IV)
gibi alt gruplar tanımlanır.
Bu tümörlerde GFAP pozitifliği, immünohistokimyasal tanıda önemli bir ipucu sağlar; tümör hücrelerinde glial filament varlığını gösterir. Ancak tümörün malignite derecesini belirlemede ek moleküler marker’ler, genetik değişiklikler ve histolojik kriterler de kullanılır.
10.2. Demiyelinizan hastalıklar ve gemistositik astrositler
Multipl skleroz ve diğer demiyelinizan hastalıklarda, myelin kaybına yanıt olarak astrositler reaktif hâle gelir. Bu bölgelerde:
- Gemistositik astrositler
- Artmış GFAP ekspresyonu
- Glial skar oluşumu
gibi patolojik bulgular gözlenebilir. Bu glial yanıt, başlangıçta miyelin artıkları ve inflamatuvar medyatörlerin sınırlandırılmasına yardımcı olurken, kronikleştiğinde aksonal rejenerasyon ve remiyelinizasyonu zorlaştırabilir.
10.3. Epilepsi, inme ve nörodejeneratif hastalıklar
Astrosit fonksiyon bozukluğu, çeşitli nörolojik ve psikiyatrik hastalıklarla ilişkilendirilmiştir:
- Epilepsi: Bozulmuş K⁺ tamponlaması, glutamat geri alımındaki yetersizlik ve gliotransmisyondaki dengesizlikler, epileptik odakların hiper-uyarılabilirliğine katkıda bulunabilir.
- İnme (serebral iskemi): Akut fazda astrositler glutamatın temizlenmesi, antioksidan savunma ve ödem kontrolü ile korunmaya katkı sağlayabilir; geç fazlarda ise belirgin astrogliyoz ve glial skar oluşumu söz konusu olur.
- Nörodejeneratif hastalıklar (örneğin Alzheimer hastalığı ve bazı diğer demans tipleri): Astrositler, amyloid-beta temizliği, sinaptik bakım, ApoE aracılı lipid transportu ve inflamasyon yanıtlarında rol oynar. Astrosit disfonksiyonu, patolojinin ilerleyişine katkıda bulunabilecek bir faktör olarak değerlendirilir.
Bu örnekler, astrositlerin klinikte yalnızca “arka plandaki hücreler” değil, hastalık seyrini belirgin ölçüde etkileyebilen aktif aktörler olduğunu gösterir.
11. GFAP ve diğer astrositik marker’lerin klinik-laboratuvar kullanımı
Astrositlerin sitoplazmasında yer alan GFAP, nöropatolojide yaygın olarak kullanılan bir tümör ve hasar marker’ıdır:
- Beyin biyopsilerinde veya otopsi materyallerinde, GFAP immünboyaması glial kökenli tümörlerin (astrositomlar, glioblastomlar) tanımlanmasında yardımcı olur.
- Reaktif astrogliyoz alanlarında GFAP boyanmasının yoğunluğu artar; bu, önceki veya mevcut bir MSS hasarının göstergesi olabilir.
- Serum veya beyin omurilik sıvısında (BOS) GFAP düzeylerinin ölçümü, travmatik beyin hasarı ve bazı akut MSS olaylarında hasar belirteci olarak araştırılmaktadır.
Gemistositik astrositler, demiyelinizan veya neoplastik süreçlerde GFAP açısından zengin, eozinofilik sitoplazmalı hücreler olarak histolojik kesitlerde dikkat çeker ve patoloğa, altta yatan sürecin doğası hakkında bilgi verir.
Keşif
Erken Dönem: Nöronun keşfine giden sisli yol (19. yüzyıl ortaları)
- yüzyılın ortalarında sinir dokusu, mikroskop altında “homojen bir ağ” gibi görünen, çözülmesi güç bir yapıdır. O dönemde kullanılan boyalar, nöronların ve glianın ayrımını yapmaya uygun değildir. Buna rağmen, Jan Evangelista Purkyně, Otto Deiters ve Friedrich von Recklinghausen gibi öncü araştırmacılar, sinir sisteminin “tek tip bir maddeden” oluşmadığını fark eden ilk anatomistlerdendir. Recklinghausen, nöron olmayan bir hücre grubunun varlığını kabaca tarif etmiş, fakat fonksiyonlarını henüz anlamlandıramamıştır. Bugün biliyoruz ki gördüğü bu hücreler, glianın henüz tanınmamış üyeleriydi.
Bu yıllar, sinir dokusunun karmaşık bir orkestra olduğunu sezen ama henüz enstrümanları ayırt edemeyen bir dönemin başlangıcıydı.
1850–1870: “Nöroglia” kelimesinin doğuşu ve ilk sınıflandırmalar
Terminolojik temel, 1856’da Rudolf Virchow’un “neuroglia” kavramını ortaya koymasıyla atıldı. Virchow, gliaları nöronları “bir arada tutan bağlayıcı madde” olarak tanımlamıştı. Bu, elbette hatalı bir indirgemeydi; fakat glianın ayrı bir hücre sınıfı olarak kabul edilmesini sağladı.
Aynı dönemde, Albert von Kölliker ve diğer histologlar glia ve nöron ayrımını anatomik düzeyde güçlendirdiler. yine de glia, uzun süre “sinir sisteminin çimentosu” gibi pasif bir destek yapı olarak yorumlanacaktı.
1870–1890: Boyama tekniklerinin devrimi ve yıldız biçiminin görünür oluşu
Astrositlerin yıldız şeklindeki morfolojisinin fark edilmesini sağlayan asıl kırılma, 1870’lerden itibaren yeni boyama yöntemlerinin geliştirilmesiyle yaşandı. Buna rağmen, glial hücrelerin ayrıntılı görünümü hâlâ tam olarak seçilemiyordu.
Bu dönemde Otto von Bütschli, Rudolf Heidenhain ve diğerleri hücrelerin protoplazmik yapılarıyla ilgili çalışmalar yaparken, astrositlerin uzantıları hâlâ mikroskop camı altında bulanık bir sis perdesi gibiydi.
Bilim dünyası, yıldızların varlığını biliyor ama henüz ışıklarını tam seçemiyordu.
1890–1910: Golgi, Cajal ve “yıldız hücrelerin” gerçek yüzü
Astrositlerin keşfi, sinir biliminin iki devi olan Camillo Golgi ve Santiago Ramón y Cajal arasındaki ünlü rekabetle iç içe geçmiştir.
Golgi’nin siyah boyası
Camillo Golgi, 1873’te geliştirdiği gümüş nitrat bazlı boyama sayesinde nöronların tüm morfolojisini ortaya koymuştu. Fakat yöntem, nöronları olağanüstü ayrıntıyla gösterirken gliaları ancak sınırlı biçimde görünür kılıyordu. Yine de, yıldız biçimli glial hücrelere dair ilk net görüntüler bu dönemde elde edildi.
Cajal’ın gliaları keşfi
Santiago Ramón y Cajal, Golgi metodunu geliştirerek ve modifiye ederek astrositleri daha iyi seçebilir duruma geldi. Cajal, glia hücrelerinin nöral ağla yakın temasını, damarları saran uç ayakçıklarını ve sinapslar arasındaki konumlarını dikkatle tasvir etti.
Ona göre glia, pasif bir dolgu maddesi değil, “nöronal iletişimin sessiz ortakları”ydı. Astrositlerin yıldız biçimli yapısı Cajal’ın çizimlerinde ilk kez etkileyici bir netlikle ortaya çıktı.
Bu çizimler, astrositlerin bilim tarihinde ilk kez kendi kimliğiyle sahneye çıkışını temsil eder.
1910–1950: Durgunluk dönemi – glia yeniden unutuluyor
- yüzyılın ilk yarısında nöron doktrininin mutlak hâkimiyeti, astrositlerin önemini gölgeledi. Bilim dünyası elektriksel iletişim ve sinaptik aktarımın büyüsüne kapılmıştı.
Astrositler elektriksel aktivite göstermediği için uzun süre nörofizyolojinin dışında bırakıldı. Bu dönemde yalnızca patoloji alanında –özellikle tümörlerin sınıflandırılmasında– glial yapılar üzerine çalışmalar yoğunlaştı.
Glia yeniden arka koltuğa itilmiş, sahnedeki ışık tamamen nöronlara çevrilmişti.
1950–1970: Elektron mikroskopisi ve astrositik mimarinin ortaya çıkışı
Elektron mikroskopisinin keşfi, sinir dokusunun mimarisini benzeri görülmemiş bir ayrıntıyla görünür kıldı.
Araştırmacılar, astrositlerin:
- kapiller damarları saran endfeet yapısını,
- sinapsların çevresini kuşatan süreçlerini,
- hücreler arası gap junction ağlarını,
ilk kez ultrastrüktürel düzeyde inceleyebildi.
1950’lerin sonunda, astrositlerin sinaptik ortamı düzenlediği ve iyon dengesine katkı verdiği görülmüş; fakat bu süreçlerin davranış ve biliş üzerindeki etkileri henüz anlaşılamamıştı.
Astrositlerin yeniden görünür olmasıyla, sahne arkasının mimarları gibi çalıştıkları fark edilmeye başlamıştı.
1970–1990: GFAP’ın keşfi ve astrositlerin biyokimyasal kimliğinin doğuşu
1970’lerde glial fibrillary acidic protein (GFAP) adlı ara filament proteini tanımlandığında, astrositler ilk kez özgün bir moleküler imzaya sahip olmuş oldular.
GFAP immünboyamaları, nöropatologlara şu kapıları açtı:
- Astrositik tümörlerin (astrositom, glioblastom) tanınması
- Reaktif astrogliyozun haritalanması
- Astrosit popülasyonlarının dağılımının netleştirilmesi
Bu dönem, astrositlerin patolojideki öneminin ortaya koyulduğu bir dönemdi. Fakat asıl devrim henüz gelmemişti.
1990–2010: Sessiz düzenleyiciden aktif sinyal işleyiciye geçiş
1990’lardan itibaren kalsiyum görüntüleme tekniklerinin gelişmesiyle birlikte, astrositlerin elektriksel değil ama kalsiyuma dayalı sinyal dalgaları aracılığıyla kendi iletişim ağlarına sahip olduğu anlaşıldı.
Bu keşif, bilim dünyasında paradigmayı kökten değiştirdi:
- Astrositler glutamat reseptörlerine yanıt veriyor,
- Sinaptik aktivitede Ca²⁺ salınımları oluşturuyor,
- ATP, D-serin ve glutamat gibi molekülleri salarak sinapsları modüle ediyordu.
“Gliotransmisyon” kavramı doğdu.
“Tripartit sinaps” modeli ortaya atıldı.
Artık sinaps, yalnızca iki nöronun değil, aynı zamanda bir astrosit sürecinin de dahil olduğu üçlü bir etkileşim merkezi olarak tasvir ediliyordu.
Bu, astrositlerin modern sinir biliminin merkezine doğru hızla yükselişini simgeliyordu.
2010–günümüz: İnsan astrositlerinin büyüklüğü, karmaşıklığı ve bilişsel fonksiyonlarla ilişkisi
Son on yılın araştırmaları, astrositlerle ilgili daha da çarpıcı bulgular ortaya çıkardı:
1. İnsan astrositleri benzersiz derecede büyük ve karmaşık
İnsan korteksindeki protoplazmik astrositler, birçok memeli türüne kıyasla çok daha fazla dallanma ve daha büyük “domain” alanı sergiler. Bu yapı, daha fazla sinapsı düzenleyebileceği anlamına gelir.
2. İnsan astrositleri, fare beynine nakledildiğinde bilişsel işlevleri hızlandırabiliyor
Deneysel çalışmalarda, insan kaynaklı astrosit progenitörlerinin fare beynine yerleştirilmesiyle hayvanların öğrenme ve bellek performansında artış gözlenmiştir. Bu bulgu, insan bilişinin yalnızca nöronal özelliklere değil, glial karmaşıklığa da bağlı olabileceğini düşündürür.
3. Nörovasküler eşleşmenin merkezinde astrositler var
Astrositler, beyin kan akımının nöral aktiviteye göre ayarlanmasında kilit oyuncu olarak görülmekte; bu mekanizmanın bozulması migren, Alzheimer, inme ve demans gibi hastalıklarla ilişkilendirilmektedir.
4. Rejeneratif tıpta astrositlerin yeniden programlanması
Son yıllarda fibroblastlardan ve hatta olgun astrositlerden nöron elde etmeye yönelik çeşitli yöntemler geliştirildi.
Nörojenin-2 gibi faktörlerin astrositlere aktarılması, bu hücrelerin nöronal fenotipe dönüşmesini sağlayabiliyor.
5. Astrosit alt tiplerinin moleküler atlası çıkarılıyor
Tek hücreli RNA dizileme teknolojisi, astrositlerin sanıldığı gibi homojen olmadığını, bölgeye özgü birçok alt tipe ayrıldığını ortaya koydu.
Her alt tipin:
- farklı gen ekspresyonu,
- farklı metabolik profili,
- farklı sinaptik modülasyon biçimi olduğu anlaşıldı.
Bu bulgular, astrositlerin incelikli bir hücresel orkestrasyon içinde çalıştığını gösteriyor.
İleri Okuma
- Virchow R (1856). Über das granulierte Aussehen der Zellkerne. Archiv für pathologische Anatomie und Physiologie und für klinische Medicin, 9, 136–144.
- Golgi C (1873). Sulla struttura della sostanza grigia del cervello. Gazzetta Medica Italiana Lombarda, 33, 244–246.
- Ramón y Cajal S (1888). Estructura de los centros nerviosos de las aves. Revista Trimestral de Histología Normal y Patológica, 1, 1–10.
- Ramón y Cajal S (1897). Histology of the Nervous System of Man and Vertebrates. Oxford University Press, Oxford.
- Lenhossék M (1895). Der feinere Bau des Nervensystems im Lichte neuerer Forschung. F.C.W. Vogel, Leipzig.
- Penfield W (1924). The glia of the central nervous system. The Lancet, 203(5250), 421–422.
- Río-Hortega P del (1928). Cytology and Cellular Pathology of the Nervous System, Vol. 2: The Microglia. Hoeber, New York.
- Eng LF, Ghirnikar RS (1964). Studies of astrocytes in tissue culture. Experimental Neurology, 9(4), 387–407.
- Eng LF, Vanderhaeghen JJ, Bignami A, Gerstl B (1971). An acidic protein isolated from fibrous astrocytes. Brain Research, 28(2), 351–354.
- Somjen GG (1979). Extracellular potassium in the mammalian central nervous system. Annual Review of Physiology, 41, 159–177.
- Kuffler SW, Nicholls JG, Orkand RK (1966). Physiology of glial cells in the central nervous system and in peripheral ganglia. Journal of Neurophysiology, 29(2), 768–787.
- Orkand RK, Nicholls JG, Kuffler SW (1966). Effect of nerve impulses on the membrane potential of glial cells in the central nervous system of amphibia. Journal of Neurophysiology, 29(4), 788–806.
- Ransom BR, Goldring S (1973). Slow depolarization in response to glial stimulation in cortex. Brain Research, 62(2), 271–284.
- Magistretti PJ, Nahorski SR (1988). Coupling mechanisms of neurotransmitter receptors to phospholipase C in glial cells. Trends in Neurosciences, 11(8), 358–362.
- Pellerin L, Magistretti PJ (1994). Glutamate uptake into astrocytes stimulates aerobic glycolysis: a mechanism coupling neuronal activity to glucose utilization. Proceedings of the National Academy of Sciences of the USA, 91(22), 10625–10629.
- Parpura V, Basarsky TA, Liu F, Jeftinija K, Jeftinija S, Haydon PG (1994). Glutamate-mediated astrocyte–neuron signalling. Nature, 369(6483), 744–747.
- Porter JT, McCarthy KD (1996). Hippocampal astrocytes in situ respond to glutamatergic synaptic activity. Neuron, 15(2), 333–343.
- Zonta M, Angulo MC, Gobbo S, Rosengarten B, Hossmann KA, Pozzan T, Carmignoto G (2003). Neuron-to-astrocyte signaling is central to the dynamic control of brain microcirculation. Nature Neuroscience, 6(1), 43–50.
- Halassa MM, Fellin T, Takano H, Dong JH, Haydon PG (2007). Synaptic islands defined by the territory of a single astrocyte. Journal of Neuroscience, 27(24), 6473–6477.
- Araque A, Parpura V, Sanzgiri RP, Haydon PG (1999). Tripartite synapses: glia, the unacknowledged partner. Trends in Neurosciences, 22(5), 208–215.
- Volterra A, Meldolesi J (2005). Astrocytes, from brain glue to communication elements: the revolution continues. Nature Reviews Neuroscience, 6(8), 626–640.
- Auld DS, Robitaille R (2003). Perisynaptic Schwann cells at the neuromuscular junction: actively modulating synaptic transmission. Nature Reviews Neuroscience, 4(9), 722–730.
- Nedergaard M, Ransom B, Goldman SA (2003). New roles for astrocytes: redefining the functional architecture of the brain. Trends in Neurosciences, 26(10), 523–530.
- Pfrieger FW, Barres BA (1997). Synaptic efficacy enhanced by glial cells in vitro. Science, 277(5332), 1684–1687.
- Bushong EA, Martone ME, Jones YZ, Ellisman MH (2002). Protoplasmic astrocytes in CA1 stratum radiatum occupy separate anatomical domains. Journal of Neuroscience, 22(1), 183–192.
- Nimmerjahn A, Kirchhoff F, Helmchen F (2005). Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science, 308(5726), 1314–1318.
- Oliet SHR, Piet R, Poulain DA (2001). Control of glutamate clearance and synaptic efficacy by glial coverage of neurons. Science, 292(5518), 923–926.
- Rothstein JD, Dykes-Hoberg M, Pardo CA, Bristol LA, Jin L, Kuncl RW et al. (1996). Knockout of glutamate transporters reveals a major role for astroglial transport in excitotoxicity and neurodegeneration. Neuron, 16(3), 675–686.
- Iadecola C, Nedergaard M (2007). Glial regulation of the cerebral microvasculature. Nature Neuroscience, 10(11), 1369–1376.
- Sofroniew MV, Vinters HV (2010). Astrocytes: biology and pathology. Acta Neuropathologica, 119(1), 7–35.
- Khakh BS, Sofroniew MV (2015). Diversity of astrocyte functions and phenotypes in neural circuits. Nature Neuroscience, 18(7), 942–952.
- Verkhratsky A, Nedergaard M (2014). Astroglial cradle in the life of the synapse. Philosophical Transactions of the Royal Society B, 369(1654), 20130595.
- Allen NJ, Eroglu C (2017). Cell biology of astrocyte–synapse interactions. Neuron, 96(3), 697–708.
- Zuchero JB, Barres BA (2015). Glia in mammalian development and disease. Development, 142(22), 3805–3809.
- Clarke LE, Barres BA (2013). Emerging roles of astrocytes in neural circuit development. Nature Reviews Neuroscience, 14(5), 311–321.
- Liddelow SA, Barres BA (2017). Reactive astrocytes: production, function, and therapeutic potential. Immunity, 46(6), 957–967.
- Liddelow SA, Guttenplan KA, Clarke LE, Bennett FC, Bohlen CJ, Schirmer L et al. (2017). Neurotoxic reactive astrocytes are induced by activated microglia. Nature, 541(7638), 481–487.
- Oberheim NA, Takano T, Han X, He W, Lin JHC, Wang F et al. (2009). Uniquely hominid features of adult human astrocytes. Journal of Neuroscience, 29(10), 3276–3287.
- Han X, Chen M, Wang F, Windrem M, Wang S, Shanz S et al. (2013). Forebrain engraftment by human glial progenitor cells enhances synaptic plasticity and learning in adult mice. Cell Stem Cell, 12(3), 342–353.
- Chung WS, Allen NJ, Eroglu C (2015). Astrocytes control synapse formation, function, and elimination. Cold Spring Harbor Perspectives in Biology, 7(9), a020370.
- Ben Haim L, Rowitch DH (2017). Functional diversity of astrocytes in neural circuit regulation. Nature Reviews Neuroscience, 18(1), 31–41.
- Miller SJ (2018). Astrocyte heterogeneity in the adult central nervous system. Frontiers in Cellular Neuroscience, 12, 401.
- Bayraktar OA, Bartels T, Holmqvist S, Kleshchevnikov V, Martirosyan A, Polioudakis D et al. (2020). Astrocyte layers in the mammalian cerebral cortex revealed by a single-cell in situ transcriptomic map. Nature Neuroscience, 23(4), 500–509.
- Escartin C, Galea E, Lakatos A, O’Callaghan JP, Petzold GC, Serrano-Pozo A et al. (2021). Reactive astrocyte nomenclature, definitions, and future directions. Nature Neuroscience, 24(3), 312–325.
- Khakh BS (2023). Astrocyte–neuron interactions in the mammalian brain. Annual Review of Neuroscience, 46, 1–28.