- Wenckebach noktası: Artan atriyal hızla AV düğümün artık her uyarıyı iletemediği kritik frekans; vagal tonus yükseldikçe düşer.
- Dromotropi: AV düğüm iletim hızına otonom etkilerin yönü (pozitif/negatif).
- AH-HV ayrımı: AV blok lokalizasyonunu (nodal vs infranodal) ayırt etmede EP laboratuvarında temel.
Makroanatomi ve Topografya
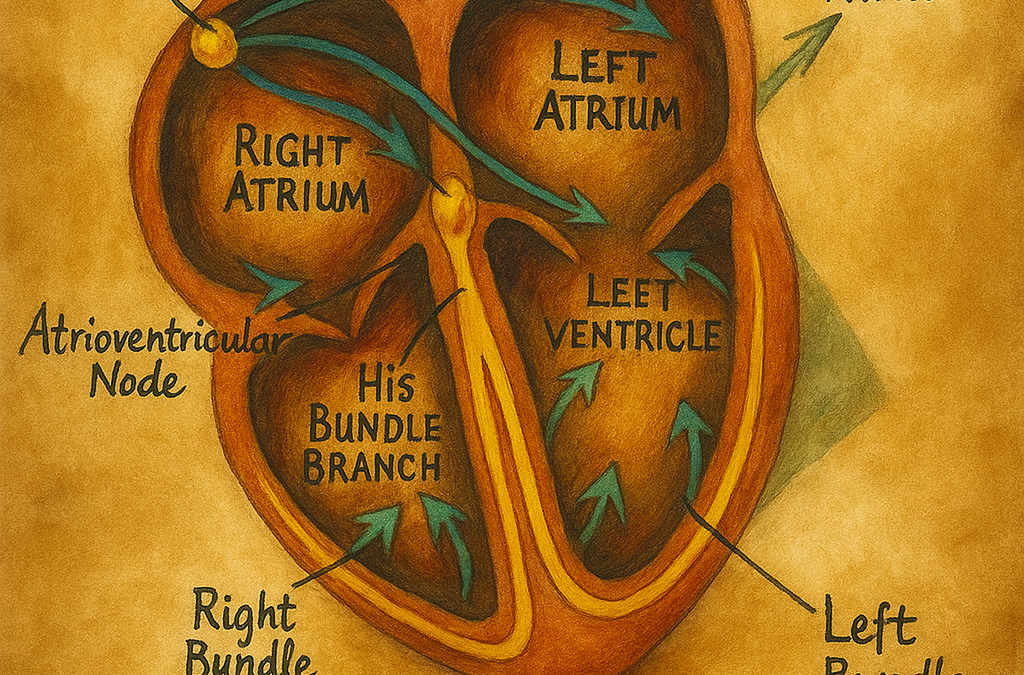
AV düğüm, sağ atriyumun inferoposterior septal bölgesinde, Koch üçgeni içinde yer alan kompakt bir yapıdır. Koch üçgeninin sınırları:
- Süperior sınır: Todaro tendonu (Eustachii kapağından çıkan fibröz bant),
- İnferior-posterior sınır: Koroner sinüs ostiumu,
- Anteroseptal sınır: Triküspit kapağın septal yaprakçığı.
Kompakt AV düğüm, üçgenin apeksine, membranöz septuma komşu olacak biçimde lokalizedir; distaline doğru His demeti başlar. Proksimalinde geçiş (transisyonel) hücreleri, distaline doğru “lower nodal bundle” ve N-His (NH) bölgesi bulunur. Bu topografi, kateter ablasyon ve kalıcı pil elektrodu yerleşiminde kritik önemdedir.
Kanlanma
AV nodal arter olguların yaklaşık %80–90’ında sağ koroner arterden (RCA), sol baskın sirkülasyonda ise sol sirkumfleks (LCx) dalından kaynaklanır. Bu varyasyon, inferior miyokard infarktı sonrasında gelişen nodal disfonksiyonların sıklığını ve seyrini etkileyebilir.
Histoloji ve Hücresel Kompozisyon
AV düğüm, iki ana hücre fenotipinden zengindir:
- P-hücreleri (pacemaker-benzeri): Küçük, miyofibril içeriği görece az, zayıf çizgili; otomatikite potansiyeli taşırlar.
- Geçiş (T) hücreleri: Atriyal miyokard ile kompakt düğüm arasında yer alır, gap-junction yoğunluğu ve boyutları ile iletim hızını belirler.
Gap junction protein repertuarı, hızlı ileten dokulara (Purkinje, ventrikül) kıyasla farklıdır: Connexin-45 (Cx45) görece baskındır; Cx43 ifadesi düşüktür. Bu yapı, düşük elektriksel eşleşme ve yavaş, kalsiyum bağımlı iletim için morfolojik temel sağlar.
Elektrofizyoloji ve İyon Kanalları
AV düğüm yavaş-yanıt dokudur. Aksiyon potansiyeli özellikleri:
- Faz 4 otomatikite: “Funny” akım (I_f) ve T-tipi/ L-tipi kalsiyum akımlarının katkısıyla diastolik depolarizasyon.
- Faz 0 depolarizasyon: Hızlı Na⁺ kanallarından ziyade L-tipi Ca²⁺ akımı (I_Ca,L) ile oluşur → yükseliş hızı (dV/dt) düşüktür.
- Refrakterlik: Nispeten uzun ve frekans-bağımlıdır; bu durum fizyolojik frekans filtresi işlevini açıklar (yüksek atriyal hızların ventriküle sınırlı aktarımı).
- Otonom modülasyon:
- Parasempatik (vagal) tonus: A1 reseptörleri/ M2 muskarinik yolaklar üzerinden I_K,ACh artışı ve I_Ca,L baskılanması → negatif dromotropi (AV iletimi yavaşlar), refrakterlik uzar; Wenckebach fenomeni kolaylaşır.
- Sempatik tonus: β₁ aracılığıyla I_Ca,L ve I_f artışı → pozitif dromotropi, refrakterlik kısalması.
Zamanlama Parametreleri ve EKG Korelatları
- AV düğümsel gecikme: Ortalama 90–120 ms (çoğu gecikme düğüm içinde gerçekleşir).
- PR (PQ) aralığı: 120–200 ms (sinüs P dalgası başlangıcından QRS başlangıcına); yalnızca AV düğüm değil, atriyal iletim + AV düğüm + His-Purkinje bileşenlerinin toplamıdır.
- EP çalışması ölçümleri:
- AH aralığı (atriyum→His): ≈ 50–120 ms (temelde AV düğüm süresini yansıtır),
- HV aralığı (His→Ventrikül): ≈ 35–55 ms (infranodal iletim).
Fizyolojik Rol ve “Frekans Filtresi”
AV düğüm, kulakçık-karıncık koordinasyonunu sağlayan zamanlayıcıdır:
- Atriyal sistolün ventriküler sistolden hemen önce gerçekleşmesini sağlayarak ventrikül doluşunu (preload) artırır.
- Refrakterlik özellikleri sayesinde atriyal taşiaritmilere karşı frekans sınırlayıcı bir kapı görevi görür.
Otomatikite ve Kaçış Ritimleri
SA düğüm baskınlığının kaybında AV düğüm ikincil pacemaker gibi davranabilir:
- Birincil kaçış hızı: ≈ 40–60 atım/dk (junctional kaçış).
- Hızlanmış junksiyonel ritim: 60–100/dk.
- Junksiyonel taşikardi: >100/dk.
Çift AV Nodal Fizyoloji ve AVNRT
Birçok erişkinde AV düğüm çevresinde dual pathways saptanır:
- Hızlı yol (superior-anterior): Kısa iletim, uzun refrakterlik,
- Yavaş yol (inferior-posterior): Uzun iletim, kısa refrakterlik.
Bu ikililik, en sık görülen SVT formu olan atriyoventriküler nodal yeniden giriş taşikardisi (AVNRT) için zemin hazırlar:
- Tipik (slow-fast) AVNRT: RP kısa; V1’de pseudo-r’ görülebilir.
- Atipik varyantlar: fast-slow veya slow-slow döngüler.
Vagal manevralar ve adenozin (A1 reseptör), AV düğüm iletimini geçici bloke ederek AVNRT’yi sıklıkla sonlandırır.
Klinik Önemi: İleti Bozuklukları
AV blok spektrumu:
- 1. derece: PR >200 ms, tüm P’ler iletilir; çoğunlukla nodal/üst düzey; genellikle benign.
- 2. derece, Mobitz I (Wenckebach): PR giderek uzar, bir P iletilmez; tipik olarak nodal kökenli; sıklıkla dar QRS.
- 2. derece, Mobitz II: PR sabit, arada P iletilmez; sıklıkla infranodal (His-Purkinje); ileri bloğa ilerleme riski nedeniyle klinik açıdan daha ciddidir.
- 3. derece (tam blok): Atriyum ve ventrikül dissosiyedir; ventrikül kaçış ritmi hız ve QRS morfolojisine göre nodal veya infranodal kökenli olabilir.
Belirti ve bulgular: Bradikardi, baş dönmesi/senkop (Adams–Stokes), egzersiz intoleransı, kalp yetmezliği alevlenmesi.
Tedavi ilkeleri (özet çerçeve):
- Reversibl nedenlerin giderilmesi (iskemi, ilaç toksisitesi, elektrolit bozuklukları, miyokardit/ Lyme karditi, post-operatif durumlar).
- Semptomatik yüksek dereceli bloklarda geçici ardından endikasyon varsa kalıcı kalp pili.
- İlaçlar: Nodal iletimi yavaşlatan ajanlar (β-bloker, verapamil/diltiazem, digoksin, adenozin, amiodaronun erken faz etkileri) blokları ağırlaştırabilir; uygun klinik bağlamda dikkat gerekir.
Farmakoloji ve Terapötik Hedefler
AV düğümü, taşiaritmilerin kontrolü ve semptom yönetiminde hedef dokudur:
- Adenozin (IV): A1 reseptör aktivasyonu → AV düğümde geçici blok; AVNRT/AVRT terminasyonu, tanısal “unmasking”.
- β-Blokerler: Negatif dromotropi; hız kontrolü (örn. AF’de) ve anjina/HT tedavilerinde yararlı.
- Non-dihidropiridin KKB (verapamil, diltiazem): AV düğümde I_Ca,L baskılanması; hız kontrolü.
- Digoksin: Vagal tonusu artırarak AV iletimini yavaşlatır; özellikle istirahatte etkilidir.
Önemli uyarı: Preeksitasyon sendromlarında (örn. WPW) atriyal fibrilasyon sırasında AV nodal bloklayıcılar (adenozin, verapamil/diltiazem, β-bloker, digoksin) aksesuar yolu hızlandırılmış iletime zorlayabileceği için kontrendike olabilir; bu tabloda prokainamid veya ibutilid gibi ajanlar tercih edilir; hemodinamik instabilitede acil kardiyoversiyon esastır.
Patolojik ve Klinik Durumlarla İlişki
- İskemi/infarkt: Inferior MI’da (RCA kaynaklı AV nodal arter tutulumu) geçici nodal blok sık; anterior MI’da infranodal Mobitz II/ tam blok daha sık ve prognoz daha kötü.
- İnfiltratif hastalıklar: Amiloidoz, sarkoidoz AV düğüm ve His-Purkinje’yi tutarak iletim defektlerine yol açabilir.
- Enfeksiyonlar: Lyme karditi değişken derecelerde AV blok yapabilir; uygun antibiyotik tedavisiyle reversibl olabilir.
- Cerrahi/Kateter girişimleri: VSD onarımı, triküspit kapak cerrahisi, TAVI/TAVR sonrası ileti bozuklukları gelişebilir.
Keşif
Kalbin “iç kablolarının” varlığı, 19. yüzyıl ortasında Purkinje’nin endokard altındaki parlak lif demetlerini betimlemesiyle sezdirilmişti; ama atriyum ile ventrikül arasında sinyali tek ve ayrıcalıklı bir aks üzerinden taşıyan bir “köprü”nün gerçekten var olduğu fikri, 1893’te genç Wilhelm His Jr.’ın, septumu delen özelleşmiş kas demetini—sonradan onun adıyla anılacak “His demetini”—tanımlamasıyla anatomik dayanağına kavuştu. His’in bulgusu, o tarihe dek kalbin tekdüze bir kas kütlesi olduğuna inananları düşündürdü: Demek ki iletim sadece yayılmıyor, yönlendiriliyordu. Bu yapbozun eksik parçası—atriyumdan gelen kıvılcımı geciktirip ventriküllere teslim eden düğüm—çok geçmeden, 1906’da Sunao Tawara’nın Jena’da yayımladığı monografiyle (“Das Reizleitungssystem des Säugetierherzens”) ayrıntılı histolojik örgüsüyle sahneye çıktı. Tawara, hocası Ludwig Aschoff’un kurduğu okulda, düğümün yalnızca “nerede” olduğunu değil, “nasıl” dokulandığını da gösterdi: kompakt bir çekirdek, geçiş hücreleri ve bu çekirdekten çıkan aksın His demetine devri. Ertesi yıl, 1907’de Arthur Keith ve Martin Flack sinoatriyal düğümü tanımlayarak “ateşleyiciyi” de yerine koydular; böylece kalbin bütüncül bir elektrik ağı olarak kavrandığı bir çağ açıldı.
Mikroskobun düzlüğünden klinisyenin engebeli sahasına inerken haritanın ayrıntıları keskinleşti. Sağ atriyumun inferoposterior septal duvarında, Todaro tendonu ile koroner sinüs ağzı ve triküspit septal yaprakçığın çizdiği Koch üçgeninin tepesine yerleşen kompakt AV düğüm; zayıf çizgili P-hücreleri ve onları çevreleyen geçiş hücreleriyle, hızlı ileti için değil “bilinçli gecikme” için inşa edilmişti. Gap junction repertuarının (özellikle Cx45 baskınlığının) düşük eşleşme ve yavaş, kalsiyum-odaklı depolarizasyon lehine olması, morfolojinin fizyolojiye tercümesiydi. Bu anatomi, ileride kateter ablasyonunun hedef haritasına, cerrahinin ise “nereden uzak durmalı?” uyarı levhalarına dönüşecekti.
20. yüzyılın ilk yarısında fizyoloji, Wenckebach fenomeninden dromotropiye uzanan kavramlarla düğümün “zaman tutucu” işlevini çerçeveledi; fakat gerçek sıçrama, invazif elektrofizyolojinin doğumuyla geldi. 1969’da Scherlag ve arkadaşları, insanda His demeti potansiyelini kateterle kaydetmeyi başardıklarında, P-R aralığını üç bileşene ayırmak ve “gecikmenin nerede olduğu”nu—atriyum mu, düğüm mü, His-Purkinje mi—saptamak bir anda mümkün oldu. Kısa süre içinde Narula ve çalışma arkadaşları, AH ve HV aralıklarını rutin ölçüm değişkenlerine dönüştürerek klinik kararları (örneğin kalıcı pil endikasyonunu) anatomik-fizyolojik bir zeminde kesinleştirdiler. Bu yeni alfabe, AV düğümünün bir “geciktirici” olmaktan çok, ritme bilinçli bir kapıcılık yapan dinamik bir “filtre” olduğunu göstermeye yaradı.
Aynı yıllarda haritalama teknolojileri olgunlaştıkça, düğüm çevresinde çift yol fizyolojisinin izleri belirginleşti: kısa ileten ama uzun refrakter “hızlı” yol ve uzun ileten ama kısa refrakter “yavaş” yol. AV nodal yeniden giriş taşikardisi (AVNRT) bu ikiz yolun mimarisinde kurulan bir kulis oyunuydu; 1992’de Warren Jackman ve ekibi, yavaş yolun atriyal ucuna radyo-frekans enerjisi uygulayarak bu oyunu sahneden indirdi. Klinik elektrofizyoloji, o günden sonra AVNRT’yi ilaçlarla yatıştırılan bir misafir değil, kalıcı olarak uğurlanabilen bir ev sahibi gibi görmeye başladı; “junksiyonel ritim”in ablatif başarıya eşlik eden ve operatöre doğru yerde olduğunu fısıldayan bir imza olduğu sezgisi de pratik bilginin parçası haline geldi.
Anatominin klinikle bu yakınlaşması, düğümün kanlanma varyasyonlarının (çoğunlukla sağ koroner arter kökenli AV nodal arter; sol baskın dolaşımda LCx kaynağı) inferior infarktlarda görülen geçici nodal blokları nasıl açıkladığına dair sezgiyi de güçlendirdi. Bunu izleyen yıllarda kılavuzlar, nodal düzeydeki blokların çoğu kez benign seyrettiğini, oysa infranodal (His-Purkinje) blokların ilerleyici ve pil gerektiren bir yol çizebildiğini sistematikleştirdi; AH/HV ayrımı bu yüzden yalnız terminoloji değil, prognoz dili oldu.
Bir yandan teknik, bir yandan biyoloji derinleşti. Optik haritalama ve yüksek hızlı görüntüleme, AV düğümdeki A-H gecikmenin yalnız “yavaş kanallar” ile değil, atriyal miyokarddan düğümsel dokuya geçişteki elektrotonik basamak ve geometriyle de belirlendiğini, yani mekânın bizzat bir değişken olduğunu gösterdi. Aynı yaklaşım Purkinje-ventrikül kavşaklarında da “geçiş dokusu”nun zamanlamaya katılımını resmetti. Moleküler tarafta tek-hücreli ve mekânsal transkriptomik çalışmalar, düğümde HCN kanalları, kalsiyum akımlarının alt tipleri ve bağ dokusu-miyosit etkileşimlerinin farklılaşan imzalarını ayıklamaya başladı; hatta bazı modeller, düğümde GABAerjik sinyal öğelerinin rolünü tartışmaya açtı. Bu, 1906’daki histolojik atlasın, 2020’lerde moleküler bir atlasla üst üste şeffaflaşmasıydı.
Laboratuvardan kliniğe en yeni köprü ise “fizyolojik pil” arayışı: iletimi bozan yerde kası uyarmak yerine, bizzat iletim sistemini uyarmak. His demeti pil uyarımı (HBP) ile başlayan ve sol dal alanı uyarımı (LBBAP) ile genişleyen “iletim sistemi pil kavrama” yaklaşımı, AV düğümün ve distal aksın doğal yollarını devreye sokarak eşzamanlı ventrikül aktivasyonu hedefliyor. Avrupa topluluklarının uzlaşı metinleri ve güncel derleme çalışmaları, HBP’nin fizyolojik oluşunu; LBBAP’in ise daha geniş hedef alanı ve daha düşük eşiklerle pratik üstünlüğünü tartışıyor. Bu eksende, bradikardi endikasyonlarından resenkronizasyona, hatta seçilmiş AF vakalarında hız kontrol stratejilerine kadar, AV düğümün “geciktirici” rolü yanında “yönlendirici” konumu da yeniden tanımlanıyor.
Düğüm biyolojisinin yeniden üretilebilir modellerde çalışılması için insan pluripotent kök hücre türevli iletim ekseni “assembloid”leri ve AV düğüm fenotipine itilmiş hücre toplulukları sahne aldı; optik-elektrik eşzamanlı haritalama platformları bu kültürlerin gerçek zamanlı iletimini ve refrakterliğini ölçebilir hale geldi. Bu modeller, örneğin lamin A/C mutasyonlarıyla ilişkili iletim bozukluklarında kalsiyum işaretleşmesinin nasıl saptığını gösterebiliyor; proteomik atlaslar ise insan düğüm dokusunun sağlıklı erişkinlerdeki imzasını çalışma miyokardı ile karşılaştırmalı olarak çıkarıyor. Böylece bir asır önceki “nerede ve nasıl görünüyor?” sorusundan, bugün “hangi hücresel-moleküler ağ ile geciktiriyor ve filtreliyor?” sorusuna uzanan bir çizgi kuruluyor.
Ve tüm bu yolculuk—Purkinje’nin cam lamlarındaki liflerden, His’in septumu delen demetine; Tawara’nın Koch üçgenindeki kompakt çekirdeğinden, Scherlag’ın kateter ucundaki H potansiyeline; Jackman’ın yavaş yolunda sonlanan yeniden giriş halkasından, LBBAP ile yeniden yakalanan fizyolojik ventrikül senkronisine—AV düğümünü bir “bekleme salonu” olmaktan çıkarıp kalp ritminin bilinçli bir editörü olarak konumlandırıyor.
İleri Okuma
- His Jr., W. (1893). Die Thatigkeit des embryonalen Herzens und deren Bedeutung für die Lehre von der Herzbewegung beim Erwachsenen. Vogel, Leipzig.
- Tawara, S. (1906). Das Reizleitungssystem des Säugetierherzens. Gustav Fischer, Jena.
- Keith, A., & Flack, M. (1907). The Form and Nature of the Muscular Connections between the Primary Divisions of the Vertebrate Heart. Journal of Anatomy and Physiology, 41, 172–189.
- Scherlag, B. J., et al. (1969). Catheter technique for recording His bundle activity in man. Circulation, 39(1), 13–18. https://doi.org/10.1161/01.CIR.39.1.13
- Meijler, F. L., & Janse, M. J. (1988). Morphology and Electrophysiology of the Atrioventricular Node. Journal of the American College of Cardiology, 12(3), 791–799. https://doi.org/10.1016/0735-1097(88)90459-8
- Jackman, W. M., et al. (1992). Treatment of supraventricular tachycardia due to AV nodal reentry by radiofrequency ablation of the slow pathway. The New England Journal of Medicine, 327, 313–318. https://doi.org/10.1056/NEJM199207303270504
- Anderson, R. H., Ho, S. Y., & Becker, A. E. (2000). Anatomy of the Human Atrioventricular Junctions. Journal of Cardiovascular Electrophysiology, 11(8), 1046–1056. https://doi.org/10.1111/j.1540-8167.2000.tb00076.x
- Anderson, R. H. (2000). Anatomy of the human atrioventricular junctions revisited. The Anatomical Record, 260(1), 81–91. https://doi.org/10.1002/1097-0185(20000901)260:1<81::AID-AR90>3.0.CO;2-3
- Silverman, M. E. (2007). Discovery of the sinus node by Keith and Flack. Heart, 93(6), 658–664.
- Antzelevitch, C., & Burashnikov, A. (2011). Overview of Basic Mechanisms of Cardiac Arrhythmia. Cardiac Electrophysiology Clinics, 3(1), 23–45. https://doi.org/10.1016/j.ccep.2010.10.012
- Josephson, M. E. (2015). Josephson’s Clinical Cardiac Electrophysiology: Techniques and Interpretations (5th ed.). Wolters Kluwer, Philadelphia. ISBN: 9781451193655.
- Anderson, R. H. (2016). Wilhelm His Junior and his bundle. Journal of Electrocardiology, 49(6), 889–893.
- Zipes, D. P., & Jalife, J. (Eds.). (2018). Cardiac Electrophysiology: From Cell to Bedside (7th ed.). Elsevier, Philadelphia. ISBN: 9780323529921.
- Herring, N., & Paterson, D. J. (2018). Neuromodulation of the Heart. Nature Reviews Cardiology, 15, 100–114. https://doi.org/10.1038/nrcardio.2017.158
- Kusumoto, F. M., et al. (2019). 2018 ACC/AHA/HRS Guideline on the Evaluation and Management of Patients With Bradycardia and Cardiac Conduction Delay. Circulation, 140(8), e382–e482. https://doi.org/10.1161/CIR.0000000000000628
- Choi, B.-R. (2023). Revisiting atrioventricular node (AVN) and Purkinje–ventricular junction delays. Frontiers in Physiology, 14, 1100132.
- EHRA/Europace Consensus (Burri, H., et al.) (2023). Conduction System Pacing: Clinical Consensus Statement. Europace, 25(4), 1237–1276.
- Li, J., et al. (2024). Modeling the atrioventricular conduction axis using human pluripotent stem cell-derived cardiac assembloids. Nature Communications, 15, 5678.
- Liang, D., et al. (2024). A GABAergic system in atrioventricular node pacemaker cells. Cell Research, 34, 1234–1246.
- ESC Clinical Consensus (Glikson, M., et al.) (2025). Conduction system pacing—current status. Europace, 27(4), euaf050.
- Jastrzębski, M., et al. (2025). His Bundle Pacing in the Era of Left Bundle Branch Area Pacing. Journal of Clinical Medicine, 14, Article 11904424.