İçindekiler
Tanım, terminoloji ve kapsam
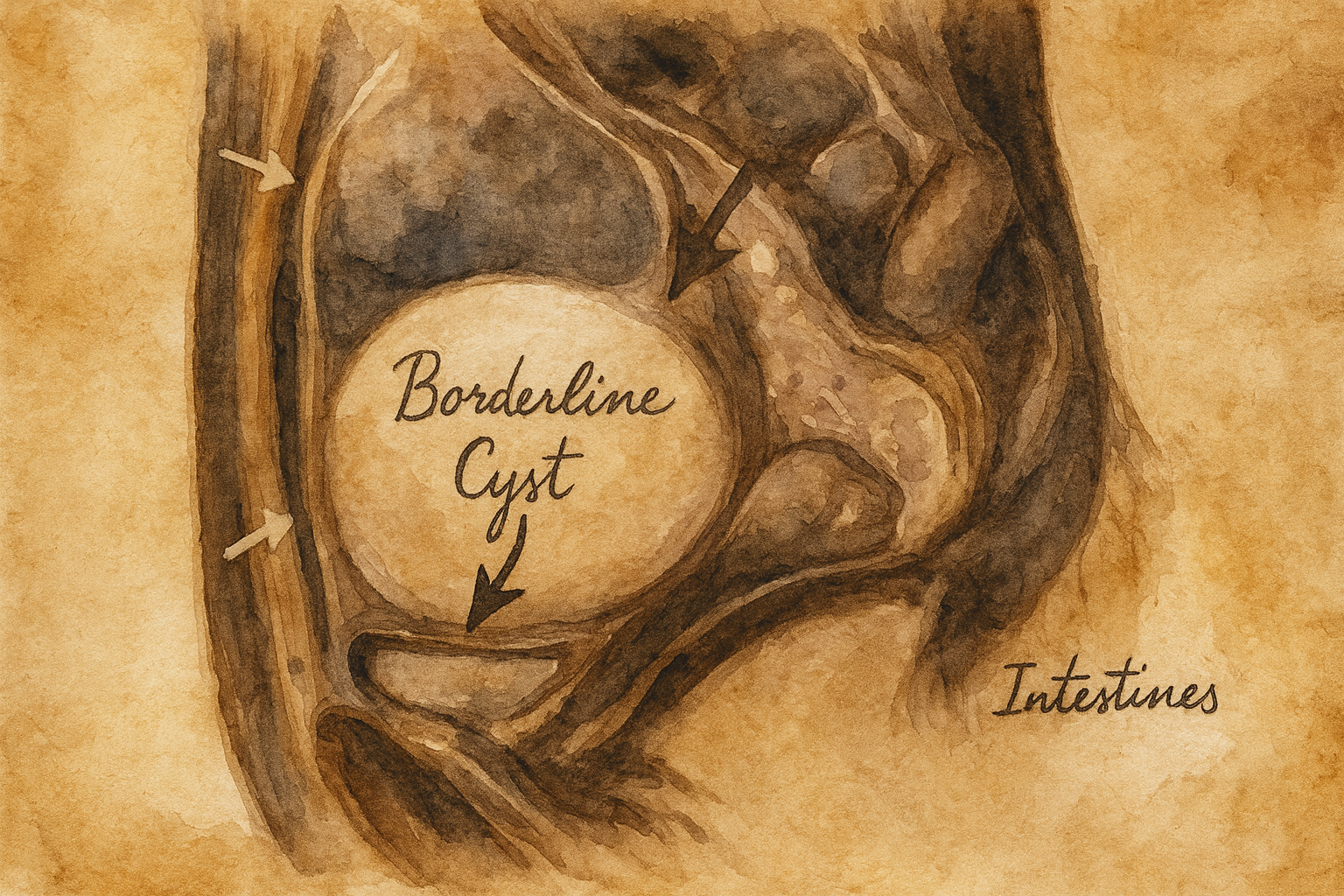
Klinik pratikte “sınırda kist” ifadesi, iyi huylu (benign) kistik oluşumlar ile kötü huylu (malign) kistik/epitelyal tümörler arasındaki histopatolojik özellikleri taşıyan, sınırda malignite potansiyeline sahip lezyonları anlatmak için kullanılır. Terminolojik olarak en yerleşik kullanım, over (yumurtalık) epitel kökenli “sınırda tümörler” (borderline ovarian tumors; BOT) içindir. Bu grup, invaziv karsinomdan ayırıcı nitelikte stromal invazyon olmaksızın belirgin hücre atipi ve epitelyal proliferasyon gösterir. “Sınırda kist” ifadesi başka organlara da (ör. pankreasın kistik neoplazileri, meme’nin borderline fillodes tümörleri, karaciğer/biliyer sistemin müsinöz kistik neoplazileri gibi) kavramsal olarak taşınabilse de, tanı ölçütleri, biyolojik davranış ve yönetim organ-özgüdür. Bu nedenle aşağıdaki anlatım, klinik karşılaşmanın en yaygın olduğu alan olan ovaryan lezyonları merkez alır; organlar arası paralellikler ayrıca işaretlenir.
Epidemiyoloji ve klinik sunum
- Sıklık: Ovaryan sınırda tümörler, epitel kaynaklı ovaryan tümörlerin hatırı sayılır bir bölümünü oluşturur ve tüm ovaryan tümörler spektrumu içinde benign kistadenomlar ile düşük dereceli seröz/müsinöz karsinomlar arasında yer alır.
- Yaş: Tanı çoğunlukla üreme çağında ve 40’lı yaşlarda konur; invaziv epitelyal over kanserlerine kıyasla daha genç yaş grubunu etkiler.
- Semptomlar: Alt karında bası hissi, şişkinlik, düzensiz kanama, pelvik ağrı veya çoğu zaman tesadüfi saptanma ile seyreder. Torsiyon/ruptür gelişirse akut karın bulguları ortaya çıkabilir.
Patogenez ve moleküler altyapı (ovaryan odaklı)
- Seröz sınırda tümörler (SBT): Sıklıkla KRAS ve BRAF mutasyonlarıyla ilişkilidir; düşük dereceli seröz karsinom gelişim yolunun öncülleri olarak kabul edilir. Mikropapiller varyant ve peritoneal implantlar (invazif olmayan ve daha nadiren invazif) prognoz ve tedavi kararlarında önem taşır.
- Müsinöz sınırda tümörler (MBT): KRAS mutasyonları baskındır; büyük boyutlu, tek taraflı ve multiloküle olma eğilimindedir. Ek apendiks patolojisi ve nadiren pseudomiksoma peritonei ile ilişki ayırıcı tanıda değerlendirilir.
- Diğer alt tipler: Seromüsinöz, endometrioid ve nadiren şeffaf hücreli sınırda lezyonlar bildirilmiştir; bunların tanısal kesinliği ve klinik davranışı alt tipe göre değişir.
Histopatoloji (temel ilkeler)
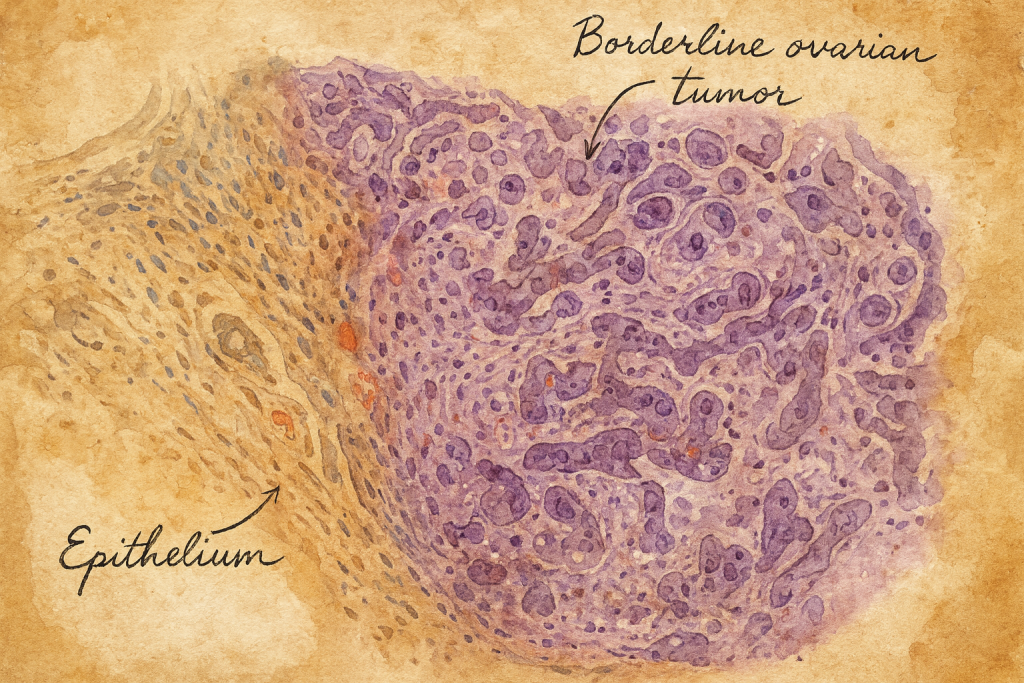
- Ayırıcı ölçüt: Belirgin epitel proliferasyonu ve nükleer atipi bulunur; stromal invazyon yoktur.
- SBT’de papiller/mikropapiller mimari, yüzey/inkoğnitoperitoneal implantlar;
- MBT’de yoğun müsin üretimi, multiloküle yapı ve epitelyal displazi dereceleri tipiktir.
- Peritoneal implantlar: İnvazif olmayan implantlar prognozu görece az etkilerken invazif implantlar yineleme riskini ve uzun dönem mortaliteyi artırabilir.
- Frozen section (intraoperatif), özellikle müsinöz lezyonlarda örnekleme hatasına açıktır; nihai karar eksizyon + ayrıntılı histopatolojik inceleme ile verilir.
Görüntüleme ve radyolojik özellikler
Ultrasonografi (ilk basamak)
- Morfoloji: Multiloküle, septalı, papiller çıkıntılı kompleks kistik kitleler; bazen solid-kistik bileşenler.
- Vaskülarite: Papiller çıkıntılarda artmış doppler akımı şüpheyi güçlendirir.
- Risk sınıflaması: IOTA (International Ovarian Tumour Analysis) basit kuralları ve O-RADS US, malignite olasılığını yapısal kriterlerle puanlar ve yönlendirme sağlar.
Manyetik Rezonans Görüntüleme (MRI)
- Yararı: Doku karakterizasyonu, hemoraji, yağ, müsin ayrımı; papiller çıkıntı ve solid komponent değerlendirmesi.
- O-RADS MRI skorlaması, seçilmiş olgularda benign-borderline-malign ayrımını destekler.
Bilgisayarlı Tomografi (BT)
- Endikasyon: Primer karakterizasyondan çok, şüpheli ileri evrede yayılım/implant ve üst batın değerlendirmesi; cerrahi planlama.
Laboratuvar ve biyobelirteçler
- CA-125: Seröz lezyonlarda yükselme görülebilir ancak spesifik değildir; normal düzeyler maligniteyi dışlamaz.
- CA19-9, CEA: Müsinöz patern şüphesinde destekleyici olabilir; tanı koydurucu değildir.
- HE4 ve ROMA gibi paneller: Borderline spektrumda sınırlı değer; karar radyoloji + klinik + patoloji entegrasyonu ile verilir.
Mikrobiyolojik boyut ve enfeksiyon potansiyeli
“Sınırda kist” neoplastik bir olgudur; infeksiyöz kökenli değildir. Mikrobiyolojik analiz ancak komplikasyon (ör. rüptür, nekroz, sekonder süperenfeksiyon, apseleşme) şüphesi olduğunda anlamlıdır. Böyle durumlarda:
- Kültür ve duyarlılık: Püy/aspirat veya cerrahi örnekten.
- Moleküler testler: PCR, belirli patojenlerin hızlı saptanması için seçili olgularda.
- Laboratuvar korelasyonu: Lökositoz, CRP artışı, klinik sepsis bulguları.
Ayırıcı tanı
- Benign kompleks kistler: Endometriyoma, hemorajik kist, kistik teratom (dermoid), adneksiyal ektopik gebelik sekelleri.
- Malign epitelyal over karsinomları: Düşük-dereceli seröz/müsinöz karsinom; solid komponent ve invazyon belirginliği.
- Pseudomiksoma peritonei: Çoğunlukla apendiks kaynaklı; jelleşmiş müsin, peritoneal yayılım.
- Diğer organ kistik neoplazileri: Pankreas IPMN/MCN’lerinde “low–intermediate–high-grade displazi” sınıflaması kavramsal olarak “borderline” ile karşılaştırılabilir; organ-spesifik protokoller geçerlidir.
Tanısal yaklaşım (pragmatik algoritma)
- Ultrason tabanlı risklendirme: IOTA/O-RADS ile düşük-orta-yüksek risk sınıflaması.
- MRI ile problem çözme: Orta-yüksek riskte veya belirsizlikte doku karakterizasyonu.
- Multidisipliner konsey: Radyoloji, jinekolojik onkoloji, patoloji.
- Cerrahi plan:
- Onkolojik prensiplerle eksizyon; kapsül bütünlüğünü koruma; endobag kullanımı.
- Evreleme prosedürleri (peritoneal lavaj sitolojisi, şüpheli odaklardan biyopsiler, omentektomi) seçili olgularda.
- Frozen section yardımcı olabilir; nihai karar kalıcı kesit ile.
- Ek organ değerlendirmesi: Müsinöz olgularda apendiks gözden geçirilmesi; gastrointestinal kaynak olasılığı.
Evreleme
- FIGO evrelemesi kullanılır. Sınırda tümörler sıklıkla Evre I’de yakalanır.
- Peritoneal implant varlığı ve niteliği (invazif/olmayan) evreyi ve prognozu etkiler.
- Lenf nodu tutulumu nadirdir ve prognostik etkisi sınırlıdır; sistematik lenfadenektominin faydası tartışmalıdır.
Tedavi ilkeleri
Cerrahi (temel yaklaşım)
- Hedef: Onkolojik güvenlik ile organ ve fertilite koruma arasında denge.
- Fertilite koruyucu cerrahi:
- Kistektomi veya unilateral salpingo-ooforektomi (karşı over ve uterus korunur).
- Kistektomi sonrası nüks riski daha yüksektir; çocuk isteği tamamlanınca tamamlayıcı cerrahi düşünülebilir.
- Komple cerrahi: Bilateral hastalık, nüks veya yüksek risk paternlerinde total histerektomi + bilateral salpingo-ooforektomi + omentektomi ve seçili biyopsiler.
- Minimal invaziv cerrahi: Deneyimli merkezlerde mümkündür; tümör yayılımını önleyici teknikler (endobag, kapsül bütünlüğü) şarttır.
Sistemik tedavi
- Kemoterapi/radyoterapi: Sınırda tümörlerde rutin endikasyon yoktur. İnvazif implant, ileri yayılım veya histolojik dönüşüm gibi istisnai durumlar dışında verilmez.
- Hedefe yönelik tedaviler/hormon tedavisi: Veri sınırlıdır; klinik denemeler dışında genellikle önerilmez.
İzlem ve nüks
- Klinik ve görüntüleme: İlk 2–3 yıl daha sık, sonrasında yıllık pelvik muayene ve ultrason; MRI gerektikçe.
- Biyobelirteçler: Başlangıçta yüksek ise CA-125/CA19-9 izlemde yardımcı olabilir; tek başına karar belirlemez.
- Nüks paterni: Sıklıkla ipsilateral/kontralateral overde ve borderline fenotipte; nadiren invazif dönüşüm. Kistektomi yapılanlarda nüks oranı ooforektomiye göre daha yüksektir.
- Uzun dönem prognoz: Erken evre ve invazif implant yokluğunda mükemmele yakın sağkalım; invazif implant veya mikropapiller varyant varlığında yakın izlem ve bireyselleştirilmiş yönetim gerekir.
Özel durumlar ve pratik noktalar
- Gebelik: Tanı/izlemde US önceliklidir; semptomatik veya yüksek riskli morfolojide trimester ve cerrahi risk dikkate alınarak ikinci trimesterde cerrahi planlanabilir.
- Apendektomi ihtiyacı (müsinöz): Apendikste makroskopik patoloji varsa çıkarılması; aksi halde rutin apendektomi gerekliliği tartışmalıdır.
- Peritoneal lavaj ve implant örneklemesi: Evrelemede değerli; sitoloji pozitifliği prognozu etkileyebilir.
- Kapsül rüptürü ve iatrojenik yayılma: Laparoskopide specimen bag ve en blok çıkarım; iğne aspirasyonundan kaçınma.
- Organlar arası perspektif:
- Pankreas kistik neoplazileri (IPMN/MCN) ve biliyer–hepatik müsinöz kistik neoplaziler “düşük/orta/yüksek dereceli displazi” şeklinde sınıflanır; “borderline”a kavramsal karşılık gelir ancak takip ve cerrahi eşikleri organ-özel rehberlerle belirlenir.
- Meme fillodes tümörleri “benign–borderline–malign” şeklinde derecelendirilir; cerrahi sınır yönetimi farklıdır. Bu örnekler, “sınırda” kavramının histolojik bir spektrum terimi olduğunu ve mikrobiyolojik içerim taşımadığını vurgular.
Klinik özet niteliğinde karar noktaları (uygulamaya dönük)
- Kompleks kistik adneksiyal kitle + papiller çıkıntı/septasyon → IOTA/O-RADS ile risk katmanı; belirsizlikte MRI.
- Reprodüktif çağ + fertilite isteği → Onkolojik güvenlik korunarak fertilite-koruyucu cerrahi planı.
- Müsinöz patern → Apendiks değerlendirmesi ve GİS kaynağı ayırımı.
- İnvazif implant şüphesi → Deneyimli merkezde evreleme ve yakın izlem.
- Enfeksiyon bulgusu (ateş, lökositoz, ağrı, püy) → Kültür + antibiyogram, komplikasyon yönetimi; bu, tümör biyolojisinden ayrı bir süreçtir.
Terminolojik uyarı
Gündelik dilde “sınırda kist” ifadesi yerleşmiş olsa da, doğru tanısal etiket çoğunlukla **“sınırda malign potansiyelli (borderline) ovaryan tümör”**dür. Bu vurgu, tedavi kararlarının histopatolojiye dayandığını ve sıradan “kist” algısıyla eşdeğer olmadığını hatırlatır.
Notlar (pratik)
- Biyopsi/aspirasyon: Ovaryan kistik lezyonlarda preoperatif perkütan iğne aspirasyonu genellikle önerilmez (saçılma/upstaging riski).
- Frozen section sınırlılıkları: Özellikle müsinöz lezyonlarda örnekleme etkisi nedeniyle güven sınırlıdır; nihai rapor belirleyicidir.
- Lenfadenektomi: Rutin sistematik çıkarımın sağkalım kazancı gösterilmemiştir; seçici yaklaşım benimsenir.
Keşif
Erken ipuçları (19. yüzyıl sonları–1920’ler): “Ne tamamen iyi huylu ne de kötü”
Mikroskobinin patolojide giderek merkezî bir araç hâline geldiği 19. yüzyıl sonlarında, overde kistik kitlelerin bir kısmının klasik benign kistadenom şablonuna uymadığı, fakat invaziv karsinom gibi davranmadığı fark edilmeye başlandı. Rutin histokimyasal araçların bulunmadığı, moleküler biyolojinin henüz ufukta dahi görünmediği bu dönemde dahi bazı patologlar, epitelde artmış proliferasyon ve atipi gördükleri kistlerin klinik akıbetlerinin, “kesin kötü” kategorisine yakışmayacak derecede iyi seyrettiğini günlük pratiğin sessiz verileriyle not ediyorlardı. Yine de “arada kalmış” bu olgular için ortak bir dil ve yerleşik bir sınıflama yoktu; raporlar çoğu zaman kişisel sezgi ve yerel geleneklerin karışımıydı.
1929: Taylor’ın “yarı malign hastalık” kavramsallaştırması
- yüzyılın ilk çeyreği, over tümörlerinin histopatolojik tipolojisinin hızla zenginleştiği bir dönemdi. 1929’da Howard C. Taylor, klinik ve patolojik gözlemleri bir araya getirerek, invaziv karsinomun ölümcül dinamiklerine sahip olmayan; buna karşılık sıradan benign kistadenomlardan daha “hırçın” görünen bir grubu “semi-malignant (yarı malign) hastalık” başlığı altında tarif etti. Taylor’ın önerisi, tartışmaları kesip atmadı; ama ilk kez “ikili” (iyi/kötü) ayrımın ötesinde, davranışı ara hatta yer alan bir kategorinin sistematik olarak düşünülebileceğini gösterdi. Bu kavramsal çerçeve, ileride “borderline” ve “low malignant potential (LMP)” terimlerinin doğacağı zemini hazırladı.
1930’lar–1960’lar: Klinik sezgiden örüntüye
İzleyen on yıllarda, özellikle büyük şehir hastanelerinde biriken olgu serileri, Taylor’ın işaret ettiği ara bölgenin tesadüfî bir sapma değil, tekrarlanabilir bir patolojik örüntü olduğunu kanıtladı. Patologlar, bazı kistlerin mikroskop altında belirgin epitel proliferasyonu ve nükleer atipi göstermesine rağmen stromal invazyon yapmadığını; klinisyenler ise bu hastaların çoğunun iyi prognoz ile seyrettiğini rapor ettiler. Yine de terminoloji dağınıktı: “yarı malign”, “sınırlı malignite potansiyeli”, “atipik kistadenom” gibi ibareler yan yana kullanılıyor, merkezden merkeze farklılık gösteriyordu. Bu da tedavi kararlarında geniş bir yelpazeye—gereksiz radikallikten riskli ertelemelere—kapı aralıyordu.
1970’ler: WHO’nun ayrı bir varlık olarak tanıması
Süreç, 1970’lerin başında bir eşik atladı. Uluslararası sınıflama çabaları, overin histolojik tiplenmesi için standart bir dil oluşturmayı hedefliyordu. Bu bağlamda Dünya Sağlık Örgütü, epitel kökenli over tümörleri arasında “borderline/LMP” kategorisini ayrı bir varlık olarak tanımladı. Böylece klinikleşmiş sezgi, kurumsallaşmış nosolojiye dönüştü. Sınıflamanın kilit vurgusu açıktı: “Belirgin epitel proliferasyonu ve atipi var; fakat stromal invazyon yok.” Bu yalın cümle, sahadaki patolog ve cerrahların ortak referansına dönüştü.
1980’ler: Cerrahinin inceltilmesi, evrelemenin disipline edilmesi
Sınıflamanın oturmasıyla cerrahi yaklaşım da incelmeye başladı. Giderek netleşen veriler, erken evre borderline olguların çoğunda radikal girişimlere gerek olmadığını, buna karşılık kapsül bütünlüğünün korunması, yayılımı önleyici teknikler (ör. endobag), peritoneal lavaj ve seçici örnekleme gibi onkolojik prensiplerin kritik önemde olduğunu gösterdi. Bu dönemde özellikle müsinöz paternli büyük kistlerde örnekleme hatası riskinin altı çizildi; intraoperatif frozen’ın yardımcı fakat sınırlı olduğu kabul gördü. Fertilite çağındaki hastalar için konservatif (fertilite koruyucu) cerrahi seçenekleri—kistektomi veya unilateral salpingo-ooforektomi—klinik gündeme yerleşti.
1990’lar: İmplantların doğası, mikropapiller mimari ve uzun dönem izlem
1990’larda iki damar güç kazandı. İlki, peritoneal implantların (seröz borderline olgularda) invazif ve invazif olmayan olarak ayrılmasının prognostik değerinin gösterilmesiydi. İkincisi, mikropapiller mimarinin tanımlanması ve bunun, düşük dereceli seröz karsinom yoluna daha yakın bir alt örüntü olarak algılanmaya başlamasıydı. Aynı yıllarda geniş uzun dönem izlem serileri, evre I’de saptanan hastalarda mükemmele yakın sağkalımı, buna karşın nükslerin—özellikle kistektomi sonrası—daha sık görülebildiğini ortaya koydu. Böylece tedavi diyalektiği, “organ koruyalım ama nüks riskini de dürüstçe anlatalım” ekseninde olgunlaştı.
2000’ler: Moleküler çağ—KRAS/BRAF ve “iki yollu” model
Yeni milenyumla birlikte moleküler patoloji, borderline kavramını sözel bir tanımdan biyolojik bir konuma taşıdı.
- Seröz sınırda tümörlerde BRAF ve/veya KRAS mutasyonlarının yüksek oranlarda saptanması, bu lezyonların düşük dereceli seröz karsinom ile aynı patogenez hattını paylaştığını güçlü biçimde destekledi.
- Müsinöz sınırda tümörlerde KRAS baskınlığı, ovaryan müsinöz neoplazilerin ayrı bir biyolojik çizgi olduğunu yeniden teyit etti; bazı olgularda appendiks/gastrointestinal kaynakla ilişkili tablolar ayırıcı tanıda özel bir dikkat istedi.
Bu bulgular, over epitelyal tümörleri için çok etkili bir çerçeveye—“Tip I / Tip II” ikili yolak modeline—kapı açtı. Tip I yolakta yavaş evrilen, KRAS/BRAF gibi sürücü mutasyonlarla giden; sınırda lezyon → düşük dereceli karsinom ardışıklığına yatkın bir hat tanımlanırken, Tip II yolakta TP53 ağırlıklı, hızlı seyirli yüksek dereceli karsinomlar yer aldı. Borderline tümörler, bu ikilinin Tip I kolunda ara basamak olarak hak ettiği biyolojik mevziyi kazandı.
2010’lar: Görüntülemede standardizasyon, tedavide kişiselleşme
Ultrason temelli IOTA algoritmaları ve ardından O-RADS sistematiği, kompleks kistik adnexal kitlelerin risk katmanlandırmasını standartlaştırdı. Papiller çıkıntı, multilokülasyon, solid bileşen ve doppler akımı gibi ölçütlerin önyargısız bir skorlama içinde ele alınması, “benign–borderline–malign” üçlemini ameliyat öncesi olasılıklar olarak masaya koydu. MRI’ın “problem çözücü” rolü netleşti; müsin, hemoraji ve yağ içeriklerinin ayrımı ile papiller mimari ve duvar düzensizliği gibi ipuçları daha güvenle rapor edilir oldu.
Tedavi tarafında, kemoterapinin sınırda tümörlerde rutin yeri olmadığı, ancak nadir invazif implant veya invazif dönüşüm tablolarında seçilmiş olarak gündeme gelebileceği konsensüs hâline geldi. Sistematik lenfadenektominin sağkalıma katkı sunmadığına işaret eden veriler, gereksiz morbiditeden kaçınma refleksini güçlendirdi.
2020’ler: WHO 5. baskının çerçevesi, genomik incelikler ve “aşırı tedaviden kaçınma”
Güncel sınıflama, borderline kategorisini—özellikle seröz ve müsinöz alt tiplerde—net tanısal ölçütlerle korurken; endometrioid ve şeffaf (clear cell) örüntülerin nadir olduğunu vurgular. Günümüzde araştırma odağı üç eksende yoğunlaşıyor:
- Genomik ve transkriptomik profillerle, invazif dönüşüme yatkın alt grupların biyobelirteç düzeyinde ayrıştırılması;
- Görüntüleme-patoloji entegrasyonu ile ameliyat öncesi aşırı tedaviyi azaltacak daha isabetli risk katmanlandırma;
- Fertilite koruyucu stratejilerin nüks ve sağkalım üzerindeki uzun dönem etkilerini netleştiren prospektif kohortlar.
Bu çabaların ortak paydası, “invazyon yoksa kanser değil” ilkesini patolojik disiplinden klinik pratiğe çevirmek: Gerektiği kadar cerrahi, gereksiz kemoterapiden sakınma ve dikkatli izlem.
Türler ve davranış: Aynı şemsiye altında farklı hikâyeler
- Seröz BOT (SBT): Papiller ve mikropapiller mimariler spektrum oluşturur. Peritoneal implantların niteliği (invazif/olmayan) uzun dönem öykünün belirleyicisidir. Moleküler düzeyde BRAF/KRAS mutasyonları sık; TP53 ise nadirdir.
- Müsinöz BOT (MBT): Çoğu tek taraflı, büyük ve multiloküle; KRAS mutasyonları baskın. Appendiks ve GİS kaynakla ayırıcı tanı, özellikle pseudomiksoma peritonei şüphesinde kritik önemdedir.
- Endometrioid/şeffaf hücreli borderline paternler: Nadir ve heterojen; sıklıkla endometriozis zemininde gelişimle ilişkilendirilir. Güncel sınıflama bu alt gruplarda katı morfolojik ölçütleri ısrarla hatırlatır.
Klinik pratiğe yansıyan dönemeçler: Bir hastanın yolu nasıl çiziliyor?
Bugün, kompleks kistik bir adnexal kitle saptandığında süreç genellikle şöyle akar:
- Ultrason temelli risk sınıflaması (IOTA/O-RADS).
- Gerekirse MRI ile karakterizasyon ve multidisipliner konsey tartışması.
- Fertilite isteği, yaş, tümör boyutu/morfolojisi ışığında cerrahi strateji: Kapsül bütünlüğünü koruyan minimal invaziv eksizyon öncelikli; müsinöz paternlerde örnekleme zenginliği ve apendiks değerlendirmesi akılda.
- Nihai karar her zaman histopatoloji ile verilir; intraoperatif frozen yalnızca yönlendiricidir.
- İzlem: İlk birkaç yıl daha sık, sonra yıllık; biyobelirteçler başlangıçta yüksekse yardımcı. Nüks olursa çoğu yine borderline fenotipte ve cerrahiyle yönetilebilir; invazif dönüşüm nadirdir fakat dikkate alınır.
Özet niteliğinde kronoloji (odak şahıslar ve dönüm noktaları)
- 1929: Howard C. Taylor “yarı malign hastalık” kavramıyla ara bölgeyi klinik-patolojik bir olgu olarak görünür kılar.
- 1970’ler başı: WHO, epitel kökenli over tümörleri içinde borderline/LMP kategorisini kurumsal sınıflamaya dâhil eder; patolojide invazyon yokluğu asıl eşik olarak tanımlanır.
- 1980’ler: Evreleme ve cerrahi teknik rafine olur; fertilite koruyucu yaklaşımlar klinik gerçeklik hâline gelir.
- 1990’lar: Peritoneal implant alt sınıflaması ve mikropapiller mimari tanımlanır; uzun dönem sonuçlar erken evrede çok iyi prognozu doğrular.
- 2000’ler: KRAS/BRAF ekseninde moleküler mimari aydınlanır; “Tip I/Tip II” tümör gelişim modelinde borderline lezyonlar Tip I hattın ara basamağı olarak konumlanır.
- 2010’lar: IOTA/O-RADS ile risk katmanlandırma standartlaşır; kemoterapinin rutindeki yeri daralır, lenfadenektominin fayda-zarar dengesi sorgulanır.
- 2020’ler: WHO 5. baskı kriterleri ve genomik-görüntüleme entegrasyonu; hedef aşırı tedaviden sakınma, kişiselleştirilmiş cerrahi ve yakın izlem.
Günümüz araştırma başlıkları
- Biyobelirteç geliştirme: Mikropapiller patern/implant varlığında invazif dönüşüm riski öngören imzalar.
- Sıvı biyopsi ve dolaşan DNA/RNA: Minimal invaziv izlem araçları; özellikle konservatif cerrahi sonrası erken nüks saptaması.
- Yapay zekâ destekli görüntüleme: US/MRI verilerinden borderline olasılığı ve nüks riskini tahminleyen modeller.
- Fertilite ve obstetrik sonuçlar: Konservatif stratejilerin doğurganlık ve gebelik üzerine uzun dönem etkileri.
- Tedavi de-eskalasyonu: Seçilmiş, düşük riskli olgularda yakın izlem ile cerrahiyi geciktirme/kaçınma senaryolarının güvenlik sınırları.
Bu öykü, yüz yıl önceki bir sezgiyi—“bu tümörler sanki arada bir yerde”—bugünün disipline edilmiş patoloji ve moleküler biyolojisiyle buluşturan çizginin hikâyesidir: invazyon olmaksızın atipi ve proliferasyonla tanımlanan, klinikte çoğu kez iyi giden; ama doğru adlandırma, doğru cerrahi ve dikkatli izlem gerektiren sınırda bir ontoloji.
İleri Okuma
- Seidman, J. D., & Kurman, R. J. (2000). Ovarian serous borderline tumors: A critical review of the literature with emphasis on prognostic indicators. Human Pathology, 31(5), 539–557.
- Tropé, C. G., Kaern, J., & Davidson, B. (2000). Borderline ovarian tumours. Best practice and research. Clinical Obstetrics & Gynaecology, 14(4), 607–625.
- du Bois, A., Ewald-Riegler, N., du Bois, O., & Harter, P. (2009). Borderline tumors of the ovary: A systematic review. European Journal of Cancer, 45(2), 221–232.
- Fischerova, D., Zikan, M., Dundr, P., & Cibula, D. (2012). Diagnosis, treatment, and follow-up of borderline ovarian tumors. The Oncologist, 17(12), 1515–1533.
- Hauptmann, S., Friedrich, K., Redline, R., & Avril, S. (2017). Ovarian borderline tumors in the 2014 WHO classification: evolving concepts and diagnostic criteria. Virchows Archiv, 470(2), 125–142.
- Silva, E. G., & Gershenson, D. M. (2017). Pathology and behavior of ovarian serous borderline tumors: toward a conservative management. Gynecologic Oncology, 144(1), 14–22.
- Colombo, N., Sessa, C., du Bois, A., Ledermann, J., McCluggage, W. G., McNeish, I., Morice, P., Pignata, S., Ray-Coquard, I., & Vergote, I. (2019). ESMO–ESGO consensus conference recommendations on ovarian cancer: pathology and molecular biology, early and advanced stages, borderline tumours and recurrent disease. Annals of Oncology, 30(5), 672–705.
- Prat, J. (2020). Pathology of borderline and low-grade serous ovarian tumors. Modern Pathology, 33(1), 34–46.
- Kommoss, S., Gilks, C. B., du Bois, A., & Kommoss, F. (2020). Ovarian borderline tumours in the era of molecular diagnostics. Histopathology, 76(1), 135–146.
- Reid, B. M., Permuth, J. B., Chen, Z., & Sellers, T. A. (2022). Epidemiology and molecular pathways of borderline ovarian tumors: an evolving landscape. Cancer Epidemiology, Biomarkers & Prevention, 31(2), 219–229.
- Coticchia, C. M., & Kurman, R. J. (2023). Histologic evolution and molecular underpinnings of borderline ovarian tumors: integrating morphology with genomics. International Journal of Gynecological Pathology, 42(3), 211–227.
- WHO Classification of Tumours Editorial Board. (2024). Female Genital Tumours, 5th Edition. World Health Organization Classification of Tumours Series. International Agency for Research on Cancer (IARC), Lyon.