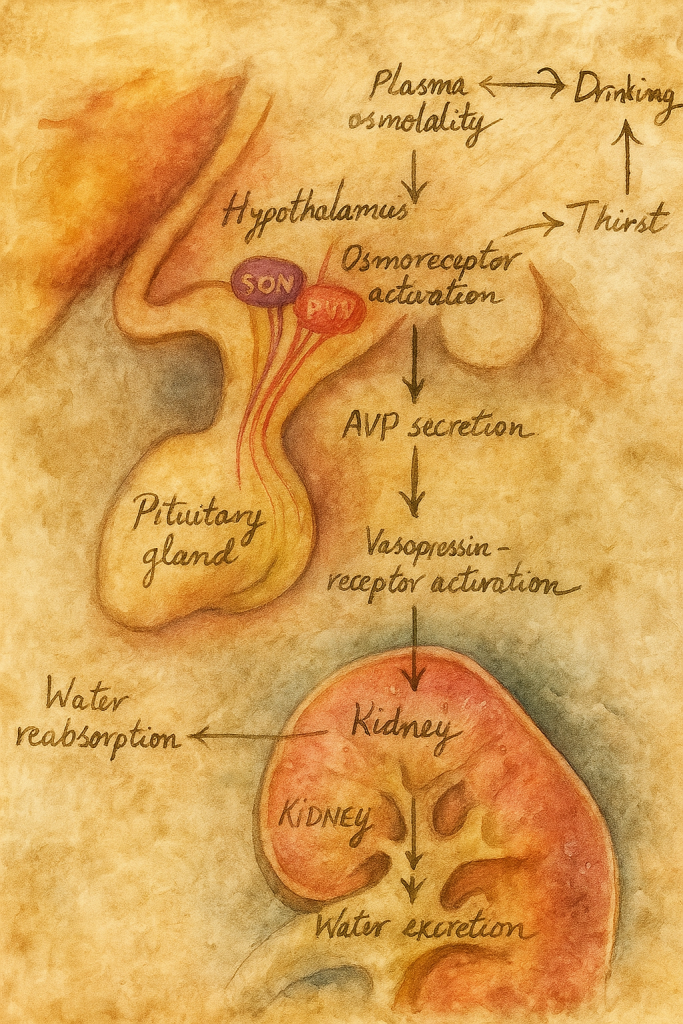
Aşağı yukarı yüz elli yılı bulan hikâyenin başında, “iç ortamın sabitliği” fikrini bilimsel düşüncenin merkezine yerleştiren Claude Bernard vardır: onun öğrencileri ve takipçileri, kanın “muhit” olarak hücrelere nasıl bir denge sunduğunu anlamaya çalışırken, su ile çözünmüş tuzların ve özellikle sodyumun bir organizmanın yaşamsal ritimlerine hükmettiğini sezmişti. Yine de “osmoreseptör” dediğimiz özel algılayıcıların varlığı—yani vücut sıvılarının osmolalitesindeki çok küçük oynamaları nöral koda dönüştüren hücreler—uzun süre yalnızca sezgi ve kuramsal gereklilik düzeyinde kaldı. Hikâye, asıl ivmesini böbreklerin su tutma kabiliyetini yöneten hipofiz arka lobu hormonunun (vasopressin/ADH) fizyolojisi aydınlandığında kazanır: antidiüretik prensibin saflaştırılması ve kimyasal doğasının anlaşılması, “pH ya da kan basıncı gibi” bir sabitin daha bulunduğunu—plazma osmolalitesinin—gözler önüne serdi.
İkinci Perde’de sahneye E. B. Verney çıkar. 1940’ların sonlarında yaptığı kusursuz fizyolojik düzeneklerle (karotid içine hipertonik eriyik infüzyonları, çapraz perfüzyon ve kontrollü diürez ölçümleri) Verney, ADH salınımının, kana karışan sodyumla değil, beynin bir yerlerindeki duyarlı alıcıların tuz/ su dengesindeki artışı “sezmesiyle” tetiklendiğini gösterir. Böylece “osmoreseptör” kavramı, saf kuramdan deneysel hakikate terfi eder: kanın osmolalitesindeki yüzde birlik artışlar—gündelik yaşamda susamayı başlatan türden çok küçük oynamalar—ADH salınımını refleks biçimde yükseltir; bu refleks, suyun böbrek tübüllerinden geri emilmesini arttırır ve içilen suyun hızla “sinyali susturmasına” olanak verir. Verney’nin köpeklerdeki o klasik “karotid hipertonik uyarım → hipofizer cevap” gösterileri, beynin ön-alt bölgelerinde, o dönemde henüz haritası kabaca çıkarılmış bir “susama alanı” ve ona komşu “osmotik kontrol devreleri” olduğuna ikna eder.
Üçüncü Perde’de yer, preoptik/ön hipotalamik alanlar çevresindeki lezyon ve mikroenjeksiyon deneylerine kalır. 1950’ler ve 60’lar boyunca, küçük elektrolit damlacıklarının anterior hipotalamusa verilmesiyle susama davranışının ani biçimde tetiklenmesi, tersi yönde, bu bölgelere yapılan sınırlı lezyonların içme davranışını “körleştirmesi”, anatomik hedefi daraltır. Aynı dönemde dolaşımsal anjiyotensinin (özellikle anjiyotensin II) merkezi etkilerinin keşfi, “susama” ile “osmotik” uyarılmışlığın birbirine eklemlendiği bir üst ağ düşüncesini doğurur. Beynin kan-beyin bariyerinin delikli/özelleşmiş pencereleri olan sirkumventriküler organlar—başta lamina terminalisin vasküloz organı (OVLT) ile forniks altı organ (SFO)—giderek daha fazla şüphe çeker; çünkü bu yapılar hem kana “açık”tır (arteriyel içeriği neredeyse doğrudan seyrederler), hem de preoptik çekirdek ve paraventriküler-supraoptik çekirdeklere zengin projeksiyonlar yollarlar. 1970’ler ve 80’lerdeki yol-izleme ve lezyon çalışmaları, “osmotik beyin”in bu iki düğüm etrafında örüldüğünü fiilen kanıtlar.
Dördüncü Perde, nöronun kendisini bir “osmotik transdüser”e dönüştüren biyofizik ile başlar. Hipotalamik nöronlar—özellikle OVLT ve supraoptik çekirdek nöronları—hacimlerinin küçülmesiyle (hipertonik ortamda su kaybı) mekanik olarak gerilen membranlarında “gerilmeyle etkisizleşen” (stretch-inactivated) katyon kanalları açar; bu, depolarizasyon ve aksiyon potansiyeli hızlanması demektir. Bu özdevinimsel osmosensitiviteye hangi moleküler gözeneklerin aracılık ettiği uzun süre tartışılır: bazı hücrelerde TRPV1-benzeri varyantların hacim büzüşmesine karşı duyarlı olduğu, başka popülasyonlarda TRPV4’ün ılımlı hipotonik-hipertonik salınımlara yanıt verdiği, hatta bazılarında mekanik kapılı katyon kanallarının (ör. Piezo ailesi ile kesişen özellikler gösteren akımlar) katkıda bulunduğu gösterilir. İçlerinden özellikle OVLT’de tanımlanan TRPV1-benzeri iletim, “hücre iskeletine bağlanmış, membran kavislenmesini algılayan” bir transdüksiyon modülü fikrini kuvvetlendirir; yani osmoreseptör nöron, yalnızca “kimyasal derişime” değil, doğrudan “hacim-mekanik” değişime kilitlidir. Bu biyofizik modül, ADH nöronlarının (supraoptik ve paraventriküler çekirdek) ateşleme paternine bağlandığında, birkaç miliosmol/kg’lık yükselmelerin dahi dakikalar ölçeğinde hormonal cevap doğurduğu açıklık kazanır.
Beşinci Perde, “tuz/su” dengesinin yalnızca osmolaliteyle değil, sodyumun mutlak derişimiyle de algılandığını gösteren buluşlarla açılır. Sirkumventriküler organların glial hücrelerinde (özellikle SFO/OVLT astrositlerinde) eksprese edilen ve klasik voltaj kapılı sodyum kanallarından yapısal olarak farklılaşan bir sensör—Na(_x) olarak adlandırılan SCN7A ürünü—uzun dönem plazma sodyumundaki değişimlere yavaş ama kalıcı bir “tonik” yanıt üretir. Bu glial algı, laktat gibi ara metabolitlerle nöronlara aktarılır; böylece “hızlı, hacim-odaklı” nöronal osmosensör ile “yavaş, sodyum-tonik” glial sensör, susama ve ADH eksenine iki zaman sabitli besleme sağlar. Bu ikili algı mimarisi, günlük yaşamda gözlediğimiz iki olguyu açıklar: tuzlu bir öğünden sonra gecikmeli ama ısrarlı susama; buna karşılık kısa sürede büyük hacimde su içilince çok hızlı kesilen susuzluk hissi.
Altıncı Perde, mimarinin devresel haritasıdır. OVLT ve SFO’nun glutamaterjik projeksiyonları median preoptik çekirdeğe (MnPO) ve oradan hipofiz arka lobunu yöneten hipotalamik nüvelere (PVN/SON) uzanır; buna paralel, SFO ve çevresinde GABAerjik “susama fren” devreleri tanımlanır. Optogenetik ve kalsiyum görüntüleme çalışmaları, SFO’daki glutamaterjik hücre gruplarının saniyeler ölçeğinde içme davranışını başlatabildiğini; GABAerjik altpopülasyonların ise içme sırasında ve hemen sonrasında devreye girerek “doyum” hissini pekiştirdiğini gösterir. Daha çarpıcı olan, “öngörücü (anticipatory) kapanış” denen olgudur: Ağıza dokunan ilk su yudumları, henüz kan ozmolalitesi değişmeden, OVLT/SFO→preoptik eksende ateşlemeyi bastırır, ADH salınımını hızla düşürür ve susama hissini dakikalar içinde söndürür. Ağız-yutak ve özofagus kaynaklı bu hızlı geri-bildirim, mide ve portal damar bölgesinden gelen daha yavaş visseral sinyallerle birleşir; beyin burada “gelecek 5–10 dakikada kana karışacak suyun” hesabını yapar. Böylece sistem, yalnızca hatayı (yüksek osmolalite) düzeltmekle kalmaz; düzelmenin hızını önceden tahmin eder.
Yedinci Perde, tek hücre çözünürlüğünde transkriptomik ve bağlanırlık atlaslarının devreye girmesiyle neredeyse bir “ansiklopedi”ye dönüşür. OVLT ve SFO’da farklı iyon kanal imzaları (ör. TRPV ailesi üyeleri, hacim-duyarlı K(^+) kanalları), peptiderjik belirteçler (ör. prodinorfin, tachykininler) ve reseptör kombinasyonları (AT(_1)R, EP(_3) vb.) ile tanımlanan altpopülasyonlar belirlenir. Bu haritalar, “aynı davranış”ın farklı bağlamsal itkiler altında (dehidrasyon, hipernatremi, hipovolemi, ateş/IL-1β aracılı pirojenik durumlar) farklı nöronal mikrodüğümlerce yönetildiğini; örneğin prostaglandin E(_2) aracılığıyla ateş ve susama arasında kurulan köprülerin ayrı devre kollarıyla işlendiğini ortaya koyar. Glia yalnızca metabolit köprüsü değildir: aquaporin-4 yoğun son ayaklar, perivasküler boşluklarda suyun mikrodolaşımını düzenler; astrosit kalsiyum dalgaları nöronal osmosensitivitenin eşik ve kazancını ayarlar. Bu “nöron-glia ansamblı”, osmoreseptör kavramını tek hücreden çok hücreli bir işbirliği paradigmasına taşır.
Sekizinci Perde, klinik fizyolojinin sahnesidir. Merkezi diyabetes insipidus, posterior hipofiz eksenindeki hasarla su tutma refleksinin çökmesini sergilerken; dipsogenik sendromlarda (OVLT/SFO çevresi irritasyonu/uyarılmışlığı) susama eşiği aşağı kayar ve birey, normal osmolalitede dahi içmeye zorlanır. Psikojenik polidipsi ile osmotik devrelerin patolojik uyarılması arasındaki ayrım, bugün nörogörüntüleme ve ADH/ko-peptin dinamikleriyle daha nesnel çizilebilmektedir. Yaşlılıkta susama eşiğinin yükselmesi ve “susuzluğu fark etme” penceresinin daralması, devrenin duyusal ve motivasyonel kollarında yaşa bağlı ayar kaymalarını düşündürür; bu, sıcak dalgaları ve ilaç etkileşimlerinde görülen kırılganlığın da nörobiyolojik altlığını açıklar. Kafa içi enfeksiyonlar, sarkoidoz veya paraneoplastik süreçler gibi nadir durumlar sirkumventriküler organları seçici biçimde hedefleyerek “osmotik denge bozukluğu” tabloları üretebilir.
Dokuzuncu Perde, bedenin dışarıyla kurduğu daha büyük döngülere odaklanır. Yemek öncesi öğrenilmiş sinyaller (zamanlama, tat/ koku), içme davranışını başlamadan önce ayarlar; bağırsak-liver–vagal eksen, portal kanın ozmolar içeriğini hızlıca beynin sap ve hipotalamik merkezlerine iletir. Bu “çok kaynaklı” veri füzyonu, susama/ADH ekseninin yalnızca bir hata-düzeltme regülatörü değil, aynı zamanda tahmin yürütme ve maliyet-minimizasyonu yapan bir karar modülü olduğunu gösterir: Sıcak yaz gününde koşuya çıkmadan önce “önlem içmesi”, bu devrenin öğrenilmiş ve bağlamsal girişlerle çalıştığının davranışsal kanıtıdır.
Onuncu Perde’de, geleceğe dönük sorular belirir: Osmosensitif nöronlarda hacim-duyarlı akımların tam moleküler kimliği nüve nüve ayrıştırılabilir mi? Glial Na(_x)–nöron ekseni farmakolojik olarak hedeflenirse—örneğin hipernatremi eğilimi olan kalp yetmezliği ya da diyaliz hastalarında—davranışsal ve hormonal cevap eşikleri rasyonel biçimde kaydırılabilir mi? Tek-hücre düzeyinde “osmotik fenotipler”i tanımlayan kanal/reseptör imzaları, yaşlanma ve inflamasyon durumlarında nasıl yeniden yazılıyor? Ve en önemlisi, öngörücü kapanışın beyin sapı–preoptik ekseninde hangi sinaptik ağırlıklar gerçek zamanlı olarak ayarlanıyor? Bu soruların peşinden giden deneysel çizgi, osmoreseptör hikâyesini klasik homeostaz fiziolojisinden bilişsel sinirbilime bağlayan bir köprüye dönüştürmektedir: organizma yalnızca iç dengesini “kurtarmak” için değil, gelecekteki dengesizliklerin olasılığını en aza indirmek için de içer.










Yorum yazabilmek için oturum açmalısınız.