Gizemli Bir Hedefin Keşfi (1990’lar)
1990’ların başlarında kanser araştırmaları dünyasında, henüz adı konulmamış bir molekül bilim insanlarının dikkatini çekti. 1992 yılında Fransa’da Dr. Yvon Laabi ve ekibi, bir T-hücreli lenfoma hastasının genetik analizini yaparken kromozom 16’da yeni bir gen keşfetti. Bu gen, lenfoma hücresinde başka bir genle birleşmiş haldeydi ve araştırmacılar onun normal işlevini merak etmeye başladılar. İki yıl sonra, 1994’te aynı ekip bu genin normalde olgunlaşan B lenfositlerinde aktif olduğunu ortaya koydu. Bu nedenle gene “B hücre matürasyon antijeni” (BCMA) adını verdiler. BCMA’nın B hücre gelişimiyle ilişkili olduğu anlaşılsa da, o dönemde kimse bunun bir gün kanser tedavisinde kilit rol oynayacak bir hedef olacağını tahmin etmemişti.
Aynı yıllarda tıp tarihindeki “sihirli mermi” fikri, yani hastalığı hedef alıp başka hiçbir şeye zarar vermeyecek bir ilaç hayali, yeniden canlanıyordu. Monoklonal antikor teknolojisinin 1980’lerde gelişmesiyle belirli hücrelere özgü tedaviler mümkün hale gelmiş, ancak bu antikorların kanserde kullanımı henüz emekleme aşamasındaydı. Yine de bilim insanları, eğer doğru hedef molekül bulunabilirse bir antikorun kanserli hücreyi doğrudan vurabileceği fikrine tutkuyla bağlıydılar. BCMA geninin keşfi, belki de böyle bir hedef olabileceğine dair ilk işaretlerden biri olacaktı.
Plazma Hücrelerinin Zayıf Noktası (2000’ler Başları)
2000’lere gelindiğinde, bağışıklık bilimi BCMA’nın gizemini yavaş yavaş çözüyordu. 2000 yılında yapılan çalışmalar, BCMA proteininin normal B lenfositlerin yüzeyinde de bulunduğunu gösterdi. Dahası, 2004’te Dr. Jelinek ve Dr. Allison Novak gibi araştırmacılar BCMA’nın multipl miyelom adı verilen kemik iliğini tutan bir kan kanserinde, yani kötü huylu plazma hücrelerinde yoğun şekilde üretildiğini ortaya koydular. Bu keşif, BCMA’yı bilim dünyasında birden ilgi odağı haline getirdi: Çünkü BCMA, miyelom hücrelerinin neredeyse tamamında varken sağlıklı dokularda yok denecek kadar az bulunuyordu. Bu da demekti ki, BCMA’yı hedef alan bir tedavi yalnızca kanserli hücreleri vurarak sağlıklı hücrelere zarar vermeyebilirdi.
Aynı dönemde immünoloji alanında başka bir önemli buluş gerçekleşti. Araştırmacılar BAFF ve APRIL adını verdikleri iki molekülün, BCMA’nın doğal ligandları (bağlandığı sinyal proteinleri) olduğunu keşfettiler. BAFF ve APRIL, B hücreleri ve plazma hücreleri için adeta “büyüme faktörü” gibiydi; bu sinyaller hücrelere hayatta kalma ve çoğalma mesajı iletiyordu. İşte BCMA, bu mesajları alan alıcıydı. Yani miyelom hücreleri hayatta kalmak için BCMA aracılığıyla BAFF/APRIL sinyallerine bel bağlıyordu. Bu anlayış, bilim insanlarının zihninde bir ampul yaktı: Eğer BCMA’yı kapatabilir veya yok edebilirsek, miyelom hücrelerini aç bırakabiliriz. BCMA bir anlamda miyelomun “zayıf karnı” olarak görülmeye başlandı.
Bu yıllarda multipl miyelom tedavisinde de bir devrim yaşanmaktaydı. 1990’ların sonundan itibaren yeni ilaçlar – talidomid ve onun türevleri lenalidomid, ardından bortezomib gibi proteazom inhibitörleri – devreye girmiş, hastaların yaşam süresi belirgin şekilde uzamıştı. Yine de bu hastalık tamamen yenilemiyor, pek çok hasta eldeki tüm ilaçlar tükendiğinde tekrar nüksediyordu. 2000’lerin ortalarına gelindiğinde deneyimli hematologlar, “üçlü refrakter” denilen bu durumdaki hastalar için bambaşka mekanizmalara ihtiyaç olduğunu dile getiriyordu. BCMA hedefi işte tam da bu ihtiyaca uygun görünüyordu. Hem özgünlüğüyle, hem de miyelom hücrelerinin yaşamındaki kritik rolüyle BCMA, laboratuvarlarda yeni stratejilerin odak noktası haline geldi. Kimileri BCMA’ya bağlanan bir monoklonal antikor geliştirmenin peşine düşerken, kimileri de bu hedefe yönelik CAR-T hücre tedavileri tasarlamaya girişti. Farklı yaklaşım ve kurumlar aynı hedefe kilitlenmişti: Miyelomu BCMA’dan vurmak.
İnovatif Bir Fikir: Antikor-İlaç Konjugatları
BCMA’yı hedeflemenin bir yolu da, antikorların taşıyıcı olarak kullanıldığı antikor-ilaç konjugatı (ADC) teknolojisiydi. Bu fikir aslında bir asır öncesine, Paul Ehrlich’in “sihirli mermi” konseptine dayanıyordu: Yani bir antikor hedefe kilitlenip, ucuna bağlı güçlü bir toksini doğrudan kanser hücresine teslim edecekti. 2000 yılına gelindiğinde bilim dünyası ilk ADC örneğini görmüştü bile (akut lösemide kullanılan Mylotarg adlı ilaç). Sonraki yıllarda Hodgkin lenfomasında brentuximab vedotin ve metastatik meme kanserinde trastuzumab emtansin gibi ADC’ler onay alarak bu teknolojinin işe yaradığını gösterdiler. Ancak multipl miyelom için daha önce ADC yaklaşımı kullanılmamıştı. Bununla birlikte, 2010’lara doğru uygun hedefler ve uygun teknoloji olgunlaşmıştı. BCMA’nın ideal bir hedef olarak ortaya çıkması, ADC stratejisinin miyelomda uygulanabileceğine dair umut verdi.
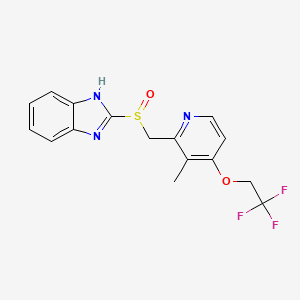
Tam da bu noktada, GlaxoSmithKline (GSK) adlı uluslararası ilaç şirketi BCMA hedefini mercek altına aldı. GSK bünyesindeki bilim insanları 2010’ların başında laboratuvarlarında hummalı bir çalışma başlattılar. İngiltere ve ABD’deki Ar-Ge merkezlerinde bir ekip, BCMA’yı tanıyacak yüksek özgüllükte bir antikor geliştirmeye koyuldu. Aylarca süren deneme-yanılma sonucunda insan kaynaklı, afukozile (fukoz şekerini içermeyen) bir antikor oluşturmayı başardılar. Bu yapısal değişiklik, antikorun bağışıklık hücrelerini (NK hücreleri gibi) kanser hücresini öldürmeye daha iyi teşvik etmesini sağlıyordu. Fakat bu antikorun asıl yenilikçi tarafı, ona eklenen ölümcül yükteydi: Araştırmacılar antikorun tail ucuna, monometil auristatin F (MMAF) adı verilen güçlü bir toksik molekülü bağladılar. Bu molekül, hücre içindeki mikrotübül denen iskelet yapıları parçalayarak hücrenin bölünmesini durdurma potansiyeline sahipti. Böylece antikor BCMA’ya yapıştığında, hücre onu içine alacak ve içeride MMAF serbest kalarak kanser hücresini içeriden vuracaktı.
Elbette bu toksik yükün, hedefine varmadan antikordan kopmaması gerekiyordu. Bu nedenle GSK ekibi, maleimidokaproil adı verilen sağlam bir kimyasal bağlayıcı (linker) kullandı. Bu linker, kan dolaşımında istikrarlı kalacak, sadece hücrenin içindeki enzimlerle karşılaştığında toksini bırakacaktı. Tüm bu tasarım aslında o dönemde ADC alanında çığır açan Seattle Genetics adlı biyoteknoloji firmasının geliştirdiği teknolojilere dayanıyordu. GSK, Seattle Genetics ile yaptığı iş birliği sayesinde onların “auristatin” temelli öldürücü ajanını ve linker sistemini kullanma lisansına sahip olmuştu. Seattle Genetics’in kurucusu Dr. Clay Siegall ve ekibi, yıllar önce ADC’lerin bu altyapısını hazırlamış ve brentuximab vedotin gibi örneklerle başarısını kanıtlamıştı. Şimdi ise bu teknoloji, GSK’nın BCMA hedefli antikoruna uygulanıyordu. Ortaya çıkan moleküle henüz bir ticari isim verilmemişti; laboratuvar koduyla GSK2857916 olarak anılıyordu. Ancak ileride dünyaca tanınacak ismiyle: Belantamab mafodotin.
Laboratuvardan Kliniklere: İlk Başarı Kıvılcımları
2013 yılı civarında GSK’nın geliştirdiği bu deneysel ilacı denemek üzere önemli bir ortaklık kuruldu. Dünyanın önde gelen miyelom uzmanlarından Dr. Kenneth Anderson ve ekibi (Dana-Farber Kanser Enstitüsü, Harvard) ile GSK bilim insanları güçlerini birleştirdi. Bir yanda deneyimli klinisyen ve araştırmacılar, diğer yanda ilacı geliştiren endüstri kimyagerleri birlikte çalışarak GSK2857916’yı laboratuvar testlerine tabi tuttular. Bu iş birliği, kısa sürede heyecan verici bulgular doğurdu. Deney tüplerinde, BCMA’ya bağlı MMAF yüklü bu antikor, miyelom hücrelerini adeta “bilim kurgu” filmlerindeki hassasiyetle avlıyordu. Normal sağlıklı hücreler ise bu saldırıdan etkilenmiyordu; çünkü yüzeylerinde BCMA yoktu ve ilacın radarına girmiyorlardı. Dahası, araştırmacılar ilacın laboratuvar modellerinde tek bir mekanizma ile değil, çok yönlü etki gösterdiğini fark ettiler. Belantamab mafodotin, bir yandan içindeki toksin sayesinde bölünmekte olan miyelom hücrelerini öldürürken, diğer yandan antikor kısmıyla bağışıklık sistemini (NK hücreleri ve makrofajları) tetikleyerek kanser hücrelerini yok etmeye yardımcı oluyordu. Bu çift taraflı saldırı, o güne dek miyelom tedavisinde pek görülmemiş bir özellikti.
Preklinik deneylerin belki de en dramatik anı, ilacın hayvan modellerinde sınandığı gün yaşandı. Araştırmacılar, laboratuvar farelerine insan miyelom hücrelerinden oluşturulmuş tümörler nakletmişlerdi. Sonra bu farelere GSK2857916 verildi ve sonuçlar nefes kesiciydi: Tedavi edilen hayvanlarda tümörler hızla küçülüyor, bazı farelerde tamamen yok oluyordu. Hatta tedaviyle tümörleri temizlenen bu hayvanlar aylar boyunca hastalıksız yaşadı; kanser geri gelmedi. Bilim insanları ilk kez BCMA hedeflemesinin, hem de tek başına bir ilaçla, böylesine güçlü bir etki doğurduğunu gözlemliyorlardı. Bu sonuçlar 2014 yılında bilimsel bir dergide yayımlandığında, miyelom araştırmaları camiasında büyük bir heyecan dalgası yarattı. Makalenin ortak yazarlarından Dr. Nikhil Munshi ve Dr. Paul Richardson gibi deneyimli klinisyenler, “bu yeni ADC molekülü, miyelom tedavisinde bir sonraki kuşak immünoterapinin habercisi olabilir” şeklinde yorumlar yapmaya başladılar.
Artık sıradaki adım belliydi: Bu umut vaat eden molekülü, insanlarda deneme zamanı gelmişti. 2015 yılına girilirken GSK, “DREAMM-1” adı verilen bir faz I klinik çalışma planını duyurdu. (DREAMM, “Drug Research Enabling a Antibody Mediated Mechanism” gibi uzun bir açılımın kısaltmasıydı, ama aynı zamanda “rüya” anlamına gelen dream kelimesini barındırmasıyla da dikkat çekiyordu). Dünya çapında birkaç seçkin kanser merkezinde, başka tedavi şansı kalmamış ileri evre multipl miyelom hastalarına ilk kez belantamab mafodotin verilecekti. İlk hastalar ilacı almaya başladığında, hem onlar hem de doktorları için bu oldukça cesur bir adımdı. Sonuçta daha önce hiç denenmemiş bir biyolojik ilaçtan, üstelik zehirli bir molekül taşıyan bir antikordan söz ediliyordu. Ancak eldeki veriler cesaret vericiydi ve çaresiz hastalar için potansiyel fayda, riskten çok daha ağır basıyordu.
DREAMM-1 denemesine katılan hastalar birer birer ilacı aldıkça, veriler düzenli aralıklarla analiz ediliyordu. Araştırmayı yürüten doktorlar, her yeni analizde biraz daha umutlandı. En sonunda sonuçlar açıklandığında görüldü ki, belantamab mafodotin verilen miyelom hastalarının yaklaşık %60’ında tümör yükü belirgin oranda azalmıştı. Bu, tek bir ilaçla elde edilen ve daha önce birçok tedavi almış bir hasta grubunda alışılmadık derecede yüksek bir yanıt oranıydı. Dahası, bazı hastalarda kanser tamamen saptanamaz hale gelmiş (tam yanıt) ve bu durum aylarca devam etmişti. Elbette tedavi yan etkisiz değildi; beklenebileceği gibi hastaların bir kısmında kanda düşük trombosit sayıları (kan pulcukları) ve kansızlık gibi durumlar gelişti. Bunlar kemik iliğini etkileyen pek çok güçlü kanser ilacında görülen yan etkilerdi. Genel olarak ise güvenlik profilinin yönetilebilir olduğu düşünüldü. Kısacası, ilk insan denemesi ilacın gerçekten işe yaradığını kanıtlamıştı. Bu sonuç, belantamab mafodotin’in hikâyesinde bir dönüm noktasıydı. Artık GSK ve ortakları ilacın daha büyük çapta sınanmasına ve onay sürecine hazırlanıyordu.
Büyük Denemeler ve Zafer Anı (2016–2020)
İlk küçük ölçekli denemeden alınan olumlu sinyaller, daha kapsamlı bir çalışmanın önünü açtı. 2017 yılında GSK, “DREAMM-2” adlı faz II çalışmayı başlattı. Bu çalışma, ilacın etkinliğini ve güvenliğini daha geniş bir hasta grubunda değerlendirecekti. Katılan hastaların hepsi, “üçlü refrakter” diye tabir edilen gruptandı: Yani daha önce hem proteazom inhibitörü, hem immunomodülatör, hem de CD38’e karşı monoklonal antikor (daratumumab gibi) almış ama hastalığı bu tedavilere rağmen ilerlemiş hastalar. Bu noktada bu hastalara söylenebilecek pek bir şey kalmıyordu; klasik kemoterapilerle bir kez daha şanslarını denemekten başka. İşte DREAMM-2, bu zorlu hasta grubunda belantamab mafodotin’in ne yapabileceğine baktı. Çalışma dünyanın dört bir yanındaki onkoloji merkezlerinde hızla hasta kaydetti; zira yeni bir umut belirmişti.
2019 yılının sonlarında DREAMM-2 çalışmasının sonuçları açıklandı. Beklentiler yüksek olsa da ihtiyatlı bir iyimserlik hakimdi. Sonuçlar gösterdi ki, belantamab mafodotin bu çok dirençli miyelom hastalarının yaklaşık üçte birinde (%30 civarında) tümörleri anlamlı ölçüde küçültmeyi başarmıştı. İlk çalışmadaki %60 yanıt oranına kıyasla bu daha düşük bir oran gibi görünse de, unutulmamalıydı ki DREAMM-2’ye katılan hastalar, gerçekten tedaviye en dirençli tüm seçenekleri tüketmiş hastalardı. Bu yüzden %30 yanıt bile, karşılaştırma olarak o döneme dek bu popülasyonda elde edilen en iyi sonuçlara yakındı. Klinik araştırmanın önde gelen isimlerinden Dr. Sagar Lonial, sonuçları bir konferansta sunarken “bu ilaçla daha önce hiçbir tedaviden fayda görmemiş hastalarımızda dahi anlamlı yanıtlar elde ettik” diyerek belantamab mafodotin’in önemini vurguladı. Yine de gözlerden kaçmayan bir yan etki vardı: Göz problemleri. İlacı alan hastaların önemli bir kısmında kornea adı verilen göz yüzeyinde hasar (keratopati) gelişiyordu. Hastalar bulanık görmeden şikâyet ediyor, ışığa hassasiyet yaşıyorlardı. Bu yan etki çoğu zaman geri dönüşlü olsa da, dozların geciktirilmesini veya azaltılmasını gerektirebiliyordu. Onkologlar, göz doktorlarıyla konsültasyonlar yaparak hastaları yakından izlemeye başladılar. Sonuçta bu yeni bir tür yan etkilenmeydi; daha önce kemoterapi protokollerinde alışılmadık bir durumdu ve nedeni belantamab’ın taşıdığı auristatin toksininin kornea hücrelerini de etkilemesiydi. Fakat uygun önlemlerle bu durum yönetilebiliyordu: Suni gözyaşı damlaları, koruyucu mercekler ve düzenli göz kontrolleri protokole eklendi.
Artık elde iki önemli veri seti vardı ve GSK bunları ilaç otoritelerine sunmaya hazırlanıyordu. 2020 yılının sıcak bir Ağustos gününde beklenen haber geldi: FDA, belantamab mafodotin’i hızlandırılmış onay programıyla kabul etti. İlacın ticari adı Blenrep olarak açıklandı. Bu onay, belantamab’ı FDA tarafından onaylanmış ilk BCMA hedefli tedavi ve miyelom için de ilk ADC ilacı yaptı. Onayın şartları gereği, hasta güvenliği için bir Risk Değerlendirme ve Azaltma Stratejisi (REMS) programı oluşturuldu. Blenrep’i reçete eden merkezlerin özel eğitim alması, hastaların her infüzyon öncesi göz muayenesinden geçmesi zorunlu kılındı. Çünkü ilacın en dikkat çekici yan etkisi gözle ilgiliydi ve bu şekilde hastaların görme problemleri yakından takip edilecekti.
FDA onayının hemen ardından Avrupa’da da benzer bir süreç işledi; 2020’nin sonuna doğru Avrupa İlaç Ajansı (EMA) da koşullu onay vererek ilacın Avrupa’daki kullanımı için yeşil ışık yaktı. Belantamab mafodotin, yıllar önce bir laboratuvar fikri olarak doğduğu günden bu yana muazzam bir yol katetmişti. Onay haberi hem GSK’daki araştırma ekibinde, hem de dünya genelindeki miyelom uzmanları ve hastalarında büyük bir sevinçle karşılandı. Çünkü artık, tüm standart tedavileri tükenmiş miyelom hastaları için yeni bir umut raflardaydı. Bu, hikâyenin bir doruk noktası gibiydi: Bilimsel merak, azim ve iş birliği, somut bir tedaviye dönüşmüştü.
Zorlu Sınavlar: Beklenmedik Engeller (2021–2023)
Belantamab mafodotin’in onay alması, elbette hikâyenin sonu değildi; aslında yeni bir perdesinin başlangıcıydı. 2021 ve sonrasında ilaç gerçek dünya kullanımında ve devam eden klinik araştırmalarda daha yakından incelenmeye devam etti. İlk gözlemler, ilacın pratikte de etkin olduğunu, ancak göz toksisitesinin dikkatle yönetilmesi gerektiğini doğruladı. Onkologlar her 2-3 haftada bir verilen infüzyonların sıklığını hastanın göz durumuna göre ayarlamayı öğrendiler. Kimi hastada ilacı birkaç doz aldıktan sonra birkaç ay ara vermek gerekebiliyordu; bu esnada hastalık ilerlemesin diye dikkatli bir denge kuruldu. Tüm bu tecrübeler, tıp camiasına ADC’lerin klasik kemoterapilerden farklı bir yan etki profili olabileceğini öğretti.
Bu arada, belantamab mafodotin’in asıl sınavı olan faz III çalışması da tüm hızıyla sürüyordu. DREAMM-3 adlı bu çalışma, belantamab’ı tek başına bir tedavi olarak mevcut standart tedaviyle doğrudan karşılaştırmaya amaçlıyordu. Karşısındaki rakip ise pomalidomid (bir immunomodülatör) ve deksametazon kombinasyonuydu – ki bu, o dönemde dirençli miyelomda sık kullanılan etkili bir rejimdi. 2022 yılına gelindiğinde DREAMM-3’ün sonuçları beklenenden erken bir hayal kırıklığı getirdi. Belantamab alan hastaların hastalık ilerlemeden geçirdiği süre (progresyonsuz sağkalım), maalesef pomalidomid kullanan hastalardan daha iyi değildi. İstatistiksel olarak ilacın üstünlüğü gösterilememişti. Bu sonuç hem bilimsel hem de ticari açıdan ciddi bir sorun teşkil ediyordu: Çünkü hızlandırılmış onay alan Blenrep’in FDA tarafından piyasada kalmaya devam etmesi, bu doğrulayıcı çalışmada üstünlük göstermesine bağlıydı.
Sonuçlar açıklanır açıklanmaz GSK yetkilileri FDA ile masaya oturdu ve 2022 Kasım’ında çok zor bir karar alındı: GSK, Blenrep’in ABD’deki onayını kendi isteğiyle geri çekiyordu. Bu, ilacın ABD piyasasından geçici de olsa kalkacağı anlamına geliyordu. Birkaç ay sonra benzer adımlar diğer ülkelerde de atıldı; 2023 yılı boyunca İsviçre ve bazı diğer pazarlarda belantamab erişimi durduruldu, 2024 başlarında Avrupa’da da koşullu onay iptal edildi. Bu gelişme, belantamab mafodotin’in hikâyesinde adeta dramatik bir düşüşe işaret ediyordu. Daha birkaç yıl önce büyük umutlarla onaylanmış “ilk” niteliğindeki bir ilaç, şimdi bekleneni veremediği için geri çekilmişti. Hem hekimler hem hastalar açısından bu karar üzüntüyle karşılandı. İlacı kullanarak fayda gören hastalar vardı ve şimdi bu tedaviye artık rutin erişim kalmamıştı (sadece klinik deneyler kapsamında alınabiliyordu). Bilimsel açıdan bakıldığında ise, BCMA hedefini vuran bu tek ajanlı yaklaşımın sınırlılıkları ortaya çıkmıştı: Miyelom gibi sinsi ve heterojen bir hastalığı tek bir silahla tamamen kontrol altına almak göründüğü kadar kolay değildi.
Bu zor dönemde, belantamab mafodotin projesinin arkasındaki ekip pes etmedi. GSK’nın araştırmacıları ve ilacı klinik çalışmalarda inceleyen bağımsız bilim insanları, “Acaba ilacı yanlış yerde mi denedik?” sorusunu yüksek sesle sormaya başladılar. Belantamab, çok ileri evre ve tüm ilaçlara dirençli hastalarda tek başına denenmişti; belki de daha erken evrede veya diğer ilaçlarla kombinasyon halinde kullanılırsa hakkını daha iyi verebilirdi. Ayrıca ilacın yan etki yönetimi konusunda edindikleri tecrübelerle, acaba doz ve zamanlama modifikasyonları yapılarak daha iyi sonuçlar elde edilebilir miydi? Bu soruların cevabını aramak üzere halihazırda devam eden ve henüz sonuçlanmamış bazı çalışmalar vardı. Özellikle DREAMM-7 ve DREAMM-8 adlı faz III denemelerinden gelecek veriler merakla bekleniyordu. Bu çalışmalar, belantamab mafodotin’i klasik miyelom tedavileriyle kombinasyon halinde deniyordu. Örneğin DREAMM-7’de belantamab; bortezomib (bir proteazom inhibitörü) ve deksametazon ile birlikte veriliyor ve bu üçlü kombinasyon, halihazırda güçlü bir rakip üçlü olan daratumumab + bortezomib + deksametazon ile kıyaslanıyordu. Amaç, belantamab’ı daha erken basamakta, ikinci basamak tedavi olarak kullanıp kullanamayacağını anlamaktı.
Azim ve Yeniden Doğuş (2023–Günümüz)
2023 yılının sonlarında, tüm miyelom camiasını şaşırtan ve sevindiren bir gelişme yaşandı. DREAMM-7 çalışmasından gelen ilk sonuçlar, belantamab içeren üçlü kombinasyonun, daratumumab’lı standart üçlü rejime karşı üstünlük gösterdiğini ortaya koydu. Belantamab mafodotin, bortezomib ve deksametazon üçlüsünü alan hastalar, diğer gruba kıyasla daha uzun süre hastalıksız yaşadılar ve daha fazla oranda minimal rezidüel hastalıksızlık (tedavi sonrası vücutta saptanabilir kanser kalmaması durumu) elde ettiler. Dahası, genel sağkalım açısından da belantamab’lı kombinasyon lehine anlamlı bir fark doğmuştu. Bu bulgular, ilacın tek başına değil ama doğru partnerlerle kullanıldığında değerini göstermeye başladığının kanıtıydı. Aynı zamanda doktorlar, kombine tedavi protokollerinde belantamab dozunu ve aralığını göz toksisitesini en aza indirecek şekilde ayarlamayı öğrendiklerini bildirdiler. Yani ilk baştaki zorlu deneyimler, daha güvenli ve etkili kullanım stratejilerine dönüşüyordu.
Bu olumlu gelişmeler hızla düzenleyici otoritelerin dikkatini çekti. GSK, eldeki yeni veriler ışığında belantamab mafodotin’i yeniden onaylatmak için kolları sıvadı. 2025 yılının Ekim ayında FDA, belantamab mafodotin’in geri dönüşüne yeşil ışık yaktı ve ilacı bu sefer bir kombinasyonun parçası olarak onayladı. Spesifik olarak, Blenrep + bortezomib + deksametazon üçlüsü, belirli özelliklere sahip tekrarlayan miyelom hastalarında kullanılmak üzere onay aldı. Bu, belantamab mafodotin için bir geri dönüş hikâyesiydi. Adeta küllerinden doğarcasına ilaç, daha güçlü bir biçimde sahneye çıktı. Bilim insanları ve doktorlar, bu geri dönüşün ardındaki başarının “çok yönlü mekanizmaya sahip bir ilacı doğru zamanda, doğru kombinasyonda kullanmak” olduğunu vurguladı.
Günümüzde belantamab mafodotin hala yoğun araştırmaların konusu olmaya devam ediyor. Çağdaş yaklaşımlar, ilacın potansiyelini tam olarak ortaya çıkarmak için farklı yenilikçi fikirler etrafında şekilleniyor. Örneğin, bir problem miyelom hücrelerinin zamanla yüzeylerindeki BCMA’yı kaybetmesi veya kana çözünür BCMA salgılayarak ilaca hedef şaşırtmasıydı. Bu sorunu çözmek için bilim insanları belantamab’ı, gamma-sekretaz inhibitörü adı verilen ve BCMA’nın hücre yüzeyinden koparılmasını engelleyen bir molekülle beraber denediler. Bu kombinasyon, öncül çalışmalarında miyelom hücrelerinin ilaca duyarlılığını artırdı; çünkü BCMA hedefi hücre yüzeyinde tutulmuş oldu. Ayrıca belantamab mafodotin’i bağışıklık kontrol noktası inhibitörleri (örneğin pembrolizumab gibi) ile veya lenalidomid gibi immunomodülatörlerle birleştirerek, ilacın etki gücünü pekiştirmeye yönelik araştırmalar sürüyor.
Belantamab’ın hikâyesi aynı zamanda, BCMA hedefli tedaviler çağının sadece bir parçası. Onunla paralel olarak geliştirilen CAR-T hücre tedavileri (örneğin ide-cel ve cilta-cel adlarıyla bilinen ürünler) 2021-2022’de onaylandı ve bazı hastalarda tümörleri tamamen yok edebilen çarpıcı yanıtlar gösterdiler. Yine BCMA’ya yönelen bispesifik T hücre bağlayıcı antikorlar (teclistamab gibi) piyasaya çıktı ve hastaların kendi T hücrelerini kullanarak miyelomla savaşta yeni bir cephe açtı. Tüm bu gelişmeler, BCMA’nın gerçekten de 1990’larda hayal edildiği gibi “altın bir hedef” olduğunu kanıtlar nitelikte. Ancak her yaklaşımın avantaj ve dezavantajları var: CAR-T hücre tedavileri kişiye özel ve karmaşık bir süreç gerektirirken, belantamab mafodotin gibi ADC’ler hazır ilaç olarak her yerde uygulanabiliyor. Bispesifik antikorlar ise sürekli hastaneye gelmeyi gerektirebiliyor. Bilim camiası şimdi bu araçları en iyi şekilde sıraya koymanın, gerektiğinde arka arkaya veya birlikte kullanmanın yollarını arıyor. Bazı klinik çalışmalarda, CAR-T tedavisiyle başarılı olamayan hastalara sonrasında belantamab mafodotin verilerek, farklı mekanizmaların arka arkaya kullanımının faydası değerlendiriliyor.
Belantamab mafodotin’in keşif ve gelişim süreci, modern tıpta bilimsel merakın ve inatçı çalışmanın ne kadar etkileyici sonuçlar doğurabileceğine güzel bir örnek teşkil ediyor. İlk başta genetik bir bulmaca olarak başlayan BCMA hikâyesi, yıllar içinde onlarca araştırmacının elinde şekillendi: Fransa’daki laboratuvarlardan Harvard’daki araştırma odalarına, GSK’nın endüstriyel AR-GE tesislerinden uluslararası klinik deneme sahalarına uzanan geniş bir yelpazede sayısız zihin bu sürece katkı sundu. Her bir dönüm noktasında farklı bir kahraman vardı: Dr. Laabi’nin 1990’lardaki keşfi; Dr. Anderson ve meslektaşlarının laboratuvar vizyonu; GSK ekibinin molekül tasarımındaki ustalığı; Dr. Lonial ve klinisyenlerin sabırlı deneme çabaları; ve daha niceleri… Her birinin ortak noktası, bilimsel merak ve hastalara daha iyi bir gelecek sunma arzusu idi.















Yorum yazabilmek için oturum açmalısınız.