- Aktif kas-iskelet sistemi sisteminin kronik (uzun süreli) şikayetlerinin yerel tedavisi için bir merhemdir.
- Ağrı kesici ve dolaşım-teşvik edici maddeler ağrı hassasiyetini giderir ve hareketliliği iyileştirir.
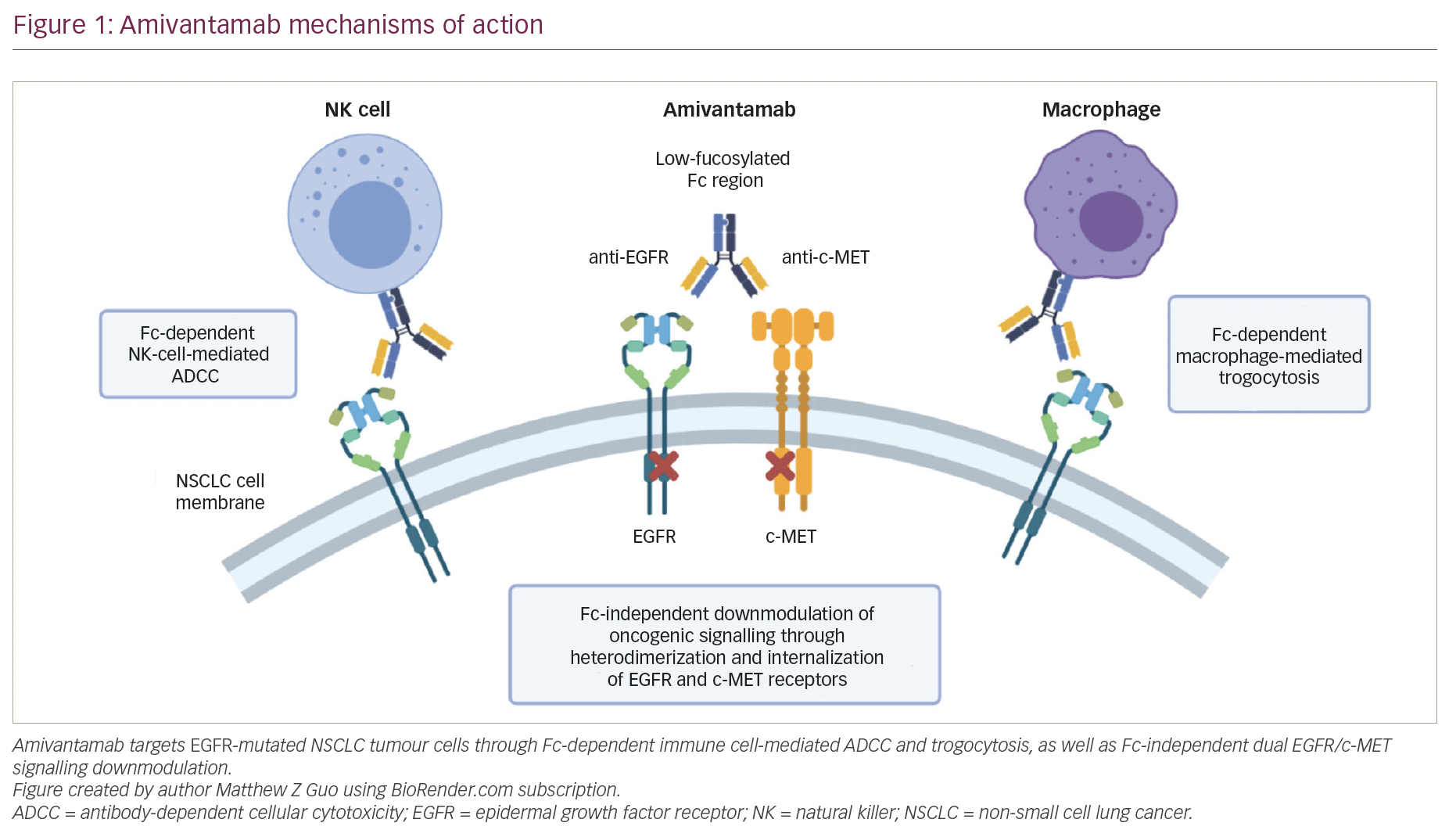
- Mayrhofer’ın Isıtma Merhemin aktif bileşenleri, analjezik ve anti-enflamatuar etkiye sahip metilsalisilat ve ayrıca kan dolaşımını teşvik eden Cayenne Biber özü ve saflaştırılmış eterik terebentin yağı olan metilsalisilat içerir. Bu bir analjezik ve ısınma etkisine yol açar.

Yetişkinler, ergenler ve 6 yaşından büyük çocuklar için kullanılır.
5 gün sonra kendinizi daha iyi hissetmiyorsanız veya daha kötü hissediyorsanız, doktorunuza başvurun.
Travma merhem ısınma Mayrhofer ile sağlıklı cilde uygulanır:
- morluklar, incinmeler, burkulmalar gibi daha eski yaralanmalar
- Kas-iskelet sisteminin aşınma ve yıpranma belirtileri
- romatizmal şikayetler
- tenisci dirseği
- siyatik ağrısı
Kontrendikasyon
Kullanmadan önce nelere dikkat etmelisiniz?
- Metil salisilat, terebentin yağı, kırmızı biber özü veya bu ilacın diğer bileşenlerinden herhangi birine karşı alerjiniz varsa.
- kanama eğilimi, mide ve bağırsak ülserleri, ciddi karaciğer veya böbrek hasarı olan hastalarda büyük ölçekli uzun süreli tedavi olarak.
Mayrhofer travma merhemi kullanmadan önce lütfen doktorunuz veya eczacınız ile konuşunuz.
- Sadece harici kullanım içindir. Yutmayın.
- Sadece sağlıklı cilt üzerinde kullanın, mukoza zarlarına, açık yaralara veya gözlere sürmeyin.
- Metil salisilat içeriği nedeniyle ağrı kesicilere karşı intoleransı olan hastalarda dikkatli olunması önerilir.
- Grip, su çiçeği veya ateşi olan çocuklara dikkat edin. Kullanmadan önce doktorunuza danışınız.
- çocuklar ve gençler
- Yeterli veri bulunmadığından 6 yaşından küçük çocuklarda kullanılması önerilmemektedir.
Kullanım
Başka ilaçlar alıyorsanız/kullanıyorsanız, yakın zamanda aldıysanız/kullandıysanız veya başka ilaçlar alıyorsanız/kullanacaksanız doktorunuza veya eczacınıza söyleyiniz.
Salisilat içeren merhemler uzun süre ve geniş alanlarda kullanılıyorsa, aşağıdaki maddelerle etkileşimler mümkündür:
- Kanı sulandıran ilaçlar (artan kanama riski).
- Metotreksat, belirli kanserlerde ve belirli artrit formlarını tedavi etmek için kullanılır.
- Hipoglisemik (düşük kan şekeri seviyeleri çok düşük).
- gut için bazı ilaçlar.
- dehidrasyon için bazı ilaçlar.
- kortizonsuz ağrı ve romatizma ilacı.
- kortizon ilaçları.
- Alkol ile birlikte travma merhem ısınma Mayrhofer uygulanması
- Aynı anda alkol alınırsa mide mukozasına zarar veren etki şiddetlenebilir.
Bu ilacı her zaman tam olarak bu kullanma talimatında belirtildiği şekilde veya doktorunuzun veya eczacınızın size söylediği şekilde kullanın. Emin değilseniz doktorunuza veya eczacınıza danışınız.
Yetişkinler, ergenler ve 6 yaşından büyük çocuklar için önerilen doz:
- Harici kullanım için, merhemi günde birkaç kez ince bir film halinde uygulayın ve masaj yapın.
6 yaşından küçük çocuklar:
- Yeterli veri bulunmadığından 6 yaşın altındaki çocuklarda kullanılması önerilmez.
Uygulama türü: Cilt üzerinde uygulama için.
Vücudun ağrıyan bölgelerine masaj yaparak uygulayınız. Sadece sağlıklı cilt üzerinde kullanın. Mukoza zarlarına, açık yaralara ve gözlere bulaşmayın. Merhem ile ovuşturduktan sonra ellerinizi iyice yıkayın. Büyük ölçekli uygulamalardan kaçınılmalıdır.
Kullanım süresi:
5 gün sonra kendinizi daha iyi hissetmiyorsanız veya daha kötü hissediyorsanız, doktorunuza başvurun.
Kullanmanız gerekenden daha fazla Mayrhofer travma merhemi kullandıysanız
Hiçbir doz aşımı vakası bildirilmemiştir.
Travma Merhemini çok kalın uyguladıysanız, merhemi suyla yıkamanızı öneririz.
Uzun süreli ve geniş çaplı kullanımda mide bulantısı veya diğer mide-bağırsak şikayetleri gibi yan etkiler göz ardı edilemez.
hamilelik ve emzirme dönemi
Hamileyseniz veya emziriyorsanız, hamile olabileceğinizi düşünüyorsanız veya bebek sahibi olmayı planlıyorsanız bu ilacı kullanmadan önce doktorunuza veya eczacınıza danışınız.
Yeterli veri olmadığından hamilelik ve emzirme döneminde kullanımı ancak bir doktora danışıldıktan sonra önerilebilir.
Araç ve makine kullanma becerisi
Araç veya makine kullanma yeteneği üzerindeki etkisine ilişkin uygun çalışmalar yapılmamıştır.
Travma merhemi setostearil alkol ve yün mumu içerir.
Setilstearil alkol ve yün mumu alkolleri (bütillenmiş hidroksitoluen içerir) lokal cilt tahrişine (örn. kontakt dermatit), gözlerde ve mukoza zarlarında tahrişe neden olabilir.
Sağlık çalışanları için not:
Doz aşımı hakkında bilgi bu broşürün sonunda bulunabilir.
Bu ilacın kullanımıyla ilgili başka sorularınız varsa, A’ya danışınız.