Ketokonazol, öncelikle mantar enfeksiyonlarının harici tedavisi için kullanılan iyi bilinen bir azol antifungal ajandır. Başlangıçta hem sistemik hem de topikal kullanım için geliştirilmiş olsa da, özellikle ağızdan alındığında güvenlik ve ilaç etkileşimleri konusundaki endişeler nedeniyle sistemik kullanımı büyük ölçüde durdurulmuştur. Bu sınırlamalara rağmen ketokonazol, şampuanlar ve kremler de dahil olmak üzere çeşitli topikal formlarda mevcut olan deri ve kafa derisi mantar enfeksiyonları için değerli bir tedavi olmaya devam etmektedir.
1. Kimya ve Yapı
Kimyasal formülü C26H28Cl2N4O4 olan ketokonazol, beyaz kristal toz halinde bulunan bir rasemik karışımdır. Mikonazol ve klotrimazol gibi diğer antifungalleri de içeren azol antifungal sınıfına, özellikle imidazol alt grubuna aittir. Yapısal olarak ketokonazol, antifungal mekanizmasının merkezinde yer alan bir imidazol halkası içerir ve ayrıca bir dioksolan ve piperazin parçası içerir. Bu yapısal unsurlar ketokonazolün mantar hücre membranları ile etkili bir şekilde etkileşime girmesini sağlayarak onu güçlü bir antifungal ajan haline getirir.
Bununla birlikte, ketokonazolün bir sınırlaması, formülasyonunu etkileyen ve topikal uygulama için kremler ve şampuanlar gibi özel dağıtım sistemlerinde kullanılmasını gerektiren **suda zayıf çözünürlüğüdür **.

2. Etki Mekanizması
Ketokonazolün birincil etki mekanizması ergosterol sentezini inhibe etme yeteneğine dayanır. Ergosterol, insan hücre zarlarındaki kolesterole benzer şekilde mantar hücre zarlarının çok önemli bir bileşenidir. Ergosterol olmadan mantar hücre zarı işlevsiz hale gelir, bu da geçirgenliğin artmasına, temel hücresel bileşenlerin sızmasına ve nihayetinde mantar hücre ölümüne yol açar.
Ketokonazol bunu, lanosterolü ergosterole dönüştürmek için gerekli olan mantar sitokrom P450-bağımlı enzim lanosterol 14α-demetilazı inhibe ederek başarır. Bu inhibisyon, ergosterol sentezini bozarak mantar hücre zarının bütünlüğünü bozar ve konsantrasyona bağlı olarak fungistatik veya fungisidal bir etki gösterir.
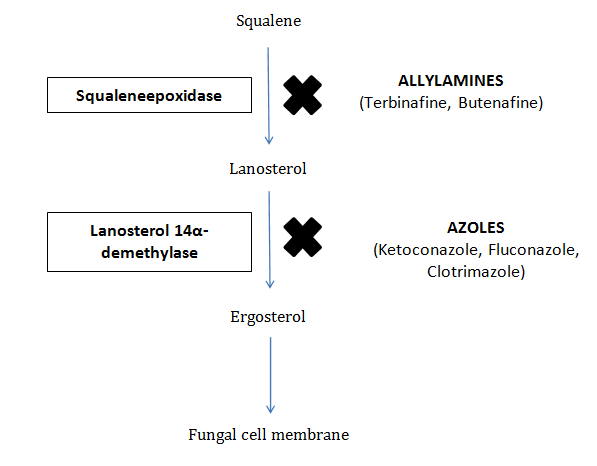
3. Faaliyet Spektrumu
Ketokonazol, aşağıdakiler de dahil olmak üzere geniş bir mantar organizması yelpazesine karşı aktivite gösterir:
- Dermatofitler*: Trichophyton, Epidermophyton* ve Microsporum* gibi *tinea corporis*, *tinea cruris* ve tinea pedis gibi deri enfeksiyonlarından sorumlu olan mantar türleri.
- Mayalar**: Özellikle *Candida albicans* dahil Candida türlerine ve *pityriasis versicolor*a neden olan ve *seboreik dermatite* katkıda bulunan Malassezia furfura (daha önce Pityrosporum ovale olarak biliniyordu) karşı etkilidir.
- Gram-pozitif bakteri**: Birincil endikasyonu olmasa da ketokonazol, membran bozulmasını içeren geniş etki mekanizması nedeniyle *Staphylococcus aureus* ve Streptococcus türleri gibi belirli gram-pozitif bakterilere karşı da bir miktar etkinlik göstermektedir.
4. Endikasyonlar
Ketokonazol esas olarak mantar cilt enfeksiyonlarının ve mayaların ve dermatofitlerin neden olduğu durumların tedavisinde kullanılır. En yaygın formülasyonları şunlardır:
- Şampuan**: Ketokonazol %2 şampuan (örn. Nizoral®, Fungoral®), genellikle kafa derisinde görülen ve *Malassezia furfur* mayasının neden olduğu iltihaplı, pul pul deri ile karakterize bir durum olan *seboreik dermatit* tedavisinde yaygın olarak kullanılır. Ayrıca, özellikle gövdede hipopigmente veya hiperpigmente yamalara neden olan bir mantar cilt enfeksiyonu olan pityriasis versicolor için de etkilidir.
- Krem**: Ketokonazol krem, *tinea corporis* (saçkıran), tinea cruris (sporcu kaşıntısı), tinea pedis (ayak mantarı) ve kutanöz kandidiyaz dahil olmak üzere kutanöz mantar enfeksiyonları için reçete edilir. Mantarın aşırı büyümesiyle mücadele etmek için doğrudan etkilenen bölgelere uygulanır.
Bazı durumlarda ketokonazol, özellikle kronik veya tekrarlayan seboreik dermatit vakalarında, bu mantar durumlarının nüksetmesini önlemek için de kullanılır.
5. Sistemik Kullanımın Farmakokinetiği ve Kesilmesi
Geçmişte ketokonazol, mantar enfeksiyonlarının sistemik tedavisi için oral tabletler olarak mevcuttu. Bununla birlikte, oral ketokonazol ciddi yan etkilerle ilişkilendirilmiş ve sistemik kullanım için birçok pazardan çekilmesine yol açmıştır. 2012 yılında Nizoral® tabletler, özellikle flukonazol ve itrakonazol gibi daha yeni azol antifungallerin mevcudiyeti ile antifungal faydalarını gölgede bırakan yüksek karaciğer toksisitesi (hepatotoksisite) potansiyeli ve ciddi ilaç etkileşimleri nedeniyle piyasadan çekilmiştir.
Sistemik ketokonazol ile ilgili temel endişe, CYP450 enzimlerini, özellikle de çok çeşitli ilaçların metabolize edilmesinde önemli bir rol oynayan CYP3A4‘ü güçlü bir şekilde inhibe etmesiydi. Bu inhibisyon çok sayıda ilaç-ilaç etkileşimine yol açarak birlikte uygulanan ilaçların kan seviyelerinin yükselmesine ve potansiyel olarak kardiyak aritmiler ve toksisite dahil olmak üzere ciddi advers reaksiyonlara neden olabilir.
Ketokonazol cilde veya kafa derisine uygulandığında kan dolaşımına minimum düzeyde emildiğinden, topikal kullanım için bu tür etkileşimler endişe verici değildir. Bu nedenle, topikal ketokonazol yaygın olarak kullanılmaya devam etmektedir ve mantar enfeksiyonlarının tedavisinde uzun süreli kullanım için güvenli kabul edilmektedir.
6. Yan Etkiler
Topikal ketokonazol genellikle iyi tolere edilmesine rağmen, özellikle hassas kişilerde lokal yan etkilere neden olabilir. Yaygın yan etkiler şunlardır:
- Cilt tahrişi**: Uygulama yerinde kızarıklık, kaşıntı ve lokalize şişlik.
- Döküntüler**: Nadiren, bazı kullanıcılar ilaca karşı kurdeşen veya döküntü şeklinde ortaya çıkan alerjik reaksiyonlar geliştirir.
- Göz tahrişi**: Şampuan yanlışlıkla gözlerle temas ederse, tahriş veya batma meydana gelebilir.
- Tat bozuklukları**: Şampuan veya krem kullanan bazı hastalar geçici olarak metalik veya acı bir tat aldıklarını bildirmişlerdir, ancak bu durum daha az yaygındır.
Sistemik alerjik reaksiyonlar gibi ciddi advers etkiler nadirdir ancak özellikle ilaca veya yardımcı maddelerine karşı aşırı duyarlılığı olan kişilerde ortaya çıkabilir.
7. Oral Tabletlerin Tarihsel Bağlamı ve Geri Çekilmesi
Ketokonazolün oral formülasyonunun hikayesi, antifungal tedavinin evrimi hakkında fikir vermektedir. 1980’lerin başında Nizoral® tabletler piyasaya sürüldüğünde, ketokonazol geniş spektrumlu aktivitesi ve sistemik mantar enfeksiyonlarının tedavisindeki etkinliği nedeniyle antifungal tedavide büyük bir atılım olarak görülmüştür. Ancak zamanla, özellikle uzun süreli kullanımda veya önceden karaciğer rahatsızlıkları olan hastalarda önemli hepatotoksisite riski ortaya çıkmıştır. Avrupa İlaç Ajansı (EMA) ve ABD Gıda ve İlaç İdaresi (FDA) dahil olmak üzere düzenleyici kurumları güvenlik profilini yeniden değerlendirmeye sevk eden çok sayıda akut karaciğer yetmezliği vakası bildirilmiştir.
2012 yılına gelindiğinde**, flukonazol gibi daha güvenli alternatiflerin bulunmasıyla birlikte, oral ketokonazolün risk-yarar oranının kabul edilemez olduğu düşünülmüştür. İlaç daha sonra birçok ülkede sistemik kullanım için *piyasadan çekildi*, ancak sistemik toksisite riskinin ihmal edilebilir olduğu topikal formülasyonlar için mevcut kalmaya devam etti.
8. İlaç Etkileşimleri
Ketokonazol, sistemik olarak kullanıldığında CYP450 enzimlerinin**, özellikle **CYP3A4‘ün güçlü bir inhibitörüdür. Ancak bu etkileşimler, sistemik emilimin minimum olduğu topikal tedavi için geçerli değildir. Oral formülasyon için, ketokonazolün CYP3A4 ve P-glikoprotein inhibisyonu, aşağıdakiler de dahil olmak üzere birçok ilacın metabolizmasını etkilemiştir:
- Statinler**: Simvastatin ve lovastatin gibi ilaçların seviyelerinde artış, kas toksisitesi (rabdomiyoliz) riskine yol açar.
- Benzodiazepinler: Sedasyon ve solunum depresyonunda artış.
- Antikoagülanlar**: Varfarin gibi ilaçlarla birlikte alındığında kanama riskinde artış.
Bu etkileşimler nedeniyle, sistemik ketokonazol kullanan hastalar, eşlik eden ilaçların dikkatli bir şekilde izlenmesini ve dozaj ayarlamalarını gerektirmiştir.
Keşif
Azol antifungal grubunun bir üyesi olan ketokonazol, 1970’lerin sonlarında keşfedilmesinden bu yana ilgi çekici ve çok yönlü bir geçmişe sahiptir. İlk oral antifungal ajanlardan biri olarak geliştirilmesi, sistemik mantar enfeksiyonlarının tedavisinde önemli bir atılımı temsil etmiştir. Bununla birlikte, ketokonazolün sistemik kullanımı daha sonra güvenlik endişeleri nedeniyle kısıtlandığından, hikayesi tıbbi anlayışın evrimini de yansıtmaktadır. Bu aksiliklere rağmen ketokonazol günümüzde topikal antifungal tedavilerin temelini oluşturmaya devam etmektedir.
1. Oral Ketokonazolün Keşfi ve İlk Vaatleri (1970’lerin Sonu-1980’ler)
1970’lerin sonlarında** tıp camiası sistemik mantar enfeksiyonlarının tedavisinde önemli bir zorlukla karşı karşıya kaldı. O dönemde, amfoterisin B gibi mevcut antifungal tedaviler genellikle toksikti ve uygulanması zordu. Araştırmacılar, daha az yan etkiyle ağızdan alınabilecek bir antifungal ajan bulmaya hevesliydi.
1977’de** Belçika’daki Janssen Pharmaceutica’daki bilim insanları ağızdan alınabilen ilk azol antifungal ajan olan ketokonazolü keşfettiler. Bu buluş, ketokonazolün sadece geniş bir mantar enfeksiyonu spektrumuna karşı etkili olmakla kalmayıp aynı zamanda tablet formunda alınabilmesi ve amfoterisin B gibi intravenöz seçeneklere göre kolaylık sağlaması nedeniyle önemli bir ilerlemeyi temsil ediyordu.
1980’lerin başında Nizoral® adı altında pazarlanan ketokonazol, hızla histoplazmoz, blastomikoz ve koksidioidomikoz gibi sistemik mantar enfeksiyonları için standart bir tedavi haline geldi. Kullanılabilirliği, doktorlara eski antifungal ajanlara daha az toksik bir alternatif sağlayarak ciddi mantar enfeksiyonlarının yönetiminde bir değişime işaret etti.
2. Topikal Ketokonazolün Cilt ve Saç Derisi Hastalıklarının Tedavisindeki Başarısı (1980’ler-1990’lar)
Ketokonazol başlangıçta sistemik kullanım için geliştirilmiş olsa da, kısa süre sonra topikal formülasyonlarının yüzeysel mantar enfeksiyonlarının tedavisinde oldukça etkili olduğu anlaşılmıştır. 1980’ler** boyunca ketokonazol şampuanları ve kremleri seboreik dermatit, pityriasis versicolor ve cutaneous candidiasis tedavisinde yaygın olarak kullanılmaya başlandı.
Göze çarpan başarılardan biri, kepek ve kafa derisi iltihabına neden olan yaygın bir durum olan seboreik dermatit tedavisinde ketokonazol şampuan kullanımıdır. Ketokonazolün antifungal özellikleri onu özellikle seboreik dermatitle ilişkili maya olan Malassezia furfur’a karşı etkili kılmıştır. 1990’larda** ketokonazol şampuan (Nizoral® şampuan gibi) reçetesiz satılan popüler bir tedavi haline geldi ve ketokonazolün saç derisi rahatsızlıkları ve cilt mantarı enfeksiyonları tedavisindeki yerini sağlamlaştırdı.
3. Oral Ketokonazolün Çöküşü: Hepatotoksisite ve İlaç Etkileşimleri (1990’ların Sonu-2000’ler)
Erken dönemdeki başarısına rağmen, oral ketokonazolün sistemik kullanımı kısa süre içinde endişelere yol açmaya başlamıştır. 1990’ların sonunda**, ilaçla ilişkili *hepatotoksisite* (karaciğer toksisitesi) raporları birikmeye başladı. İlaç mantarlara karşı etkili olsa da, sitokrom P450 enzimlerini inhibe etmesi, özellikle uzun süreli veya yüksek dozlarda kullanıldığında bazı hastalarda ciddi karaciğer hasarına yol açmıştır.
Ayrıca ketokonazolün, çok çeşitli ilaçların metabolize edilmesinde rol oynayan önemli bir enzim olan CYP3A4’ün güçlü bir inhibitörü olduğu bulunmuştur. Bu durum, özellikle statinler, benzodiazepinler ve antikoagülanlar gibi ilaçlarla ilaç etkileşimleri için önemli riskler yaratmıştır. Hepatotoksisite ve ilaç etkileşimlerinin kombinasyonu, doktorların daha uygun güvenlik profillerine sahip flukonazol ve itrakonazol gibi yeni azol antifungallere yönelmesiyle oral ketokonazol kullanımının azalmasına yol açmıştır.
2012 yılında Avrupa İlaç Ajansı (EMA) ve ABD Gıda ve İlaç Dairesi (FDA) dahil olmak üzere düzenleyici kurumlar oral ketokonazolün güvenliğini gözden geçirdi. Bulgular kesindi: sistemik mantar enfeksiyonlarının tedavisinde riskler faydalardan daha ağır basıyordu. Sonuç olarak, oral ketokonazol, ABD ve Avrupa’nın çoğu dahil olmak üzere birçok ülkede piyasadan çekildi ve sistemik kullanımına son verildi. Bu karar, devam eden farmakovijilansın önemini yansıtan, ilaç güvenliği düzenlemesinde önemli bir kilometre taşı olmuştur.
4. Ketokonazolün Topikal Tedavilerdeki Rolü: Yeni Bir Odak (2010’lar-Günümüz)
Oral ketokonazol büyük ölçüde kesilmiş olsa da, ilacın topikal formülasyonları yaygın olarak bulunmaya ve harici kullanım için güvenli olmaya devam etmiştir. Ketokonazol kremlerinin ve şampuanlarının topikal uygulaması, oral formla aynı sistemik riskleri oluşturmadı ve cilt ve kafa derisi koşulları için kullanılmaya devam etmesine izin verdi. Aslında, 2010’lara gelindiğinde, ketokonazol seboreik dermatit, kepek ve tinea enfeksiyonları (saçkıran) için en sık reçete edilen tedavilerden biri haline gelmiştir.
Bu süre zarfında, ketokonazol bazlı şampuan ve kremlerin jenerik versiyonları daha yaygın bir şekilde kullanılabilir hale geldi ve erişilebilirliğini daha da artırdı. Fungoral®** ve Ketoderm® gibi markalar, ketokonazolün yüzeysel mantar enfeksiyonlarının tedavisindeki etkinliğinden faydalanarak, oral formun geri çekilmesine rağmen düzenli kullanımda kalmasını sağladı.
5. Tarihsel Anekdotlar ve Dermatoloji Üzerindeki Etkisi
Ketokonazolün etkisine ilişkin kayda değer bir anekdot 1980’lerdeki dermatoloji konferanslarından gelmektedir. Böyle bir etkinlik sırasında, önde gelen bir dermatolog ketokonazol şampuanın sadece seboreik dermatit tedavisini iyileştirmekle kalmayıp, aynı zamanda kronik kepeklenmenin sosyal utancı ile mücadele eden milyonlarca kişiye de rahatlama getirdiğini belirtmiştir. Bu, ilacın yaygın kafa derisi rahatsızlıkları olan hastaların yaşam kalitesini iyileştirmedeki önemini yansıtmaktadır.
Daha mizahi bir şekilde, ketokonazol şampuanı, ünlü bir Hollywood aktörü tarafından kusursuz saç stilini korumak için kullanıldığı söylendiğinde bir tür kültürel tanınma kazanmıştır. Anekdot niteliğinde olsa da bu hikaye, ketokonazolün etkinliğinin özellikle kepekle ilişkili kozmetik kaygıların tedavisinde kliniğin ötesine ve günlük yaşama nasıl ulaştığının altını çizmektedir.
6. Miras ve Modern Rolü
Günümüzde ketokonazol, dermatolojide anahtar oyuncu olmaya devam etmektedir. Hem mantar enfeksiyonlarını hem de inflamatuvar deri hastalıklarını tedavi etme kabiliyeti onu değerli bir terapötik ajan yapmaya devam etmektedir. Oral ketokonazolün geri çekilmesi aynı zamanda ilaç güvenliği konusunda bir ders niteliğinde olup, uzun süreli ilaç kullanımında yan etkilerin ve ilaç etkileşimlerinin dikkatli bir şekilde izlenmesi gerektiğini vurgulamaktadır.
Daha yeni antifungal tedaviler ortaya çıkmış olsa bile, ketokonazolün topikal tedavideki rolü kesin olarak belirlenmiştir. Nispeten düşük maliyeti, kullanım kolaylığı ve geniş aktivite spektrumu, birçok yaygın cilt ve kafa derisi rahatsızlığı için ilk basamak tedavi olmaya devam etmesini sağlamaktadır.
İleri Okuma
- Faergemann, J., & Fredriksson, T. (1980). “Nizoral (ketoconazole) cream and shampoo in the treatment of seborrhoeic dermatitis.” Acta Dermato-Venereologica, 60(2), 92-95.
- Gupta, A.K., Kohli, Y., & Batra, R. (2002). “Role of Pityrosporum in seborrheic dermatitis and dandruff.” Journal of the American Academy of Dermatology, 47(6), 852-855.
- European Medicines Agency (EMA). (2013). “Ketoconazole-containing medicinal products: suspension of marketing authorisations for oral formulations.”
- Gupta, A.K., & Lyons, D.C. (2015). “The rise and fall of oral ketoconazole.” Journal of Cutaneous Medicine and Surgery, 19(4), 352-357.










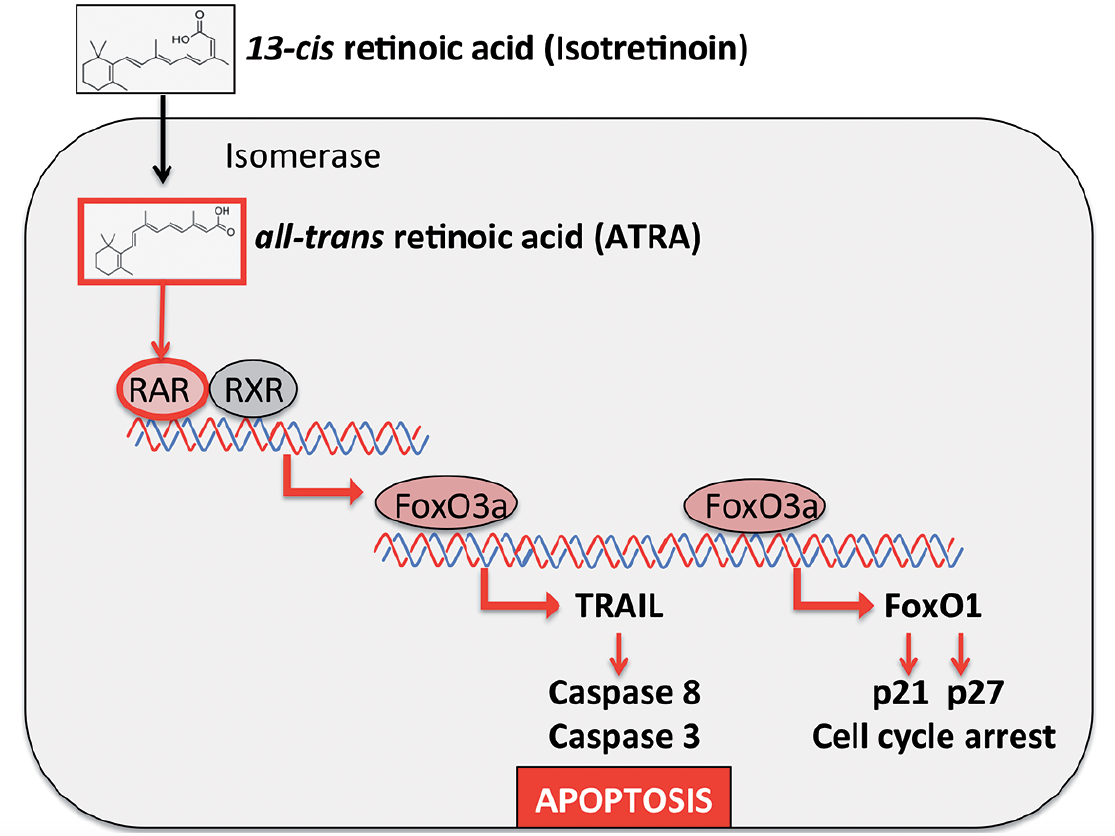
-448-3-1358157301.jpg)





Yorum yazabilmek için oturum açmalısınız.