“Sekel” terimi Latince “sequela” kelimesinden gelmektedir ve “takip eden” anlamına gelmektedir. Tıbbi terminolojide, önceki bir hastalık veya yaralanmanın sonucu olan bir durumu ifade eder.
Tıpta sekel, bir hastalık, yaralanma, tedavi veya başka bir travmadan kaynaklanan patolojik bir durumdur. Sekeller tipik olarak kroniktir ve ilk hastalık veya yaralanmanın akut fazını takiben uzun bir süre devam eder.
” Sequela ” teriminin tıbbi bağlamda en eski ve en dikkate değer kullanımlarından biri ünlü Romalı hekim Aulus Cornelius Celsus‘a (MÖ 25 – MS 50) atfedilir. Celsus, “De Medicina” adlı kapsamlı tıbbi çalışmasında, akut bir hastalık veya yaralanmayı takip eden uzun vadeli sonuçları ve koşulları tanımlamak için “sekel” terimini kullanmıştır.”De Medicina”: Bu kapsamlı tıbbi eser, diyet, farmakoloji, cerrahi ve hastalıkların tedavisi de dahil olmak üzere tıbbın çeşitli yönlerini ele alan sekiz kitaptan oluşmaktadır. Eski hekimlerin, bugün sekel olarak adlandırdığımız, hastalıkların ve yaralanmaların uzun vadeli sonuçlarını nasıl anladıkları ve yönettiklerine dair içgörüler sağlar.
Sekellerin Patolojik Örnekleri:
Nörolojik Sekeller:
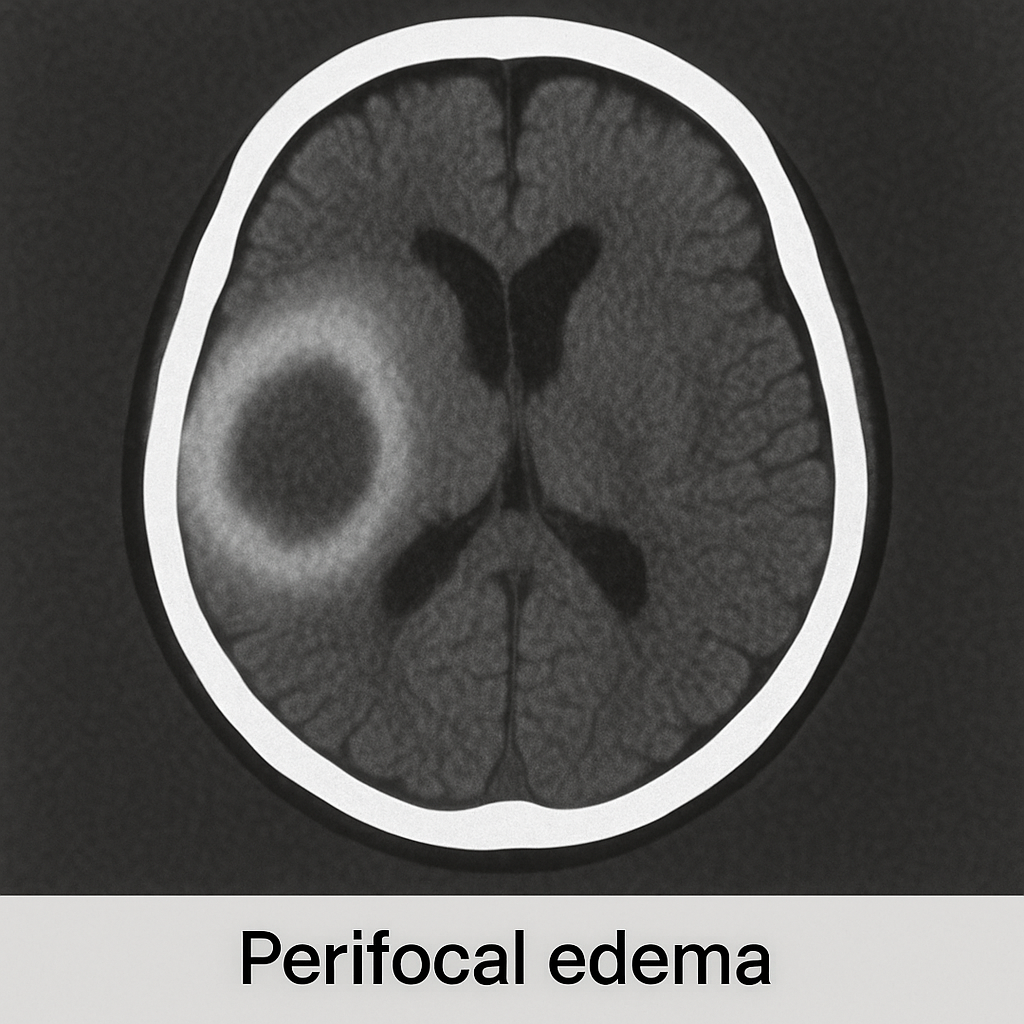
- İnme: Sekeller felç, konuşma güçlüğü (afazi), bilişsel bozukluklar ve kronik ağrıyı içerebilir.
- Travmatik Beyin Hasarı (TBH): Uzun vadeli etkiler arasında hafıza kaybı, duygusal ve davranışsal değişiklikler ve kalıcı baş ağrıları yer alabilir.
- Post-Polio Sendromu: İlk poliovirüs enfeksiyonundan yıllar sonra ortaya çıkan kas güçsüzlüğü, yorgunluk ve ağrı ile karakterizedir.
Kardiyovasküler Sekeller:
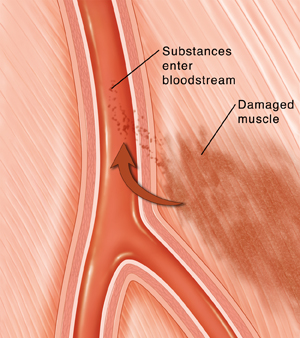
- Miyokard Enfarktüsü (Kalp Krizi): Kronik kalp yetmezliğine, aritmilere ve gelecekteki kardiyak olay riskinin artmasına yol açabilir.
- Hipertansiyon: Uzun süreli yüksek kan basıncı hipertansif kalp hastalığı, böbrek hasarı ve vasküler komplikasyonlara neden olabilir.
Solunum Sekelleri:
- Kronik Obstrüktif Akciğer Hastalığı (KOAH): Kronik bronşit veya amfizemi takip ederek kalıcı solunum sıkıntısına ve akciğer fonksiyonlarında azalmaya yol açabilir.
- Tüberküloz Sonrası: Aktif tüberküloz enfeksiyonundan sonra akciğer fibrozu ve solunum yetmezliği ortaya çıkabilir.
Gastrointestinal Sekeller:
- İnflamatuar Bağırsak Hastalığı (IBD): Uzun vadeli sonuçlar arasında darlıklar, fistüller ve kolorektal kanser riskinde artış yer alabilir.
- Kolesistektomi: Safra kesesinin alınması kronik ishale veya safra asidi malabsorpsiyonuna yol açabilir.
Kas İskelet Sistemi Sekelleri:
- Romatoid Artrit: Eklem deformiteleri, kronik ağrı ve sakatlıkla sonuçlanabilir.
- Osteomiyelit: Kronik kemik ağrısı ve kırıklara yol açabilen kemik enfeksiyonu.
Dermatolojik Sekeller:
- Yanıklar: Ciddi yanıklar hipertrofik skarlaşmaya ve kontraktürlere neden olabilir.
- Herpes Zoster (Zona): Kronik bir ağrı durumu olan postherpetik nevralji, deri lezyonları iyileştikten uzun süre sonra da devam edebilir.
Bulaşıcı Hastalık Sekelleri:
- HIV/AIDS: Fırsatçı enfeksiyonlara ve malignitelere yol açan uzun vadeli bağışıklık sistemi tehlikesi.
- Lyme Hastalığı: Tedavi sonrası Lyme hastalığı sendromu (PTLDS) yorgunluk, kas-iskelet ağrısı ve bilişsel zorlukları içerir.
Endokrin Sekeller:
- Diabetes Mellitus: Uzun vadeli komplikasyonlar arasında nöropati, retinopati, nefropati ve kardiyovasküler hastalıklar yer alır.
- Tiroid Bozuklukları: Tedavi edilmeyen hipotiroidizm veya hipertiroidizm kardiyovasküler ve nörolojik komplikasyonlara neden olabilir.
Psikiyatrik Sekeller:
Travma Sonrası Stres Bozukluğu (TSSB): Travmatik olayların ardından bireyler uzun süreli anksiyete, geriye dönüşler ve depresyon yaşayabilir.
Depresyon: Uykusuzluk, madde bağımlılığı ve kardiyovasküler hastalık gibi kronik durumlara yol açabilir.
İleri Okuma
- Yehuda, R., & LeDoux, J. (2007). “Post-Traumatic Stress Disorder: Sequelae and Therapeutic Approaches.” Biological Psychiatry, 61(9), 1025-1032.
- Edwards, J. R., & Spector, T. D. (2008). “Chronic Musculoskeletal Sequelae of Rheumatoid Arthritis.” Arthritis & Rheumatism, 58(10), 2981-2990.
- Klein, N. P., & Bartlett, J. G. (2011). “Post-Treatment Lyme Disease Syndrome: Definition and Sequelae.” Journal of Infectious Diseases, 203(5), 747-753.
- Baumgart, D. C., & Sandborn, W. J. (2012). “Inflammatory Bowel Disease: Clinical Aspects and Sequelae.” Lancet, 380(9853), 1606-1619.
- Johnson, R. W., & Rice, A. S. (2014). “Postherpetic Neuralgia: Pathophysiology and Management.” New England Journal of Medicine, 371(16), 1526-1533.
- Smith, M. S., & Vowels, M. (2016). “Neurological Sequelae of Stroke.” Journal of Neurology, Neurosurgery & Psychiatry, 87(12), 1392-1398.
- Kim, J., & Fonarow, G. C. (2017). “Heart Failure as a Sequela of Myocardial Infarction.” American Journal of Cardiology, 120(8), 1231-1240.
- Liu, L., & Ho, Y. (2018). “Long-term Respiratory Sequelae of Tuberculosis.” American Journal of Respiratory and Critical Care Medicine, 198(6), 730-740.
- Feldman, E. L., & Callaghan, B. C. (2019). “Diabetic Neuropathy and Other Sequelae.” Diabetes Care, 42(5), 949-958.












Yorum yazabilmek için oturum açmalısınız.