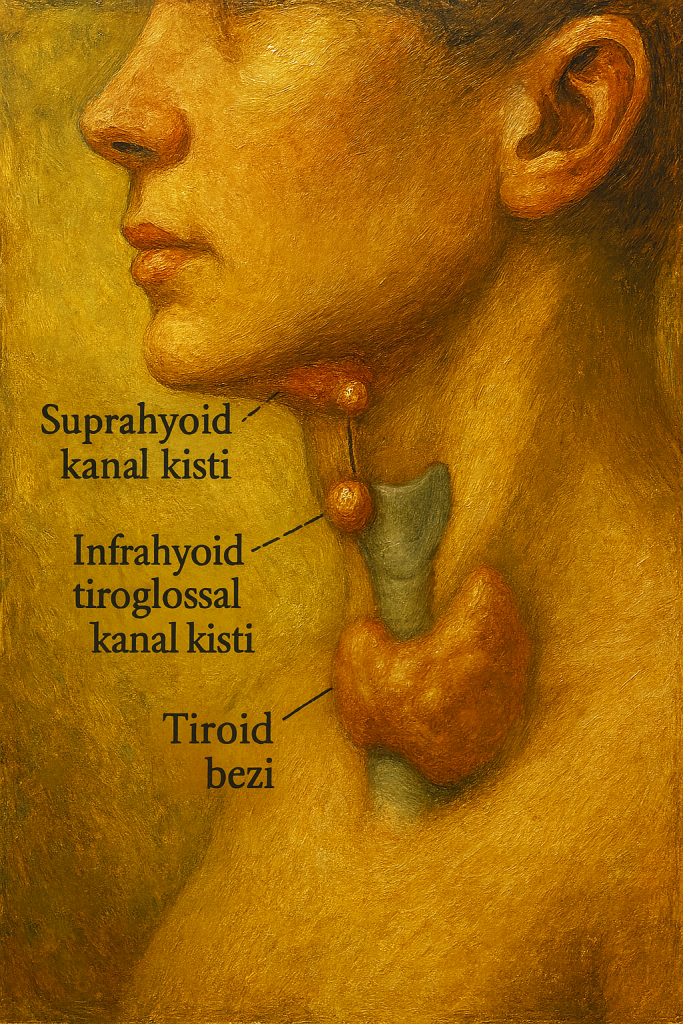
Açık bir yaz sabahı, küçük bir çocuğun boynunda ortanın tam üstünde, yumuşak ve ele gelen bir kabarıklık fark edilir. Çocuk dilini dışarı çıkarınca şişlik bir kuş gibi yukarı sıçrar, yutkununca yeniden aşağı döner. Bugün bir pediatrik cerrah için bu sahne, tiroglossal kanal kistinin “klasik” temsilidir. Fakat bu yalın klinik manzara, anatomistlerin, embriyologların ve cerrahların üç yüzyılı aşan birikiminin sessizce sahnelenmiş halidir: foramen çekum’dan başlayan bir yolculuk, hyoid kemiğin içinden ya da ona sürtünerek geçen bir traktus ve nihayet en güvenilir çare olarak Sistrunk prosedürü.
Erken Anatomik Kavrayışın Doğuşu (17.–18. yüzyıllar)
Tiroid bezinin adlandırılmasında dönüm noktası, 1656’da Thomas Wharton’dır. Wharton, “glandula thyroidea”yı tanımlarken bezin konumunu ve komşuluklarını sistematik bir dille betimler; böylece orta hat boyun anatomisinin bir “sözcüğü” olur. Birkaç on yıl sonra tiroidin sıklıkla ince bir uzantı taşıdığını fark eden anatomi çevresi, bu yapıya sonradan Lalouette piramidi adını verecektir; ad, 18. yüzyılın dikkatli gözlemcisi Pierre Lalouette’in (1711–1792) üzerine yapışır. Pyramidal lobun varlığı, ileride tiroglossal yolun kalıntılarına işaret eden önemli bir ipucu sayılacaktır: Tiroidin bir “yukarıdan geliş” hikâyesi olmalıdır ki, orta hatta yükselen bir piramit bırakabilsin.
Aynı yüzyılın sonuna doğru ve 18. yüzyıl boyunca, Morgagni ve çağdaşlarının sistematik otopsileri orta hattın küçük kistik oluşumlarına da not düşer; fakat bu kitlelerin bir “gelişimsel yol”la ilişkisi henüz açık değildir. Klinik raporlarda zaman zaman “orta hat fistülleri”nden söz edilir; bunlar çoğu kez tekrarlayan enfeksiyonlarla dikkat çeker, drenajlarla geçici yatışır, sonra yine nükseder.
Embriyolojinin Netleşmesi (19. yüzyıl)
- yüzyıl anatominin mikroskobik ve karşılaştırmalı aklıyla hızlanır. H. W. Luschka (1820–1875) orta hat boynun histolojik ve cerrahi anatomisini ayrıntılandırırken, Wilhelm His (1831–1904) embriyonik dil ve boyun gelişimini sistematikleştirir. His ve dönemin embriyologları, tiroid bezinin foramen çekumdan başlayıp aşağıya, ön boyuna doğru göç ettiğini; bu göçün izinin bir tiroglossal kanal oluşturduğunu, normalde kanalın silindiğini ama yer yer persistans gösterebileceğini ortaya koyar. Böylece orta hat kist ve fistüller, ilk kez tutarlı bir nedensellikle açıklanır: Silinmeyen kanal parçaları, epitel artıklarının salgısı ve inflamasyonu; sonuçta kistik genişleme.
Bu dönemde cerrahi literatür, orta hattaki bu kitlelerin basitçe boşaltılıp bırakılmasının nüksle sonuçlandığını, hatta cilde açılan fistül yolları geliştirdiğini defalarca kayda geçirir. Theodor Kocher’in önderlik ettiği tiroid cerrahisi ekolleri, orta hat anatomisine yaklaşımda cerrahi prensip ve asepsi-antisepsi devrimini kalıcı kılar; yine de tiroglossal yol kalıntılarında “kes ve bırak” yaklaşımının yetersizliği henüz sistematik bir çözümle taçlanmamıştır.
Bu arada bir epönim karmaşası da yavaş yavaş belirir: 19. yüzyıl anatomi literatüründe adı sık geçen Vinzenz Alexander Bochdalek, aslında konjenital diyafram hernisiyle anılır; dil kökü kistlerine “Bochdalek kisti” deme eğilimi ise tarihin dip notlarında kalan bir kullanım olarak yer yer görülse de, modern sınıflamada yerleşik bir karşılığı yoktur. Bu hatırlatma, orta hattaki lezyonların doğru adlandırılması bakımından önemlidir.
Tedavide Paradigma Değişimi: Sistrunk’ın Çağı (20. yüzyılın ilk yarısı)
Gerçek sıçrama, 20. yüzyılın başında Walter Ellis Sistrunk ile gelir. Sistrunk, nükslerin kader olmadığını, asıl sorunun yalnız kistin değil, ona bağlanan traktusun ve hyoid kemiğin orta parçasının da patogenezde rol oynaması olduğunu sahaya kanıta dayalı bir netlikle koyar. 1920’lerde yayımladığı deneyimiyle, orta hattaki kistin eksizyonuyla yetinmeyip hyoid korpusunun en bloc çıkarılmasını ve traktusun foramen çekuma kadar izlenip eksize edilmesini önerir. Bu, bugün bile altın standart sayılan Sistrunk prosedürüdür.
Sistrunk’ın çizdiği yol haritası, iki düzlemde devrimdir: Birincisi, anatomik-embriyolojik rasyonel ile cerrahi tekniği aynı cümlede buluşturur; ikincisi, nüks oranlarını dramatik biçimde düşürür. Öncesinde kimi merkezlerin sezgisel olarak denediği hyoid rezeksiyonu, Sistrunk ile sistematik ve standart hale gelir. Böylece “basit eksizyon” dönemi kapanır; orta hat kisti, ayrıntılı bir gelişimsel anatomi ameliyatının konusu olur.
Görüntüleme, Patoloji ve Klinik Standartların Yerleşmesi (20. yüzyılın ikinci yarısı)
Savaş sonrası dönemde ultrasonografinin klinikleşmesiyle USG, ilk basamak görüntülemeye dönüşür: Kistin hipoekoik, düzgün sınırlı doğası; bazen çok odacıklı görünümü ve en önemlisi ortotopik tiroid bezinin varlığının doğrulanması, klinik algoritmanın temeline yerleşir. Seçilmiş olgularda BT/MRG, traktusun derin uzanımı ve rekürrenslerin haritasını çıkarır. Patoloji laboratuvarları, kist duvarındaki psödostratifiye silli kolumnar ya da çok katlı yassı epitel döşemesini, bazen de duvar içinde tiroid folliküllerini göstermeye devam eder; bu, embriyolojik hikâyeyi lam-lamel güvence altına alır.
Aynı dönemde endokrin cerrahisi ile baş-boyun cerrahisinin yolları daha çok kesişir. Erişkinlerde saptanan olgularda malignite olasılığının (özellikle papiller tiroid karsinomu) çocuklara göre görece daha yüksek oluşu, tanı ve tedavi planını rafine eder. Yine de olguların büyük çoğunluğu iyi huyludur ve Sistrunk prosedürü tek başına kalıcı çözüm sağlar.
Günümüze Doğru: Minimal İnvaziv Çözümler, Moleküler Ayrıntılar ve İnce Ayar
- yüzyılda tablo olgunlaşır, ayrıntılar keskinleşir. Ultrason rehberli değerlendirme neredeyse evrensel ilk basamaktır; ortotopik tiroid dokusunun varlığını belgelenmeden cerrahi planlanmaz. Akut enfeksiyon döneminde antibiyotik ve gerekirse drenajla sakinleştirme, ardından elektif Sistrunk yaklaşımı standartlaşır. Basit aspirasyon ya da skleroterapi girişimleri uzun dönem başarısızlık ve nüksle anıldığından, yerleri pratikte kısıtlıdır.
Cerrahide “iz”in kısaltılması arayışı, seçilmiş olgularda endoskopik/robotik yardımlı Sistrunk varyantlarıyla sınanır: Fonksiyonel sonuçlar benzerdir; kozmetik kazanç hedeflenir, ancak evrensel standart hâlâ açık Sistrunktır. Rekürrensi öngören etmenler—önceden geçirilmiş insizyon-drenaj, yetersiz hyoid rezeksiyonu, dallanan çoklu traktuslar, yoğun enfeksiyon öyküsü—klinik kararlara eşlik eden risk haritasını oluşturur.
Tiroglossal kanal kisti karsinomu başlığı altında literatür, erişkin olgularda özellikle papiller tip üzerine birikir. Güncel patoloji ve moleküler patoloji, BRAF V600E gibi sürücü mutasyonların bir alt kümede görülmesini not eder; bu bilgi, kılavuzların “yalnız Sistrunk yeterli mi, yoksa tiroidde eşlik eden nodül/şüphe varsa tiroidektomi eklenmeli mi?” sorusuna risk temelli yanıt vermesine yardım eder. Bugün yaklaşım, düşük riskli, sınırlı odaklı olgularda Sistrunk ile yetinme; tiroidde şüpheli bulgu, cerrahi sınır sorunları veya nodal tutulum varsa tiroit cerrahisini gündeme alma yönünde rafine edilmiştir.
Görüntüleme alanında yüksek frekanslı problarla daha iyi yüzeyel doku ayrımı, nükslerin erken saptanmasını kolaylaştırır. Pediyatrik anestezi ve hava yolu yönetimi ilerledikçe, lingual yerleşimli kistlerin güvenli yönetimi de belirginleşir. Patolojik raporlama, epitel döşemesine ek olarak kist duvarında kronik inflamasyon, granülasyon dokusu ve fibrozis derecesini daha standardize biçimde aktarır; cerrahi kararların arka planını güçlendirir.
Zihin Haritası: Keşiften Standarta Uzanan İzlek
- 1656 – Thomas Wharton: Tiroid bezinin adlandırılması ve konumsal çerçevenin yerleşmesi.
- 18. yy – Pierre Lalouette: Pyramidal lobun dikkatli betimi; “yukarıdan iniş” fikrinin anatomik ipucu.
- 19. yy – Luschka & Wilhelm His: Tiroglossal kanalın embriyolojik izahı; orta hat kist/fistüllerin nedensel açıklaması.
- Geç 19. yy – Erken 20. yy cerrahları: Basit eksizyon ve drenajların yüksek nüksle seyri; hyoid ile ilişkili traktus fikrinin olgunlaşması.
- 1920’ler – Walter E. Sistrunk: Hyoid korpusu ve traktusun foramen çekuma kadar eksizyonunu içeren prosedürün tanımlanması; nükste dramatik düşüş ve modern standardın tesisi.
- 20. yy ikinci yarısı: USG’nin ilk basamak hâline gelmesi; BT/MRG ile karmaşık uzanımların haritalanması; patolojide epitel ve tiroid follikülleri ile doğrulama.
- 21. yy: Risk temelli onkolojik yaklaşım; seçilmiş olgularda endoskopik/robotik yardımlı teknikler; rekürrens öngörüsü ve izlem şemalarının standardizasyonu.
Bugünün Klinik Gerçeği
Bugün bir klinisyen için ortanca (medyan) boyun kisti, öngörülebilir bir algoritmanın hastasıdır: Klinik muayene ve USG ile tanı; ortotopik tiroidin varlığının belgelenmesi; enfeksiyonun sakinleştirilmesi; uygun zamanda Sistrunk prosedürü; patolojiye göre gerekirse ek onkolojik değerlendirme ve hedefe yönelik takip. Bu akış, Wharton’un bir ad koymasıyla başlayan, Lalouette’in piramidini not eden gözün ve His’in embriyolojik aklının, en sonunda Sistrunk’ın cerrahi sezgisiyle birleştiği uzun bir düşünce zincirinin klinikteki somut karşılığıdır.
Ve o küçük çocuğun şişliğinin dil dışarı uzatılınca yukarı doğru “çekilmesi”—yüzyıllar boyunca biriken bilginin en şiirsiz, en sade ama en ikna edici kanıtıdır: Boynumuzun orta hattında, dil kökünden hyoide uzanan görünmez bir çizgi vardır; doğru adı konduğunda ve doğru düzlemde kesildiğinde, hastaya hem nükssüz bir gelecek hem de kolay nefes alıp verme, kolay yutkunma armağan eder. Sahnede görünen tek şey basit bir şişliktir; perde arkasında ise anatominin, embriyolojinin ve cerrahinin müşterek hikâyesi.




















Yorum yazabilmek için oturum açmalısınız.