İçindekiler
Tanım ve terminoloji
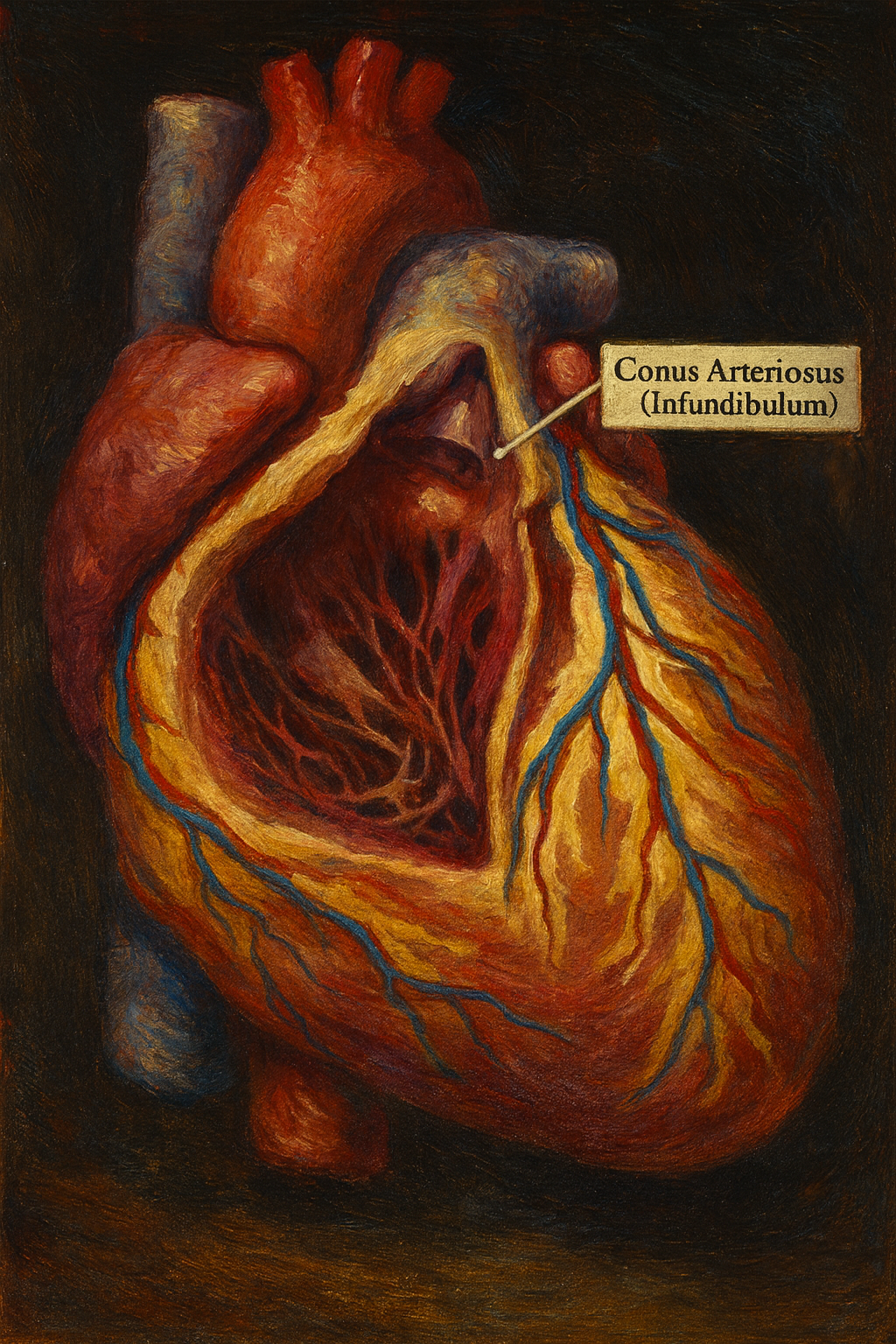
Conus arteriosus (insanda sık kullanılan eşanlamlısıyla infundibulum), sağ ventrikülün (SV) trunkus pulmonalise (pulmoner gövde) açılan ventriküler çıkış yolu (right ventricular outflow tract, RVOT) segmentidir. Klinik ve anatomik yazında “kalbin hunisi” benzetmesi, bu bölgenin koni/huni biçimli morfolojisini vurgular. İnsan kalbinde sol ventrikül ile aort kapak arasında fibröz süreklilik bulunurken, sağ tarafta pulmoner kapak ile triküspit kapak arasında bu tamamıyla kaslı infundibüler segment yer alır; bu fark, sağ ve sol çıkış yollarının embriyolojik köken ve klinik davranışlarındaki ayrımları açıklar.
Embriyoloji ve filogeni
Kalp tüpünün kraniyal bölümünde yer alan konus cordis ve truncus arteriosus, nöral krest hücrelerinin katılımıyla gelişen aortopulmoner spiral septum tarafından ayrılarak aortik ve pulmoner çıkışları oluşturur. Sağ ventrikül infundibulumu, bu konotrunkal bölgenin sağ-ventriküler bileşenidir. Septasyon, spiral bir geometri izlediği için, olası malalignmanlar ve rotasyon kusurları Fallot tetralojisi (TOF), çift çıkışlı sağ ventrikül (DORV), transpozisyon gibi konotrunkal anomalilerin anatomik temelini oluşturur. Filogenetik açıdan, alt omurgalılarda “conus arteriosus” terimi, kapakçıklı ayrı bir pompa segmentini ifade edebilir; insanda ise terim, sağ ventrikülün subpulmoner, kaslı çıkış konisini işaret eder.
Makro-anatomi: konum, sınırlar ve ilişkiler
- Konum: Conus arteriosus, sağ ventrikülün anterosuperior bölümünde, triküspit kapak düzleminin ön-üstünde yer alır ve pulmoner kapak ile sonlanır. Sternuma en yakın sağ ventrikül bölümlerinden biridir.
- Sınırlar: Proksimalde trabeküllü sağ ventrikül boşluğundan crista supraventricularis (supraventriküler krista) ve çevre kas demetleri ile ayrılır; distal sınırında pulmoner anulus ve üç yaprakçıklı pulmoner kapak bulunur. İnflow ile outflow bölmeleri, sağ ventrikülde belirgin biçimde kaslı duvarlarla birbirinden ayrılır.
- Morfoloji: Lümen, proksimalde daha geniş, distale doğru nazikçe daralan bir koni oluşturur. İç yüzeyi sağ ventrikül gövdesine kıyasla pürüzsüz olup trabeculae carneae ve belirgin papiller kas çıkıntılarından fakirdir; bu, akışın düzenlenmesine yardım eder.
Mikro-anatomi ve histoloji
Infundibüler duvar, çevresel (sirkumferensiyel) ve spiral yönelimli miyosit tabakalarından oluşur; bu lif mimarisi sistolde eşzamanlı daralma ve uzun eksende kısalmayla lümeni düzenler. Endokard, trabekülasyondan yoksun düz bir yüzey sunar; elastik ve kollajen dokuların düzeni, distaldeki kapak aparatına geçişte gerilim dağılımını optimize eder. Purkinje lifleri RVOT’ta bulunmakla birlikte, yoğun ağ yapısı trabeküllü bölgelere kıyasla daha seyrektir; bu durum, RVOT kaynaklı ektopilerin elektrofizyolojik özelliklerine yansır.
Vaskülarizasyon ve venöz drenaj
- Arteriyel beslenme: En önemli kaynak, çoğunlukla sağ koroner arterin (RCA) başlangıcından çıkan konus dalıdır (arteria coni; “üçüncü koroner” olarak ayrı bir ostiumla köken alması anatomik bir varyanttır). Bu dal, RVOT’un anterosuperior duvarını ve ön sağ ventrikül serbest duvarını besler. Sıklıkla proksimal LAD (ramus interventricularis anterior) ile Vieussens arteriyel halkası denen bir halka/ark üzerinden anastomoz yapar.
- Venöz drenaj: RVOT’tan kan, anterior kardiyak venler ve küçük kardiyak venler yoluyla doğrudan sağ atriyuma veya koroner sinüse döner.
- Otonom innervasyon: Üst kardiyak pleksustan gelen sempatik lifler ve n. vagus parasempatik dalları infundibüler miyokardı innerve eder; sempatovagal tonus, RVOT’un elektrofizyolojik uyarılabilirliğini etkiler.
Fizyoloji ve hemodinamik
Conus arteriosus, laminar akışı destekleyen konik bir geçit sağlar. Proksimal genişlikten distale doğru yumuşak daralma, Reynolds sayısını düşürerek türbülansı sınırlar; bu, pulmoner kapak düzeyinde enerji verimliliğini artırır. Sistolde infundibüler duvarın koordineli kasılması, kapak düzleminin açılımıyla eşzamanlıdır ve pulmoner yatağa akışı hızlandırır. Normal koşullarda subpulmoner bölgede belirgin bir basınç gradyanı oluşmaz; ölçülebilir bir gradyan saptanması, subvalvüler (infundibüler) darlık lehinedir.
Görüntüleme anatomisi ve ölçümler
- Transtorasik ekokardiyografi (TTE): Parasternal kısa eksende (baza düzeyinde) ve uzun eksende RVOT segmenti, pulmoner kapak ve proksimal trunkus pulmonalis ile birlikte değerlendirilir. Sürekli dalga Doppler ile tepe hız ve gradyan ölçümü, subvalvüler/valvüler darlık ayrımında kritiktir.
- Kardiyak MR (CMR): RVOT morfolojisi, sağ ventrikül hacimleri ve pulmoner regürjitasyon fraksiyonu nicel olarak ölçülebilir. 4D-flow sekansları, RVOT içi hız vektörleri ve vorteks yapıları hakkında ayrıntı verir.
- BT anjiyografi: Ameliyat/kateter planlamasında konik segmentin çap profili, pulmoner anulus ve ana/sağ-sol pulmoner arter ilişkileri netleştirilir.
- Elektro-fizyoloji (EP): RVOT kaynaklı idiopatik taşikardilerde haritalama, sıklıkla anterosuperior serbest duvar veya subvalvüler bölgede odak gösterir; konus arterinin seyrine yakın enerji uygulamalarında koroner güvenlik değerlendirmesi zorunludur.
Anatomik varyasyonlar
- Kaslı infundibulumun genişliği ve uzunluğu bireyler arasında değişkenlik gösterir.
- Konus arterinin RCA’dan ayrı ostiumla çıkması (“üçüncü koroner”), işlemsel ve cerrahi girişimlerde önem taşır.
- Crista supraventricularisin belirginliği, inflow–outflow ayrımını ve subvalvüler alanın geometrisini etkiler.
Klinik önem ve patoloji
Subvalvüler (infundibüler) darlık
Saf veya valvüler stenozla birlikte olabilir. Doppler’de artmış tepe hız ve subvalvüler hızlanma paterni görülür. Uzun dönemde sağ ventrikül basınç yüklenmesi, hipertrofi ve egzersiz intoleransı gelişebilir. Cerrahide rezeksiyon ve gerekirse transanüler patch ile RVOT genişletme uygulanır; bu işlemler sonrası pulmoner yetmezlik gelişimi ve RV dilatasyonu dikkatle izlenir.
Fallot tetralojisi (TOF)
TOF’un en karakteristik komponentlerinden biri infundibüler darlık/obstrüksiyondur. Dinamik infundibüler kasılma (“spazm”) hipersiyanoz ataklarını ağırlaştırabilir. Onarım sonrası dönemde geniş RVOT ve pulmoner yetersizlik, sağ ventrikül hacim yüklenmesi, aritmiler ve egzersiz performansında azalma ile ilişkilidir; CMR ile volüm ve regürjitasyon takibi esastır.
Çift odacıklı sağ ventrikül (DCRV)
Anormal kas bantları, RV kavitesini ikiye böler; proksimal yüksek basınçlı odacık ile distal düşük basınçlı infundibulum arasında hemodinamik gradyan oluşur. Cerrahi rezeksiyon etkindir.
İdiopatik RVOT taşikardisi
Genellikle yapısal kalbi normal bireylerde, outflow bölgesinden kaynaklanan monomorfik VT’ler görülür. Adrenerjik tetiklenme (egzersiz, stres) tipiktir. Adenozin ve β-blokerlere yanıt verebilir; kateter ablasyonu yüksek başarı oranına sahiptir. Anatomik olarak konusa yakın odaklarda enerji uygulaması, konus arterinin korunmasını gerektirir.
Konotrunkal anomaliler
DORV, transpozisyon, persistan truncus arteriosus gibi lezyonlarda infundibulumun konumu, uzunluğu ve ilişkileri cerrahi stratejiyi belirler (ör. intraventriküler tüneller, konduitler, arteriyel switch teknikleri).
İskemi ve konus arteri
Proksimal RCA’nın konus dalı tutulumu, RVOT–anteriyor RV segmentlerinde odak iskemilere neden olabilir; nadiren özgül EKG bulguları ve aritmojenik odak davranışları ile seyreder. Konus dalı ile LAD arasında Vieussens halkası varlığı, kronik proksimal darlıklarda kolateral önem taşır.
Girişimsel ve cerrahi yaklaşımlar
- Cerrahi RVOT rekonstrüksiyonu: Transanüler patch, valvotomi/valvüloplasti, homogreft/konduit kullanımı.
- Transkateter pulmoner kapak yerleştirme (ör. Melody, SAPIEN platformları): Postoperatif pulmoner yetmezlik ve konduit dejenerasyonunda cerrahiye alternatif/köprü çözüm. İşlem öncesi RVOT çap profili ve komşu koronerlerin (özellikle konus dalı) baskılanma riski dikkatle değerlendirilir.
- RVOT stentleme: Seçilmiş doğumsal lezyonlarda palyatif veya köprü amaçlı.
Biyomekanik ve akış karakteristikleri
Koni biçim, duvar eğriliği ve spiral miyofiber yönelimi, akım çizgilerini kapak düzlemine doğru odaklayan bir nozul etkisi yaratır. Bu, sistolik eylem sırasında enerji kaybını azaltır, kapak yaprakçıklarına binen şer (kayma) stresini homojenleştirir ve distal pulmoner damarlara daha düzgün hız profilleri iletilmesini sağlar. RVOT geometri bozulduğunda (patch ile aşırı genişleme, anulus dilatasyonu), vorteks oluşumu artar ve pulmoner yetersizlikte jet difüzyonu ve enerji verimsizliği gözlenir.
Terminolojik notlar ve karşılaştırmalı anatomi
İnsan kalbinde conus arteriosus = infundibulum eşdeğer kullanılır. Alt omurgalılarda “conus arteriosus” terimi, kapakçıklı kaslı bir çıkış segmentini ayrı bir pompa odacığı gibi tanımlayabilir; bu, memelilerdeki kaslı infundibulumla homolog olsa da, işlevsel bağlamı farklıdır. Sol ventrikülde gerçek bir kaslı infundibulum yoktur; mitral–aortik fibröz süreklilik bulunur.
Pratik ipuçları (klinik ve görüntüleme)
- RVOT darlık şüphesinde Doppler tepe hız/orta gradyan ile valvüler–subvalvüler ayrımı yapılır.
- Post-TOF onarımında CMR ile RV uç-diyastolik hacim ve pulmoner regürjitasyon izlenir; eşikler, pulmoner kapak replasmanı zamanlamasını yönlendirir.
- EP laboratuvarında RVOT ablasyonlarında koroner haritalama ve konus arterine mesafe güvenlik sınırları planlamanın parçasıdır.
- BT/MR’da pulmoner anulus ve RVOT çapları, transkateter kapak için uygunlukta kilittir; komşu koroner sıkışma testi (balonla provokasyon) düşünülebilir.
Keşif
Kalbin sağ ventrikülünde, pürüzsüz duvarlı kaslı bir huni gibi yer alan conus arteriosus (insan kalbinde eşanlamlısıyla infundibulum), anatominin dilinde yüzyıllar boyunca iki ayrı düzlemde konuşuldu: Bir yanda balıklarda ve amfibilerde bağımsız kapakçıklı bir “odacık” olarak karşılaştırmalı anatominin konusu, öte yanda memelilerde özellikle insanda, sağ ventrikülün subpulmoner çıkış kesimi olarak klinik kardiyolojinin hedef bölgesi. Bu ikili kimlik, tarihsel anlatının da çifte kulvarını oluşturur: 1) gözleme dayanan morfolojik betimlemeler ve adlandırmalar; 2) dolaşım fiziolojisi, elektriksel iletim ve hemodinamiğe ilişkin deneysel-klinik kavrayışın giderek incelmesi.
Rönesans: “kalbin hunisi”nin sahneye çıkışı
- yüzyılın büyük diseksiyon devriminde Andreas Vesalius, De humani corporis fabrica’da kalbin makro-morfolojisini Galenik şemalardan koparıp kendi görgül zemini üzerine koydu. Vesalius’un “septumun gözenekli olduğu” dogmayı reddedişi, pulmoner geçiş kavrayışının (İbnü’n-Nefîs’ten beri sürüp gelen hattın) Avrupa tıbbında yeniden canlanmasına yardım etti. Conus/infundibulum terimleri Rönesans metinlerinde bugünkü kesinliğiyle standardize edilmemiş olsa da, sağ ventrikülden akciğerlere uzanan çıkış kanalının koni biçimli morfolojisi, resimli anatominin diliyle görünür kılındı.
17.–18. yüzyıl: damar halkaları, adlandırmalar ve ilk patoloji kronikleri
Erken modern çağda kardiyak anatominin mikroyapısal ayrıntıları büyüteç altına girerken, Raymond de Vieussens conus bölgesini besleyen konus dalını ve onun LAD ile yaptığı kolateral bağlantıyı tarif ederek (bugün “Vieussens arteriyel halkası”) subpulmoner alanın damar ağını isimlendirdi; bu, daha sonra girişimsel-cerrahi çağda “üçüncü koroner” varyantı olarak önem kazanacaktı. Aynı yüzyıllarda saptanan doğumsal defekt öyküleri—Stensen’in (1671/1673) TOF’a öncül sayılan tasvirleri gibi—pulmoner çıkış yolunun patolojideki ağırlığını yavaş yavaş tıp literatürüne yazdı.
19. yüzyıl: deneysel fizyolojinin kalbe girişi ve iletim sisteminin keşfi
François Magendie’nin öncülük ettiği canlı-üzerinde deneyci fizyoloji, kalbin de dâhil olduğu çok sayıda sistemi laboratuvara taşıdı; Magendie’nin adı doğrudan conus arteriosus spesifik deneylerle değil, modern deneysel metodun kuruculuğuyla anılır. Aynı yüzyılda Jan Evangelista Purkinje’nin subendokardiyal iletim liflerini (1839) betimlemesi ve Walter Gaskell’in myojenik kuramı, sağ ventrikül çıkışındaki uyarı-yayılım paternlerine dair daha sonra çok şey açıklayacak elektrofizyolojik zeminini kurdu. Yüzyılın sonunda Otto Frank’ın izovolümik basınç-uzunluk deneyleri (1895) ve 20. yüzyıl başında Ernest Starling’in kalp-akciğer hazırlığı, Frank–Starling ilişkisini inşa ederek ventriküler doluş-atım fiziolojisinin temel kanonunu yazdı; bu çerçeve conus/infundibulumun enerji kaybını azaltan geometrisini düşünmenin de dilini verdi. (Not: “Starling eğrisi”, conus’a özgü bir basınç tekniği değil, kalbin global mekanik yanıtını tanımlayan bir ilişkidir.)
Karşılaştırmalı anatomi hattı: balık kalbinden memeli kalbine “konus”
Karşılaştırmalı anatominin 19. yüzyıldaki yıldızları (örn. Richard Owen), balık ve amfibilerde çok kapakçıklı, kaslı conus arteriosusun ritmik kasılarla akımı yönlendirdiğini ve spiral valfin rolünü ayrıntılandırdı. Bu çizgi, memelilerde conus’un bağımsız bir “odacık” olmaktan ziyade sağ ventrikül çıkış konisi olarak evrildiği fikrinin tarihini de aydınlatır.
20. yüzyılın ilk yarısı: doğumsal kalp cerrahisinin doğuşu ve “dar çıkışın” hedeflenmesi
Pulmoner çıkış yolu patolojileri, 20. yüzyılın ortasında kardiyak cerrahinin sahnesine çıktı. Blalock–Taussig–Thomas şantı (1944), Tetralojî of Fallot’lu “mavi bebeklerin” oksijenlenmesini artırarak devrim yarattı. Hemen ardından Lord Russell Brock’un pulmoner valvotomi/infundibüler rezeksiyon girişimleri (1948 ve sonrası), subvalvüler-valvüler darlığın doğrudan cerrahi çözümünü tarif etti. Bu dönem, conus/infundibulumun anatomik sınırlarına ve darlığın dinamik bileşenine dair cerrahi duyarlığı kalıcılaştırdı.
Görüntüleme devrimi: ekodan CMR’a, CMR’dan 4D-flow’a
1953’te Inge Edler ve Hellmuth Hertz, endüstriyel ultrasonu göğüs duvarına çevirip ilk M-mod ekokardiyografiyi kaydettiklerinde, RVOT’nin yapısal-dinamik değerlendirmesi bambaşka bir çağın eşiğine girdi. 1980’lerden itibaren kardiyak MR (CMR) ve ardından 4D-flow CMR, infundibulum içindeki hız vektörlerini, vorteksleri ve enerji kaybı/duvar kayma stresi gibi metrikleri nicel olarak ölçmeyi mümkün kıldı; RVOT geometristesinde (örn. geniş transanüler patch sonrası) ortaya çıkan akım düzensizlikleri, bugün artık sayısallaştırılabilir bir fenomendir.
“Tetraloji”nin 300 yılı ve RVOT’un cerrahi yeniden şekillenişi
TOF’un patolojik anatomi-cerrahi öyküsü Stensen’den Fallot’ya, oradan transanüler patch ve primer tam onarıma uzanır. Kirklin ekolünün 1960’lar-80’lerde standartlaştırdığı onarımlar, uzun dönemde pulmoner yetersizlik ve RV hacim yüklenmesi pahasına RVOT akışını genişleterek siyanoti sonlandırdı; bu da conus/infundibulum mekaniğinin uzun dönem remodelingini izlemeyi bir takip standardı hâline getirdi.
Kateter çağında conus: Melody-SAPIEN hattı ve planlamanın merkezinde RVOT
2000’de Philipp Bonhoeffer’in ilk transkateter pulmoner kapak implantasyonu, eski konduit/patch’li RVOT’larda tekrar kapaklandırmayı cerrahiye alternatif bir kulvara taşıdı (Melody® ve akabinde SAPIEN platformları). Bugün kateter öncesi planlama, RVOT ölçümleri, koroner komşuluk ve olası sıkışma riskinin BT/CMR ile değerlendirilmesine dayanıyor; conus bölgesinin damar varyantları (örn. izole konus arteri, Vieussens halkası) bu planlamanın kritik parçası.
Elektrofizyoloji cephesi: RVOT taşikardisi ve adenozi̇n duyarlılığı
Yapısal kalbi normal bireylerde görülen idiopatik RVOT taşikardisi, 1980’ler-90’lardan beri cAMP aracılı tetiklenmiş aktivite kavrayışıyla açıklanır; çoğu olgu adenozi̇n/β-bloker ile sonlanır ve kateter ablasyonu yüksek başarı oranına sahiptir. RVOT’un pürüzsüz, ince duvarlı mimarisiyle konus arterinin seyrinin yakınlığı, ablasyon stratejisinde güvenlik sınırlarını belirler.
Güncel ufuk: 4D-flow, hesaplamalı akışkanlar ve “akıllı” RVOT
Son beş-on yılda RVOT ve pulmoner kökün 4D-flow CMR ile enerji kaybı (EL), duvar kayma stresi (WSS), vorteks mimarisi gibi metriklerle nicellenmesi; hesaplamalı akışkanlar dinamiği (CFD) ile hasta-özgül modellerin geliştirilmesi; ve PPVI öncesi doğru RVOT boyutlandırması için CMR/BT tabanlı ortak standartların yazılması, conus/infundibulumun klinik karar desteğinde merkezî bir yer tuttuğunu gösteriyor. Bu çalışmalar, RVOT aneurizması gibi post-onarımlı nadir tabloların vortikal akım ve enerji kaybı profilini de ortaya koyuyor.
Kavramsal düğümler ve düzeltmeler
- “Starling eğrisi conus’a özgü bir basınç tekniğidir” yargısı tarihsel olarak doğru değildir. Starling’in kalp-akciğer hazırlığı ve Frank–Starling ilişkisi global ventrikül mekanik yanıtını tanımlar; conus arteriosus üzerinde spesifik bir “Starling yöntemi” yoktur.
- Magendie modern deneysel fizyolojinin kurucularındandır; fakat literatürde conus arteriosus’un işlevini tekil deneylerle “ilk kez” gösterdiğine dair özgül bir kayıt değil, daha genel yöntembilimsel öncülük ve dolaşım-ilaç etkileri çalışmaları ön plandadır.
Son kertede tarihî süreklilik
Conus arteriosus’un hikâyesi, resimli diseksiyonlardan damar halkalarının adlandırılmasına; myosit lif yönelimi ve iletim sisteminin fark edilmesinden cerrahi-kateterik yeniden şekillendirmelere; ekodan CMR’a, oradan 4D-flow ve CFD çağında sayısallaştırılmış hemodinamik haritalara uzanır. Sağ ventrikül çıkışının bu kaslı “hunisi”, bugün doğumsal kalp cerrahisinden aritmi ablasyonuna ve transkateter kapaklandırmaya dek uzanan geniş bir uygulama alanında, geometri-fizyoloji-klinik üçgeninin tam kesişim noktasında durmaktadır.
İleri Okuma
- Vesalius, A. (1543). De humani corporis fabrica. Basel: Oporinus.
- Frank, O. (1895). Zur Dynamik des Herzmuskels. Zeitschrift für Biologie, 32, 370–447.
- Starling, E. H. (1918). The Linacre Lecture on the Law of the Heart. London: Longmans, Green & Co.
- Campbell, M.; Deuchar, D. C.; Brock, R. C. (1954). Results of pulmonary valvotomy and infundibular resection in 100 cases of Fallot’s tetralogy. British Medical Journal, 2(4880), 111–122.
- Neill, C. A.; Clark, E. B. (1994). Tetralogy of Fallot: The first 300 years. Texas Heart Institute Journal, 21(4), 272–279.
- Lerman, B. B.; Stein, K. M.; Markowitz, S. M. (1996). Adenosine-sensitive ventricular tachycardia: evidence suggesting cyclic AMP-mediated triggered activity. Journal of Cardiovascular Electrophysiology, 7(6), 559–569.
- Markowitz, S. M.; Weinsaft, J. W.; Waldman, L.; et al. (1997). Adenosine-sensitive ventricular tachycardia: right ventricular outflow tract as the site of origin. Journal of the American College of Cardiology, 30(1), 103–110.
- Fraser, A. G. (2001). Echocardiography: a brief history. Heart, 85(6), 616–620.
- Farzaneh-Far, A.; Lerman, B. B. (2005). Idiopathic right ventricular outflow tract tachycardia: clinical features and management. Heart, 91(11), 1365–1371.
- Silverman, M. E. (2006). Why Does the Heart Beat? The Discovery of the Electrical System of the Heart. Circulation, 113(24), 2775–2781.
- Singh, S. (2007). M-mode and the dawn of echocardiography. Texas Heart Institute Journal, 34(3), 431–438.
- Pohost, G. M. (2008). The history of cardiovascular magnetic resonance. JACC: Cardiovascular Imaging, 1(5), 672–678.
- Klabunde, R. E. (2012). Cardiovascular Physiology Concepts (2nd ed.). Lippincott Williams & Wilkins.
- van der Wall, E. E. (2013). Crown years for non-invasive cardiovascular imaging (Part IV): 30 years of cardiac magnetic resonance. Netherlands Heart Journal, 21, 315–317.
- McElhinney, D. B.; Hennesen, J. T. (2013). The Melody® valve and Ensemble® delivery system for transcatheter pulmonary valve replacement. Annals of the New York Academy of Sciences, 1291(1), 77–85.
- Zampieri, F. (2015). Andreas Vesalius: Celebrating 500 years of dissecting nature. Global Cardiology Science & Practice, 2015(5), 66.
- Mesquita, E. T.; Souza Júnior, C. V.; Ferreira, T. R. (2015). Andreas Vesalius 500 years—A Renaissance that revolutionized cardiovascular knowledge. Revista Brasileira de Cirurgia Cardiovascular, 30(2), 260–265.
- Sequeira, V.; van der Velden, J. (2015). Historical perspective on heart function: the Frank–Starling law. Biophysical Reviews, 8, 345–358.
- Standring, S. (Ed.). (2016). Gray’s Anatomy: The Anatomical Basis of Clinical Practice (41st ed.). Elsevier.
- Shahanavaz, S.; et al. (2018). Transcatheter Pulmonary Valve Replacement With the Melody Valve in Small Conduits. JACC: Cardiovascular Interventions, 11(11), 1130–1140.
- Moore, K. L.; Dalley, A. F.; Agur, A. M. R. (2018). Clinically Oriented Anatomy (8th ed.). Wolters Kluwer.
- Netter, F. H. (2018). Atlas of Human Anatomy (7th ed.). Elsevier.
- Azarine, A.; Garçon, P.; Stansel, J.; et al. (2019). Four-dimensional Flow MRI: Principles and Cardiovascular Applications. RadioGraphics, 39(6), 1856–1882.
- Tsuchiya, N.; et al. (2021). Circulation derived from 4D flow MRI correlates with right ventricular dysfunction in repaired tetralogy of Fallot. Scientific Reports, 11, 11776.
- Karsenty, C.; et al. (2023). 4D flow magnetic resonance imaging to assess right ventricular outflow tract. Revista Española de Cardiología (English Edition), 76(10), 843–851.
- Han, B. K.; Garcia, S.; Aboulhosn, J.; et al. (2024). Technical recommendations for computed tomography guidance of intervention in the right ventricular outflow tract: Native RVOT, conduits, and bioprosthetic valves. Journal of Cardiovascular Computed Tomography, 18(1), 75–99.
- Shiina, Y.; Nagao, M.; Itatani, K.; et al. (2024). 4D flow MRI-derived energy loss and RV workload in adults with tetralogy of Fallot. Journal of Cardiology, 83(6), 382–389.