Terminoloji Tartışmaları
Literatürde bazı araştırmacılar, “nöroendokrin hücre” terimini fazla geniş ve belirsiz bulmakta ve bunun yerine sadece “endokrin hücre” teriminin kullanılmasını önermektedirler. Ancak bu öneri henüz yaygın klinik ya da akademik kullanımda benimsenmemiştir ve nöroendokrin terimi yaygın olarak kullanılmaya devam etmektedir.
Tanım ve Genel Özellikler
Yaygın nöroendokrin sistem (Diffuse Neuroendocrine System; DNES), nöropeptidler ve monoaminler gibi biyolojik olarak aktif maddeler salgılayan ve kromogranin A, sinaptofizin gibi nöroendokrin hücre belirteçlerini eksprese eden, farklı organlarda yerleşik özel hücre topluluklarını ifade eder. Bu hücreler, hem morfolojik hem de fonksiyonel açıdan nöronlara benzerlik gösterir. Bu nedenle, “nöroendokrin” terimi ile adlandırılmaktadırlar.
Histolojik Özellikler ve Anatomik Dağılım
Yaygın nöroendokrin sistem, klasik endokrin sistemin bir uzantısı olarak kabul edilir. Nöroendokrin hücreler iki temel şekilde bulunur:
- Organize Endokrin Yapılar İçinde:
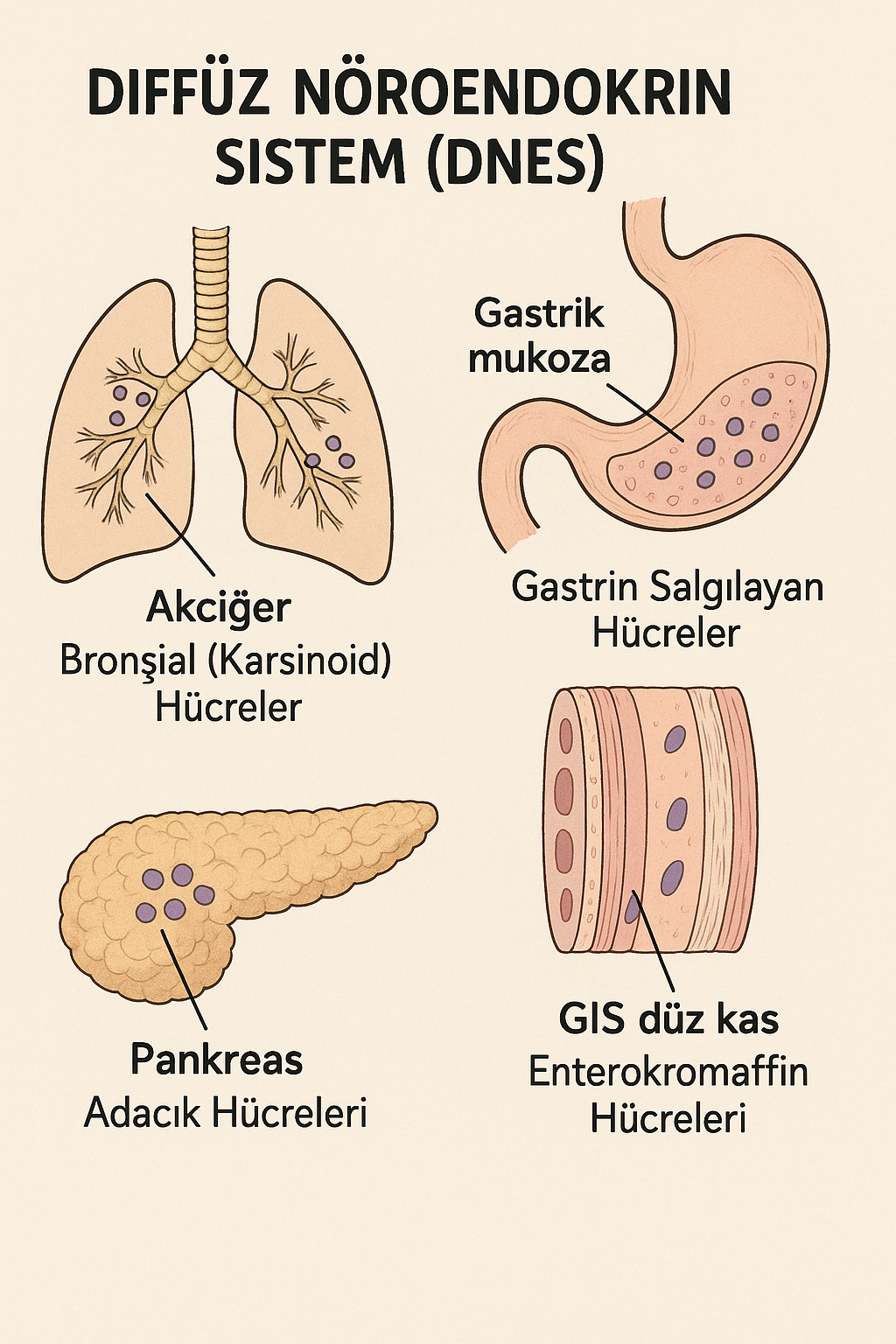
Bu hücreler hipofiz (özellikle adenohipofiz), paratiroid bezleri, adrenal medulla, pankreas adacıkları (Langerhans adacıkları) ve tiroid bezinin parafolliküler (C) hücreleri gibi endokrin organlarda yer alır. - Dağınık (Diffüz) Yerleşimli Hücreler:
Çok sayıda nöroendokrin hücre, gastrointestinal sistem (GİS), solunum yolları (özellikle bronşiyal sistem), ürogenital sistem, kardiyovasküler sistem ve deri gibi organların yüzey epitellerinde tek tek veya küçük gruplar halinde dağılmış şekilde bulunur. Bu özelliklerinden dolayı bu hücreler “dağınık nöroendokrin hücreler” olarak da tanımlanır. Özellikle GİS’te, midenin glandüler epitelinde, ince ve kalın bağırsağın mukozasında yoğun olarak bulunurlar ve bu bölgelerde enteroendokrin hücreler olarak adlandırılırlar.
Fonksiyonel açıdan, enteroendokrin hücreler ile pankreasın endokrin hücreleri arasında önemli benzerlikler mevcuttur. Bu nedenle bu iki grup, birlikte gastroentero-pankreatik nöroendokrin sistem (GEP sistemi) olarak sınıflandırılır.
Alt Gruplar ve Hücre Tipleri
Yaygın nöroendokrin sistem içerisinde yer alan hücre grupları genellikle APUD (Amine Precursor Uptake and Decarboxylation) hücreleri olarak adlandırılır. Bu hücreler amin prekürsörlerini alarak dekarboksilasyon yoluyla biyolojik olarak aktif aminleri sentezleyebilir. APUD hücreleri, organlara göre aşağıdaki alt gruplara ayrılır:
- Gastrointestinal sistem ve pankreastaki hücreler:
- G hücreleri: Gastrin üretir (mide antrumu)
- I hücreleri: Kolesistokinin (CCK) üretir (duodenum ve jejunum)
- S hücreleri: Sekretin üretir (duodenum)
- K hücreleri: Gastrik inhibitör peptid üretir (duodenum ve jejunum)
- L hücreleri: Glukagon-benzeri peptidler (GLP-1, GLP-2) üretir (ileum ve kolon)
- N hücreleri: Nörotensin üretir (jejunum ve ileum)
- Enterokromafin hücreleri: Serotonin sentezler (tüm GİS boyunca)
- Bronşiyal sistemdeki APUD hücreleri: Kultschitzky hücreleri dahil, solunum yollarında bulunurlar.
- Ürogenital sistemdeki APUD hücreleri: Mesane ve prostat gibi bölgelerde tanımlanmıştır.
- Kardiyovasküler sistemdeki APUD hücreleri: Özellikle kalpte endokrin benzeri işlev gösteren hücreler mevcuttur.
- Derideki nöroendokrin hücreler: Özellikle Merkel hücreleri bu grupta yer alır.
Klinik Önemi
Klinik açıdan nöroendokrin hücreler büyük öneme sahiptir. Özellikle Kultschitzky hücreleri, bronşiyal sistemde yer alan APUD hücreleri arasında yer alır ve çeşitli malign tümörlerin, özellikle de küçük hücreli akciğer karsinomu (small cell lung carcinoma, SCLC) gibi yüksek dereceli nöroendokrin karsinomların kaynağı olabilir. Benzer şekilde, GİS’te yer alan enteroendokrin hücrelerden kaynaklanan tümörler de klinik olarak “nöroendokrin tümörler” (NET) adı altında değerlendirilir.
Eğer bu metni belirli bir bağlamda (sunum, akademik yayın, ders materyali) kullanmak istiyorsanız, yapıya uygun olarak genişletebilir ya da kaynakça ile destekleyebilirim.
Keşif
Gastrointestinal kanalın endokrin düzenleyici sistemine ilişkin daha ayrıntılı karakterizasyon, 1938 yılında Friedrich Feyrter tarafından gerçekleştirilmiştir. Feyrter, dönemin ileri histokimyasal yöntemlerinden biri olan Masson boyama tekniğini kullanarak, pankreatik duktal sistem ile intestinal epitel içerisinde yer alan, sitoplazmaları açık boyanan hücreleri tanımlamış ve bu hücreleri “helle Zellen” (aydınlık hücreler) olarak adlandırmıştır. Feyrter’in bu gözlemleri, yalnızca pankreas ve bağırsaklarla sınırlı olmayan, çeşitli organlara yayılmış, fonksiyonel açıdan benzerlik gösteren bir hücre grubunun varlığını ortaya koymuş; böylece günümüzde “yaygın nöroendokrin sistem (DNES)” olarak bilinen kavramın temelleri atılmıştır. Bu yaklaşım, endokrin hücrelerin klasik bez yapılarla sınırlı olmadığı, aksine epitelial yüzeylerde dağınık halde de bulunabileceği yönünde paradigmatik bir değişime öncülük etmiştir.
İçindekiler
1938 – Feyrter ve “Helle Zellen” Kavramı
- Friedrich Feyrter, Masson boyama yöntemiyle pankreatik ve intestinal epitelde açık sitoplazmalı hücreleri tanımladı ve bunları helle Zellen olarak adlandırdı.
- Bu hücrelerin endokrin fonksiyon gösterdiğini ve vücutta yaygın olarak bulunduklarını öne sürerek “diffus endokrines System” (yaygın endokrin sistem) kavramını ortaya attı.
1940’lar–1950’ler – Enterokromafin Hücrelerin Keşfi ve Serotonin
- Enterokromafin hücrelerin keşfiyle, bu hücrelerin serotonin (5-HT) üretimi yaptığı bulundu.
- Özellikle bağırsakta bulunan bu hücrelerin, hem nörotransmitter üretmesi hem de hormonal etki göstermesi nöroendokrin özellikleri destekledi.
1960 – APUD Kavramının Ortaya Atılması (Pearse)
- A.G.E. Pearse, amino prekürsörlerin alımı ve dekarboksilasyon yeteneğine sahip hücreleri tanımlayarak APUD (Amine Precursor Uptake and Decarboxylation) sistemini tanıttı.
- Bu hücrelerin ortak bir embriyonik kökenden (nöral krista) türediğini öne sürdü.
- Geniş bir doku spektrumunda bulunmaları nedeniyle, yaygın nöroendokrin sistemin histogenetik ve fonksiyonel temeli için çığır açıcı oldu.
1970–1980’ler – Hücresel İşaretleyiciler ve Kromograninler
- Nöroendokrin hücreleri tanımlamak için kromogranin A, sinaptofizin gibi immünohistokimyasal belirteçler kullanılmaya başlandı.
- Bu belirteçler sayesinde hem normal doku dağılımı hem de nöroendokrin tümörler (NET) daha güvenilir şekilde tanımlanabildi.
1990’lar – GEP Sistemi ve Nöroendokrin Tümörlerin Moleküler Sınıflandırılması
- Gastrointestinal ve pankreatik nöroendokrin hücrelerin ortak fonksiyonel birim oluşturduğu gastroentero-pankreatik (GEP) nöroendokrin sistem kavramı yerleşti.
- GEP kaynaklı tümörlerin (örn. insulinoma, gastrinoma, VIPoma) klinik ve moleküler alt tipleri sınıflandırıldı.
2000’ler – Nöroendokrin Tümörlerde Genetik ve Moleküler Profiling
- MEN1, DAXX/ATRX, mTOR gibi genetik mutasyonların özellikle pankreatik NET’lerde rol oynadığı gösterildi.
- Dünya Sağlık Örgütü (WHO), nöroendokrin tümörlerin histolojik sınıflandırmasını güncelledi (düşük dereceli NET’ler ve yüksek dereceli NEC’ler ayrımı).
2010–Günümüz – Nöroendokrin Hücre Plastisitesi ve İmmün Onkoloji
- Nöroendokrin hücrelerin plastisitesi (örn. adenokarsinomdan nöroendokrine dönüşüm gibi) özellikle akciğer ve prostat kanserlerinde vurgulandı.
- İmmünoterapötik yaklaşımlar, nöroendokrin tümörlerin tedavisinde değerlendirilmeye başlandı.
- Somatostatin reseptörlerine yönelik görüntüleme ve tedavi (örn. Ga-68 PET, Lu-177 terapi) klinik pratiğe girdi.
İleri Okuma
- Feyrter, F. (1938). Über diffuse endokrine Epitheliale in Magen- und Darmkanal. Zentralblatt für allgemeine Pathologie und pathologische Anatomie, 70, 11–23.
- Pearse, A.G.E. (1966). The cytochemistry and ultrastructure of polypeptide hormone-producing cells of the APUD series and the embryologic, physiologic and pathologic implications of the concept. Journal of Histochemistry & Cytochemistry, 14(9), 721–755.
- Polak, J.M., & Bloom, S.R. (1977). The diffuse neuroendocrine system and its relevance to pathology. Pathology Annual, 12, 423–441.
- Grimelius, L., & Wilander, E. (1980). Silver stains in the study of enterochromaffin cells. The American Journal of Clinical Pathology, 74(4), 429–432.
- Capella, C., Heitz, P.U., Höfler, H., Solcia, E., & Klöppel, G. (1995). Revised classification of neuroendocrine tumors of the lung, pancreas and gut. Virchows Archiv, 425(6), 547–560.
- Klöppel, G., Rindi, G., Anlauf, M., Perren, A., & Komminoth, P. (2004). Site-specific biology and pathology of gastroenteropancreatic neuroendocrine tumors. Virchows Archiv, 444(1), 1–9.
- Yao, J.C., Hassan, M., Phan, A., et al. (2008). One hundred years after “carcinoid”: epidemiology of and prognostic factors for neuroendocrine tumors in 35,825 cases in the United States. Journal of Clinical Oncology, 26(18), 3063–3072.
- Rindi, G., Klimstra, D.S., Abedi-Ardekani, B., et al. (2018). A common classification framework for neuroendocrine neoplasms: an international agency for research on cancer (IARC) and World Health Organization (WHO) expert consensus proposal. Modern Pathology, 31(12), 1770–1786.