1. Kavramsal Çerçeve ve Tanım
Dissemine intravasküler koagülasyon (DIC), dolaşım sistemi içinde pıhtılaşma kaskadının yaygın ve kontrolsüz aktivasyonu ile karakterize, çok sistemli, dinamik ve sıklıkla yaşamı tehdit eden bir sendromdur.
Temel olarak iki eş zamanlı süreç bir arada bulunur:
- Mikrovasküler tromboz: Küçük ve orta çaplı damarların lümeninde yaygın fibrin zengini trombüs oluşumu.
- Tüketim koagülopatisi ve kanama: Pıhtılaşma faktörleri, trombositler ve fibrinojenin hızla tüketilmesi sonucunda gelişen, sıklıkla kontrolü güç yaygın kanama.
Bu iki süreç, hemodinamik ve metabolik bozukluklar, doku hipoksisi ve mikrosirkülasyon yetmezliği üzerinden çoklu organ disfonksiyonu/çoklu organ yetmezliği ile sonuçlanabilir. DIC, başlı başına bağımsız bir hastalık değil, altta yatan bir tetikleyici durumun (sepsis, travma, malignite, obstetrik komplikasyon vb.) sistemik koagülasyon yanıtı olarak anlaşılmalıdır.
2. Etimoloji ve Tarihsel Gelişim
2.1. Etimoloji
- Dissemine: Latince disseminare (“tohum saçmak, etrafa yaymak”) fiilinden gelir; pıhtıların vücut genelinde dağınık biçimde oluşmasını ima eder.
- Intravasküler: Latince intra (“içinde”) ve vasculum (“küçük damar, küçük kap”) sözcüklerinden türemiştir; olayın damar lümeni içinde gerçekleştiğini belirtir.
- Koagülasyon: Latince coagulare (“bir araya getirmek, pıhtılaştırmak”) fiilinden; kanın sıvı halden yarı katı pıhtı haline geçiş sürecini tanımlar.
Türkçede kullanılan “yaygın damar içi pıhtılaşma” veya “yaygın damariçi pıhtılaşma sendromu” ifadesi, bu Latince–İngilizce kökenli bileşik terimin anlamını doğrudan yansıtır. Eski literatürde “tüketim koagülopatisi”, “defibrinasyon sendromu” gibi terimler de kullanılmış, ancak günümüzde DIC kısaltması baskın hale gelmiştir.
2.2. Tarihsel Perspektif
- İlk gözlemler, obstetrik komplikasyonlar (özellikle plasenta dekolmanı ve amniyon sıvısı embolisi), şiddetli sepsis ve uygunsuz kan transfüzyonu olgularında görülen, hem tromboz hem de yaygın kanama ile giden olgular üzerinden yapılmıştır.
- yüzyıl ortasında koagülasyon faktörlerinin, fibrinojen düzeylerinin ve fibrin yıkım ürünlerinin ölçülebilmesiyle bu tablo giderek daha iyi tanımlanmış, “dissemine intravasküler koagülasyon” terimi yerleşmiştir.
- 1960–1980’ler boyunca, travma cerrahisi, yoğun bakım tıbbı ve hematoloji alanlarının gelişmesi ile DIC, sepsis ve çoklu organ yetmezliği sendromu (MODS) çerçevesinde yeniden yorumlanmış; heparin, kan ürünleri ve daha sonra da hedefe yönelik moleküllerle birçok tedavi stratejisi denenmiştir.
- Güncel kavrayışta DIC, “immunotromboz” kavramı ile birlikte, bağışıklık sisteminin ve pıhtılaşmanın iç içe geçmiş savunma mekanizmalarının patolojik aşırısı olarak değerlendirilmektedir.
3. Evrimsel ve Fizyolojik Perspektif: “İmmunotrombozdan” DIC’ye
Pıhtılaşma sistemi, evrimsel olarak yalnızca kanamayı durdurmak için değil, mikroorganizmaların yayılımını sınırlamak için de şekillenmiştir.
- İmmunotromboz: Enfeksiyon sırasında damar endotelinde ve mikrosirkülasyonda, fibrin ve trombositlerin, mikroorganizmaları “hapseden” bir ağ oluşturmasıdır. Bu sayede patojenlerin yayılımı sınırlandırılır, fagositik hücrelerin etkinliği artar.
- Bu mekanizma normalde yerel ve kontrollü olduğunda koruyucudur.
- Ancak ağır sepsis, travma veya malignite gibi durumlarda:
- Tüm organizmada yaygın doku faktörü ekspresyonu,
- Sitokin fırtınası (IL-6, TNF-α vb.),
- Endotel hasarı ve antikoagülan mekanizmaların (protein C sistemi, antitrombin, trombomodulin vb.) baskılanması
sonucunda bu fizyolojik immunotromboz sistemik ve dissemine hale gelir.
Ortaya çıkan tablo, evrimsel olarak yararlı bir savunma mekanizmasının, kontrolsüz biçimde tüm organizmaya yayılması sonucu gelişen maladaptif bir sendromdur; bu sendromun klinik adı DIC’dir.
4. Etiyoloji ve Tetikleyici Durumlar
DIC, farklı klinik durumların ortak son yolu olarak görülebilir. En sık tetikleyiciler:
4.1. Enfeksiyon ve Sepsis
- Gram-negatif ve gram-pozitif sepsis,
- Menenjit, pnömoni, intraabdominal enfeksiyonlar,
- Viral enfeksiyonlar (örn. ağır viral hemorajik ateşler)
Patojenle ilişkili moleküler paternler (PAMP) ve hasarla ilişkili moleküler paternler (DAMP), monosit ve endotel hücrelerinde doku faktörü ekspresyonunu artırır; bu da koagülasyon kaskadını tetikler.
4.2. Travma, Yanıklar, Şok
- Çoklu travma, crush yaralanmaları
- Geniş yüzey alanlı yanıklar
- Uzamış hipotansiyon ve şok tabloları
Doku yıkımı, endotel hasarı, hipoperfüzyon ve asidoz; koagülasyon kaskadını tetikleyen önemli uyarılardır.
4.3. Obstetrik Komplikasyonlar
- Plasenta dekolmanı (ablatio placentae)
- Amniyon sıvısı embolisi
- Ölü fetüsün uzun süre uterusta kalması
- Şiddetli preeklampsi/eclampsia, HELLP sendromu
Plasental doku faktörü ve doku tromboplastinin dolaşıma karışması DIC’yi hızla tetikleyebilir.
4.4. Maligniteler
- Özellikle akut promiyelositik lösemi (APL) başta olmak üzere akut lösemiler
- Pankreas, prostat, mide gibi solid tümörler
- Mukoza/kanal içine invaze olan, mukin salgılayan tümörler
Tümör hücreleri ve tümör mikroçevresi, doku faktörü ve prokoagülan mikropartiküller salgılayarak kronik veya akut DIC tablolarına yol açabilir.
4.5. Diğer Nedenler
- Uygunsuz kan transfüzyonu (ABO uyumsuzluğu)
- Dev aort anevrizmaları
- Bazı yılan sokmaları, zehirlenmeler
- Isı çarpması, hipersensitivite reaksiyonları
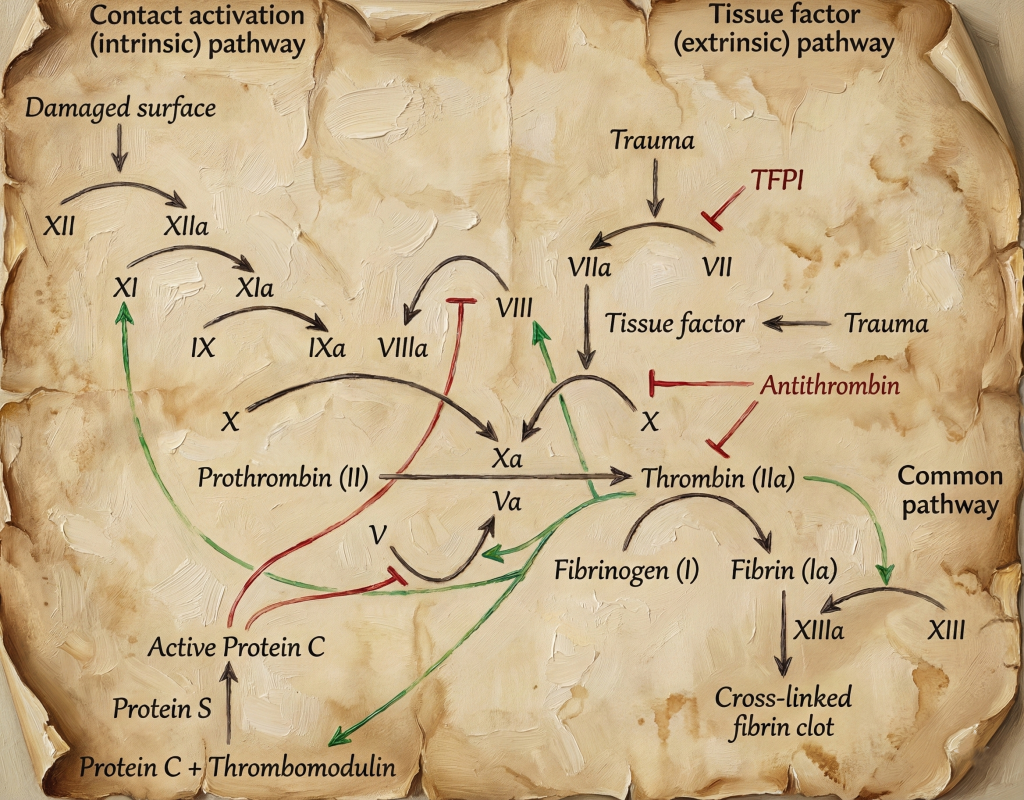
5. Patofizyoloji: Koagülasyon Kaskadının Kontrolsüz Aktivasyonu
DIC’nin patofizyolojisi, birkaç temel sürecin iç içe geçmesiyle anlaşılabilir.
5.1. Doku Faktörü Aracılı Trombin Fırtınası
- Monositler, endotel hücreleri ve doku makrofajları, sitokinlerin ve endotoksinlerin etkisiyle doku faktörü (Tissue Factor, TF) ekspresyonunu artırır.
- TF, dolaşımdaki faktör VII/VIIa ile kompleks oluşturarak ekstrinsik koagülasyon yolunu aktive eder.
- Bu yol, faktör X ve IX üzerinden trombin üretimini dramatik biçimde artırır.
- Trombin:
- Fibrinojeni fibrine dönüştürür.
- Trombositleri aktive eder, agregasyonu artırır.
- Pozitif geri bildirim ile koagülasyon kaskadını daha da güçlendirir.
Sonuç: Mikrosirkülasyonda yaygın fibrin birikimi ve mikrotromboz.
5.2. Doğal Antikoagülan Sistemlerin Baskılanması
Normalde koagülasyonu frenleyen sistemler:
- Antitrombin (trombin ve faktör Xa inhibitörü)
- Protein C – Protein S – Trombomodulin sistemi
- Doku faktör yolu inhibitörü (TFPI)
Ağır inflamasyon ve endotel hasarı sırasında:
- Trombomodulin ekspresyonu azalır → protein C aktivasyonu düşer.
- Antitrombin düzeyleri tüketim ve kayıplarla azalır.
- TFPI etkisi görece yetersiz kalır.
Bu durum, “freni alınmış, gaza sonuna kadar basılmış” bir koagülasyon sistemi anlamına gelir.
5.3. Fibrinolitik Sistem: Başlangıçta Aktivasyon, Sonra İnhibisyon
- Başlangıçta, dolaşımdaki fibrinin fazlalığına karşı plazmin aracılı fibrinoliz artar;
- Ancak sepsis ve ağır inflamasyon sırasında PAI-1 (plasminojen aktivatör inhibitörü-1) düzeyleri yükselir, fibrinoliz baskılanır.
Bu sıra dışı dinamik, bazı DIC alt tiplerinde fibrinolitik aktivitenin aşırı olduğu, bazılarında ise tam tersine fibrinolitik baskılanmanın öne çıktığı klinik tablolar doğurabilir (örneğin APL’de ağır fibrinolitik DIC).
5.4. Tüketim Koagülopatisi ve Kanama
- Sürekli trombin üretimi ve fibrin oluşumu:
- Fibrinojen,
- Faktör V, VIII gibi pıhtılaşma faktörleri,
- Trombositler
hızla tüketilir.
- Karaciğer sentez kapasitesi bu tüketimi karşılayamaz hale geldiğinde koagülasyon faktörü eksikliği gelişir.
- Ayrıca fibrin yıkım ürünlerinin (FDP) artışı, trombosit fonksiyon bozukluğu ve endotel disfonksiyonu da hemostazı bozar.
Net sonuç: Aynı hasta bir yandan damar yatağında tromboz, diğer yandan cilt, mukozalar ve cerrahi alanlarda yaygın kanama ile seyreder.
5.5. Organ Disfonksiyonu ve Çoklu Organ Yetmezliği
Mikrotromboz ve hipoperfüzyonun yol açtığı başlıca organ hasarları:
- Böbrek: Akut tübüler nekroz, oligüri/anjüri, akut böbrek hasarı
- Akciğer: ARDS benzeri tablo, hipoksemi
- Karaciğer: Sitoliz, kolestaz, sentrilobüler nekroz
- Serebral dolaşım: Konfüzyon, koma, nörolojik defisitler
- Cilt ve ekstremiteler: Purpura fulminans, akral nekroz, gangren
6. Klinik Özellikler
DIC’nin klinik görünümü, altta yatan neden, süreç hızı ve hastanın rezervine göre değişir. Ancak tipik semptom ve bulgular belli kümeler hâlinde gruplanabilir.
6.1. Kanama Bulguları
- Mukozal kanamalar:
- Epistaksis (burun kanaması)
- Diş eti kanaması
- Hematüri
- Gastrointestinal kanama (melena, hematemez)
- Cerrahi ve girişim yerlerinden kanama:
- İV kateter alanları, enjeksiyon bölgeleri
- Ameliyat sahasından sızma tarzında kanama
- Cilt bulguları:
- Peteşi: iğne ucu büyüklüğünde, basmakla solmayan kırmızı/mor noktalar
- Purpura: daha büyük, birleşme eğilimli morluklar
- Ekimoz ve hematomlar
Ağır olgularda kontrol altına alınması güç, çok odaklı kanama görülebilir.
6.2. Tromboz ve Organ Disfonksiyonu Bulguları
- Böbrek yetmezliği: idrar çıkışında azalma, kreatinin yükselişi
- Solunum yetmezliği: dispne, oksijen satürasyonunda düşme
- Hepatik disfonksiyon: sarılık, transaminaz artışı, koagülasyon bozukluğunun derinleşmesi
- Nörolojik bulgular: ajitasyon, letarji, koma
- Periferik dolaşım bozukluğu: soğuk ekstremiteler, akral siyanoz, nekroz, purpura fulminans
Bazı hastalarda tromboz baskın, bazılarında ise kanama baskın tablo hâkimdir; bu da klinik yönetim açısından önemli bir nüanstır.
7. Laboratuvar Bulguları ve Tanı
DIC tanısı, yalnızca tek bir testle konmaz; klinik bağlam içinde birden fazla laboratuvar bulgunun birlikte değerlendirilmesini gerektirir.
7.1. Temel Laboratuvar Bulguları
- Trombosit sayısı:
- Genellikle düşük (trombositopeni)
- Düşüş hızı da önemlidir; kısa sürede belirgin azalma DIC lehinedir.
- Fibrinojen düzeyi:
- Çoğunlukla azalmıştır, özellikle akut, tüketimin baskın olduğu DIC’de.
- Ancak bazı inflamatuvar durumlarda fibrinojen “akut faz reaktanı” olarak yüksek de başlayıp daha sonra düşebilir; bu dinamik dikkatle izlenmelidir.
- Pıhtılaşma süreleri:
- Protrombin zamanı (PT) uzamış
- Aktive parsiyel tromboplastin zamanı (aPTT) uzamış olabilir
- D-dimer ve fibrin yıkım ürünleri (FDP):
- Genellikle belirgin yüksek; artmış fibrin oluşumu ve yıkımını yansıtır.
- Periferik yayma:
- Mekanik hemolize bağlı şistositler görülebilir.
- Antitrombin düzeyi:
- Genellikle düşmüştür; prognostik önemi olduğu düşünülür.
7.2. Skorlama Sistemleri
Uluslararası toplumlar, DIC tanısına yardımcı olmak için skorlamalar geliştirmiştir (örneğin ISTH DIC skoru). Bu skorlar tipik olarak:
- Trombosit sayısı
- D-dimer/FDP düzeyleri
- PT uzaması
- Fibrinojen düzeyini
puanlayarak bir toplam skor üretir ve “olası” veya “açık” DIC lehine yorumlama yapılmasına yardım eder. Özellikle sepsisli hastalarda seri ölçümler ile skorun zaman içindeki seyri, prognoz ve tedavi yanıtının izlenmesinde değerlidir.
7.3. Ayırıcı Tanı
DIC, aşağıdaki durumlarla karışabilir veya birlikte bulunabilir:
- Karaciğer yetmezliği (faktör sentez bozukluğu)
- Primer fibrinoliz sendromları
- Trombositopenik purpura, immün trombositopeni (ITP)
- Trombotik mikroanjiyopatiler (TTP, HUS)
Bu tabloların ayrımı, periferik yayma, ADAMTS13 düzeyi, LDH, haptoglobin, klinik bağlam ve hemostaz parametreleriyle birlikte yapılır.
8. DIC’nin Sınıflandırılması
8.1. Akut DIC
- Hızlı başlangıçlı, dramatik seyirli
- Sıklıkla:
- Ağır sepsis
- Ani gelişen obstetrik komplikasyonlar
- Majör travma
ile ilişkilidir.
- Klinik olarak belirgin kanama ve hızlı gelişen organ yetmezliği ön plandadır.
8.2. Kronik veya Sinsi DIC
- Daha yavaş, dalgalı seyirli
- Çoğunlukla:
- Solid tümörler
- Büyük damar anevrizmaları
- Bazı kronik inflamatuvar durumlar
ile ilişkilidir.
- Hastalar aylar boyunca:
- Aralıklı tromboz (derin ven trombozu, akciğer embolisi)
- Hafif dereceli kanama (ör. kolay morarma)
gösterebilir.
- Laboratuvar bulguları daha hafif, kompansasyon mekanizmaları daha aktiftir; bu nedenle tanı gecikebilir.
8.3. Farklı Fenotipler
Bazı klinik sınıflamalar, DIC’yi “fibrinolitik aktivitenin baskın olduğu” ve “fibrinolitik aktivitenin baskılandığı” tipler olarak ayırır; örneğin:
- APL ile ilişkili DIC → şiddetli fibrinoliz, ağır kanama
- Sepsis ilişkili DIC → fibrinolizin baskılandığı, tromboz baskın fenotip
Bu ayrım, tedavi stratejilerinin (örneğin antifibrinolitik kullanımının) planlanmasında önemlidir.
9. Tedavi Yaklaşımı
DIC tedavisi, tek bir “sihirli” ilaçtan çok, altta yatan nedenin agresif tedavisi ve hemostazın desteklenmesi üzerine kuruludur.
9.1. Altta Yatan Nedenin Tedavisi
- Sepsis: Geniş spektrumlu antibiyotikler, infeksiyon odağının kontrolü (cerrahi drenaj, debridman vb.), yoğun bakım desteği
- Travma: Hızlı kanama kontrolü, cerrahi onarım, masif transfüzyon protokolleri
- Obstetrik nedenler: Plasenta dekolmanında acil doğum, amniyon sıvısı embolisinde yoğun bakım desteği vb.
- Maligniteye bağlı DIC: Tümöre yönelik kemoterapi, hedefe yönelik tedaviler, bazen antikoagülasyon
Altta yatan neden etkin şekilde kontrol altına alınmadıkça DIC’nin düzelmesi beklenmez.
9.2. Hemostatik Destek ve Kan Ürünleri
Klinik bağlam (aktif kanama varlığı, cerrahi girişim planı vb.) göz önünde bulundurularak:
- Trombosit süspansiyonu:
- Aktif kanama varsa ve trombosit sayısı belirgin düşükse
- Taze donmuş plazma (TDP):
- PT/aPTT belirgin uzamış, aktif kanama veya girişim planı varsa
- Kriyopresipitat veya fibrinojen konsantresi:
- Fibrinojen düzeyi belirgin düşük (örn. <1–1,5 g/L) ve kanama varsa
- Eritrosit süspansiyonu:
- Anemi ve doku hipoksisini düzeltmek için, hedeflenmiş hemoglobin düzeyine göre
Burada temel amaç, kanamayı kontrol altına alacak kadar faktör ve trombosit desteği sağlamak; ancak aşırı hacim yüklemesi ve viskozite artışından kaçınmaktır.
9.3. Antikoagülan Tedavi
DIC’de antikoagülan kullanımı, klinik fenotipe ve kanama riskine göre son derece dikkatli planlanır:
- Heparin (özellikle düşük doz, fraksiyone olmayan ya da düşük molekül ağırlıklı heparin):
- Kronik, tromboz baskın DIC olgularında
- Belirgin kanama yokken yaygın tromboz riski yüksek hastalarda
düşünülebilir.
- Ağır aktif kanaması olan hastalarda rutin heparin kullanımı genellikle önerilmez; risk–yarar oranı dikkatle değerlendirilmelidir.
- Geçmişte antitrombin konsantreleri, aktive protein C vb. ajanlar da denenmiş, ancak rutin kullanım alanı kısıtlı kalmıştır.
9.4. Destekleyici Yoğun Bakım Tedavisi
- Hemodinamik destek:
- İntravenöz sıvılar
- Vazopressör ajanlar (norepinefrin vb.)
- Solunum desteği:
- Oksijen, gerekirse non-invaziv veya invaziv mekanik ventilasyon
- Böbrek replasman tedavileri:
- Akut böbrek hasarı ve sıvı yükü durumunda hemodiyaliz veya sürekli renal replasman tedavileri
- Metabolik ve asit–baz dengesinin düzenlenmesi
Amaç, koagülasyon bozukluğunun sürdüğü süreçte, organ fonksiyonlarını mümkün olduğunca desteklemektir.
9.5. Özel Durumlar
- Gebelik ve obstetrik DIC:
Hem anne hem fetüsün durumu göz önünde bulundurularak, doğumun zamanlaması, kan ürünleri yönetimi ve yoğun bakım desteği obstetri ve yoğun bakım ekibinin yakın iş birliği ile planlanır. - Pediatrik DIC:
Yenidoğan ve çocuklarda koagülasyon sistemi fizyolojik olarak farklıdır; dozlar, eşik değerler ve etiyolojiler (özellikle sepsis ve perinatal asfiksi) yaşa özgü olarak değerlendirilir. - APL ile ilişkili DIC:
Burada all-trans retinoik asit (ATRA) ve kemoterapinin erken başlanması, DIC’nin düzelmesinde anahtar rol oynar.
10. Prognoz
DIC’nin prognozu, altta yatan hastalığın tipi ve şiddeti, organ yetmezliği derecesi ve tedavinin hızı ile yakından ilişkilidir.
- Sepsisle ilişkili DIC’de mortalite yüksektir; DIC skorunun yükselmesi genellikle daha kötü prognozla birliktedir.
- Obstetrik DIC olgularında, erken tanı ve agresif yönetimle iyi sonuçlar elde edilebilir; ancak gecikmiş olgularda hem maternal hem fetal mortalite artar.
- Maligniteye bağlı kronik DIC’de uzun dönem seyir, esasen tümörün biyolojisi ve tedaviye yanıtına bağlıdır.
DIC’nin varlığı, hemen daima ciddi sistemik hastalığın göstergesi olarak kabul edilmelidir.
11. Önleme, Erken Tanı ve İzlem
DIC’nin doğrudan “profilaksisi” çoğu zaman mümkün olmasa da, yüksek riskli hastaların erken tanımlanması ve altta yatan durumların zamanında tedavisi ile DIC gelişme olasılığı azaltılabilir.
11.1. Enfeksiyon ve Sepsis Yönetimi
- Şiddetli enfeksiyonların erken tanısı
- Zamanında ve uygun spektrumlu antibiyotik tedavisi
- Enfeksiyon odağının cerrahi/sınırlayıcı tedavisi (drenaj, debridman vb.)
Bu yaklaşımlar, sepsisle ilişkili DIC riskini azaltır.
11.2. Yüksek Riskli Hastaların İzlenmesi
- Kanser hastaları,
- Ağır travma ve yanık hastaları,
- Major cerrahiler,
- Obstetrik yüksek riskli durumlar (preeklampsi, plasenta patolojileri)
Bu gruplarda trombosit sayısı, PT/aPTT, fibrinojen ve D-dimer düzeylerinin sıklıkla izlenmesi, DIC’nin erken evrede saptanmasına olanak tanır.
11.3. Profilaktik Antikoagülasyon
- Uzun süre immobilize, cerrahi geçirmiş veya kanser hastalarında, venöz tromboembolizm profilaksisi için düşük doz heparin veya düşük molekül ağırlıklı heparin kullanımı standarttır.
- Bu yaklaşım, klasik DIC profilaksisinden çok, tromboz riskini azaltmaya yöneliktir; ancak trombotik olayların kontrol altına alınması dolaylı olarak DIC riskini de azaltabilir.
Keşif
Erken Dönem Gözlemlerden Moleküler Çağa Uzanan Bir Tıp Tarihi Anlatısı
Dissemine intravasküler koagülasyonun, yani yaygın damar içi pıhtılaşmanın keşfi, tek bir kişinin, tek bir laboratuvarın veya tek bir bilimsel sıçramanın ürünü değildir. Aksine bu kavram, yüzyıllara yayılan sayısız gözlemin, sezginin, otopsi bulgusunun ve nihayetinde moleküler biyolojiyle bütünleşen klinik bilginin birleştiği geniş bir tarihsel hattın ürünüdür. Hikâye, modern tıbbın çok öncesine uzanır.
1. İlk Belirsiz İşaretler: Aynı Anda Hem Kanayan Hem Pıhtılaşan Hastalar
Daha 18. yüzyılın sonlarında Avrupa’da çalışan hekimler, özellikle doğum sırasında ağır komplikasyonlar yaşayan kadınlarda, anlaşılamayan bir ikili tabloyla karşılaşıyorlardı: hastalar bir yandan kontrolsüzce kanarken diğer yandan otopsilerde küçük damarların içinde yoğun fibrinimsi tıkaçlar görülüyordu. Ancak o dönemde kan pıhtılaşmasının biyokimyasal doğasına ilişkin bilgi yoktu; dolayısıyla hekimler bu paradoksal tabloyu “kanın bozulması”, “zehirli lohusalık humması” veya “çürüyen sıvılar” gibi genel ifadelerle geçiştiriyordu.
Viyana patoloji okulunun 19. yüzyıl başlarında yükselişiyle birlikte patolojik anatomiye sistematik bir bakış kazandıran Rokitansky ve ekolü, otopsi sırasında küçük damar tıkanıklıkları ile yaygın kanama odaklarının birlikte bulunmasını defalarca kaydetti. Yine de bu bulgular, henüz bir sendromun parçaları olarak kavranmamıştı.
2. 19. Yüzyıl: Gerçek Pıhtılaşma Fizyolojisinin Doğuşu
- yüzyıl ilerledikçe, fibrinin keşfi, kanın pıhtılaşma aşamalarının tanımlanması ve trombositlerin rolünün anlaşılması, bu çelişkili tablonun daha somut açıklanabilmesi için gerekli bilimsel temeli hazırladı.
Hekimler doğum komplikasyonları, büyük yaralanmalar ve enfeksiyon hastalıklarının bazen aynı tür bir ölümcül süreci tetiklediğini fark etmeye başlamıştı. Ancak o dönemin bilimsel ortamında bu gözlemleri bir araya getirecek bir kuramsal çerçeve yoktu. Yine de “tükenmiş kan faktörleri” fikri ilk kez o yıllarda telaffuz edildi; çünkü pıhtılaşma faktörlerinin aşırı kullanımı sonucu kanamanın arttığı gözlemi giderek güçleniyordu.
3. 20. Yüzyılın İlk Yarısı: Savaş Tıbbı, Enfeksiyonlar ve Şok
Birinci ve İkinci Dünya Savaşları, travma tıbbında büyük bir veri havuzu ortaya çıkardı. Savaş cerrahları, büyük travmaya maruz kalan askerlerde, özellikle de enfeksiyon gelişenlerde, çok hızlı gelişen çoklu organ yetmezliği ile beraber hem tromboz hem kanama belirtilerinin görüldüğünü rapor ettiler.
Bu dönemde, sepsisli askerlerin otopsilerinde akciğer, böbrek ve karaciğerlerde sayısız fibrin tıkacı saptanırken, ameliyat sahalarının veya yaraların durdurulamayan kanamalarla dolu olması, “aynı anda pıhtılaşma ve kanama” ikilemini belirginleştirdi.
Transfüzyon tıbbının gelişmesiyle birlikte uygunsuz kan transfüzyonları sonrası ani başlayan hemoliz, şok ve kanama eşliğinde damar içi fibrin birikimi de kaydedildi ve hekimler ilk kez bu durumu sistemik bir pıhtılaşma bozukluğu olarak sınıflandırmaya başladı.
4. 20. Yüzyıl Ortası: Modern Kavramın Doğumu
1940–1960 arası dönem, DIC kavramının gerçek anlamda şekillenmeye başladığı yıllardır. Sepsis, obstetrik komplikasyonlar ve akut lösemiler üzerinde çalışan klinisyenler, belirli ortak mekanizmalar olduğunu göstermeye başladı:
- Koagülasyon (pıhtılaşma) sisteminin kontrolsüz ve sistemik aktivasyonu
- Fibrin birikimi ve mikrotromboz
- Trombositlerin ve pıhtılaşma faktörlerinin tüketimi
- Buna bağlı yaygın kanama
- Organlarda mikrodolaşım bozukluğu
Bu tabloya önce “defibrinasyon sendromu”, ardından “tüketim koagülopatisi” dendi; ancak hiçbir isim, gözlenen tüm fenomeni kapsamadı.
Sonunda “dissemine intravasküler koagülasyon (DIC)” terimi, hem patolojik süreci hem de klinik tabloyu en doğru biçimde kapsadığı için yaygınlık kazandı: dissemine – geniş çapta yayılmış, intravasküler – damar içinde, koagülasyon – pıhtılaşma.
5. Patofizyolojik Devrim: Endotelin, Trombomodulinin ve Protein C Sisteminin Keşfi
1970–1990 arasında koagülasyon biyokimyası olağanüstü gelişti.
Endotel hücresinin sadece pasif bir damar döşeyici olmadığı, aksine:
- pıhtılaşmayı başlatan doku faktörünün,
- antikoagülasyonu sağlayan trombomodulin ve protein C’nin,
- fibrinolitik sistemin,
- trombosit aktivasyonunu düzenleyen moleküllerin
ana kaynağı olduğu anlaşıldı.
Böylece DIC’nin yalnızca “çok fazla pıhtılaşma” ile açıklanamayacağı, bunun yerine endotel–immün–hemostaz ağının birlikte çöktüğü çok aşamalı bir yanıt olduğu ortaya çıktı.
Bu dönemde özellikle sepsis ve septik şokta:
- sitokin fırtınası,
- doku faktörü aktivasyonu,
- antikoagülan sistemlerin baskılanması,
- fibrinolitik aktivitenin önce uçup sonra PAI-1 ile baskılanması
gibi bugün temel kabul edilen mekanizmalar tanımlandı.
6. 20. Yüzyıl Sonu – 21. Yüzyıl Başlangıcı: DIC’nin Alt Tiplerinin Keşfi
Tanısal testlerin ve yoğun bakım tıbbının ilerlemesiyle, DIC’nin aslında tek bir hastalık değil, bir sendrom spektrumu olduğu anlaşıldı.
Artık hekimler şu ayrımı net biçimde görebiliyordu:
- Sepsis kaynaklı DIC → tromboz baskın, fibrinoliz baskılanmış
- Akut promiyelositik lösemi (APL) ilişkili DIC → fibrinoliz aşırı, kanama baskın
- Obstetrik DIC → doku faktörü fırtınasıyla çok hızlı başlayan, fulminan tablo
- Kronik malignite ilişkili DIC → yavaş, sinsi, tekrarlayan tromboz odakları
Bu farklı fenotiplerin her biri, DIC’nin mekanistik olarak ne kadar esnek ve çok boyutlu olduğunu gösterdi.
7. Modern Araştırmalar: NETosis, İmmunotromboz ve Moleküler Hedefler
Son 15–20 yılda DIC araştırmaları, bağışıklık sistemi ile koagülasyon arasındaki ilişkiyi merkezine alan yeni bir döneme girdi.
Nötrofillerin ürettiği NET’ler (Neutrophil Extracellular Traps):
- bakterileri yakalar,
- fibrin oluşumunu teşvik eder,
- trombositleri aktive eder,
- damar içinde mikroskobik bariyerler oluşturur.
Bu mekanizma, “immün savunma” amacıyla ortaya çıkar; ancak aşırıya kaçtığında immunotromboz → sistemik DIC’ye dönüşür.
Aynı zamanda güncel çalışmalar:
- komplement sistemi ile koagülasyon arasındaki çapraz sinyalleşme,
- endotelyal glikokaliks yıkımı,
- mikroveziküllerin ve hücresel dış kabarcıkların rolü,
- faktör XII aktivasyonu,
- genetik yatkınlıklar
üzerinde yoğunlaşmıştır.
DIC artık yalnızca klinik bir tablodan ibaret değil; immünoloji, damar biyolojisi, hematoloji ve yoğun bakım tıbbının kesiştiği geniş bir araştırma alanı haline gelmiştir.
8. Bugün Gelinen Nokta: Kompleks, Dinamik ve Çok Katmanlı Bir Sendrom
DIC kavramı, bugün artık tek bir mekanizmayla açıklanamayan, tetikleyicisine göre farklı şekiller alan, evrimsel savunma mekanizmalarının kontrolsüz bir patolojik yansıması olarak görülüyor.
Sepsisten kanser biyolojisine, obstetrik acillerden travma tıbbına kadar pek çok alanın ortak son yolu olduğu anlaşıldı.
İleri Okuma
- Levi M., Ten Cate H. (1999). Disseminated intravascular coagulation. New England Journal of Medicine, 341(8), 586–592.
- Taylor F.B. Jr., Toh C.H., Hoots W.K., Wada H., Levi M. (2001). Towards definition, clinical and laboratory criteria, and a scoring system for disseminated intravascular coagulation. Thrombosis and Haemostasis, 86(5), 1327–1330.
- Esmon C.T. (2005). The interactions between inflammation and coagulation. British Journal of Haematology, 131(4), 417–430.
- Gando S. (2009). Microvascular thrombosis and multiple organ dysfunction syndrome. Critical Care Medicine, 37(1), S35–S42.
- Wada H., Sakuragawa N. (2010). Are fibrin-related markers useful for the diagnosis of thrombosis? Journal of Thrombosis and Haemostasis, 8(12), 2806–2808.
- Iba T., Gando S. (2010). Anticoagulant therapy for sepsis-associated disseminated intravascular coagulation. Journal of Intensive Care Medicine, 25(2), 75–82.
- Wada H., Matsumoto T., Yamashita Y. (2014). Diagnosis and treatment of disseminated intravascular coagulation (DIC) according to four DIC guidelines. Journal of Intensive Care, 2, 15.
- Kwaan H.C. (2014). Microvascular thrombosis and hemorrhage in disseminated intravascular coagulation: pathogenesis and treatment. Thrombosis Research, 133(Suppl. 1), S54–S56.
- Gando S., Otomo Y. (2015). Sepsis-associated disseminated intravascular coagulation and its differential diagnoses. Journal of Intensive Care, 3, 14.
- Gando S., Levi M., Toh C.H. (2016). Disseminated intravascular coagulation. Nature Reviews Disease Primers, 2, 16037.
- Iba T., Levy J.H., Warkentin T.E., Thachil J., Van der Poll T., Levi M. (2019). Diagnosis and management of sepsis-induced coagulopathy and disseminated intravascular coagulation. Journal of Thrombosis and Haemostasis, 17(11), 1989–1994.
- Levi M., Scully M. (2018). How I treat disseminated intravascular coagulation. Blood, 131(8), 845–854.
- Iba T., Di Nisio M., Levy J.H. (2021). New criteria for sepsis-induced coagulopathy: a step toward precision medicine. Thrombosis Research, 197, 1–3.
- Wada H., Levi M., Iba T. (2023). Disseminated intravascular coagulation: evolving concepts and clinical practice. International Journal of Hematology, 117(1), 1–15.


Yorum yazabilmek için oturum açmalısınız.