İçindekiler
Terminoloji ve Keşif
“Dopamin” terimi, kimyasal adından türetilmiştir. Adın ilk kısmı dopa, 3,4-dihidroksifenilalanin (kısaca L-DOPA) adına dayanır. Bu birleşik kelimede dihidroksi moleküldeki iki hidroksil grubuna (-OH) işaret ederken, fenil benzen halkasını, alanin ise amino asit alanini ifade eder. Kısacası dopa, “dihidroksifenilalanin” adının kolay telaffuz için kısaltılmış halidir. İkinci kısım olan -amin son eki ise organik kimyada bir amino grubu (-NH₂) içeren bileşikleri tanımlar. Bu ek, dopamin molekülünün amonyaktan türeyen bir organik amin olduğunu, yani bir veya daha fazla hidrojen atomunun organik gruplarla yer değiştirmesiyle oluştuğunu belirtir.
Dopamin ilk kez 1910 yılında Londra’daki Wellcome Laboratuvarlarında George Barger ve James Ewens tarafından sentezlendi Ancak o dönemde dopaminin önemi anlaşılamadı; sadece norepinefrin’in (noradrenalin) öncüsü olan bir monoamin olduğu düşünülerek yaklaşık 40 yıl boyunca göz ardı edildi. 1950’lerde bu algı değişmeye başladı: 1957’de Katharine Montagu dopaminin memeli beyninde bağımsız bir kimyasal olarak bulunduğunu gösterdi. Ardından 1958’de İsveçli bilim insanları Arvid Carlsson ve Nils-Åke Hillarp, dopaminin yalnızca bir öncü madde değil, aynı zamanda sinir hücreleri arasında sinyal ileten gerçek bir nörotransmiter olduğunu kanıtladılar. Carlsson, tavşanlarda yaptığı kritik deneylerde tüm dopamin iletimini ilaçla blokladığında hayvanların tamamen hareketsiz (Parkinson benzeri) kaldığını, ardından dopaminin öncüsü L-DOPA enjekte ederek normal hareket kabiliyetlerini geri getirdiğini gösterdi. Bu buluş, dopamin eksikliğinin hareket bozukluğuna yol açtığını açıkça ortaya koydu ve Parkinson hastalığının tedavisi için çığır açtı. Carlsson’un çalışmaları, dopaminin beyindeki kritik rolünü ortaya koyduğu için kendisine 2000 yılında Nobel Fizyoloji veya Tıp Ödülü kazandırmıştır.
Kimyasal Yapı ve Özellikler
Dopamin molekülünün kimyasal yapısı (çizimde siyah: karbon, mavi: azot, kırmızı: oksijen, beyaz: hidrojen).
Dopamin, C₈H₁₁NO₂ moleküler formülüne sahip küçük bir organik moleküldür. Molar kütlesi yaklaşık 153,18 g/mol olup katekolamin ve feniletilamin ailesine ait bir bileşiktir. Yapısında, bir benzen halkasına bağlı iki hidroksil grubu içeren katekol çekirdeği ve bu halkaya etil köprüsüyle bağlanmış bir amin grubu bulunur. Bu yapı itibariyle dopamin, mümkün olan en basit katekolamindir; adrenalin (epinefrin) ve noradrenalin (norepinefrin) gibi daha büyük katekolamin nörotransmiterlerin temel iskeletini oluşturur. Benzer şekilde bir feniletilamin türevi olduğundan, bazı psikoaktif moleküllerle de kimyasal akrabalık gösterir.
Dopamin, bir monoamin nörotransmiter olarak sınıflandırılır; yani kimyasal yapısı bir amino grubunu içerir ve biyokimyasal olarak bir amino asitten türetilmiştir. Özellikle L-DOPA molekülünün dekarboksilasyonu (karboksil grubunun çıkartılması) ile oluşur. Bu nedenle L-DOPA dopaminin doğrudan öncüsüdür. Dopamin ayrıca kimyasal baz özellik gösterir: Fizyolojik koşullarda genellikle protonlanmış (dopamin hidroklorür gibi tuz formunda) bulunur ve suda çözünürlüğü bu sayede yüksektir. Yeterince kararlı olduğundan, ilaç formülasyonlarında dopamin genellikle tuz halinde kullanılır (örneğin intravenöz uygulama için dopamin hidroklorür şeklinde).
Kimyasal yapısının bir sonucu olarak dopamin, vücutta noradrenalin ve adrenalin gibi diğer katekolaminlerin sentezi için bir ara basamak görevi görür. Sinir sistemi ve adrenal bezlerde dopamin, enzimatik süreçlerle sırasıyla noradrenaline ve oradan adrenaline dönüştürülebilir. Bu açıdan dopamin, kendi başına önemli bir nörotransmiter olmanın yanı sıra, vücuttaki diğer hayati hormon ve nörotransmiterlerin de öncülüdür.
Biyosentez ve Metabolizma
İnsan vücudunda dopamin sentezi, esansiyel amino asit fenilalanin veya ondan türetilen tirozin ile başlar. Diyetle alınan fenilalanin, karaciğerde tirozin amino asidine çevrildikten sonra dopaminerjik hücrelerde bu yol devam eder. Dopamin sentezinin gerçekleştiği başlıca yerler, beynin belirli bölgeleri (özellikle orta beyindeki substantia nigra ve ventral tegmental alan, ayrıca hipotalamus) ile böbrek üstü bezinin öz bölgesi olan adrenal medulla gibi dokulardır. Sentez basamaklarında hız kısıtlayıcı adım, tirozin hidroksilaz enziminin tirozin üzerine etki ederek onu L-DOPA’ya (3,4-dihidroksifenilalanin) dönüştürmesidir. Bu reaksiyonda tirozin molekülüne ikinci bir –OH grubu eklenerek L-DOPA üretilir. Ardından aromatik L-amino asit dekarboksilaz (daha yaygın adıyla DOPA dekarboksilaz) enzimi, L-DOPA’nın karboksil grubunu ayırır ve sonuçta dopamin molekülü oluşur. Sentezlenen dopamin, nöronların sinir ucu bölgelerindeki veziküllerde depolanır ve sinaptik iletim gerektiğinde bu depolardan salınır.
Dopamin salındıktan sonra sinaptik aralıktaki ömrü çok uzun değildir. Etkisini gösterdikten sonra sinir sisteminde dopaminin temizlenmesi iki ana yoldan gerçekleşir: geri alım (reuptake) ve enzimatik yıkım. Birincisinde dopamin, presinaptik nöronun dopamin taşıyıcıları tarafından tekrar içeri alınarak yeniden kullanılabilir. İkinci yolda ise dopamin, hedef bölgedeki enzimler tarafından parçalanarak etkisiz hale getirilir. Bu metabolizmada iki anahtar enzim rol oynar: Katekol-O-metiltransferaz (COMT) ve Monoamin oksidaz (MAO). COMT enzimi, dopamin molekülünün katekol halkasına bir metil grubu ekleyerek onu 3-metoksitiramin ve devamında homovanilik asit gibi metabolitlere dönüştürür. MAO enzimi ise amin grubunu okside ederek dopamini asit türevlerine parçalar; sonuçta oluşan ürünlerden biri vanilmandelik asit gibi idrarla atılabilen son metabolitlerdir. Bu yıkım ürünlerinin (özellikle homovanilik asit (HVA)) seviyeleri, klinikte dopaminerjik aktivitenin dolaylı göstergesi olarak ölçülebilir. Neticede dopamin, görevini tamamladıktan sonra ya presinaptik hücre tarafından tekrar depolanmak üzere geri alınır ya da bu enzimatik mekanizmalarla inaktive edilerek vücuttan atılır.
Dopaminerjik Yollar ve Görevleri
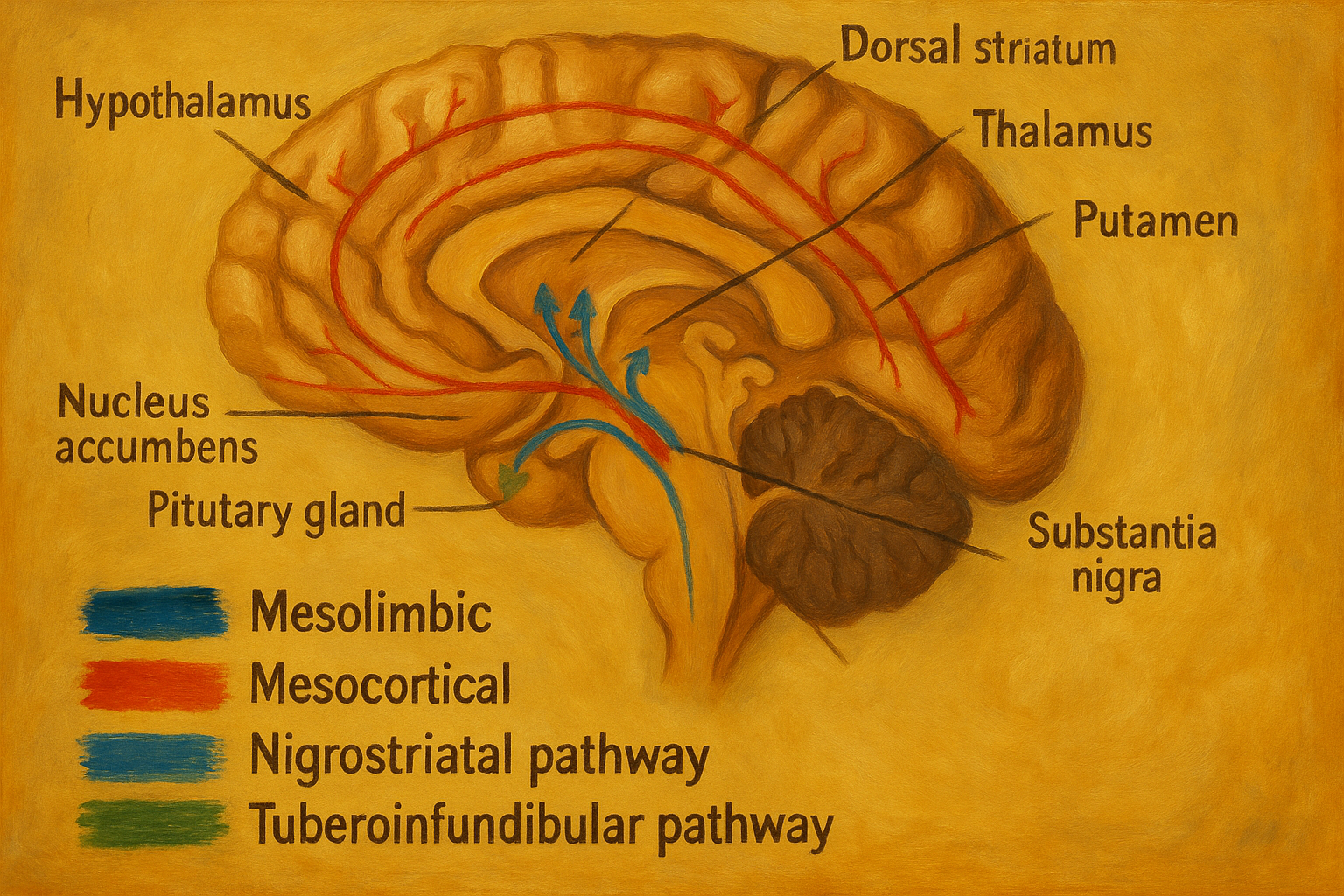
Beyinde dopamin salgılayan sinir hücreleri nispeten az sayıdadır (insan beyninde toplam birkaç yüz bin dopaminerjik nöron bulunduğu tahmin edilmektedir), ancak bunların aksonları geniş alanlara yayılır ve etkileri oldukça büyüktür. Merkezi sinir sisteminde dopamin, dört ana nöral yolak (dopaminergik yol) üzerinden etki gösterir:
- Nigrostriatal yol: Substantia nigra (orta beyinde dopamin üreten siyah çekirdek) nöronlarından başlar ve striatum denilen (bazal ganglionların bir parçası olan) beyin bölgesine uzanır. Bu yol, motor kontrol (hareketlerin düzenlenmesi) ile ilişkilidir. Özellikle Parkinson hastalığında substantia nigra’daki dopamin üreten hücrelerin ölümüyle bu yolak ciddi hasar görür; bunun sonucunda hareketlerin yavaşlaması, katılık ve titreme gibi motor semptomlar ortaya çıkar.
- Mezolimbik yol: Orta beyindeki ventral tegmental alan (VTA) nöronlarından başlar, limbik sistemin çekirdeklerinden olan nükleus akumbens başta olmak üzere çeşitli yapılara projekte olur. Bu yol, ödül ve motivasyon mekanizmalarında kilit rol oynar. Keyif verici deneyimler, doğal ödüller ya da bağımlılık yapan maddeler mezolimbik dopamin yolunda aktivite artışına yol açar. Bu nedenle ödül hissi, haz ve bağımlılık oluşumunda mezolimbik dopaminin önemli etkisi vardır.
- Mezokortikal yol: Yine ventral tegmental alandan köken alıp bu kez beyin korteksinin özellikle prefrontal korteks gibi ön bölgelerine uzanan dopamin yoludur. Bilişsel kontrol, dikkat, planlama ve duygusal tepki gibi daha üst düzey beyin fonksiyonlarında etkilidir. Bu yolaktaki dopamin dengesizliklerinin, şizofrenide bilişsel ve negatif semptomlar ile ilişkili olabileceği düşünülür (örneğin dopamin aktivitesinin azalmasıyla motivasyon ve planlama yetilerinde düşüş görülebilir).
- Tuberoinfundibular yol: Hipotalamusta bulunan dopamin nöronlarından başlar ve hipofiz bezinin ön lobundaki (adenohipofiz) damar yataklarına uzanır. Bu yol, endokrin hormon salınımının kontrolü ile ilgilidir. Özellikle prolaktin hormonunun salınımını tonik olarak baskılamak dopaminin bu yoldaki görevidir. Sağlıklı bireylerde hipotalamustan sürekli salınan dopamin, prolaktin hormonunun seviyelerini düşük tutarak meme bezleri ve üreme sistemi fonksiyonlarını dengede tutar.
Bir nörotransmiter olarak dopamin, yukarıda değinilen yollar aracılığıyla hafıza, öğrenme, dikkat, duygu durum ve hareket başta olmak üzere pek çok nörolojik işlevi düzenler. Örneğin dopamin salınımındaki artış, genellikle ödül beklentisi yaratan davranışlar sırasında ortaya çıkar ve bu da canlıyı öğrenme ve motivasyon açısından güdüler. Aynı şekilde, dikkat gerektiren bir görev esnasında optimum düzeyde dopamin salgılanması, kişinin odaklanma becerisini artırır.
Dopamin sıklıkla popüler kültürde “mutluluk hormonu” olarak anılsa da, aslında doğrudan mutluluk vermekten ziyade motivasyon ve ödül beklentisi ile ilgilidir. Yani dopamin, bir ödülün elde edilebilirliğini veya bir davranışın istenirliğini sinyaller ve organizmayı o hedefe yönlendirir. Eğer bir eylemin sonucunda ödül beklenmiyorsa dopamin düzeyi düşerken, beklenen bir ödül veya olumlu sonuç varsa dopamin salınımı artar. Bu mekanizma, canlıların hayatta kalma ve haz alma davranışlarını pekiştiren temel biyolojik süreçlerden birini temsil eder.
Reseptörleri ve Etki Mekanizmaları
Reseptörlerle Etkileşim: Dopamin, etkilerini hedef hücrelerin yüzeyindeki dopamin reseptörlerine bağlanarak gösterir. Dopamin için memelilerde tespit edilmiş beş temel reseptör alt tipi vardır: D₁, D₂, D₃, D₄, D₅. Bu reseptörler yapı ve sinyal iletim mekanizmalarına göre iki ana aileye ayrılır: D₁-benzeri (D₁ ve D₅) reseptörler ve D₂-benzeri (D₂, D₃, D₄) reseptörler. D₁-benzeri reseptörler hücre içinde uyarıcı bir etki yaparak ikinci haberci cAMP düzeylerini artırırken, D₂-benzeri reseptörler cAMP düzeylerini azaltır ve daha inhibitör bir etki gösterir. Bu nedenle dopaminin bir hücre üzerindeki etkisi, o hücrenin hangi tip dopamin reseptörü taşıdığına bağlıdır. Örneğin belirli bir sinir hücresinde D₁ reseptörü ağırlıktaysa dopamin o hücreyi aktive edebilir, buna karşın D₂ reseptörü taşıyan başka bir hücrede dopamin etkinliği azaltıcı olabilir. Özetle, dopamin molekülünün kendisine “uyarıcı” veya “baskılayıcı” diye mutlak bir rol atfetmek doğru değildir; reseptör etkileşimine bağlı olarak her iki rolü de üstlenebilir. Ayrıca dopamin yüksek dozlarda verildiğinde, kendi spesifik reseptörleri dışında adrenerjik reseptörleri de (özellikle kalpte β₁, damarlarda α₁ reseptörleri) uyarabilir. Bu yüzden dopamin, hem kendi dopamin reseptörleri hem de adrenerjik reseptörler üzerinden etkiler gösterebilen çok yönlü bir moleküldür.
Bir Sempatomimetik Olarak Dopamin: Dopamin, periferik sinir sisteminde sempatik sinyalleri taklit edebilen bir maddedir, yani bir sempatomimetik gibi davranır. Sempatik sinir sistemi “kaç ya da savaş” tepkisini düzenleyen sistemdir ve dopamin bu sistemin bazı bileşenlerini doz-bağımlı şekilde etkiler. Düşük konsantrasyonlarda dopamin, D₁ reseptörlerini uyararak özellikle böbrek ve karın bölgesi damarlarında genişleme (vazodilatasyon) yapar; bu da böbreklere giden kan akışını ve idrar üretimini artırır. Yani az miktarda dopamin dolaşımdayken böbrek perfüzyonu artar ve böbrekler daha fazla sodyum ile su atar. Yüksek dozlarda ise dopamin, adrenerjik reseptörler üzerinden etkili olmaya başlar: Kalpte β₁ reseptörlerini uyararak kalp atım gücünü ve hızını artırabilir, çok yüksek dozlara çıkıldığında ise damar düz kaslarındaki α₁ reseptörlerini aktive ederek damarlarda büzülmeye (vazokonstriksiyon) ve kan basıncında yükselmeye neden olabilir. Bu eşsiz doz-bağımlı çift yönlü etki, dopamini diğer nörotransmiterlerden ayıran önemli bir özelliktir.
Hipotalamus ve Nöroendokrin Rolü: Dopamin, merkezi sinir sisteminde nörotransmiter olmanın yanı sıra nörohormon olarak da işlev görür. Hipotalamusta arcuate nukleus adlı bölgedeki dopamin nöronları tarafından üretilir ve portal dolaşıma salınır. Buradan hipofiz bezinin ön lobuna (adenohipofiz) ulaşan dopamin, prolaktin salgılayan hücreler üzerindeki D₂ reseptörlerini uyararak prolaktin hormonunun salgılanmasını baskılar. Normalde vücut, prolaktin seviyesini düşük tutmak için hipotalamustan devamlı dopamin salgılar. Bu mekanizma, süt üretiminin kontrolü, üreme fonksiyonları ve cinsel dürtü gibi fizyolojik süreçlerde kritik önem taşır. Örneğin dopamin etkisinin azalması veya ortadan kalkması durumunda prolaktin hormonunda yükselme görülür; bu da adet düzensizlikleri, kısırlık veya galaktore (erkek ya da gebe olmayan kadınlarda süt üretimi) gibi klinik durumlara yol açabilir. Dolayısıyla dopaminin hipotalamik rolü, endokrin sistem ile sinir sistemi arasındaki önemli bir iletişim köprüsüdür.
Striatum ve Bazal Gangliyonlar Üzerindeki Etki: Dopaminin beynin bazal gangliya denen hareket ve davranış kontrol merkezlerindeki rolü, en az yukarıdaki işlevleri kadar hayati önemdedir. Striatum (kaudat ve putamen çekirdekleri) ve diğer bazal gangliyon yapıları, motor hareketlerin başlatılması ve istemli kontrolüyle yakından ilişkilidir. Dopamin, nigrostriatal yol üzerinden striatuma ulaştığında burada genel olarak inhibitör (baskılayıcı) bir etki gösterir – yani hareketleri gereksiz yere başlatan sinyalleri frenler ve hareketin düzgün, istemli bir şekilde gerçekleşmesine yardımcı olur. Parkinson hastalığında dopamin eksildiğinde bu fren mekanizması zayıflar ve sonuçta hastaların hareketleri kontrolsüzce yavaşlar veya katılaşır. Ayrıca bazal gangliyonlardaki dopamin sinyali, bilişsel süreçlerin (alışkanlık oluşturma, ödül-ceza öğrenmesi gibi) düzenlenmesinde de rol oynar. Bu nedenle dopamindeki dengesizlikler, yalnız motor semptomlara değil davranışsal ve kognitif değişimlere de yol açabilir. Özetle, dopaminin striatum ve bazal gangliya üzerindeki etkisi, hareketlerin koordinasyonu ve davranışların düzenlenmesi açısından kritiktir; bu etkinin bozulması ciddi nörolojik bozukluklarla sonuçlanır.
Klinik Önemi
Dopaminin vücuttaki çok yönlü rolleri, bir dizi nörolojik ve psikiyatrik bozukluğun temelinde yer alır. Sinir sisteminde dopamin dengesinin bozulmasıyla ilişkili pek çok hastalık tanımlanmıştır Örneğin Parkinson hastalığı, nigrostriatal dopamin nöronlarının dejenerasyonu sonucu dopamin eksikliğiyle ortaya çıkar; bu durum hastalardaki hareket bozukluklarının başlıca sebebidir. Dopamin eksikliğinin giderilmesi, Parkinson tedavisinin temel prensibidir – bu amaçla dopaminin öncüsü L-DOPA (levodopa) ilaç olarak verilir ve beyinde dopamin seviyesini artırarak hastaların hareketlerinde belirgin düzelme sağlar.
Diğer yandan dopamin fazlalığı veya dopaminerjik aktivitenin aşırı olması da sorunludur. Şizofreni ve benzeri psikotik bozukluklarda, özellikle mezolimbik yolakta dopaminin aşırı sinyalleme yaptığı düşünülmektedir; bu da hezeyan, halüsinasyon gibi pozitif semptomlara yol açabilir. Nitekim birçok antipsikotik ilacın, dopamin antagonisti olarak D₂ reseptörlerini bloke etmesi ve dopamin etkisini azaltması, bu hastalık belirtilerini hafifletmektedir. Aynı şekilde, dopaminin aşırı salınımı ve ödül mekanizmasının kontrolsüz çalışması, madde bağımlılığı ve tıkanırcasına yeme gibi dürtüsel davranış bozukluklarının gelişiminde rol oynar.
Dopamin düzeylerinin normalden düşük olması ise farklı problemlere yol açabilir. Dikkat eksikliği/hiperaktivite bozukluğu (DEHB) olan bireylerde prefrontal korteksteki dopamin aktivitesinin yetersiz olmasının dikkat problemlerine katkıda bulunduğu düşünülmektedir; bu nedenle düşük dozlarda dopamin artırıcı ilaçlar (ör. bazı stimulant ilaçlar) DEHB tedavisinde kullanılmaktadır. Huzursuz bacak sendromu da dopaminerjik sistemdeki bir dengesizlikle ilişkilendirilmiş olup dopamin agonisti ilaçlara genellikle yanıt verir. Bunların dışında, depresyon, bipolar bozukluk, obsesif-kompulsif bozukluk gibi durumlarda da dopaminin rolü olabileceğine dair bulgular mevcuttur; örneğin majör depresyonda ödül mekanizmasındaki dopamin katkısının azalması, ilgi ve haz kaybı (anhedoni) şeklinde kendini gösterebilir.
Dopaminin periferik etkileri de klinik açıdan önem taşır. Özellikle dopaminin damar genişletici etkisi ve böbrek kan akımını artırıcı özelliği, şok durumlarında veya akut kalp yetmezliğinde tedavi amacıyla kullanılmasına yol açmıştır. Dopamin ilacı, kontrollü dozlarda damar yolundan verildiğinde düşük dozlarda böbrek ve diğer organ perfüzyonunu artırarak, yüksek dozlarda ise kan basıncını yükselterek kritik hastaların yönetimine katkı sağlayabilir. Örneğin yoğun bakım ünitelerinde dopamin infüzyonu, ciddi hipotansiyon (düşük tansiyon) veya kardiyojenik şok vakalarında hayat kurtarıcı olabilmektedir. Ancak dopamin tedavisinin uygun doz ayarı ve sürekli izlem gerektirdiği unutulmamalıdır.
Dopaminin keşfinden bu yana geçen sürede, bu molekülün vücudumuzda oynadığı rolleri taklit eden veya engelleyen birçok ilaç geliştirilmiştir. Parkinson hastalığında dopamin eksikliğini gidermeye yönelik agonist ilaçlar veya L-DOPA kullanılırken, şizofreni gibi durumlarda dopaminin etkisini azaltan antagonist ilaçlar (antipsikotikler) kullanılır Ayrıca kusma refleksinin kontrolü (antiemetik ilaçlar), hormon bozuklukları (ör. hiperprolaktinemi tedavisi için bromokriptin) gibi pek çok alanda dopaminerjik mekanizmaları hedef alan tedaviler mevcuttur. Özetle, dopaminin fizyolojik etkilerini anlamak, nörolojik bozukluklardan endokrin hastalıklara ve kalp-damar sorunlarından psikiyatrik rahatsızlıklara kadar geniş bir yelpazede hastalıkların yönetimi için kritik önem taşır. Bu nedenle dopamin, modern tıpta hem araştırmaların odak noktası olmaya devam eden bir nörotransmitter, hem de çeşitli hastalıklarda hedef alınan bir terapötik ajandır.
Keşif
Laboratuvar kokusu, koyu kahve bir çözelti, titizlikle işaretlenmiş cam şişeler. 1910’ların başında Londra’daki Wellcome Araştırma Laboratuvarları’nda George Barger ve James Ewens, o gün için sıradan sayılabilecek bir sentezle 3,4-dihidroksifeniletilamin—daha sonra “dopamin” diye anılacak—bir molekülü elde ettiler. Kimse onun bir yüzyıl boyunca sinir bilimin simge kavramlarından biri olacağını öngörmüyordu. O dönemki çerçeve, katekolamin biyokimyasında egemen olan hiyerarşiydi: asıl aktörler adrenalin ve noradrenalindi; dopamin ise, en iyi ihtimalle, biyokimyasal zincirin küçük bir basamağıydı. Bilim tarihinin birçok örneğinde olduğu gibi, küçük bir “yan ürün”, paradigmanın merkezine girmek için zamana, teknik gelişmelere ve ısrarcı zihinlere ihtiyaç duydu.
“Beyinde dopamin var mı?” sorusunun doğuşu: İlk kanıtlar ve sessiz devrim
İkinci Dünya Savaşı sonrasında monoaminlerin sinir sistemindeki rolüne ilgi hızla arttı. 1950’lerin başında histokimyasal ve biyokimyasal teknikler keskinleşirken, 1957’de Katharine Montagu memeli beyninde dopaminin bağımsız bir bileşen olarak varlığını gösterdi. Bu bulgu, dopaminin “sadece bir öncü” olduğu düşüncesine ilk gediklerden birini açtı. Aynı yıllarda Julius Axelrod ve meslektaşlarının katekol-O-metiltransferazı (COMT) tanımlaması ile monoaminlerin sentez-yıkım döngüsü netleşiyor, Udenfriend okulunun katkılarıyla dopamin-β-hidroksilaz üzerinden “dopaminden noradrenaline” geçişin biyokimyasal adımları somutlaşıyordu. Ama asıl kırılma, dopaminin yalnızca bir metabolit değil, bizzat bir nörotransmiter olduğunun gösterilmesiydi.
İsveç’te bir paradigma değişimi: Carlsson, Hillarp ve dopaminin nörotransmiter olarak sahneye çıkışı
1950’lerin sonuna gelindiğinde Arvid Carlsson, İsveç’te yürüttüğü bir dizi deneyle dopaminin işlevsel önemini görünür kıldı. Çalışmalarında, monoamin depolarını boşaltan rezerpin ile hareketsizleşen hayvanların, L-DOPA verildiğinde yeniden hareket etmeye başladığını gösterdi. Buradaki incelik şuydu: L-DOPA kan-beyin engelini aşabiliyor ve beyinde dopaminin tekrar sentezini mümkün kılıyordu. Bu basit gibi görünen gözlem, motor davranışın altında yatan dopaminerjik katkıyı deneysel olarak açığa çıkardı. Carlsson’un yakın bilimsel çevresinde yer alan Nils-Åke Hillarp’ın, Bengt Falck ile geliştirdiği formaldehit floresans tekniği, monoaminlerin beyin boyunca haritalanmasını sağladı; dopaminerjik nöronların çekirdekleri ve projeksiyon alanları ilk kez “ışıldayarak” görünür oldu. Artık dopaminin beyindeki dağılımı ve özgül yolları ölçülebilir, tartışılabilir ve yeni hipotezlere kapı aralayacak kadar somuttu.
Viyana hattı: Hornykiewicz’in cesur ölçümleri ve Parkinson bilmecesinin çözülmesi
1960’ların başında Viyana’da Oleh Hornykiewicz ve Herbert Ehringer, post-mortem insan beyni üzerinde yaptıkları ölçümlerde, Parkinson hastalarının striatumunda dopaminin dramatik biçimde azaldığını gösterdiler. Bu bulgu, Carlsson’un hayvan deneyleriyle birleşince tablo tamamlandı: nigrostriatal sistemdeki dopamin kaybı, Parkinson’un motor semptomlarının biyokimyasal karşılığı olmalıydı. Hornykiewicz, nörokimyasal farkı gördükten sonra klinik sahaya döndü. Walther Birkmayer ile birlikte 1961’de L-DOPA’yı intravenöz olarak Parkinson hastalarına uyguladılar; dakikalar içinde akineziye mahkûm bedenlerin kıpırdanmaya başladığı, konuşmaların akıcılaştığı gözlemlendi. Bu “akut dramatik etki”, nörolojinin belki de en ikna edici çeviri-bilim (translational) anlarından biriydi.
Bir süre sonra New York’ta George Cotzias, L-DOPA’nın ağızdan, kademeli doz artışıyla uzun süreli ve tolere edilebilir şekilde verilebileceğini gösterdi. 1967–1969 arasında yayımlanan çalışmalar Parkinson tedavisinde yeni bir çağ başlattı. Böylece dopamin, laboratuvarda bir “molekül” olmaktan çıkıp, klinikte milyonlarca insanın yaşamını dönüştüren bir terapötik stratejinin kurucu taşına dönüştü.
Antipsikotik devrimi ve birleştirici bir çerçeve: Dopaminerjik hipotez
Bu sırada, Paris’te Delay ve Deniker’in 1952’de klorpromazin ile başlattığı antipsikotik devrim, ardından haloperidol gibi butirofenonların gelişi, psikoz tedavisinde yeni bir farmakolojik dönemi açmıştı. Klinik etkiyle eş zamanlı olarak, bu ilaçların ekstrapiramidal yan etkiler ve Parkinson benzeri belirtiler doğurması, ortak bir biyolojik eksene işaret ediyordu. 1960’ların ortasında Jacques van Rossum, antipsikotik etkinin dopamin reseptörlerinin—özellikle D2 ailesinin—blokajıyla ilişkili olabileceğini öne sürdü; 1970’lerin ortasında Philip Seeman ve çalışma arkadaşları, antipsikotiklerin klinik gücü ile D2 bağlanma afinitesi arasındaki korelasyonu göstererek bu bağı güçlendirdi. Böylece şizofrenide dopaminerjik hipotez, hem klinik ilaç etkilerini açıklayan hem de yeni ajanların rasyonel tasarımına yön veren bir omurga haline geldi. Zaman içinde bu hipotez rafine edilerek, mezolimbik aşırı iletimin “pozitif belirtiler”le, prefrontal hipodopaminerginin ise “negatif/bilişsel belirtiler”le ilişkisi biçiminde bölgesel-işlevsel bir nüansa kavuşturuldu.
Reseptörlerin keşfi ve sinyallemenin derinleşmesi: D1’den D5’e ve ötesi
1970’lerin sonu, “dopamin” adının ardında birden çok reseptör ailesi olduğunu gösteren dönüm noktasıydı. Kebabian ve Calne, farmakolojik profiller üzerinden D1-benzeri ve D2-benzeri reseptör ayrımını önerdiler; 1980’ler ve 1990’larda gen klonlama teknikleriyle D2’nin, ardından D3 ve D4’ün dizilenmesi, reseptör ailesinin moleküler kimliğini kesinleştirdi. D4 reseptörünün kimi antipsikotiklere (örneğin klozapin) yüksek afinitesi, “atipik” antipsikotik profilin farmakolojik temelini tartışmaya açtı. Paralelde Paul Greengard’ın DARPP-32 eksenli çalışmaları, dopamin reseptör uyarısının hücre içindeki fosforilasyon kaskatlarına nasıl çevrildiğini gösterdi; dopamin sinyallemesinin yalnız “aç-kapa” değil, plastisiteyi ve ağ dinamiklerini uzun süreli biçimde yeniden ayarlayan bir aygıt olduğu anlaşıldı. Bu çizgi, 2000 Nobel Ödülü’nün Carlsson, Greengard ve Kandel’e birlikte verilmesinin bilimsel arkaplanını oluşturdu.
Beynin görünürleşmesi: Haritalama teknikleri, PET/SPECT ve canlı insan dopamini
Falck-Hillarp floresansından başlayıp immünohistokimya ve in situ hibridizasyona uzanan yöntemler, dopaminerjik yolları anatomik düzeyde ayrıntılandırdı: substantia nigra pars compacta’dan striatuma uzanan nigrostriatal, ventral tegmental alandan nükleus akumbense ve limbik yapılara giden mezolimbik, prefrontal kortekse uzanan mezokortikal ve hipotalamus-hipofiz portal sistemini düzenleyen tuberoinfundibular yolların bütüncül haritası ortaya çıktı. 1980’lerin sonundan itibaren PET ve SPECT ile in vivo dopamin taşıyıcısı (DAT), D2/D3 reseptör bağlanması ve uyarana bağlı dopamin salınımı ölçülebilir hale geldi. Schizofrenide D2 reseptör işgal düzeylerinin antipsikotik etkinlikle ilişkisi, Parkinson’da nigrostriatal dejenerasyonun erken göstergeleri, bağımlılıkta ödül devrelerinin duyarlılığı gibi sorular ilk kez yaşayan insanda kantitatif olarak sınanabildi.
Kliniklere yayılan yankılar: Nöroloji, psikiyatri ve endokrinolojide dopamin izleri
Dopaminin keşif hikâyesi, klinikte üç büyük hatta iz bıraktı. Nörolojide, L-DOPA ve dopamin agonistleri Parkinson semptom kontrolünün temelini oluştururken, dopaminin aşırı “pulsatil” uyarımının uzun dönemde diskinezilerle ilişkisi tedavi stratejilerinin incelmesini gerektirdi; derin beyin stimülasyonu gibi girişimler, dopaminerjik devrelerin elektriksel modülasyonuna dayanan tamamlayıcı araçlar sundu. Psikiyatride, D2 reseptör işgal eşiğinin yaklaşık bir aralıkta optimum olduğu (fazlasının yan etki, azının yetersiz etki doğurduğu) görüldü; “atipik” antipsikotiklerin geniş reseptör profilleri, negatif ve bilişsel belirtilere yönelik yeni dengeler aradı. Endokrinolojide ise hipotalamustan tonik olarak salınan dopaminin prolaktin baskılayıcı etkisi, hiperprolaktinemi tedavisinde D2 agonistlerinin (ör. bromokriptin, kabergolin) rasyonel kullanımını mümkün kıldı. Akut tıpta dopaminin doz-bağımlı hemodinamik etkileri, belirli seçilmiş senaryolarda dikkatle dozlanan damar içi tedavilere kapı araladı.
İnsan hikâyesi: İnat, merak ve yöntemin gücü
Bu anlatının arka planında, kimyagerlerin titiz türevleştirmeleri, farmakologların yıpratıcı doz-yanıt eğrileri, histologların floresan altında sabaha kadar süren sayımları, klinisyenlerin riskle cesaret arasında kurduğu köprü var. Barger ve Ewens’in “küçük” sentezi; Montagu’nun sabırlı ölçümleri; Carlsson’un rezerpinle “söndürdüğü” hareketi L-DOPA ile “yakıp” geri getirmesi; Hillarp ve Falck’ın beyindeki görünmezi görünür kılan tekniği; Hornykiewicz ve Birkmayer’in İstanbul kahvesi kadar koyu bir L-DOPA çözeltisini hastaya verip dakikalar içinde açılan pencerelere tanıklığı; Cotzias’ın doz titrasyonu ile ilacı günlük hayata yerleştirişi… Hepsi, yan ürün sanılan bir molekülün temel ilkeye dönüşmesinin farklı yüzleri. Bilimin ilerleyişi burada bir kez daha kendini ele veriyor: Varsayımı değiştiren, çoğu kez yeni bir olgu değil, onu görmemizi sağlayan yöntem ve onu sınayan ısrar oluyor.
İleri Okuma
- Barger, G., & Ewens, J. (1910). The synthetic production of substituted phenylethylamines. Journal of the Chemical Society, Transactions, 97, 1313–1327.
- Montagu, K. A. (1957). Catechol compounds in rat brain. Nature, 180, 244–245.
- Carlsson, A., Lindqvist, M., & Magnusson, T. (1958–1959). On the role of monoamines in brain function. Acta Physiologica Scandinavica, 44(Suppl. 158), 1–28.
- Axelrod, J., & Tomchick, R. (1958). Enzymatic O-methylation of epinephrine and other catechols. Journal of Biological Chemistry, 233(3), 702–705.
- Udenfriend, S., Zaltzman-Nirenberg, P., & Nagatsu, T. (1960). Dopamine β-hydroxylase: a copper protein. Journal of Biological Chemistry, 235(10), 2910–2913.
- Ehringer, H., & Hornykiewicz, O. (1960). Verteilung von Noradrenalin und Dopamin im Gehirn des Menschen und ihr Verhalten bei Erkrankungen des extrapyramidalen Systems. Klinische Wochenschrift, 38, 1236–1239.
- Birkmayer, W., & Hornykiewicz, O. (1961). Der L-Dioxyphenylalanin (DOPA)-Effekt bei der Parkinson-Akinese. Wiener Klinische Wochenschrift, 73, 787–788.
- Falck, B., & Hillarp, N.-Å. (1962). Fluorescence histochemical demonstration of monoamines. Journal of Histochemistry & Cytochemistry, 10(3), 348–354.
- Van Rossum, J. M. (1966). The significance of dopamine-receptor blockade for the mechanism of action of neuroleptic drugs. Archives Internationales de Pharmacodynamie et de Thérapie, 160, 492–494.
- Cotzias, G. C., Van Woert, M. H., & Schiffer, L. M. (1967). Aromatic amino acids and modification of parkinsonism. New England Journal of Medicine, 276, 374–379.
- Cotzias, G. C., Papavasiliou, P. S., & Gellene, R. (1969). Modification of parkinsonism—Chronic treatment with L-DOPA. New England Journal of Medicine, 280, 337–345.
- Seeman, P., et al. (1976). Antipsychotic drug doses and dopamine receptor occupancy. Nature, 261, 717–719.
- Kebabian, J. W., & Calne, D. B. (1979). Multiple receptors for dopamine. Nature, 277, 93–96.
- Bunzow, J. R., et al. (1988). Cloning and expression of a rat D2 dopamine receptor cDNA. Nature, 336, 783–787.
- Van Tol, H. H. M., et al. (1991). Cloning of the human dopamine D4 receptor. Nature, 350, 610–614.
- Farde, L., et al. (1992). D2 dopamine receptors in neuroleptic-naive schizophrenic patients. Archives of General Psychiatry, 49, 538–544.
- Svenningsson, P., et al. (2004). DARPP-32: an integrator of neurotransmission. Annual Review of Pharmacology and Toxicology, 44, 269–296.
- Carlsson, A. (2001). A paradigm shift in brain research. Science, 294(5544), 1021–1024.
- Costa, K. M., & Schoenbaum, G. (2022). Dopamine. Current Biology, 32(15), R817–R824.
- Neurotransmitter.net. Dopamine: Synthesis and Function.
- Psychology Today. Dopamine Pathways.
- Archives of General Psychiatry. The Role of Dopamine in the Pathophysiology of Depression.
- Journal of Neurochemistry. Dopamine Receptors and their Function.
- American Journal of Physiology. Dopamine’s Role in the Renal System.
- Neuroscience & Biobehavioral Reviews. Neurohormonal Regulation by Dopamine.
- Cleveland Clinic. Dopamine: What It Is, Function & Symptoms.
- Wikipedia (İngilizce). Dopamine – Medical significance.
- Wikipedia (Türkçe). Dopamin.
- Begün, C. (2022). Başlıca ana dopamin yolakları (Şekil). Wikimedia Commons.