Eksüdasyon terimi, Latince kökenlidir ve klasik tıpta inflamasyon süreçlerini tanımlamak için kullanılan terimlerden biridir.
Eksüdasyon, inflamasyonun hem savunucu hem de potansiyel olarak zararlı bir bileşenidir. Evrimsel açıdan bakıldığında, organizmanın kendini onarma ve dış tehditlere karşı bariyer oluşturma yeteneğinin fizyolojik yansımasıdır. Bu mekanizma, damar geçirgenliğinin dinamik kontrolü, endotel hücre davranışları ve plazma proteinlerinin seçici taşınımı aracılığıyla gerçekleşir. Eksüdanın oluşumu, inflamasyonun varlığını gösteren biyokimyasal bir “imza” niteliğindedir; transüda ise sistemik homeostazın bozulduğunun habercisidir. Her iki olgu da damar fizyolojisi, hemodinamik denge ve immün yanıt arasındaki ince çizgiyi temsil eder.
Etimoloji:
- Latince: exsūdāre → ex- (“dışa, dışarı”) + sūdāre (“terlemek” → sūdō = ter)
- Yapısal çözümleme:
- ex- → “dışa doğru, dışarıya” anlamındadır (bkz. exitus, exitus mortis)
- sūdō, sūdāre → “terlemek”, sūdor → “ter”
- -ātiō, -ātiōn- → Latince isim yapma eki, fiilden soyut isim üretir: “-ma, -me, -ış, -iş”
Ortaçağ ve Yeni Latince’de kullanımı:
- Exsudatio: “terleme gibi dışarıya sıvı sızması” anlamında kullanılmıştır.
- ve 18. yüzyıl tıp metinlerinde exsudatio humorum (“vücut sıvılarının dışarı sızması”) şeklinde, iltihabi sıvıların damar dışına geçişini tanımlamak için kullanılmıştır.
- Fransızca’ya exsudation (17. yüzyıl sonu), Almanca’ya Exsudation (18. yüzyıl başı) olarak geçmiştir.
Türkçeye Geçişi:
- Türkçeye Fransızca ve Almanca tıp terimleri üzerinden geçmiş olup, ilk kullanımları 19. yüzyıl sonu – 20. yüzyıl başı Osmanlı tıbbı literatüründe görülür (örneğin: “eksüdasyon hâsıl olmuş” gibi ifadeler).
- Günümüz TDK tıp sözlüklerinde “eksüdasyon”, “iltihapla ilişkili olarak damar dışına sıvı geçişi” anlamında kullanılmaktadır.
Karşılık gelen diğer terimler:
| Latince / İngilizce | Türkçe Karşılığı | Açıklama |
|---|---|---|
| Exsudatio | Eksüdasyon | Damar dışına sıvı sızması |
| Exsudatum | Eksüda | Sızan sıvının kendisi |
| Exsudativus | Eksüdatif | Eksüda ile ilişkili, sıvı sızdıran |
| Transsudatio | Transüdasyon | İnflamasyon dışı sıvı sızması |
| Transsudatum | Transüda | Transüdasyon sonucu çıkan sıvı |
Eksüdasyonun Patofizyolojisi ve İnflamasyonla İlişkisi
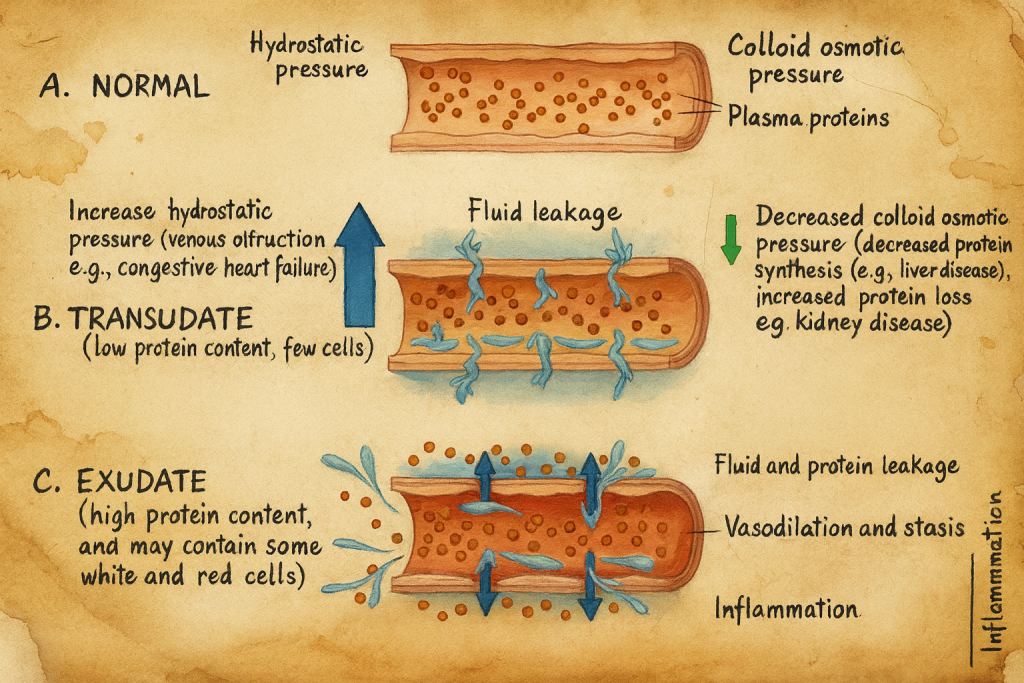
Eksüdasyon, Latince exsūdāre (“terlemek, sızmak”) fiilinden türetilmiş olup, “dışarıya doğru sıvı sızması” anlamına gelir. Tıp terminolojisinde bu kavram, inflamasyonun temel bileşenlerinden biri olarak, plazma proteinleri ve hücresel elemanların damar dışına geçmesiyle karakterize bir süreçtir. Eksüdasyon, akut inflamasyonun dinamik fizyopatolojik olaylar zinciri içinde; vazodilatasyon, artmış damar permeabilitesi, plazma proteinlerinin sızıntısı, lökosit emigrasyonu ve fagositoz aşamalarının ikinci halkasında yer alır.
Akut inflamatuvar yanıtın erken evresinde, öncelikle arteriyoller ve kapiller düz kas hücrelerinde vazodilatasyon meydana gelir. Bu olay histamin, nitrik oksit (NO) ve prostaglandin E₂ gibi medyatörlerin etkisiyle ortaya çıkar. Vazodilatasyon sonucu artan kan akımı, klasik inflamasyon belirtilerinden rubor (kızarıklık) ve calor (ısı artışı) fenomenlerini oluşturur. Bunu takiben, postkapiller venüllerde endotel hücreleri arasındaki bağlantılar gevşer ve damar geçirgenliği belirgin biçimde artar. Bu artış, histamin, bradikinin, lökotrien C₄/D₄/E₄, platelet-activating factor (PAF) ve vasküler endotelyal büyüme faktörü (VEGF) gibi medyatörlerin etkisiyle endotel hücrelerinin kasılarak aralarında geçici intersellüler boşluklar oluşması sonucunda gelişir.
Böylece, plazma proteinleri (özellikle albümin, immünoglobulinler, fibrinojen, kompleman komponentleri) damar dışına geçerek doku interstisyumuna ulaşır. Bu protein açısından zengin sıvıya eksüda denir. Artan damar permeabilitesi, inflamasyon alanına immün savunma faktörlerinin taşınmasını sağlar. Fibrinojenin fibrine dönüşmesi, hasarlı bölgeyi çevreleyen bir bariyer görevi görür; bu durum hem mikroorganizmaların yayılımını sınırlar hem de onarım sürecine zemin hazırlar.
Eksüdasyonun biyolojik işlevi, savunma ve onarımın kolaylaştırılmasıdır. Kompleman sistemi aracılığıyla mikroorganizmaların opsonizasyonu sağlanır; immünoglobulinler antijenleri nötralize eder; fibrin ağı ise fagositlerin göçünü destekler. Ancak bu süreç, aşırı veya uzamış olduğunda dokusal basınç artışı, ödem, fonksiyon kaybı ve ağrıya neden olur. Bu mekanizmalar, inflamasyonun klasik beş bulgusundan tumor (şişlik) ve dolor (ağrı) semptomlarının patofizyolojik temelini oluşturur.
Eksüdanın inflamatuvar yanıt içindeki rolü, evrimsel açıdan değerlendirildiğinde, dokuların korunması için gelişmiş bir homeostatik mekanizma olarak yorumlanabilir. İlkel canlılarda bile, yaralanma sonrası sıvı sızması yoluyla patojenlerin mekanik olarak uzaklaştırılması gözlenmiştir. Bu süreç, memelilerde kompleks immün ve vasküler yanıt sistemlerine entegre hale gelmiştir.
Eksüdanın Biyokimyasal Özellikleri ve Sınıflandırılması
Eksüda, protein içeriği yüksek (>%3), hücre ve enzim açısından zengin, özgül ağırlığı genellikle 1.020’nin üzerinde olan bir sıvıdır. İçeriğinde albümin, globulinler, pıhtılaşma faktörleri, nötrofiller, makrofajlar ve nekrotik hücre kalıntıları bulunur. Mikroskobik olarak, inflamasyonun süresine göre hücresel içerik değişkenlik gösterir: akut süreçlerde nötrofil baskınken, kronik inflamasyonlarda lenfosit ve makrofajlar hakimdir.
Eksüda, içerdiği protein tipi ve hücresel bileşime göre çeşitli alt tiplere ayrılır:
- Seröz eksüda: Düşük proteinli, berrak veya hafif sarı, plazma ultrafiltratına yakın karakterdedir. Hafif inflamasyonlarda görülür (örneğin deri kabarcıkları).
- Fibrinöz eksüda: Yüksek fibrinojen içeriği nedeniyle fibrin ağları oluşturur. Şiddetli inflamasyonlarda, örneğin fibrinöz perikarditte tipiktir.
- Pürülan (irinli) eksüda: Yoğun nötrofil, lökosit ve hücresel debris içerir. Enfeksiyonlara eşlik eder; dokuda sınırlı birikimi apse, seröz boşlukta birikimi ampiyem olarak adlandırılır.
- Hemorajik eksüda: Şiddetli damar hasarında eritrositlerin sıvıya karışması sonucu gelişir. Kanlı görünümlüdür; tümör infiltrasyonu veya ağır enfeksiyonlarda görülebilir.
- Kataral eksüda: Mukus açısından zengin, yapışkan ve visköz yapıdadır; mukozal inflamasyonlarda (örneğin nezle, bronşit) tipiktir.
Bu sınıflandırma, klinik pratikte inflamasyonun doğası ve etiyolojisi hakkında bilgi verir. Örneğin fibrinöz eksüda, kronikleşme ve fibrozis riski taşırken, pürülan eksüda bakteriyel etyolojiyi düşündürür.
Transüdasyonun Mekanizması ve Transüdanın Özellikleri
Eksüdasyonun karşıtı olarak transüdasyon terimi, damar geçirgenliğinde bir artış olmadan, yalnızca hidrostatik basınç artışı veya kolloid osmotik basınç düşmesi sonucunda damar dışına sıvı geçişini tanımlar. Etimolojik olarak “trans-” (öteye) ve “sūdāre” (terlemek) köklerinden türetilmiştir.
Transüda, düşük protein içeriğine (<2,5 g/dL), düşük özgül ağırlığa (<1.012) ve düşük hücresel içeriğe sahiptir. Bu sıvı berrak, renksiz ve su gibidir. Oluşumunda endotel bütünlüğü korunmuştur; sıvı hareketi yalnızca Starling denklemiyle açıklanan hidrostatik ve onkotik basınç dengesinin bozulması sonucudur.
Transüdasyona yol açan tipik patofizyolojik durumlar şunlardır:
- Konjestif kalp yetmezliği: Artan venöz basınç nedeniyle plevral transüda birikir.
- Karaciğer sirozu: Azalmış albümin sentezi ve portal hipertansiyon sonucu asit oluşur.
- Nefrotik sendrom: Hipoproteinemiye bağlı plazma onkotik basıncının düşmesiyle ödem ve effüzyon gelişir.
Transüda, inflamatuvar medyatörlerle ilişkili değildir; sistemik dolaşım dengesizliklerinin sonucudur.
Eksüda ve Transüda Arasındaki Temel Farklar
| Özellik | Eksüda | Transüda |
|---|---|---|
| Mekanizma | Artmış kapiller permeabilite (inflamasyon) | Starling dengesi bozulması |
| Protein içeriği | >30 g/L | <25 g/L |
| Özgül ağırlık | >1.018 | <1.012 |
| Hücresel içerik | Yüksek, inflamatuvar hücreler içerir | Düşük, genellikle hücresiz |
| LDH düzeyi | Yüksek | Düşük |
| Görünüm | Bulanık, fibrinli veya irinli olabilir | Berrak, renksiz |
| pH | Düşük (özellikle infeksiyöz süreçlerde <7.2) | Normal veya hafif alkali (~7.4–7.5) |
| Klinik örnek | Pnömoni, tüberküloz, malignite | Kalp yetmezliği, siroz, nefrotik sendrom |
Light Kriterleri ve Tanısal Önemi
Eksüda–transüda ayrımında 1972 yılında Richard Light tarafından tanımlanan kriterler, günümüzde de en yaygın kullanılan biyokimyasal değerlendirme yöntemidir. Buna göre, plevral sıvının aşağıdaki üç ölçütten en az birini karşılaması eksüda olarak kabul edilmesi için yeterlidir:
- Plevral sıvı/serum protein oranı > 0.5
- Plevral sıvı/serum LDH oranı > 0.6
- Plevral sıvı LDH düzeyi, serum normal üst sınırının 2/3’ünden fazla
Bu kriterlerin duyarlılığı yüksektir (%98’e kadar). Ancak özgüllüğü, özellikle diüretik tedavisi gören kalp yetmezliği hastalarında azalmaktadır. Bu durumda serum–plevral albümin gradyanı (>1.2 g/dL) veya plevral kolesterol düzeyi (>45 mg/dL) ek parametre olarak kullanılabilir.
Klinik Yansımalar ve Patofizyolojik Önemi
Eksüda ve transüda ayrımı, effüzyonlu hastaların tanısında temel belirleyicidir. Transüdatif efüzyonlar, sistemik hemodinamik dengesizliklerin göstergesi olup genellikle altta yatan kalp, karaciğer veya böbrek hastalıklarının tedavisiyle düzelir. Buna karşılık, eksüdatif efüzyonlar lokal inflamatuvar, enfeksiyöz veya neoplastik süreçleri işaret eder ve ileri tanısal araştırma gerektirir.
Örneğin plevral eksüda, parapnömonik efüzyon, malign plevral efüzyon veya tüberküloz plörezi gibi nedenlerle ortaya çıkabilir. Eksüda tespit edildiğinde, sıvıdan kültür, sitoloji ve biyokimyasal analiz yapılması altta yatan hastalığın tanımlanmasını sağlar.
Ampiyem, pürülan eksüdanın klasik örneğidir ve inflamasyonun patolojik sınırlarını gösterir. Tedavi edilmezse fibrinöz organizasyon ve plevral kalınlaşma ile sonuçlanabilir.
Peritoneal boşlukta benzer şekilde transüdatif asit, sirozun bir belirtisidir; buna enfeksiyon eklendiğinde eksüdatif bir hal alır (örneğin spontan bakteriyel peritonit). Bu durumda serum-asit albümin gradyanı (SAAG) <1.1 g/dL bulunur ve inflamatuvar bir sürecin varlığını gösterir.
Keşif
Eksüdasyonun keşfi ve tanımlanması, modern inflamasyon patofizyolojisinin gelişim süreciyle yakından ilişkilidir. Bu süreç özellikle 19. yüzyılın ortalarından itibaren mikroskobinin yaygınlaşması ve histopatolojik tekniklerin gelişmesiyle hız kazanmıştır.
1. Erken Gözlemler (Antik Çağ – 18. yy)
Eksüdasyon kavramı henüz bilinmezken, inflamasyona dair ilk sistematik tanımlamalar Hipokrat ve Galen gibi antik hekimlerce yapılmıştır. Galen (M.S. 2. yy), inflamasyonun dört klasik belirtisini – rubor (kızarıklık), tumor (şişlik), calor (sıcaklık) ve dolor (ağrı) – tariflemiş, “şişlik” olgusunu da sıvı birikimiyle ilişkilendirmiştir. Ancak bu dönemlerde inflamasyonun mekanizması ve sıvı geçişi hakkında mikroskobik bilgi yoktu.
2. Giovanni Battista Morgagni (1682–1771)
Patolojik anatominin kurucularından sayılan Morgagni, post-mortem gözlemler yaparak inflamasyon alanlarında sıvı ve pürülan madde birikimini belgeledi. Ancak bu birikimin nasıl oluştuğu o dönemde bilinmiyordu.
3. Marie François Xavier Bichat (1771–1802)
Fransız anatomist Bichat, dokuların fizyolojik yanıtlarını makroskopik düzeyde inceledi ve inflamasyonun doku özelliklerine bağlı farklı şekillerde geliştiğini gösterdi. Yine de mikroskobik bir eksüda tanımı yapılamamıştı.
4. Rudolf Virchow (1821–1902)
Virchow, hücresel patolojiyi geliştiren öncü isimdir. 1858’de yayımlanan “Die Cellularpathologie” adlı eserinde inflamasyonu, dokuların hücresel yanıtı olarak tanımladı. Ancak eksüda kavramını henüz açıkça ayırmadı; onun yaklaşımında inflamasyon, hücre düzeyinde dejenerasyon ve proliferasyonla tanımlanıyordu.
5. Julius Cohnheim (1839–1884): Eksüdasyonun Modern Anlamda Keşfi
Eksüdasyonun mikroskobik düzeyde tanımlanması ve bilimsel olarak açıklanması, Alman patolog Julius Friedrich Cohnheim tarafından gerçekleştirilmiştir.
Cohnheim, 1867 yılında kurbağa mezenteri üzerinde yaptığı canlı mikroskobik incelemelerle, inflamasyon sırasında damar geçirgenliğinin arttığını ve plazma ile lökositlerin damar dışına çıktığını doğrudan gözlemledi. Bu deneylerle:
- Vazodilatasyon,
- Endotelden sıvı sızması (eksüdasyon),
- Lökosit marginationu ve diapedezi süreçlerini
ilk kez ayrıntılı olarak tanımladı.
Bu gözlemler, eksüdasyonun inflamasyonun ana bileşeni olduğunu bilimsel olarak kanıtlayan ilk deneysel çalışmalardı. Bu nedenle, eksüdasyonun modern anlamdaki keşfi Julius Cohnheim’a atfedilir.
6. Elie Metchnikoff ve Fagositoz (1880’ler)
Cohnheim’in bulgularını takiben, Rus bilim insanı Elie Metchnikoff fagositik hücrelerin inflamasyon bölgesine göç ederek mikroorganizmaları yuttuğunu gösterdi. Bu, eksüdada görülen hücresel bileşenlerin işlevini açıklayan ilk teorilerden biriydi. Eksüdanın sadece bir sıvı değil, aynı zamanda bağışıklık fonksiyonu taşıyan hücreleri içeren bir savunma cevabı olduğu anlaşıldı.
7. 20. Yüzyıl ve Moleküler Dönem
- yüzyılda eksüdasyonun düzenlenmesinde rol alan vazoaktif medyatörler (histamin, bradikinin, prostaglandinler, lökotrienler), sitokinler (IL-1, TNF-α), kompleman sistemi, kemokinler, ve endotel hücrelerinin reseptör düzeyindeki davranışı gibi moleküler düzeydeki mekanizmalar tanımlandı. Böylece eksüda oluşumu, hücre sinyalleşmesiyle bütünleşmiş bir süreç olarak anlaşılmaya başlandı.
İleri Okuma
- Galen (ca. 200 AD). De Usu Partium Corporis Humani.
- Morgagni, G. B. (1761). De Sedibus et Causis Morborum per Anatomen Indagatis. Venice.
- Bichat, M. F. X. (1801). Anatomie générale appliquée à la physiologie et à la médecine. Paris.
- Virchow, R. (1858). Die Cellularpathologie in ihrer Begründung auf physiologische und pathologische Gewebelehre. Berlin: A. Hirschwald.
- Cohnheim, J. F. (1867). Über Entzündung und Eiterung. Virchows Archiv für pathologische Anatomie und Physiologie, 40, 1–79.
- Metchnikoff, E. (1884). Über eine neue Form von phagocytären Zellen im Blut der Seesterne. Archiv für pathologische Anatomie.
- Light, R. W., Macgregor, M. I., Luchsinger, P. C., Ball, W. C. (1972). Pleural Effusions: The Diagnostic Separation of Transudates and Exudates. Annals of Internal Medicine, 77(4), 507–513. DOI: 10.7326/0003-4819-77-4-507.
- Weissmann, G. (1980). Mediators of Inflammation: Histamine, Bradykinin, and Leukotrienes. New England Journal of Medicine, 303(11), 569–575. DOI: 10.1056/NEJM198009113031106.
- Sahn, S. A. (1998). The Pleura. American Review of Respiratory Disease, 138(1), 184–234.
- Cotran, R. S., Kumar, V., & Collins, T. (1999). Robbins Pathologic Basis of Disease. 6th ed. Philadelphia: Saunders.
- Majno, G., & Joris, I. (2004). Cells, Tissues, and Disease: Principles of General Pathology. 2nd ed. Oxford University Press.
- Porcel, J. M., Light, R. W. (2006). Diagnostic Approach to Pleural Effusion in Adults. American Family Physician, 73(7), 1211–1220. PMID: 16623206.
- Medzhitov, R. (2008). Origin and Physiological Roles of Inflammation. Nature, 454, 428–435. DOI: 10.1038/nature07201.
- Hooper, C., Lee, Y. C. G., Maskell, N. (2010). Investigation of a Unilateral Pleural Effusion in Adults: British Thoracic Society Pleural Disease Guideline. Thorax, 65(Suppl 2), ii4–ii17. DOI: 10.1136/thx.2010.136978.
- Roth, B. J., O’Meara, T. F., Cragun, W. H. (1990). The Serum-Effusion Albumin Gradient in the Evaluation of Pleural Effusions. Chest, 98(3), 546–549. DOI: 10.1378/chest.98.3.546.
- Runyon, B. A., Hoefs, J. C., Morgan, T. R. (1992). Serum Ascites Albumin Gradient is Superior to Exudate-Transudate Distinction in the Differential Diagnosis of Ascites. Annals of Internal Medicine, 117(3), 215–220. DOI: 10.7326/0003-4819-117-3-215.
- Runyon, B. A. (1994). Ascitic Fluid Analysis in the Differential Diagnosis of Ascites. Gastroenterology, 108(6), 1933–1949. DOI: 10.1016/0016-5085(94)90364-6.
- Heffner, J. E., Brown, L. K., Barbieri, C. A. (1997). Diagnostic Value of Tests That Discriminate Between Exudative and Transudative Pleural Effusions. Chest, 111(4), 970–980. DOI: 10.1378/chest.111.4.970.
- Cotran, R. S., Kumar, V., Robbins, S. L. (2021). Robbins and Cotran Pathologic Basis of Disease. Elsevier, 10th Edition.
- Kumar, V., Abbas, A. K., Aster, J. C. (2020). Robbins Basic Pathology. Elsevier.
- Rhoades, R. A., Tanner, G. A. (2023). Medical Physiology: Principles for Clinical Medicine. Wolters Kluwer, 6th Edition.
- D’Agostino, H. P., Edens, M. A. (2023). Physiology, Pleural Fluid. StatPearls [Internet]. StatPearls Publishing; Güncelleme: 28 Ağustos 2023.
- StatPearls Publishing. (2025). Physiology, Pleural Fluid; Pleural Effusion; Empyema. NCBI Bookshelf.
- İzmir Göğüs Hastanesi Eksüda-Transüda Çalışma Grubu. (2018). Plevral Efüzyonlarda Light Kriterleri, Albümin Gradyanı ve Protein Gradyanı Tanısal Değeri. İzmir Göğüs Hastanesi Dergisi., 2018;??(??):???.
- Saguil, A., Wyrick, K., Hallgren, J. (2014). Diagnostic Approach to Pleural Effusion. American Family Physician, 90(2), 99–104. PMID: 25077579.
- Varaday, S. S. (2024). Light’s Criteria – Differentiating Transudative vs. Exudative Effusions. Medscape Reference. Güncelleme: 30 Temmuz 2024.

Yorum yazabilmek için oturum açmalısınız.