İçindekiler
Tanım ve Genel İlkeler
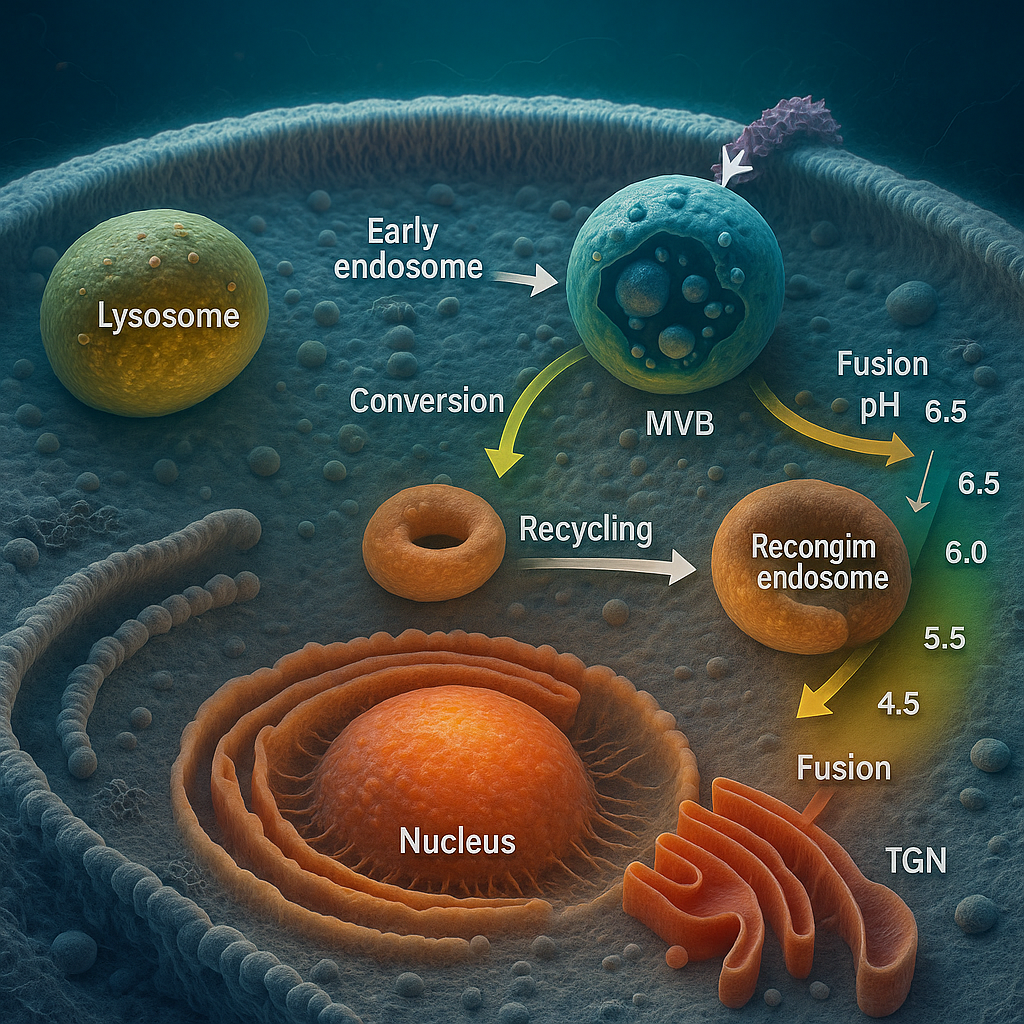
Endozomlar, endositozla hücre içine alınan ligandlar, reseptörler, lipitler ve çözünebilen makromoleküller için merkezî bir “sınıflandırma (sorting) ve yönlendirme” platformu oluşturan zarla çevrili bölmelerdir. Plazma zarından kopan endositik veziküllerle sürekli füzyona girer; içerik ve membran bileşenlerini ayrıştırıp, bir kısmını geri dönüşüm yollarına, bir kısmını Geç Golgi Ağı’na (TGN), bir kısmını ise ilerleyen asitleşme ve membran yeniden düzenlenmesi eşliğinde lizozomal yıkıma yönlendirir. Kompartımanlar arası geçiş, Rab GTPazları, PI-fosfoinozitidler, SARS/cis-SNARE’ler, tethering kompleksleri (CORVET/HOPS), ESCRT makineleri, mikrotübül–aktin iskeleti ve motor proteinleri (kinezin/dinein) tarafından spatio-temporal olarak koordine edilir.
Endositoz Yolları ve Endozoma Giriş
Clathrin-aracılı endositoz (CME), adaptör kompleksleri (özellikle AP-2) ve ubiquitin/sinyal motifleri (YxxΦ, [D/E]xxxL[L/I]) ile seçilen kargoları taşır. Clathrin-bağımsız yollar (kaveolalar, CLIC/GEEC, flotillin-ilişkili yolaklar) ile makropinositoz ve fagositoz, hacim ve kargo doğasına göre alternatif giriş kapıları sağlar. Yeni oluşan endositik veziküller, erken endozomlarla hızla kaynaşır ve kargo, burada ilk karar noktasına ulaşır.
Kompartmental Organizasyon ve Ayırt Edici Özellikler
- Erken Endozom (EE): Rab5 ve EEA1 ile tanımlanır; pH ~6.0–6.5. PI3P açısından zengindir. Hızlı geri dönüşüm (Rab4) ve yavaş geri dönüşüm (Rab11) kollarına ayrımın başlıca düğümüdür.
- Geri Dönüşüm Endozomu (RE): Özellikle Rab11 ile işaretlenir; reseptörlerin ve membran lipidlerinin plazma zarına geri gönderilmesinde rol alır. Transferrin reseptörü klasik bir belirteçtir.
- Geç Endozom/MVB (LE/MVB): Rab7 ile tanımlanır; pH ~5.0–5.8. İntraluminal vezikül (ILV) oluşumu belirgindir; ESCRT-bağımlı veya ceramid-aracılı ESCRT-bağımsız mekanizmalarla ILV’ler oluşur. LE’ler lizozomlara olgunlaşır veya onlarla kaynaşır.
- Lizozom: LAMP1/2 ile tanımlanır; pH ~4.5–5.0; V-ATPaz ile asidifiye olur; hidrolazlarca zengindir.
Maturasyon: Rab Dönüşümü ve Asitleşme
Erken-geç endozom geçişi, Rab5→Rab7 dönüşümü ile betimlenir. Bu süreçte Rab5-pozitif membran alanları, PI3P zenginliği ve EEA1 aracılı tethering özellikleri kaybolurken, Rab7-pozitif alanlar kazanılır; CORVET’ten HOPS’a geçişle SNARE eşleşmesi ve lizozomal yönlendirme yetkinliği artar. V-ATPaz aktiviteleri kompartıman pH’ını kademeli düşürerek ligand-reseptör ayrışmasını, hidrolaz aktivasyonunu ve ESCRT işlevlerini kolaylaştırır.
Kargo Sınıflandırma Mantığı
- Geri Dönüşüm:
- Hızlı geri dönüşüm (Rab4): Transferrin reseptörü gibi kargolar saniyeler-dakikalar ölçeğinde plazma zarına döner.
- Yavaş geri dönüşüm (Rab11-RE): Polariteye duyarlı, sıklıkla spesifik sıralama motifleriyle yönlendirilen kargolar (ör. epitelyal apikal/bazolateral ayrışma).
- TGN’ye Geri Taşınma (Retrograd): Retromer kompleksi (VPS26-29-35) ve SNX-BAR proteinleri, CI-MPR gibi reseptörleri TGN’ye geri taşır; lizozomal hidrolazların doğru adreslenmesi için kritiktir.
- Lizozomal Yıkım: Ubiquitinlenmiş membran proteinleri, ESCRT-0/I/II/III kademeleri ile ILV’lere ayrıştırılır ve MVB-lizozom yoluyla parçalanır. Bu yol, ligand-bağımlı reseptör down-regülasyonunda (ör. EGFR) belirleyicidir.
Lipit Mikrodomainleri ve PI-Fosfoinozitid Kodları
Endozomal zar kimliği, PI3P (erken), PI(3,5)P₂ (geç) ve kolesterol/LBPA (lizobifosfatidik asit; MVB iç yapısı) gibi lipitlerce belirlenir. Bu “lipit kodu”, FYVE/PH/ENTH alanlı efektörleri toplayarak tethering, motor bağlanması ve ESCRT/retromer gibi makineleri konumlandırır.
Hücresel İskelet, Motorlar ve Mekanik Akış
Endozomlar, periferi-→perinükleer yönelimde mikrotübüller boyunca dinein (− uç) ve perifere taşınmada kinezin (+ uç) ile hareket eder. Aktin-bağımlı “fisyon” ve lokalleşme olayları, özellikle hücre kenarında ve filopod/membran kıvrımlarında rol oynar.
Sinyalizasyonun Endozomal Mantığı
Endozomlar yalnızca “trafik düğümü” değil, aynı zamanda sinyal platformu işlevi görür.
- “Signaling endosomes”: NGF-TrkA gibi reseptörlerin retrograd aksonal taşınmasıyla nöronal farklılaşma ve hayatta kalma sinyalleri taşınır.
- mTORC1 ve besin duyarlılığı: Amino asitlerin ve Rag GTPazlarının koordinasyonuyla, geç endozom/lizozom membranındaki sensörler büyüme ve otofaji kararlarını etkiler.
- Gelişimsel yollar: Notch, Wnt ve TGF-β reseptörlerinin endozomal işlenmesi, sinyal gücünü ve süresini belirler.
Bağışıklık ve Antijen Sunumu
Profesyonel antijen sunan hücrelerde (APC), endozom-türevi MHC sınıf II bölmeleri (MIIC), endositozla alınan antijenlerin proteolitik işlenmesine ve MHC II–peptit yüklenmesine aracılık eder. TLR3/7/9 gibi endosomal TLR’ler, nükleik asit paternlerini algılayarak antiviral/inflamatuvar yanıtları tetikler.
Nöronal Sistem ve Uzak Mesafe Trafik
Nöronlarda uzun aksonal mesafeler boyunca retrograd/endograd endozomal taşınma, sinaptik reseptör dönüşümü (AMPA/NMDA), büyüme konisi davranışları ve plastisite için kritiktir. Disfonksiyon, sinaptik homeostazın bozulmasına ve nörodejeneratif fenotiplere zemin hazırlayabilir.
Patojen–Endozom Etkileşimleri
Pek çok virüs ve toksin, endozomal asitleşme ve proteazlardan (katespinler) yararlanarak membran füzyonu/kaçışı gerçekleştirir. İnfluenza, Ebola ve koronavirüslerin bazı hücre tiplerinde endozomal giriş/primerlenme stratejileri; difteri ve Shiga toksinleri gibi bakteriyel faktörlerin pH-bağımlı translokasyonu, bu bölmenin savunma-kaçış dengesindeki önemini vurgular. Salmonella ve Mycobacterium, endozomal olgunlaşmayı modüle ederek fagolizozomal birleşmeyi saptırabilir.
Hastalıklarla İlişki
- Nörodejenerasyon: Retromer yetersizliği (VPS35 mutasyonları), endozomal şişme ve reseptör/lipit mistargeting ile Alzheimer ve Parkinson patofizyolojisine katkıda bulunabilir.
- Lipoidozlar ve kolesterol taşınım bozuklukları: Niemann-Pick C’de geç endozom/lizozom kolesterol birikimi.
- Periferik nöropatiler: Erken endozomal Rab5/Rab7 aksının bozulması ve aksoplazmik taşımada aksaklıklar Charcot-Marie-Tooth gibi tablolarla ilişkilidir.
- Tümör biyolojisi: EGFR/HER2 gibi reseptörlerin endozomal kaderi proliferasyon ve tedavi yanıtını belirleyebilir; endozomal pH ve trafikteki değişiklikler invazyon/metastazla ilişkilendirilmiştir.
- Enfeksiyon ve inflamasyon: Endozomal TLR sinyalleşmesinin aşırı/eksik aktivasyonu otoinflamatuvar ve immün yetmezlik tablolarına neden olabilir.
Hücre Kutupsallığı ve Doku Mimarisinde Rol
Epitelyal hücrelerde apikal/bazolateral hedefleme, geri dönüşüm endozomu ve Rab11-FIP ailesi efektörleri üzerinden düzenlenir. Nöronlarda somato-dendritik ve aksonal membran kompartımanlarına özgü trafikte endozomlar seçicilik sağlar; gelişen dokularda morfogen gradientlerinin şekillenmesine dolaylı katkı verir.
Ekzososomal Salım ve Hücrelerarası İletişim
MVB’lerin plazma zarıyla füzyonu, ILV’lerin ekzosome olarak salınmasına yol açar. Ekzosome’lar protein/lipit/nükleik asit kargolar taşıyarak tümör mikroçevresi, immün modülasyon ve sistemik sinyal iletiminde görev alır; aynı zamanda tanısal biyobelirteç ve ilaç taşıyıcısı potansiyeli taşır.
Deneysel Yaklaşımlar
- Canlı hücre görüntüleme: pH-duyarlı fluoroforlar (pHluorin), Rab/EEA1/Rab7 işaretlemeleri, TIRF ve konfokal mikroskopi.
- Süper-çözünürlük ve korrelatif yöntemler: STORM/PALM, FIB-SEM; ILV ve ESCRT dinamiklerinin ayırt edilmesi.
- Biyokimya ve proteomik: Endozomal fraksiyonlama, proximity-labeling (BioID/APEX), fosfoproteomik ile sinyal düğümlerinin haritalanması.
- Fonksiyonel testler: Transferrin geri dönüşüm esaslı akış ölçümleri, EGF-EGFR down-regülasyon kinetikleri, V-ATPaz inhibitörleri (bafilomisin A1) ile pH manipülasyonu.
Terapötik ve Biyoteknolojik Uygulamalar
- Hedefli ilaç taşıma: pH-duyarlı polimerler, “proton-sünger” (proton sponge) tasarımları ve membran-aktif peptitler ile endozomal kaçış veriminin artırılması.
- Gen/siRNA/mRNA teslimi: Reseptör-aracılı endositoz ve akıllı nanopartikül yüzey kimyasıyla spesifik hücre hedefleme.
- Endozomal sinyal modülasyonu: ESCRT, retromer veya Rab akslarının küçük molekül/peptidik modülatörlerle ayarlanması; lizozom-odaklı mTORC1 inhibisyonu/aktivasyonu stratejileri.
- İmmünoterapi ve aşı geliştirme: Endozomal TLR agonistleri ve antijen yükleme stratejileriyle güçlü yardımcı sinyal üretimi.
Keşif
Öncesi: Hücrelerin “İçe Alması”nı Farketmek (1880’ler–1950’ler)
Hikâye, hücrelerin dış çevreden madde alabileceği fikrinin filizlendiği bir çağda başlar. 1880’lerde İlya Metçnikov’un fagositozu tanımlamasıyla hücresel içselleştirme (endositoz) fikri bilimsel zemine yerleşti; 1931’de Warren H. Lewis “pinotositoz” adını verdiği olguyu sinematik mikroskopiyle betimledi. 1950’lere gelindiğinde elektron mikroskobunun yaygınlaşması, hücre içi veziküler trafiğin ilk somut görüntülerini sundu: George Palade, Keith Porter ve meslektaşları hücrenin zar sistemlerini morfolojik olarak ayrıştırmaya başladı. 1964’te Thomas F. Roth ve Keith R. Porter, plazma zarındaki “kıllı/bristle-coated” çukurların tomurcuklanarak kaplı veziküller oluşturduğunu gösterdi; bu, seçici reseptör aracılı endositoz kavrayışını mümkün kılan dönüm noktasıydı. (PMC)
De Duve’un Çağı: Lizozomlar, Terimler ve Bir Yanlış Atıfın Düzeltilmesi (1960’lar–1970’ler)
1960’larda Christian de Duve ve çalışma arkadaşları lizozomları ve peroksizomları tanımlayarak hücresel sindirim fikrini kurumsallaştırdılar; bu çalışmalar 1974 Nobel Ödülü (Claude–de Duve–Palade) ile taçlandı. Ancak sık yinelenen bir yanlışı düzeltmek gerekir: “Endozom” terimini de Duve ortaya koymadı; de Duve 1963’te “endositoz” kavramını sistemleştirirken, endozom adı ve kavramsal çerçevesi daha sonra doğdu. Kaplı veziküllerin protein bileşeni klatrin ise 1975’te Barbara Pearse tarafından saflaştırılarak adlandırıldı; reseptör seçimi ve kargo paketleme fikri moleküler dayanağını böylece kazandı.
Adın Konuluşu ve “Sıralama İstasyonu” Fikrinin Doğuşu (erken 1980’ler)
1970’lerin sonundan 1980’lerin başına uzanan dönemde, hücre içine alınan ligandların ayrışması için asitli bir ara bölme gerektiği fikri doğdu; endositoz yolundaki pH gradyanını ve V-ATPaz bağımlı asitleşmeyi gösteren deneyler bu kavrayışı pekiştirdi. 1983’te Ari Helenius, Ira Mellman ve meslektaşları, “endozomlar” adını vererek bu ara bölmeyi açıkça tanımladı; endozom artık sadece morfolojik bir “postane” değil, kargo sıralayan özgül bir kompartımandı. Aynı yıllarda transferrin reseptörünün geri dönüştüğü gösterilerek endozomların geri dönüşüm ve parçalanmaya yönlendirme ayrımı işlevsel olarak somutlaştı.
Yolun İnşası: Erken–Geç Endozom Ayrımı, Asitleşme ve MVB’ler (1990’lar–2000’ler)
1990’larda ve 2000’lerin başında endozomal alt bölmelerin kimlik kodları çözüldü: erken endozom (Rab5, PI3P, EEA1), geç endozom/multiveziküler cisim (Rab7, PI(3,5)P₂, LBPA) ve geri dönüşüm endozomu (Rab11). 2005’te Marino Zerial ve meslektaşlarının çalışması, Rab5→Rab7 “dönüşümü” ile erken kompartımanın zamanla geç kompartımana olgunlaştığını göstererek, hattın dinamik doğasını kanıtladı. ESCRT proteinlerinin tanımlanması ise membran proteinlerinin ILV’lere ayrılması ve MVB biyogenezinin kurallarını ortaya koydu. Aynı dönemde retromer kompleksi, lizozomal hidrolaz reseptörlerinin TGN’ye geri taşınmasında kilit unsur olarak keşfedildi; böylece endozomun sadece “aşağı akış” değil, “yukarı akış” (retrograd) lojistikte de merkez olduğu anlaşıldı.
Sinyal Platformu Olarak Endozom (2000’ler–2010’lar)
2000’lerden itibaren endozomların, reseptörleri sadece söndürüp geri gönderen pasif duraklar olmadığı; sinyal iletimini uzamsal-ve-zamansal olarak ayarlayan platformlar olduğu gösterildi. Büyüme faktörü reseptörleri (EGFR vb.) için endozomal ikamet süreleri sinyalin şiddeti ve süresini belirlerken, besin duyarlılığı ve mTORC1 etkinliğinin lizozomal/endozomal zarlardaki sensörlerle ayarlandığı bir “organellere yerleşik sinyal düğümü” kavramı yerleşti. Bu bakış, endozomal pH ve trafik bozukluklarının kanser, nörodejenerasyon ve immün yanıt sapmalarıyla ilişkisini moleküler düzeyde yorumlamayı sağladı.
Modern Çağ: Temas Noktaları, Virolojik Kapılar ve Tedaviye Açılan Yollar (2010’lar–2025)
Son on beş yılda üç eksen öne çıktı:
(i) Organeller arası temas yüzeyleri (MCS): Endozom–ER ve endozom–mitokondri temaslarının lipit taşınımı, kolesterol homeostazı ve Rab7/ORP1L gibi sensörlerle konumlandığı gösterildi; trafik kararları sadece vezikül değişimiyle değil, temas temelli sinyallerle de yönetiliyor.
(ii) Patojen giriş stratejileri: Zarflı virüslerin önemli bir bölümü, endozomal asitleşme ve proteazları kullanarak füzyon gerçekleştiriyor; 2020’den itibaren SARS-CoV-2 için de hücre tipine bağlı endozomal giriş kollarının önemi vurgulandı. Bu, endozomal proteazları ve pH’ı hedefleyen antiviral stratejileri gündeme taşıdı.
(iii) Biyoteknoloji ve tedavi: Nanopartikül, siRNA/mRNA ve antikor-ilaç konjugatları için endozomal kaçış başat darboğaz olmaya devam ediyor; ESCRT ve membran onarım yolları, hücre içi iletim verimini artırmak için yeni hedefler sağlıyor. Ek olarak, retromer ve yardımcı SNX proteinleri üzerine yeni yapısal/işlevsel çalışmalar, nörodejeneratif hastalıklarda endozomal–lizozomal eksenin nasıl düzeltilebileceğine dair mekanistik çerçeveler üretiyor.
Kavramsal Bütünleşme
Bugünden bakınca endozomlar, üç ana temanın kesiştiği yer olarak okunur: (1) Seçici alım ve sıralama (klatrin ve alternatif yollar), (2) Kimlik ve zaman kodu (Rab ağları, PI-fosfoinozitidler, asitleşme) ve (3) Son yazgı kararları (geri dönüşüm, retrograd taşıma, MVB/lizozom). Bu üç tema; kanserden nörodejenerasyona, viral girişten immün duyarlanmaya kadar geniş bir biyomedikal yelpazeyi açıklayıcı bir iskelet sunar.
İleri Okuma
- Metchnikoff, I. (1883). Lectures on the Comparative Pathology of Inflammation. G. Masson Éditeur, Paris.
- Lewis, W. H. (1931). Pinocytosis. Anatomical Record, 51(1), 11–19. Wiley-Liss, New York.
- Palade, G. E. (1955). A small particulate component of the cytoplasm. Journal of Biophysical and Biochemical Cytology, 1(1), 59–68. Rockefeller University Press, New York.
- Roth, T. F., & Porter, K. R. (1964). Yolk protein uptake in the oocyte of the mosquito. Journal of Cell Biology, 20(2), 313–332. Rockefeller University Press, New York.
- de Duve, C. (1963). The lysosome concept. Ciba Foundation Symposium on Lysosomes, 1–31. Little, Brown and Co., Boston.
- Pearse, B. M. F. (1976). Clathrin: a unique protein associated with intracellular transfer. Annual Review of Biochemistry, 45(1), 623–629. Annual Reviews, Palo Alto, CA.
- Ohkuma, S., & Poole, B. (1982). Fluorescence probe measurement of the intralysosomal pH in living cells and the perturbation of pH by various agents. Proceedings of the National Academy of Sciences (PNAS), 79(9), 2758–2762. National Academy of Sciences, Washington, D.C.
- Helenius, A., Mellman, I., Wall, D., & Hubbard, A. (1983). Endosomes. Trends in Biochemical Sciences (TIBS), 8(7), 245–250. Elsevier, Cambridge.
- Seaman, M. N. J., Marcusson, E. G., Cereghino, J. L., & Emr, S. D. (1997). Endosome to Golgi retrieval of the vacuolar protein sorting receptor requires the VPS35–VPS29–VPS26 complex (retromer). Journal of Cell Biology, 137(1), 79–92. Rockefeller University Press, New York.
- Seaman, M. N. J., McCaffery, J. M., & Emr, S. D. (1998). A membrane coat complex essential for endosome-to-Golgi retrograde transport. Journal of Cell Biology, 142(3), 665–681. Rockefeller University Press, New York.
- Maxfield, F. R., & McGraw, T. E. (2004). Endocytic recycling. Nature Reviews Molecular Cell Biology, 5(2), 121–132. Nature Publishing Group, London.
- Rink, J., Ghigo, E., Kalaidzidis, Y., & Zerial, M. (2005). Rab conversion as a mechanism of progression from early to late endosomes. Cell, 122(5), 735–749. Cell Press, Elsevier Inc., Cambridge, MA.
- Hurley, J. H., & Emr, S. D. (2010). The ESCRT complexes: structure and mechanism of a membrane-trafficking network. Annual Review of Biophysics, 39(1), 277–298. Annual Reviews, Palo Alto, CA.
- Huotari, J., & Helenius, A. (2011). Endosome maturation. The EMBO Journal, 30(17), 3481–3500. Nature Publishing Group, London.
- White, J. M., Whittaker, G. R., & Helenius, A. (2016). Fusion of enveloped viruses in endosomes. Annual Review of Virology, 3(1), 369–391. Annual Reviews, Palo Alto, CA.