İmmünfloresans, özgül antijen–antikor etkileşimini optik olarak görünür kılmak için antikorların bir florofor (flüorokrom) ile kimyasal olarak işaretlenmesine dayanan bir görüntüleme ve tanı yöntemidir. Floroforla konjuge edilen immünoglobulinler, uygun dalga boyunda uyarıldıklarında daha uzun dalga boyunda (daha düşük enerjili) ışık yayarlar; uyarılan ve yayılan ışık arasındaki bu fark Stokes kayması olarak adlandırılır. Böylece antikorun bağlandığı antijenik hedef, mikroskopta karakteristik bir renk ve desenle seçici biçimde izlenebilir.
Floroforlar ve optik okuma
Sık kullanılan florofor örnekleri arasında FITC (fluorescein izotiyosiyanat) ve TRITC (tetrametilrhodamin izotiyosiyanat) bulunur. FITC tipik olarak yeşil emisyon verirken, TRITC turuncu-kırmızı bölgede emisyon yapar. Dolayısıyla renk atamalarında zaman zaman görülen karışıklıkların önüne geçmek için, her floroforun uyarılma ve emisyon bölgelerinin cihazdaki filtre setleriyle uyumlu olduğundan emin olmak gerekir. Çoklu boyamada spektral örtüşme (bleed-through) riskine dikkat edilir; kanallar arası ayrımı güçlendirmek için uygun filtre kombinasyonları ve, gerekiyorsa, daha uzak spektrumlu boyalar seçilir.
Antikorların kimyasal işaretlenmesi (konjugasyon) – prensipler
Antikorlar, izotiyosiyanat türevleri gibi reaktif gruplar üzerinden protein üzerindeki nükleofilik yan zincirlere (çoğunlukla lizinin ε-amin grupları) bağlanarak kovalent biçimde işaretlenir. İyi bir konjugasyon, antikorun paratop bölgesini sterik olarak engellemeden veya afinitesini düşürmeden yeterli sayıda florofor taşımasını hedefler. Bu denge, sinyal şiddeti ile fonksiyonel özgüllük arasında bir optimizasyon gerektirir; aşırı yükleme, sönümlenme (quenching) ve bağlanma kaybına yol açabilirken, yetersiz yükleme düşük sinyalle sonuçlanır. Hazır (ticari) konjugatlar, bu denge profesyonelce ayarlandığı için rutin tanıda tercih edilir.
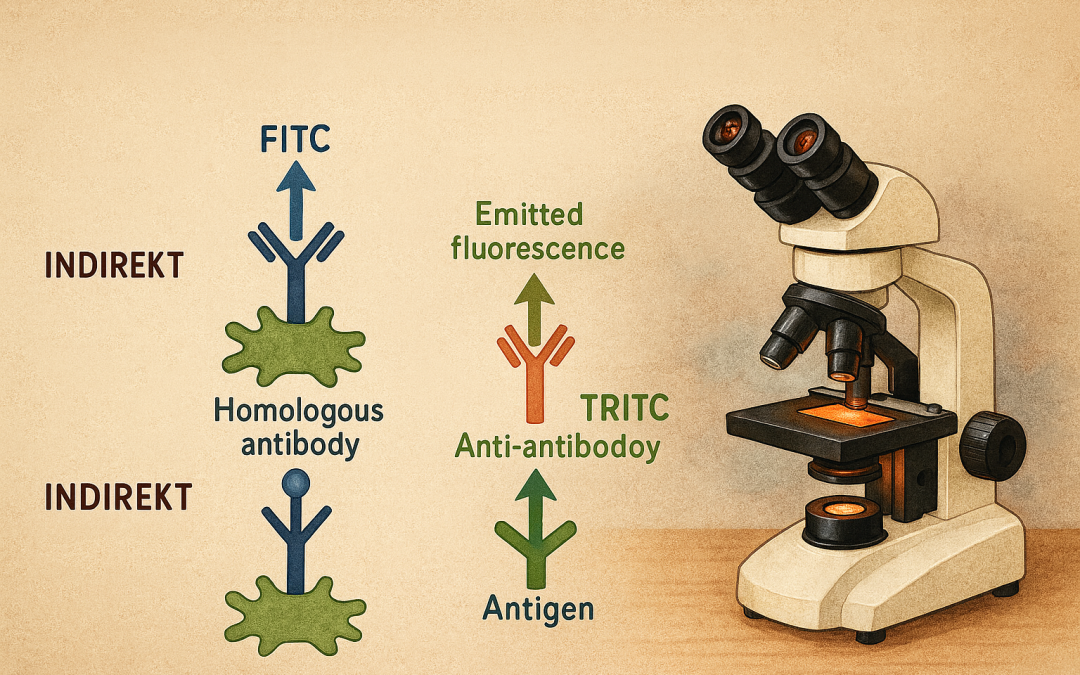
Yöntem tipleri: Doğrudan (DIF) ve dolaylı (IIF)
Doğrudan immünfloresans (DIF) – ilke
Hedef antijene özgül primer antikorun bizzat floroforla işaretli olduğu yaklaşımdır. Örnek/lam üzerine hedeflenen antijen ve homolog (hedef antijenin bulunduğu tür/örnek matrisine uygun) floroforlu antikor birlikte uygulanır. Antijen–antikor bağlanması varsa, yıkanma adımlarından sonra mikroskopta özgül floresan desen görülür; bağlanmayan antikor uzaklaştırıldığı için arka plan görece düşüktür.
Güçlü yönler (kavramsal):
- Hızlı okuma; tek antikor katmanı.
- Sinyal kaynağı tek bileşen olduğu için yorumlaması yalın.
Sınırlılıklar (kavramsal):
- Her hedef için ayrı ayrı konjugat gereksinimi.
- Sinyal güçlendirme sınırlı; düşük bolluklu antijenlerde duyarlılık kısıtlı olabilir.
Dolaylı immünfloresans (IIF) – ilke
Hedef antijene özgül primer antikor işaretli değildir. Bağlanmayı takiben, primerin türüne (ör. insan, fare, tavşan IgG vb.) karşı geliştirilmiş floroforlu sekonder (anti-antikor) kullanılır. Bir primer molekülüne birden fazla sekonder bağlanabileceği için sinyal amplifiye olur.
Neden rutinde daha yaygın:
- Duyarlılık genellikle daha yüksektir; düşük düzeyli antijenler daha iyi görünür.
- Maliyet/lojistik avantajı: Tek bir floroforlu sekonder, aynı türden çok sayıda farklı primer antikorla kullanılabilir.
- Panel kurulumlarında esneklik; çoklu belirteçler için pratik.
Dikkat noktaları (kavramsal):
- Sekonder antikorun istenmeyen Fc-aracılı veya türler arası bağlanmaları arka plan oluşturabilir; uygun bloklama ve kontrol stratejileri önemlidir.
- Çoklu boyamalarda çapraz reaktiviteyi önlemek için primer/sekonder tür uyumu ve sıra kurgusu dikkatle planlanır.
Örnek türleri ve tipik kullanım alanları
- Klinik solunum örnekleri: Nazofaringeal sürüntü veya bronş lavajı gibi materyallerde Respiratuvar sinsityal virüs (RSV) antijenlerinin hızlı gösterimi. Bu yaklaşım, uygun klinik bağlamda, yatak başı kararlarını hızlandıran bir antijen tespit stratejisidir.
- Hücre kültürü izolasyonları: CPE (sitopatik etki) gelişimini beklemeden, kültürde çoğalan virüslerin tip tayini için hücre monolaylarında spesifik antijenlerin gösterimi.
- Doku kesitleri: Örneğin böbrek biyopsisinde immün kompleks birikimlerinin (granüler/lineer paternler) gösterimi gibi histopatolojik sorular.
- Otoimmün seroloji alt alanı: HEp-2 hücreleri üzerinde antinükleer antikor (ANA) paternleri, nötrofil granüllerinde ANCA paternleri gibi; burada IIF, patern-fenotip korelasyonlarıyla klinik yoruma katkı verir.
- Diğer viral/bakteriyel hedefler: Uygun validasyonla HSV, VZV, influenza, adenovirüs, bazı solunum bakteriyel antijenleri vb. için paneller.
Klasik yöntemlerle karşılaştırmalı zaman boyutu
Hücre veya doku kültüründe yalnızca ışık mikroskobisine dayalı CPE gözlemi belirginleşene kadar beklemek gerekebilir. İmmünfloresans, hedef antijen oluşur oluşmaz sinyali görünür kılabildiği için, sonuç alma süresini anlamlı biçimde kısaltabilir; klinik uygulamada saatler mertebesinde erken yanıt, enfeksiyon kontrolü ve tedavi kararlarını hızlandırır.
Yorumlama mantığı: patern, özgüllük ve duyarlılık
- Patern tanıma: Sinyalin hücresel/lokalizasyonel deseni (nükleer, sitoplazmik, membranöz; granüler, diffüz, lineer vb.) biyolojik anlam taşır.
- Özgüllük: Doğru hedefe bağlanmayı teyit etmek için pozitif/negatif kontrol preparatları ve uygun izotip ya da no-primary kontrolleri kavramsal çerçevenin parçasıdır.
- Duyarlılık: IIF’in sinyal amplifikasyonu, düşük bolluklu antijenleri yakalamaya yardımcı olur; ancak pre-analitik faktörler (örnek alınma zamanı, materyal bütünlüğü) duyarlılığı ciddi biçimde etkiler.
- Arka plan ve çapraz bağlanma: Matris kaynaklı oto-floresans (örneğin bazı dokular, mukus, eritrositler), non-spesifik elektrostatik etkileşimler ve sekonder antikorun hedef dışı bağlanmaları yalancı sinyale yol açabilir. Yorumlama, bu olasılıkları sistematik biçimde dışlamayı gerektirir.
Görüntüleme bileşenleri (kavramsal)
- Mikroskopi: Epifloresan veya konfokal sistemler; uygun uyarma/emisyon filtreleri.
- Sinyal bütünlüğü: Fotoblekaj ve sönümlenme gibi fotofiziksel süreçler sinyali azaltabilir; okuma sırası ve pozlama süreleri buna göre düşünülür.
- Çoklu kanallar: Kanal ayrımı, spektral uyum ve gerektiğinde hesaplamalı ayrıştırma yaklaşımları ile desteklenir.

Klinik tanı ekosisteminde yeri
İmmünfloresans, hız ve örüntü bilgisi sayesinde acil klinik kararları desteklemede değerlidir; ancak modern tanı algoritmalarında çoğu zaman nükleik asit amplifikasyon testleri (ör. PCR) ve kültür-temelli yaklaşımlarla komplementer kullanılır. İmmünfloresans antijenin varlığını ve dağılımını gösterir; moleküler yöntemler ise genomik düzeyde doğrulama ve tiplendirme sağlar. Sonuçların klinik öykü, zamanlama ve diğer laboratuvar verileriyle bütüncül yorumlanması esastır.
Uygulamaya dair terminoloji ve doğru kullanım
- “Konjugat” terimi, floroforla işaretli antikoru ifade eder (primer ya da sekonder olabilir).
- “Homolog” ifadesi, sekonder antikorun, ilk antikorun üretildiği türe karşı geliştirilmiş olmasını ve örnek matrisine uygunluğunu anlatmak için kullanılır.
- Renk atamaları: FITC yeşil, TRITC turuncu-kırmızı emisyonludur; bu, filtre seti seçimini ve kanal etiketlemesini belirler.
- “Dolaylı” yöntemin duyarlılığı: Sekonder tabakası sayesinde sinyal amplifikasyonu sağlar; bu da rutin taramalarda tercih edilmesinin temel gerekçesidir.
- Kullanım örnekleri: RSV’nin solunum yolu örneklerinde antijen düzeyinde saptanması; hücre kültüründe virüs tiplerinin ayırt edilmesi; doku kesitlerinde immün kompleks paternlerinin gösterilmesi; CMV antijenlerinin uygun klinik materyallerde görüntülenmesi gibi durumlar, yöntemin karakteristik uygulama alanlarıdır.
Sık kavramsal hatalar ve dikkat edilmesi gerekenler
- Renk/spektrum karışıklığı: FITC’nin mavi değil, yeşil emisyon verdiği; TRITC’nin ise yeşil değil, turuncu-kırmızı emisyon bölgesinde olduğu hatırlanmalıdır.
- “Pozitif = var, negatif = yok” indirgemesi: Düşük yükte antijen, hatalı örnekleme veya yoğun oto-floresans gibi etmenler yalancı negatif/pozitif sonuçlara yol açabilir; bağlam dışı yorum yanlıştır.
- Tek testle kesin tanı beklentisi: İmmünfloresans güçlü bir gösterim aracıdır; kesin etiyolojik sınıflama ve epidemiyolojik izlem çoğu zaman ilave doğrulamalar gerektirir.
Keşif
1940’ların Bilim Dünyası: Savaş Gölgesinde Araştırma
İkinci Dünya Savaşı’nın ortasında, bilim dünyası çift yönlü bir atmosferdeydi: bir yanda savaşın getirdiği kısıtlamalar, diğer yanda ise tıpta hızlı ilerlemeler. Enfeksiyon hastalıkları, özellikle de bakteriyel ve viral etkenlerin hızlı tespiti, askeri ve sivil sağlık açısından hayati önemdeydi.
İşte bu dönemde, Albert H. Coons adlı genç bir patolog, Harvard Tıp Fakültesi’nde bir deney hayali kuruyordu: “Peki ya antikorları görünür kılabilsek? Onları doğrudan gözümüzle seçebilsek?”
O zamana kadar antijen–antikor bağlanması yalnızca dolaylı testlerle (çökelme, aglütinasyon) saptanabiliyordu; bu da zaman alıyor ve hücre içi lokalizasyonu gösteremiyordu.
1941 – Fikirden Deneye
Coons, Harvard’da çalışırken kimyacı Hugh J. Creech ile işbirliği yaptı. Amacı, antikor moleküllerine “ışık saçan” bir işaret takmaktı.
O dönemde “florokrom” olarak en kolay bulunabilen maddelerden biri fluorescein izotiyosiyanat (FITC) idi. Creech, FITC’yi antikorların amino gruplarına kovalent bağlamayı başardı — bu, kimyasal olarak riskli ama teorik olarak mümkün bir adımdı.
Kritik nokta: Bağlanan boyanın antikorun antijen tanıma bölgesini (paratop) engellememesi gerekiyordu. İlk denemelerde boya yüklemesi fazla olunca antikorlar işlevini yitiriyordu; doz ayarı ve arıtma teknikleri bu nedenle geliştirildi.
1942 – İlk Başarı
Coons ve ekibi, FITC ile işaretlenmiş antikorları fare dokularına uyguladı. Mikroskop altında, koyu alanın içinden aniden parlak yeşil desenler ortaya çıkıyordu. Bu, tarihte ilk kez, özgül antijen–antikor reaksiyonunun doğrudan optik olarak görülmesiydi.
Bu buluş, 1942’de Proceedings of the Society for Experimental Biology and Medicine’da yayımlandı. Yönteme “fluorescent antibody technique” adını verdiler.
1950’ler – Klinik Tanıya Giriş
Savaş sonrası dönemde immünfloresans, patoloji laboratuvarlarında hızla ilgi gördü. İlk uygulama alanları arasında:
- Bakteri tespiti (özellikle Streptococcus, Treponema pallidum)
- Viral antijen lokalizasyonu (örn. kuduz virüsü, grip)
- Hastalık paternlerinin gösterilmesi (örn. lupus nefritinde immün kompleksler)
Bu yıllarda “doğrudan immünfloresans” yaygınlaşırken, 1950’lerin sonlarında dolaylı yöntem geliştirildi. Bu teknik, sekonder florokromlu antikorlar sayesinde sinyalin kuvvetlenmesini sağladı ve tek konjugatla çok sayıda test yapabilmeyi mümkün kıldı.
1960–1970’ler – Spektrumun Genişlemesi
Florokrom çeşitliliği arttı:
- TRITC (tetrametilrhodamin izotiyosiyanat) → turuncu-kırmızı emisyon
- Texas Red, AMCA, ve daha sofistike boyalar
Mikroskop teknolojisi de paralel gelişti: epifloresan sistemler, optik filtre setleri, çoklu kanal görüntüleme. Bu dönemde immünfloresans, histopatoloji ve virolojide altın standartlardan biri hâline geldi.
1980’ler – Otoimmün Serolojide Devrim
HEp-2 hücreleri ile antinükleer antikor (ANA) testleri, nötrofiller ile ANCA testleri gibi otoimmün hastalık paternleri tanımlandı.
Bu sayede immünfloresans yalnızca “var/yok” cevabı veren bir teknik olmaktan çıkıp patern analizine dayalı tanısal ipuçları sunan bir yöntem oldu.
Günümüz – Dijitalleşme ve Çoklu Etiketleme
Modern immünfloresans, konfokal mikroskopi, spektral ayrıştırma, dijital arşivleme ve görüntü analizi ile birleşerek neredeyse üç boyutlu moleküler haritalar çıkarabilir hâle geldi. Coons’un 1940’lardaki hayali, bugün çoklu florokromlu, yüksek çözünürlüklü, dakikalar içinde sonuç veren sistemlere evrildi.
İleri Okuma
- Coons, A.H., Creech, H.J., Jones, R.N. (1941). Immunological properties of an antibody containing a fluorescent group. Proceedings of the Society for Experimental Biology and Medicine, 47(2), 200–202.
- Coons, A.H., Creech, H.J. (1942). Fluorescent antibodies for the localization of antigens. Journal of Immunology, 45(3), 159–170.
- Riggs, J.L., Seiwald, R.J., Burckhalter, J.H., Downs, C.M., Metcalf, T.G. (1958). Isothiocyanate compounds as fluorescent labeling agents for immune serum. American Journal of Pathology, 34(6), 1081–1097.
- Weller, T.H., Coons, A.H. (1954). Fluorescent antibody studies with agents of varicella and herpes zoster propagated in vitro. Proceedings of the Society for Experimental Biology and Medicine, 86(4), 789–794.
- Goldman, M. (1968). Fluorescent antibody methods. Academic Press, New York.
- Wold, L.J., Tenover, F.C., Giger, O., Swenson, J.M., Thornsberry, C. (1988). Application of direct and indirect immunofluorescence to the identification of bacteria in clinical specimens. Clinical Microbiology Reviews, 1(1), 82–101.
- Mason, D.Y., Cordell, J.L., Abdulaziz, Z. (1991). Immunofluorescence techniques in histopathology: principles and practice. Histopathology, 19(1), 1–11.
- Hermanson, G.T. (2013). Bioconjugate Techniques (3rd ed.). Academic Press, London.

Yorum yazabilmek için oturum açmalısınız.