Ketamin, modern tıbbın hem en kullanışlı hem de en tartışmalı moleküllerinden biri olarak, anesteziyoloji, acil tıp, psikiyatri ve nörobilim tarihinin kesişim noktasında yer alır.
İçindekiler
1. Etimoloji ve Tarihsel Gelişim
1.1. İsim kökeni
“Ketamin” adı, molekülün yapısal özelliklerini yansıtan üç unsuru birleştirir:
- “Keto–”: Molekülde yer alan keton fonksiyonel grubuna gönderme yapar (siklohekzanon iskeleti).
- “–amin”: Moleküldeki sekonder amin yapısını ifade eder.
- “–in” son eki: Pek çok ilaçta olduğu gibi (morfin, kokain, lidokain) farmasötik isimlendirmede sık kullanılan, belirgin bir anlam taşımayan ama “etkin madde” iması olan bir ektir.
Dolayısıyla “ketamin” ismi, kelime kökeni açısından “keton içeren amin” fikrini kimyasal düzeyde doğrudan yansıtır.
1.2. Tarihsel bağlam
- 1950’ler–1960’lar: Fensiklidin (PCP) güçlü anestetik ve analjezik etkileri nedeniyle araştırılır, ancak ağır ve uzun süreli psikotomimetik etkileri nedeniyle klinik kullanım için fazla tehlikeli bulunur.
- 1962 civarı: PCP türevleri üzerinde çalışan araştırmacılar, daha güvenli ve daha kısa etkili bir analog arayışı içinde 2-(o-klorofenil)-2-metilaminosiklohekzanon türevlerini sentezler; bunlar arasında ketamin, görece daha iyi tolere edilen bir aday olarak öne çıkar.
- 1966: Ketamin için ilk klinik çalışmalar; insanlar üzerinde anestezik olarak denenmeye başlar.
- 1969: Enjeksiyon çözeltisi formu, anestezik olarak resmi onay alır. Ticari olarak özellikle Ketalar® adıyla bilinir.
- 1970’ler–1990’lar:
- Savaş ve afet bölgelerinde, “solunumu baskılamayan, kan basıncını düşürmeyen, damar yolu bulmanın zor olduğu koşullarda intramüsküler uygulanabilen anestezik” olarak özellikle tercih edilir.
- Aynı dönemde, psikodellik ve “disosiyatif” deneyimlere ilgi gösteren topluluklar içinde, ketaminin psikotropik özellikleri keşfedilir ve eğlence amaçlı kullanımı yaygınlaşır.
- 1990’lar:
- S-enantiomer (esketamin) saflaştırılır ve S-ketamin preparatları (ör. Ketanest S®) klinik kullanıma girer.
- Aynı dönemde, ketaminin nörobiyolojik olarak NMDA reseptör antagonizması üzerinden “glutamat hipotezi” ve depresyon patofizyolojisi ile ilişkisi giderek daha fazla tartışılmaya başlanır.
- 2000’ler sonrası: Düşük doz ketaminin hızlı antidepresan etkisine ilişkin çalışmalar, özellikle tedaviye dirençli depresyon alanında paradigmayı değiştiren bulgular sunar.
- 2019: Esketamin nazal sprey formu, tedaviye dirençli majör depresyonun tedavisi için onaylanır; ketamin, anesteziden bağımsız olarak resmi ruhsatlı bir psikotrop/antidepresan endikasyona kavuşmuş olur.
Bu tarihsel çizgi, ketamini önce “saha şartlarına uygun, hemodinamik açıdan ayrıksı bir anestezik”, ardından “disosiyatif parti uyuşturucusu”, en son da “hızlı etkili antidepresan” olarak farklı anlatı evrenlerine yerleştirmiştir.
2. Kimyasal Yapı, Stereokimya ve Fiziksel Özellikler
2.1. Temel kimyasal özellikler
- Molekül formülü: C₁₃H₁₆ClNO
- Molekül ağırlığı (Mr): 237.7 g/mol
- Yapı:
- Siklohekzanon iskeleti üzerinde,
- o-klorofenil grubu
- ve metilamin yan zinciri taşıyan siklik bir keton türevi.
- Fonksiyonel gruplar:
- Bir keton fonksiyonel grubu (–C=O)
- Bir sekonder amin (–NH–)
Bu iki grup, hem lipofilisiteyi hem de reseptör bağlanma karakterini belirleyen temel öğelerdir.
2.2. Kiralite ve enantiyomerler
Ketamin kiral bir moleküldür; asimetrik karbonu nedeniyle iki enantiyomer biçiminde bulunabilir:
- S-(+)-ketamin (esketamin)
- R-(–)-ketamin (arketamin)
Klinikte uzun yıllar boyunca rasemik karışım (R/S 1:1) kullanılmıştır. Daha sonra:
- S-ketamin (esketamin) için:
- Daha yüksek anestezik ve analjezik güç
- Bazı çalışmalarda nispeten daha düşük psikotomimetik potansiyel
rapor edilmiştir.
- R-ketamin için:
- Özellikle antidepresan etkiler açısından bazı deneysel çalışmalarda farklı ve potansiyel olarak daha uzun süreli etki profilleri tartışılmaktadır; fakat klinik uygulamada ana vurgu hâlen esketamin üzerindedir.
Ticari preparatlar çoğunlukla:
- Ketamin hidroklorür (rasemik)
- Esketamin hidroklorür (S-enantiomer)
şeklinde, enjeksiyonluk çözelti için suda kolay çözünen, beyaz kristal tozlar halinde formüle edilir.
2.3. Fensiklidin ile yapısal akrabalık
Ketamin, kimyasal olarak fensiklidin (PCP) türevidir. Bu akrabalık:
- Nöronal NMDA reseptör kanalındaki PCP bağlanma bölgesi ile etkileşimini açıklar.
- Disosiyatif ve psikotomimetik etkilerle yapısal düzeyde paralellik kurma imkânı verir.
Ayrıca ketaminin analjezik karakteri, tarihsel olarak sentetik opioidler (örneğin pethidin) ile bazı farmakolojik analojiler üzerinden de tartışılmıştır; doğrudan opioid olmasa da opioid reseptörleriyle zayıf agonist etkileşimi bu tarihsel bağlamla uyumludur.
3. Farmakodinamik: Etki Mekanizması ve Sistem Düzeyindeki Sonuçlar
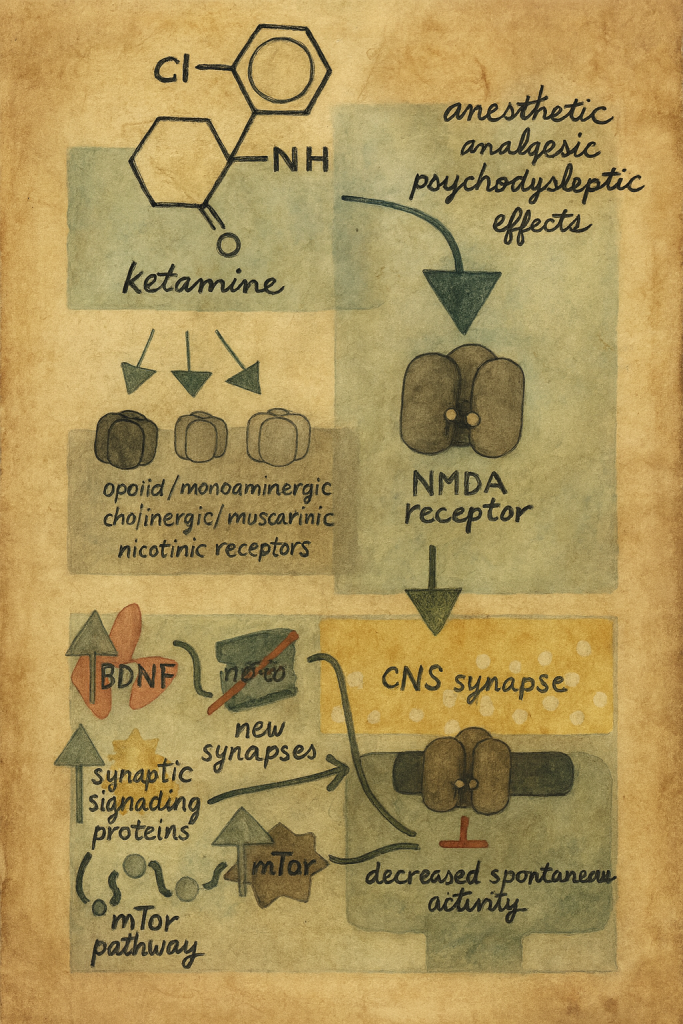
Ketamin, klasik anlamda “saf” bir ilaç olmaktan çok, multimodal etki profiline sahip bir nörofarmakolojik araçtır. En belirgin ve en iyi tanımlanmış etkisi, glutamat sistemi üzerinden, özellikle NMDA reseptörüne yönelik antagonizmadır; ancak bununla sınırlı değildir.
3.1. NMDA reseptör antagonizması
- Glutamat, MSS’de başlıca uyarıcı nörotransmitterdir.
- NMDA reseptörü, öğrenme, bellek, sinaptik plastisite ve nöronal gelişim süreçlerinde kritik rol oynar.
- Ketamin:
- NMDA reseptörünün iyon kanalının içine, PCP bağlanma bölgesine non-kompetitif antagonist olarak bağlanır.
- Kanal içi blok, Ca²⁺ girişini azaltır ve buna bağlı hücre içi sinyal yolları baskılanır.
Klinik düzeyde bu durum:
- Bilinç içeriğinin organizasyonunda bozulma
- Algı ve beden şeması ayrışması (disosiyasyon)
- Ağrı ile ilgili afferent uyarıların santral işleminde kesinti
olarak kendini gösterir.
3.2. Diğer reseptör ve sistemlerle etkileşim
Ketaminin etkileri yalnızca NMDA blokajı ile açıklanamaz; molekül, çok sayıda ek hedefle etkileşir:
- Opioid reseptörleri
- μ, κ ve δ reseptörlerinde zayıf agonist etki bildirilmiştir.
- Analjezik bileşenin bir kısmı bu yolla desteklenebilir.
- GABAerjik sistem
- GABA-A reseptörlerine belirli bir afinitesi olduğu, GABAerjik inhibisyonu dolaylı yollardan modüle ettiği düşünülür.
- Diğer glutamat reseptörleri
- AMPA ve kainat reseptörleriyle dolaylı etkileşimler, özellikle antidepresan etki için önemlidir; NMDA blokajı sonrası glutamat nörotransmisyonunun yeniden dengelenmesi ve AMPA aracılı sinyal yollarının güçlenmesi, hızlı sinaptik plastisite ile ilişkilendirilir.
- Kolinerjik sistem
- NMDA reseptörüyle bağlantılı asetilkolin salınımını azaltarak kolinerjik transmisyonu etkiler.
- Bu durum, bilişsel ve psikotrop etkilerin bir kısmına katkıda bulunabilir.
- Katekolaminerjik sistem
- Norepinefrin ve dopaminin sinaptik aralıktaki geri alımını periferik düzeyde inhibe eder.
- Hem endojen hem de eksojen katekolaminlerin etkisini artırır.
- Bu, sempatomimetik kardiyovasküler yanıtta belirleyici rol oynar.
- Diğer hedefler
- Voltaj kapılı Na⁺ kanalları: lokal anestezik benzeri membran stabilizasyonu
- HCN kanalları ve diğer iyon kanalları: uyarılabilirlik ve ritm üzerinde nüanslı etkiler
Bu çoklu hedef profili, ketamini “disosiyatif anestezik”, “analjezik”, “hipnotik”, “antikonvülsan” ve “bronkodilatör” özelliklerin birleştiği bir farmakolojik “düğüme” çevirir.
3.3. Disosiyatif anestezi kavramı
Ketaminin en karakteristik klinik etki modeli, “disosiyatif anestezi” olarak adlandırılır. Bu durumda:
- Hasta dış uyaranlara yanıt vermez;
- Ağrı iletimi ve algısı belirgin ölçüde kesintiye uğrar;
- Bilinç içeriği, özellikle beden algısı ve çevresel bağlamdan ayrışmış (disosiye) bir hal alır;
- Bununla birlikte:
- Koruyucu refleksler (yutma, öksürme vb.) genellikle büyük ölçüde korunur,
- Spontan solunum çoğu durumda sürer.
Nörofizyolojik olarak:
- Talamokortikal sistem baskılanır: Duyu entegrasyonu ve bilinçli algı zayıflar.
- Limbik sistem (özellikle hipokampus ve amigdala ağları) görece aktive olur: duygusal, imgesel, bazen de yoğun içsel deneyimler ortaya çıkar.
Bu çift yönlü etki, ketamine özgü rüya benzeri, halüsinatuvar ve bedenden ayrışma (out-of-body) deneyimlerinin temelini oluşturur.
3.4. Kardiyovasküler ve solunum sistemi üzerindeki etkiler
Ketamin, hipnotik ajanlar arasında benzersiz bir hemodinamik profile sahiptir:
- Sempatik sinir sistemini aktive eder ve katekolamin geri alımını inhibe eder:
- Kalp hızı ↑
- Kan basıncı (sistolik ve diyastolik) ↑
- Kardiyak output ↑
- Bu özellikler, hipovolemik, travmalı veya hemodinamik olarak instabil hastalarda diğer anesteziklere kıyasla daha az kan basıncı düşüşü anlamına gelir.
Solunum açısından:
- Ketamin, klasik dozlarda belirgin solunum depresyonu yapmayan tek hipnotiklerden biridir.
- Spontan solunum genellikle korunur, üst hava yolu refleksleri daha az baskılanır.
- Ayrıca bronkodilatör etkisi nedeniyle ağır bronkospazm ve status astmatikus gibi durumlarda entübasyon ve ventilasyon stratejilerine eşlik eden bir ilaç olarak değerlidir.
Bu profil, ketamini özellikle acil tıpta, sahada ve pediatride önemli kılar, ancak aynı hemodinamik uyarı, koroner arter hastalığı ve miyokardiyal iskemi riski yüksek hastalarda dezavantaja döner.
4. Farmakokinetik Özellikler
4.1. Uygulama yolları
Ketamin, çoklu uygulama yolları ile dikkat çeker:
- İntravenöz (IV):
- Anestezi indüksiyonu için en klasik yol.
- Etki başlangıcı genellikle saniyeler–1 dakika içinde.
- İntramüsküler (IM):
- Damar yolu zor veya imkânsız olduğunda, özellikle pediatri, veterinerlik ve sahada.
- Etki başlangıcı 3–5 dakika.
- Nazal (IN):
- Özellikle esketamin nazal sprey formu, tedaviye dirençli depresyon için.
- Hızlı sistemik absorpsiyon.
- Oral / sublingual / bukal:
- Biyoyararlanım, ilk geçiş metabolizması nedeniyle IV’ye göre daha düşüktür; ancak kronik ağrı ve bazı psikiyatrik protokollerde araştırma ve deneysel uygulamalar mevcuttur.
- Diğer yollar (rektal, SC): daha sınırlı ve seçilmiş durumlarda.
4.2. Dağılım, metabolizma ve eliminasyon
- Dağılım:
- Yüksek lipofilisitesi nedeniyle, beyne hızlı geçer.
- Kan-beyin bariyerini kolay aşar; bu, hızlı indüksiyonun temel nedenidir.
- Metabolizma:
- Başlıca karaciğerde sitokrom P450 enzimleri tarafından metabolize edilir.
- Aktif metabolitlerinden norketamin, hem anestezik hem de antidepresan etkiler açısından belirli katkılar sağlayabilir.
- Eliminasyon:
- Metabolitler ağırlıklı olarak böbrekler yoluyla atılır.
- Etkinin sonlanması, büyük ölçüde hızlı dağılım (redistribution) ve daha sonra metabolik klirense bağlıdır.
Klinik olarak, anestezik doz uygulamasından sonra:
- Anestezik faz dakikalar–onlarca dakika içinde sonlanır,
- Ancak psikotrop etkilerin (rüyalar, halüsinasyonlar, dezoryantasyon) çözülmesi ve “uyanma reaksiyonları” daha uzun sürebilir.
5. Klinik Kullanım Alanları
5.1. Anestezi ve sedasyon
Ketamin, anestezide:
- Genel anestezi indüksiyonu ve
- Anestezinin sürdürülmesi için kullanılır.
Özellikle:
- Hemodinamik instabilite riski olan, hipovolemik veya travmalı hastalar
- Spontan solunumun korunmasının istendiği durumlar
- Pediyatrik hastalarda kısa girişimler
- Veteriner anestezisinde (örneğin ksylazin gibi sedatiflerle kombinasyon halinde, “Hellabrunn karışımı” vb.)
gibi bağlamlarda tercih edilir.
Klinisyen jargonunda ketamin, bazen karakteristik endikasyonlarını özetlemek için “çocuklar, kediler, felaketler” için anestezik olarak anılır; bu ifade, pediatri, veterinerlik ve afet/kriz ortamlarındaki değerine vurgu yapar.
5.2. Analjezi ve acil tıp
Düşük–orta dozlarda ketamin, güçlü bir analjezik olarak:
- Travma hastasında ağrı kontrolü
- Yanık pansumanları gibi ağrılı prosedürler
- Acil servislerde kısa süreli cerrahi girişimler
- Kronik ağrı sendromlarının bazı tedavi protokollerinde (örneğin refrakter nöropatik ağrı)
kullanılabilir.
Acil tıpta benzersiz özelliği:
- Hem dolaşım stabilizasyonu (semptomatik hipotansiyonla mücadele)
- Hem de analjezik/anestezik etkiyi aynı anda sağlayabilmesidir.
5.3. Status astmatikus ve bronkospazm
Ketaminin bronkodilatör etkisi ve solunumu belirgin baskılamaması:
- Konvansiyonel tedavilere dirençli status astmatikus olgularında
- Ağır bronkospazmın eşlik ettiği kritik solunum yetmezliği tablolarında
özellikle entübasyon ve mekanik ventilasyon stratejilerine eşlik eden, koruyucu ve köprüleyici bir ajan olarak değerlendirilmesine yol açmıştır.
5.4. Psikiyatri: Tedaviye dirençli depresyon
Son yıllarda ketamin, psikiyatride özellikle tedaviye dirençli majör depresyon alanında yeni bir paradigmanın merkezine yerleşmiştir.
5.4.1. Hızlı antidepresan etki
Klasik antidepresanlar:
- Serotonin, norepinefrin veya dopamin geri alımını veya metabolizmasını hedef alır
- Etkilerinin tam ortaya çıkması çoğu zaman haftalar alır.
Ketamin ise:
- Tek bir düşük doz uygulamadan sonra bile saatler içinde belirgin ruh hali düzelmesi sağlayabilir.
- Etkisi genellikle 1–2 saat içinde başlar, günler seviyesinde sürebilir; sürdürülebilirlik için tekrarlayan doz protokolleri araştırılmaktadır.
5.4.2. Olası mekanizmalar
Antidepresan etki için çeşitli mekanizmalar tartışılır:
- NMDA reseptör blokajına bağlı olarak glutamat salınım dinamiklerinin değişmesi
- AMPA reseptör aracılı sinyal yollarının göreli güçlenmesi
- Sinaptik plastisiteyi artıran sinyal kaskadlarının (ör. BDNF, mTOR) aktive olması
- Prefrontal korteks–limbik ağlar arasındaki patolojik bağlantısallığın yeniden düzenlenmesi
Bu etkiler, yalnızca semptomatik bir sedasyon değil, beyindeki ağ seviyesinde “yeniden ayar (reset)” benzeri, hızlı ama karmaşık bir yeniden yapılanma fikrini gündeme getirir.
5.4.3. Esketamin nazal sprey
- S-enantiomer olan esketamin, nazal sprey formunda tedaviye dirençli depresyon endikasyonu için ruhsatlandırılmıştır.
- Genellikle bir oral antidepresan ile kombinasyon halinde, kontrollü klinik ortamda, belirlenmiş protokoller çerçevesinde uygulanır.
- Uygulama sırasında hemodinamik ve psikiyatrik yan etkiler açısından izlem gerekir.
6. Yan Etkiler, İstenmeyen Etkiler ve Uyanma Reaksiyonları
6.1. Kardiyovasküler yan etkiler
- Taşikardi (hızlı kalp atımı)
- Arteriyel hipertansiyon
- Artmış kardiyak iş yükü ve oksijen tüketimi
Bu profile göre:
- Hipovolemik veya hipotansif hastalarda avantaj
- Belirgin koroner arter hastalığı, ağır miyokardiyal iskemi veya dekompanse kalp yetmezliği olan hastalarda ise risk söz konusudur; bu grupta ketaminden kaçınılması veya çok dikkatli kullanılması gerekir.
6.2. Psikotrop yan etkiler
Ketaminin en sık ve en belirgin yan etkileri, psikotrop niteliktedir:
- Psödohalüsinasyonlar, canlı rüyalar
- Dezoryantasyon, “benlik” sınırlarında çözülme hissi
- Uyanma döneminde kabuslar, korku, panik, “bad trip” olarak adlandırılan yoğun kaygı ve tehdit algıları
Bilincin çözülme ve yeniden örgütlenme süreci, bazı hastalar tarafından son derece rahatsız edici, bazıları tarafından ise “özgürleştirici” ve “transandantal” olarak betimlenir. Bu geniş yelpaze, kişilik özellikleri, beklenti, çevresel bağlam ve eşlik eden sedatif/anksiyolitik ilaçlara bağlı olarak değişir.
Benzodiazepin eklenmesi:
- Uyanma dönemindeki kabus ve halüsinasyon sıklığını azaltabilir.
- Psikotrop yükü tamponlayabilir.
Ayrıca:
- Hastayı önceden bilgilendirmek,
- Psikolojik olarak eğitimli personelin eşliğinde, güvenli bir çevrede uyanma sürecini yönetmek,
yan etkilerin subjektif şiddetini ve olası travmatize edici etkilerini azaltmaya yardımcı olur.
6.3. Diğer yan etkiler
- Bulantı, kusma
- Hipersalivasyon (özellikle yüksek dozlarda)
- Nistagmus, diplopi
- Nadiren solunum depresyonu (özellikle çok yüksek dozlar veya diğer depresanlarla birlikte kullanımda)
- Uzun süreli veya yüksek doz kullanımda mesane ve üriner sistemle ilgili bazı toksisite riskleri (eğlence amaçlı kronik kullanıcılarda daha belirgin)
7. İlaç Etkileşimleri ve Kontrendikasyonlar
7.1. Temel kontrendikasyonlar (prensip düzeyinde)
- Belirgin koroner kalp hastalığı, yeni miyokard enfarktüsü geçirmiş hastalar
- Kontrolsüz ağır hipertansiyon
- Artmış intrakraniyal basınç söz konusu olan bazı nörolojik tablolar (duruma göre değerlendirme gerekir)
- Şiddetli psikoz öyküsü veya ağır psikotik bozukluklar (psikotrop etkiyi ağırlaştırma potansiyeli nedeniyle dikkatli değerlendirme gerekir)
Bu noktalar genel prensip düzeyinde olup, bireysel klinik kararlar ilgili uzman hekimler tarafından verilmelidir.
7.2. İlaç etkileşimlerine genel bakış
- Diğer santral sinir sistemi depresanları (benzodiazepinler, opioidler, alkol, barbitüratlar) ile:
- Sedasyon ve solunum depresyonu riski artabilir.
- Sempatomimetikler (adrenalin, noradrenalin, bazı dekongestanlar):
- Ketaminin sempatomimetik etkisiyle sinerji sonucu aşırı hipertansiyon, taşikardi riski.
- Antihipertansifler:
- Ketaminin kan basıncını artırıcı etkisi, antihipertansif tedavinin etkinliğini geçici olarak azaltabilir.
8. Kötüye Kullanım, Disosiyatif Parti Uyuşturucusu ve Psikoterapötik Bağlamlar
8.1. Eğlence amaçlı kullanım
Ketamin, düşük–orta dozlarda güçlü disosiyatif ve algı değiştirici etkileri nedeniyle pek çok ülkede parti uyuşturucusu olarak yayılmıştır. Sık kullanılan sahne isimleri arasında:
- K, Keta, Ket, Kitty, Special K, Vitamin K, Kate vb. yer alır.
Kullanıcılar, ketamin deneyimini sık sık:
- Zaman ve mekân algısının çözülmesi
- Beden sınırlarının kaybı
- Tünel vizyonu, “ölüme yakın deneyim” benzeri sahneler
- İçsel imgelerin olağandışı yoğunluğu
ile tarif ederler.
Özellikle yüksek dozlarda yaşanan, yoğun dezoryantasyon ve ölüm korkusuyla birlikte seyreden olumsuz deneyimler, kültürel terminolojide “korku gezisi” veya “bad trip” olarak tanımlanır. Bazı kullanıcılar için bu korku ve sınır deneyimi aranır hâle gelirken, diğerleri için ağır ve travmatize edici olabilir.
8.2. “K-hole” fenomeni
İngilizce literatürde sık kullanılan “K-hole” terimi, ketaminin yüksek dozlarında yaşanan:
- Bedenle bağın dramatik azalması
- Dış gerçeklikle ilişki kopuşu
- Zamanın durması veya sonsuz uzaması hissi
- Kimlik sınırlarının çözünmesi
gibi deneyimlere atıfta bulunur. Bu durum bir yandan yoğun merak uyandıran, diğer yandan ciddi riskler barındıran bir bilinç durumu olarak tanımlanır.
8.3. Psikoterapötik ve deneysel bağlamlar
Ketamin, yalnızca “parti” ortamlarında değil, aynı zamanda:
- Gözetimli, yapılandırılmış psikoterapötik seanslar
- Anlam arayışı, ego çözülmesi ve yeniden yapılanma temaları etrafında tasarlanmış psikedelik destekli terapiler
gibi bağlamlarda da araştırılmış ve kullanılmaktadır.
Bu çerçevede:
- Disosiyatif deneyim, benlik sınırlarının gevşemesi ve duygusal materyale yeni açılma biçimleri, terapötik süreçte “pencere” yaratma potansiyeli taşır.
- Ancak aynı zamanda, ketaminin kötüye kullanım riski, bağımlılık potansiyeli, psikotrop etkilerin öngörülemezliği ve tıbbi–etik çerçevelerin gerekliliği, bu alanı yüksek derecede uzmanlık, protokollü çalışma ve düzenleyici çerçeveler içinde tutmayı zorunlu kılar.
9. Nörobilimsel ve Evrimsel Perspektif (Evrimsel/Evrimsel-Nörobiyolojik Çerçeve)
Ketamin, doğrudan “evrimsel” bir molekül olmamakla birlikte, evrimsel nörobiyoloji perspektifiyle bakıldığında:
- Glutamat sistemi, evrimsel olarak en eski ve en yaygın uyarıcı nörotransmisyon mekanizmalarından biridir.
- NMDA reseptörleri ve ilişkili kalsiyum sinyali, sinaptik plastisite, öğrenme ve bellek mekanizmalarının çok temel bileşenleri olarak, türler arası geniş bir korunum gösterir.
- Ketaminin bu kadar derin bilişsel, algısal ve duygusal etkiler yaratması, tam da bu “temel” sinaptik mekanizmalara müdahale etmesinden kaynaklanır.
Bu açıdan:
- Disosiyatif anestezi, yalnızca farmakolojik bir fenomen değil, **evrimsel olarak son derece korunaklı algı, beden şeması ve benlik temsili ağlarının geçici olarak “yeniden düzenlenmesi”**dir.
- Hızlı antidepresan etkisi, kronik stres ve depresyonun bozduğu sinaptik plastisite ve ağ örgütlenmesinin, kısa süreli ama güçlü bir nörokimyasal müdahale ile yeniden dengelenebileceğini göstermesi açısından, evrimsel nörobilim için de çarpıcı bir model sunar.
10. Genel Değerlendirme
Ketamin; kimyasal olarak PCP türevi bir sikloheksanon, farmakolojik olarak NMDA reseptör antagonisti, klinik olarak disosiyatif anestezik ve hızlı etkili antidepresan, sosyokültürel olarak ise hem “parti uyuşturucusu” hem de “bilinç değiştiren deneyim aracı” olarak çok katmanlı bir varlığa sahiptir.
Anestezide:
- Koruyucu refleksleri nispeten tümden ortadan kaldırmadan derin analjezi ve hipnoz sağlayabilmesi,
- Hemodinamik stabiliteyi (hatta artmış kan basıncı ve kalp atımı aracılığıyla) desteklemesi,
- Solunum depresyonunun klasik ajanlara göre daha az belirgin olması,
onu travma, pediatri, veterinerlik ve afet tıbbında vazgeçilmez kılar.
Psikiyatride:
- Tedaviye dirençli depresyonda hızlı etki gösterebilmesi,
- Glutamat sistemi ve sinaptik plastisite üzerinden yeni tedavi paradigmalara kapı aralaması,
ketamini geleceğin nöropsikiyatrik tedavilerinin kavşağına yerleştirmiştir.
Buna karşın:
- Kötüye kullanım riski,
- Psikotrop yan etkilerin öngörülemezliği,
- Kardiyovasküler yük ve belirli hasta gruplarında risk artışı,
- Uzun dönem güvenlik verilerinin ve bağımlılık riskinin dikkatle izlenmesi gerekliliği,
ketaminin, yalnızca tıbbi denetim altında, iyi tanımlanmış protokoller çerçevesinde kullanılmasını zorunlu kılar.
Keşif
Ketaminin hikâyesi, modern tıbbın laboratuvarlarından savaş alanlarına, yeraltı kulüplerinden psikiyatri kliniklerine uzanan, neredeyse bir roman gibi okunabilecek kadar çok katmanlıdır. Bu hikâyeyi, kimyasal “ata molekülü” fensiklidinden başlayarak, Calvin L. Stevens’ın Detroit’teki laboratuvarına, Edward Domino’nun Michigan’daki deneylerine, Vietnam’daki sahra hastanelerine, 1990’ların nörobilim laboratuvarlarına ve günümüzün ketamin kliniklerine kadar kronolojik ve sürükleyici bir anlatı halinde takip edebiliriz.
1. Gölgede Kalan Ata Molekül: Fensiklidin (PCP) ve 1950’ler
1950’lerin ortasında, ABD’de Parke-Davis ilaç firmasının araştırma laboratuvarlarında, o dönem için son derece cazip görünen bir bileşik sentezlendi: fensiklidin, yani PCP. O yılların hayali, barbitüratların solunum depresyonu ve dolaşım üzerindeki olumsuz etkilerini taşımayan, kısa etkili, güvenli bir intravenöz anestezik bulmaktı. PCP ilk denemelerde adeta mucize gibi görünüyordu:
- Solunumu ve dolaşımı görece az etkiliyor,
- Anesteziyi derin ve güçlü şekilde sağlıyor,
- Kas tonusunu ve refleksleri ilginç bir biçimde koruyordu.
Ancak kısa süre içinde karanlık yüzü ortaya çıktı. Ameliyat sonrası hastalar:
- Günlerce süren psikotik epizodlar,
- Şizofreniye benzer paranoid hezeyanlar,
- Yoğun halüsinasyonlar ve ağır dezoryantasyon
yaşıyorlardı. PCP’nin bu uzun ve şiddetli psikotomimetik etkileri, onu “ideal anestezik” adaylığından hızla düşürdü. Klinikler, dolaşımı koruyan ama zihin dünyasını altüst eden bu molekülden ürkerken, Parke-Davis’teki farmakologlar için yeni bir araştırma sorusu belirdi:
“PCP’nin hemodinamik avantajlarını koruyup, psikotik kabuslarını törpüleyen ‘daha yumuşak’ bir kardeş molekül yaratılabilir mi?”
Ketamin, işte bu soruya verilen kimyasal bir cevaptır.
2. Detroit, 1962: Calvin L. Stevens ve CI-581’in Doğumu
1960’ların başında Parke-Davis, Detroit’teki Wayne State University ile işbirliği yaparak, yeni PCP türevleri geliştirme görevini organik kimyager Calvin L. Stevens’a verdi. Stevens, PCP iskeletini daha kısa etkili, daha öngörülebilir ve daha iyi tolere edilebilir hale getirmek için sistematik değişiklikler yapmaya koyuldu.
Nisan 1962’de, siklohekzanon iskeleti üzerine:
- o-klorofenil grubu
- metilamin yan zinciri
eklenmiş yeni bir molekül sentezledi. Bu bileşiğe laboratuvar kodu olarak CI-581 adı verildi. Kimyasal olarak:
- Fensiklidinle akraba,
- Ama daha küçük,
- Daha “kesik” ve daha kısa etkilere sahip olduğu düşünülen bir sikloheksanon türevi idi.
Hayvan deneylerinde CI-581:
- Belirgin analjezi ve anestezi,
- Görece korunmuş solunum ve dolaşım,
- PCP’ye göre çok daha kısa süren davranışsal anormallikler
ile dikkat çekti. Laboratuvar defterlerine, PCP’nin kaba ve uzun etkili darbelerine karşı daha zarif, daha kısa, ama hâlâ güçlü bir “disosiyatif darbe” olarak geçti.
O sırada kimse, bu küçük şişe içindeki berrak çözeltinin, yıllar sonra hem anestezi tarihini hem de depresyon tedavisini değiştireceğini bilmiyordu.
3. Michigan, 1964–1965: Edward F. Domino, Guenter Corssen ve “Disosiyatif Anestezi”
Parke-Davis, CI-581’i hayvan çalışmalarından insan klinik çalışmalarına taşımak için, Michigan Üniversitesi’nde çalışan klinik farmakolog Edward F. Domino ile temasa geçti. Domino’nun intravenöz anestezikler üzerine klinik deneyimi vardı, ancak anestezist değildi; bu nedenle Michigan Üniversitesi Anesteziyoloji Bölümü’nden Guenter Corssen ile işbirliği kurdu. Böylece CI-581’in insanlardaki ilk sistematik değerlendirmesi, Domino–Corssen ikilisinin elinde başladı.
1964 yazında Domino, önce kendi üzerinde düşük doz bir deneme yaptı; ardından sağlıklı gönüllü ve cerrahi hastalar üzerinde kontrollü uygulamalara geçildi. Elde edilen tablo, klasik anesteziklerden radikal biçimde farklıydı:
- Hastalar cerrahi uyarana yanıt vermiyor,
- Analjezi ve hareketsizlik yeterli düzeyde sağlanıyor,
- Solunum genellikle korunuyor,
- Hemodinamik yanıt çoğunlukla artmış kalp hızı ve kan basıncı şeklinde oluyordu.
Ancak EEG kayıtları ve hastaların ameliyat sonrası anlatıları, “sıradan narkoz”tan çok, garip bir kopukluk hâlini işaret ediyordu. Hastalar uyandıktan sonra deneyimlerini şöyle tarif ediyorlardı:
- “Sanki bedenim salondaydı ama ben başka bir yerdeydim.”
- “Rüya ile gerçek arası bir yerdeydim; duvarlar eriyordu.”
- “Zamanın akışı bozulmuş gibiydi; dakikalar mı saatler mi, anlayamadım.”
Domino, günün sonunda eve gidip yaşadıklarını eşi Toni Domino’ya anlattığında, deneyimlerin ortak noktasını “gerçeklikten ayrışma, bağlantının kopması” olarak özetledi. Rivayete göre Toni Domino, bu hâlin psikolojideki “dissociation” kavramına benzediğini söyleyerek, “Bu bir tür dissociative anesthesia olabilir” fikrini ortaya attı.
Bir yıl sonra, 1965’te yayınlanan klasik makalede Domino, Chodoff ve Corssen, CI-581’in ortaya çıkardığı bu benzersiz bilinç durumunu tanımlarken ilk kez “dissociative anesthetic” terimini kullandılar. Böylece ketaminin hem farmakolojik sınıflaması hem de sonraki on yılların terminolojisi şekillenmiş oldu.
4. 1966–1970: CI-581’den “Ketamine”e, Klinik Onay ve Ketalar®
1966’ya gelindiğinde Parke-Davis, artık CI-581 kod adını geride bırakmaya hazırdı. İnsanlarda ve veteriner hekimlikte kullanılmak üzere patente başvuruldu. Yeni ticari isim, molekülün yapısına doğrudan gönderme yapan bir birleşimdi:
- “Keto–”: keton fonksiyonel grubunu,
- “–amin”: amin fonksiyonel grubunu,
- “–e” son eki ise tıpkı kokain, prokain, lidokain gibi “aktif madde” havasını temsil ediyordu.
Böylece “ketamine” adı doğdu.
1960’ların sonuna doğru yapılan klinik çalışmalar, ketaminin:
- İntravenöz ve intramüsküler yoldan kolay uygulanabildiğini,
- Hipovolemik ve travmalı hastalarda kan basıncını desteklediğini,
- Solunumu barbitüratlar ve opioidler kadar baskılamadığını,
- Özellikle çocuklar ve hemodinamik olarak kırılgan hastalarda avantajlı olduğunu
gösterdi. Buna karşın ameliyat sonrası sık görülen halüsinasyonlar, kabuslar ve dezoryantasyon, ketamini anesteziyologlar için hem çekici hem de tedirgin edici bir ajan hâline getiriyordu.
1970 civarında ketamin; ABD’de ve diğer birçok ülkede, insan ve veteriner hekimliğinde kullanılan bir genel anestezik olarak resmî onay aldı. Parke-Davis’in ürünü Ketalar®, sarımsı etiketli küçük flakonlarıyla ameliyathanelerde, acil servislerde ve sahra hastanelerinde yerini aldı. Anestezi tarihi, tiopental ve halotan gibi klasiklerin yanına, yeni ve alışılmadık bir ismi eklemişti.
5. Vietnam Savaşı: Savaş Alanından “Special K” Efsanesine
1970’li yılların başı, ketaminin laboratuvar ve ameliyathanelerden çıkıp savaş alanına indiği dönemdi. Vietnam Savaşı sırasında ABD ordusunun sağlık birimleri için ketamin adeta biçilmiş kaftandı:
- Damar yolu açmanın zor olduğu kaotik koşullarda intramüsküler uygulanabiliyordu.
- Hızlı etki başlangıcı sayesinde ağır yaralı askerler kısa sürede sedasyon ve analjezi altına alınabiliyordu.
- Kardiyovasküler sistemi baskılamak yerine destekliyor, travmalı ve hipovolemik hastada kan basıncı ve kalp debisini korumaya yardımcı oluyordu.
- Solunumu görece az etkilediğinden, sahada solunum desteği sınırlı iken avantaj sağlıyordu.
Ancak savaş alanı, bir molekülün kaderini sadece tıpta değil, kültürde de belirleyen bir laboratuvar gibidir. Ketaminin disosiyatif ve psikedelik etkileri, kısa süre içinde askerler arasında konuşulmaya başlandı. Bedenden ayrılma hissi, tünel vizyonları, “ölüme yakın deneyim” benzeri sahneler, ilacın tıbbi bağlamın ötesinde de merak uyandırmasına yol açtı.
ABD argosunda ketamin için “Special K” lakabı yerleşti. Savaş sonrası yıllarda bu lakap, sivil uyuşturucu sahnesine taşındı. Kulüplerde, yeraltı partilerinde ve rave kültüründe ketamin, kokain ve amfetaminlerden farklı, “disosiyatif” bir yolculuk vaat eden madde olarak öne çıktı.
1990’larda Larry Clark’ın “Kids (Çocuklar)” filmi, 2000’de İngiliz grup Placebo’nun “Special K” şarkısı ve birçok film/dizi, ketamini popüler kültürün karanlık ama çekici motiflerinden biri hâline getirdi. Six Feet Under dizisinde Russell’ın Claire’e anlattığı “ketamine hole” deneyimi ya da Alman filmi **“Kammerflimmern”**deki ketamin kullanım sahneleri, bu disosiyatif boşluğu – K-Hole’u – sinematik bir metafora dönüştürdü.
Artık ketamin, aynı anda hem ameliyathanenin soğuk, floresan ışığında parlayan bir anestezik, hem de gece kulüplerinin stroboskop ışıkları altında dolaşan bir “parti uyuşturucusu” idi.
6. “Kabuslu Uyanışlar” ve S-Ketamin Arayışı
Ketamin klinikte ne kadar kullanışlıysa, uyanma dönemindeki psikotrop yan etkileri de o kadar rahatsız ediciydi. Yetişkin hastalar; ameliyat sonrası:
- Son derece canlı, bazen korkutucu rüyalar,
- Görsel-işitsel halüsinasyonlar,
- Kafa karışıklığı ve kimlik dezoryantasyonu
yaşayabiliyorlardı. Bu “uyanma reaksiyonları”, pek çok anestezistin ketamine temkinli yaklaşmasına yol açıyordu.
Farmakologlar, bu sorunu çözmek için molekülün stereokimyasal yapısına yöneldiler. Ketaminin bir rasemik karışım, yani eşit miktarda iki enantiyomer (ayna görüntülü izomer) – R-ketamin ve S-ketamin (esketamin) – karışımı olduğu biliniyordu. Soru şuydu:
“Bu iki enantiyomerin etkileri birbirinden farklıysa, acaba daha ‘temiz’ olanı seçip kullanmak mümkün mü?”
1990’ların ortalarına doğru yapılan çalışmalar, S-ketaminin:
- Anestezik ve analjezik gücünün rasemik karışımdan daha yüksek,
- Doz başına daha öngörülebilir,
- Bazı serilerde psikotomimetik yan etkilerinin görece daha hafif
olabileceğini düşündürdü. Bunun üzerine Almanya’da 1997’de S-ketamin (esketamin) ayrı bir ilaç olarak piyasaya sürüldü; Ketanest® ve Ketanest S® gibi preparatlar Avrupa anestezi pratiğinde yerini aldı.
Anestezistler, S-ketamini özellikle:
- Daha kontrollü hemodinamik profil,
- Güçlü analjezi,
- Bazı hastalarda daha tolere edilebilir uyanma deneyimi
nedeniyle tercih etmeye başladılar. Her ne kadar daha sonraki çalışmalar, rasemik ketaminle psikotrop yan etkiler arasındaki farkın her durumda dramatik olmadığını gösterse de, “daha rafine enantiyomer” fikri, ketaminin anestezideki ikinci evresini belirledi.
7. 1990’lardan 2000’lere: Model Psikozdan Hızlı Antidepresana
1990’lara gelindiğinde, ketaminin hikâyesi yeni bir istikamete yöneldi: nöropsikiyatri. Araştırmacılar, ketamini bu kez bir “tedavi ajanı” olarak değil, bir model madde olarak kullanmaya başladılar. Subanestezik dozlarda ketamin verilen sağlıklı gönüllülerde:
- Düşünce süreçlerinde dağılma,
- Kendilik ve çevre algısında bozulma,
- Zaman-mekân deneyiminde kayma,
- Bazen paranoid çağrışımlar
gibi fenomenler gözleniyordu. Bu deneyler, glutamat ve özellikle NMDA reseptörlerinin, şizofreni benzeri psikotik tabloların patofizyolojisinde rol oynayabileceği fikrini güçlendirdi. Ketamin, “glutamat/NMDA hipotezi”nin adeta canlı bir deneyi hâline geldi.
Ancak asıl büyük sürpriz, 2000’lerin başında ortaya çıktı. Tedaviye dirençli ağır depresyonu olan hastalara, çift-kör, plasebo kontrollü koşullarda düşük doz IV ketamin verildiğinde, sonuç beklenmedikti:
- Depresif duygu durum,
- Anhedoni,
- Hatta intihar düşünceleri
tek bir infüzyondan sonraki 24 saat içinde belirgin şekilde azalıyordu. Bu, klasik antidepresanların haftalar süren “etkiyi bekleme” dönemine radikal bir alternatif demekti.
Araştırmacılar, o ana kadar “problemli anestezik” ve “parti uyuşturucusu” olarak bilinen bir maddenin, en dirençli depresyon tablolarında dahi birkaç saat içinde klinik iyileşme sağlayabildiğini gördüklerinde, psikiyatri paradigmasında yeni bir sayfa açıldı. Ketamin artık üçüncü kimliğine bürünüyordu: hızlı etkili antidepresan.
8. 2010’lar: Glutamat Paradigması, Klinik Protokoller ve Esketamin Nazal Sprey
2010’lu yıllarda ketamin üzerine yapılan çalışmalar adeta patladı. Çok merkezli, kontrollü araştırmalar:
- Tedaviye dirençli unipolar depresyon,
- Bipolar depresyonun depresif atakları,
- Travma sonrası stres bozukluğu,
- Obsesif kompulsif bozukluk
gibi çeşitli psikiyatrik tablolar üzerinde ketaminin etkilerini inceledi. Birçok çalışmada:
- Tek bir IV ketamin infüzyonu sonrası saatler içinde başlayan,
- Birkaç günle sınırlı kalsa bile klinik açıdan anlamlı,
- Özellikle intihar düşüncesinde hızlı azalma sağlayan
yanıtlar rapor edildi. Tekrarlayan infüzyon protokolleriyle, bu etkinin haftalar, hatta bazı serilerde aylar düzeyinde sürdürülebileceği görüldü.
Bu arada S-ketamin (esketamin) bu kez anestezik değil, psikiyatrik ajan olarak yeniden sahneye çıktı. Enantiyomer saflaştırması ve nazal sprey formülasyonu, ayaktan tedaviye ve standartlaştırılmış dozlamaya uygun bir yol sundu. Büyük ölçekli randomize kontrollü çalışmalarla esketamin nazal sprey, tedaviye dirençli depresyonda:
- Bir oral antidepresana ek tedavi olarak,
- kontrollü klinik koşullarda,
- belirli gözlem süresi ve güvenlik protokolleriyle
değerlendirildi ve ruhsat aldı. 2019’da ABD ve Avrupa’da onaylanması, ketamin ailesini ilk kez resmî bir psikiyatrik endikasyonla tedavi algoritmalarına soktu.
Bu dönem, ketaminin artık yalnızca “off-label infüzyon” olarak değil, düzenleyici otoritelerce tanınan bir ruhsatlı antidepresan stratejisi olarak kabul gördüğü bir dönemeçti.
9. 2020’ler: Psikedelik Rönesans, Ketamin Klinikleri ve Güncel Araştırma Alanları
2020’lere girerken, ketamin daha geniş bir psikedelik rönesansın parçası hâline geldi. Psilosibin, LSD, MDMA gibi klasik psikedeliklerle birlikte, ketamin de:
- Psikedelik destekli psikoterapi protokollerinde,
- Disosiyatif deneyimin terapötik olarak işlendiği seanslarda,
- Travma, kronik depresyon ve bağımlılık tedavisinde
araştırılmaya başlandı. Dünyanın çeşitli yerlerinde “ketamin klinikleri” açıldı; bu merkezlerde, protokollü infüzyonlar veya nazal uygulamalar, psikoterapötik çerçeveyle birleşerek yürütülüyor.
Nörobilim cephesinde güncel araştırmalar şunlara odaklanıyor:
- Mekanizma:
- NMDA reseptör blokajını izleyen glutamat salınım dinamikleri,
- AMPA reseptör aracılı sinyalin güçlenmesi,
- BDNF, mTOR ve benzeri yollar üzerinden sinaptik plastisite artışı,
- Prefrontal korteks ve limbik sistem arasındaki bağlantısallığın fonksiyonel görüntüleme ile haritalanması.
- Yeni moleküller ve metabolitler:
- R-ketaminin ve hidroksinorketamin gibi metabolitlerin, psikotrop yan etkileri daha az ama antidepresan etkisi daha kalıcı bileşiklere ilham verip veremeyeceği,
- “Ketamin benzeri ama daha güvenli” yeni NMDA modülatörlerinin geliştirilmesi.
- Uzun dönem güvenlik:
- Ketaminin kronik kullanımının bilişsel işlevler, mesane sağlığı ve bağımlılık riski üzerine etkileri,
- Uzun süreli bakım protokollerinde optimum doz sıklığı ve toplam tedavi süresinin belirlenmesi.
- Yeni endikasyonlar:
- Alkol ve opioid bağımlılığı gibi madde kullanım bozukluklarında ketamin destekli psikoterapinin etkinliği,
- Kronik ağrı, migren, kompleks bölgesel ağrı sendromu gibi durumlarda düşük doz ketamin protokollerinin yeri.
Günümüzde ketamin; bir yandan ruhsatlı esketamin nazal sprey formu ile depresyon tedavi algoritmalarında resmî olarak yer alırken, diğer yandan infüzyon klinikleri, deneysel psikoterapi protokolleri ve temel bilim laboratuvarları aracılığıyla yeni soruların ve cevapların odağında duruyor.
10. Çok Kimlikli Bir Molekül: Laboratuvardan K-Hole’a, Oradan Ketamin Kliniğine
Böylece, 1950’lerin Parke-Davis laboratuvarlarında fensiklidinin gölgesinde başlayan hikâye;
- Calvin L. Stevens’ın Detroit’te sentezlediği CI-581,
- Edward F. Domino ve Guenter Corssen’in Michigan’da tanımladığı “disosiyatif anestezi”,
- Vietnam savaş alanlarında “Special K” lakabıyla sahra anesteziği,
- 1990’ların yeraltı kültüründe K-Hole metaforu,
- 1997’de Almanya’da rafine enantiyomer S-ketamin/Ketanest S®,
- 2000’lerde tedaviye dirençli depresyonda hızlı antidepresan etki,
- 2019’dan itibaren esketamin nazal spreyin ruhsatlı bir psikiyatrik tedavi hâline gelişi,
- 2020’lerde psikedelik destekli psikoterapi ve ketamin klinikleri
şeklinde, çok katmanlı bir evrime dönüşmüştür.
Bugün ketamin, aynı anda hem ameliyathanede damar yolundan enjekte edilen bir anestezik, hem gece kulüplerinde korku ve hayranlıkla anılan bir disosiyatif maddi, hem de psikiyatri polikliniğinde tedaviye dirençli depresyon için tartışılan, hızlı ama dikkatle kullanılmak zorunda olan bir antidepresandır.
Hukuki statüsü
Ketaminin dünya çapındaki hukuki statüsü, şaşırtıcı derecede parçalı ve katmanlıdır:
Bir yandan DSÖ tarafından “esansiyel ilaç” olarak kabul edilen, anestezide vazgeçilmez bir araç; diğer yandan pek çok ülkede uyuşturucu yasaları kapsamında sıkı kontrol edilen, parti uyuşturucusu ve psikedelik bir madde.
Bu gerilim, hem uluslararası antlaşma düzeyinde hem de ulusal ceza yasalarında izlenebilir.
1. Uluslararası hukuk: “kontrolsüz” ama sürekli tartışma altında bir ilaç
1.1. Birleşmiş Milletler sözleşmeleri ve ketamin
Opioidler, kokain türevleri ya da amfetaminler gibi birçok madde, BM’nin 1961 Tek Sözleşmesi ve 1971 Psikotrop Maddeler Sözleşmesi eklerinde “schedule / çizelge”lere yerleştirilmiş durumdadır.
Ketamin için durum farklıdır:
- DSÖ Uyuşturucu Bağımlılığı Uzman Komitesi (ECDD), 2006’dan itibaren birkaç tur değerlendirme sonrası ketaminin uluslararası düzeyde (1971 Sözleşmesi kapsamında) çizelgeye alınmamasını önermiştir. Gerekçe; küresel ölçekte kötüye kullanımın görece sınırlı olması, buna karşılık düşük ve orta gelirli ülkelerde ketaminin ameliyathane dışı koşullarda dahi tek güvenilebilir anestezik olmasıdır.
- 2015’te Çin, ketaminin 1971 Sözleşmesi kapsamında en sıkı kategorilerden biri olan Çizelge I veya IV’e alınmasını teklif etti. Bu girişim, birçok ülke, anesteziyoloji derneği ve veteriner örgütünden gelen güçlü itirazlarla karşılaştı; DSÖ de tekrar ketaminin uluslararası düzeyde çizelgelenmesine karşı tavrını teyit etti.
- 2016’da Viyana’da toplanan BM Uyuşturucu Komisyonu (CND), ketamini herhangi bir uluslararası çizelgeye yerleştirmedi; ketamin hâlâ BM sözleşmeleri kapsamında resmen çizelgelenmemiş durumda.
Yani ketamin, uluslararası antlaşmalar düzeyinde “kontrolsüz”dür; buna rağmen DSÖ raporları, ülkelerin ulusal düzeyde sıkı kontrol uygulayabileceklerini, ancak bunun tıbbi erişimi engellememesi gerektiğini vurgular.
1.2. Pratik sonuç
Bu durum, ülkelerin eline geniş bir takdir alanı bırakır:
- Bazıları ketamini klasik narkotikler gibi çok sıkı schedule’lara alır (ör. Kanada, ABD, Çin’in psikiyatrik mevzuatı, Hong Kong).
- Bazıları onu reçeteye tabi, fakat klasik “uyuşturucu” kategorisine girmeyen bir ilaç olarak düzenler (ör. Almanya, Hollanda).
- Hemen her yerde tıbbi/veteriner kullanımı yasal, eğlence amaçlı kullanımı ve düzen dışı ticareti ise cezai yaptırıma tabidir.
2. Kuzey Amerika
2.1. Amerika Birleşik Devletleri
ABD’de ketamin, 1970 tarihli Controlled Substances Act (CSA) kapsamında Schedule III kontrollü madde olarak sınıflandırılmıştır (1999’dan beri).
Bu statü şu anlamlara gelir:
- Tıbbi statü:
- İnsan ve veteriner anesteziğinde ruhsatlı preparatlar (Ketalar® vb.) serbestçe reçete edilebilir;
- depresyon ve kronik ağrı için IV infüzyon şeklindeki kullanım “off-label”dir, ama federal düzeyde yasaktır denemez; klinik etik kurulları ve eyalet düzeyindeki düzenlemelere bağlıdır.
- Cezai boyut:
- Reçetesiz bulundurma ve yasa dışı dağıtım, Schedule III kapsamında hapis ve para cezası ile cezalandırılır;
- yasadışı piyasadaki ketaminin büyük kısmı, veteriner kliniklerinden saptırılmış veya yurt dışından kaçak sokulmuş ürünlerden gelir.
Esketamin nazal sprey (Spravato®), tedaviye dirençli depresyon için FDA onaylıdır ve kendi REMS (Risk Evaluation and Mitigation Strategy) programı kapsamında sadece sertifikalı merkezlerde, gözetim altında uygulanabilir; düzenleyici olarak da ketaminle aynı Schedule III çerçevesine tabidir.
2.2. Kanada
Kanada’da ketamin, Controlled Drugs and Substances Act kapsamında Schedule I’de yer alır; yani heroin, kokain gibi maddelerle aynı çizelgededir.
- Tüm satış, üretim ve bulundurma faaliyetleri, tıbbi veya bilimsel yetkilendirme dışında cezai suçtur.
- Buna rağmen Kanada’da ketamin ve esketaminle çalışan depresyon klinikleri vardır; bunlar, ruhsatlı ilaçların hekim gözetiminde kullanımı çerçevesinde, federal ruhsat ve eyalet sağlık düzenlemeleri ile uyumlu olmak zorundadır.
3. Avrupa
Avrupa’da ketaminin hukuki konumunu anlamak için hem narkotik yasalarını hem de ilaç/eczacılık mevzuatını birlikte düşünmek gerekir. AB düzeyinde doğrudan bir “ketamin çizelgesi” yoktur; ancak çoğu ülke, ulusal yasalarında ketamini kontrol altına almıştır.
3.1. Birleşik Krallık
Birleşik Krallık’ta ketamin, Misuse of Drugs Act 1971 kapsamında:
- 2006’da artan parti kullanımı nedeniyle önce Class C uyuşturucu olarak sınıflandırıldı;
- 12 Şubat 2014’te, mesane hasarı ve ağır bağımlılık tabloları nedeniyle Class B’ye yükseltildi (amfetamin ve kannabis reçinesine yakın bir kategori).
Bu statü:
- Bulundurma için 5 yıla kadar hapis,
- üretim ve tedarik için 14 yıla kadar hapis ve sınırsız para cezası riski anlamına gelir.
2024–2025 döneminde, ketamin kullanımındaki rekor artış nedeniyle İçişleri Bakanlığı, ketaminin Class A (heroin, kokain, MDMA seviyesinde) yapılmasını tartışmaya açtı; ACMD’nin (Advisory Council on the Misuse of Drugs) raporu bekleniyor.
Tıbbi tarafta ketamin, hâlâ ruhsatlı bir anestezik ve analjezik; esketamin nazal sprey ise ulusal sağlık sisteminde kısıtlı kullanım onaylarına sahip.
3.2. Almanya
Almanya ilginç bir istisna oluşturur:
- Ketamin Betäubungsmittelgesetz (BtMG) kapsamındaki çizelgelere dahil değildir; yani Almanya’da ketamin, klasik anlamda “Betäubungsmittel” sayılmaz.
- Buna karşılık Arzneimittelgesetz (AMG) kapsamında reçeteye tabi bir tıbbi üründür; hekim reçetesiyle yasal olarak temin edilebilir.
Bu çerçevede:
- Yasal kaynaktan temin edilmiş ketamini bulundurmak, ceza hukuku açısından suç değildir.
- Yetkisiz ticaret, sahte reçete, kaçak ithalat gibi eylemler ise AMG ve diğer ceza hükümleri uyarınca ağır biçimde cezalandırılır.
- Trafik hukuku, ketamin etkisi altında araç kullanmayı alkol ve diğer psikoaktif maddelerle aynı kategoride değerlendirir; fakat bu, ayrı bir idari-cezai alan oluşturur.
3.3. Hollanda ve “ketamin başkenti” tartışması
Hollanda’da ketamin, esas olarak ilaç mevzuatı kapsamında değerlendirilen bir madde; pek çok diğer psikedelik gibi doğrudan Opiumwet’in en sert sınıflarında yer almaz. Bu durum:
- Veteriner ve farmasötik amaçlarla ketamin ithalatına izin verir,
- ancak “medikal” görünen ithalatın bir kısmının yasadışı pazara saptırılmasına zemin hazırlar.
Avrupa Uyuşturucu İzleme Merkezi (EUDA), Avrupa’da ele geçirilen ketaminin büyük kısmının Hindistan menşeli olduğunu ve Hollanda ile Belçika üzerinden dağıtıldığını bildirir.
Son yıllarda Amsterdam, medyada “Avrupa’nın ketamin başkenti” olarak anılmaya başladı; ketamin, Hollanda’da tıbbi ürün mevzuatına tabi olduğundan, klasik narkotiklerle kıyaslandığında daha “yumuşak” bir yasal statüye sahiptir; bu da organize suç örgütlerinin yasal ithalatı maske olarak kullanıp ürünü kara piyasaya kaydırmasını kolaylaştırmaktadır.
3.4. Diğer Avrupa ülkeleri
- Birçok AB ülkesinde (örn. İspanya, Fransa, İtalya, İskandinav ülkeleri) ketamin, ulusal narkotik yasaları veya psikotrop maddeler listeleri kapsamında kontrollü maddedir; ancak detaylar ülkeye göre değişir.
- İsviçre’de ketamin, Betäubungsmittelverordnung eklerinde kontrollü madde olarak listelenmiş; fakat tıbbi kullanım için reçeteyle erişilebilen, denetimli bir ilaç statüsündedir.
Genel eğilim; tıbbi/veteriner kullanımı korurken, eğlence amaçlı kullanıma ve yasa dışı ticarete karşı ceza hukukunu giderek sıkılaştırmak yönündedir.
4. Asya-Pasifik
4.1. Çin Halk Cumhuriyeti
Çin’de ketamin, Psikotrop Maddeler mevzuatı altında sınıflandırılmış ve en sıkı kategorilerden birine yerleştirilmiştir.
- 2016 tarihli yüksek mahkeme içtihadı, ketaminle ilgili suçlar için geçerli eşik miktarları yarıya indirerek cezalandırmayı sertleştirmiştir.
- Belirli miktarların üzerindeki kaçakçılık ve ticaret suçları, uzun süreli hapis cezası ve – yüksek miktarlarda – ölüm cezasına kadar uzanan yaptırımlara neden olabilir.
Çin, aynı zamanda ketaminin uluslararası düzeyde çizelgelenmesi yönündeki BM girişimlerinin başlıca itici güçlerinden biridir.
4.2. Hindistan
Hindistan, ketamini uzun süre görece gevşek düzenlemiş ülkelerden biriydi; özellikle veteriner kullanım için büyük hacimlerde ticaret serbestti.
- Artan eğlence amaçlı kullanım ve “date-rape drug” olarak kötüye kullanım iddiaları sonrası, ketamin Narcotic Drugs and Psychotropic Substances (NDPS) Act kapsamına alındı ve psikotrop madde olarak çizelgelendi.
- Ayrıca 2013’te Drugs and Cosmetics Act altında Schedule X listesine dâhil edilerek satışı için özel lisans ve ayrıntılı kayıt tutma zorunluluğu getirildi; eczaneler ketamin satışlarını en az iki yıl süreyle kayıt altında tutmak zorunda.
Bu çerçevede:
- Yetkisiz bulundurma ve kaçakçılık, NDPS kapsamında ağır hapis cezaları ve yüksek para cezaları ile karşılanır.
- Tıbbi ve veteriner kullanım ise lisans, kayıt ve stok denetimiyle sıkı biçimde izlenir.
4.3. Japonya
Japonya’da ketamin, Narcotics and Psychotropics Control Law kapsamında 2007’den beri “narcotic” kategorisinde ulusal kontrol altındadır.
- Sağlık Bakanlığı’nın kontrol listesinde ketamin, “N” (narkotik) kodu ile sayılmıştır; tüm tuz ve preparatları bu kapsama girer.
- Yasal statü:
- Tıbbi olarak yalnızca anestezik endikasyonu için onaylıdır; depresyon ya da kronik ağrı için psikiyatrik endikasyonla ruhsatı yoktur.
- Lisanssız bulundurma ve ithalat, ciddi cezai yaptırımlara tabidir; 2025’te Haneda Havalimanı’nda 40 kg’lık ketamin yakalanması, ülkenin şimdiye kadarki en büyük ketamin operasyonu olarak gündeme gelmiştir.
4.4. Hong Kong, Singapur, Tayvan
- Hong Kong: 2000’den beri Dangerous Drugs Ordinance (Cap.134) kapsamında Schedule 1’de “tehlikeli uyuşturucu” olarak listelenmiştir; yetkisiz üretim, bulundurma ve tedarik ciddi hapis cezaları ile sonuçlanır.
- Singapur ve Tayvan: Ketamin, bu ülkelerde de “controlled drug / dangerous drug” statüsündedir; sıkı cezalar (özellikle Singapur’da) söz konusudur ve kronik kullanımın karaciğer, safra yolları ve mesane üzerindeki hasarları nedeniyle halk sağlığı müdahaleleri de yürütülmektedir.
4.5. Avustralya
Avustralya’da ketamin, Poisons Standard’da Schedule 8 (S8) “controlled drug” olarak listelenmiştir.
- S8 statüsü, morfin ya da metadon gibi maddelerle benzer düzeyde denetim anlamına gelir:
- yalnızca yetkili hekimlerce reçete edilebilir,
- eyalet düzeyinde ek bildirim/izin gerekebilir,
- kayıt ve stok kontrolü sıkıdır.
- Örneğin Batı Avustralya’da, S8 opioidler ve ketamin için özel “Monitored Medicines Prescribing Code” uygulanmakta; hekimlerin belirli durumlarda eyalet sağlık otoritesinden önceden yazılı izin almaları gerekmektedir.
4.6. Yeni Zelanda
Yeni Zelanda, ketamini hem tıbbi ilaç hem de yasadışı uyuşturucu olarak çifte çerçevede düzenler:
- Misuse of Drugs (Classification of Ketamine) Order 2009, ketamini Misuse of Drugs Act 1975 uyarınca Class C controlled drug olarak tanımlamıştır; 1 Aralık 2010’da yürürlüğe girmiştir.
- Sağlık Bakanlığı, ketamini kontrollü ilaçlar arasında sayar; medikal kullanımda triplikat reçete formları ve özel kayıt yükümlülükleri vardır.
- Tıbbi/veteriner kullanım dışındaki bulundurma, ithalat ve ticaret yasa dışıdır; ketamin, pratikte “illegal party drug” olarak değerlendirilir; buna karşın dirençli depresyon için sınırlı sayıda ketamin tedavi merkezi de faaliyet göstermektedir.
5. Latin Amerika ve Afrika
5.1. Brezilya
Brezilya’da ketamin, Portaria nº 344/1998 (Brezilya Kontrollü İlaç ve Maddeler Yasası) kapsamında kontrol edilen psikoaktif maddeler listesindedir:
- Ketamin ve esketamin, B1 sınıfı psikoaktif ilaçlar arasında sayılır; bu, özel renk kodlu “B reçete bildirim formu” ile reçete edilmesi gereken, sıkı kontrol altındaki ilaç kategorisidir.
- Bu statü, ketaminin tıbbi kullanımını mümkün kılarken, eczane ve hekimler üzerinde çok sıkı kayıt ve denetim yükümlülüğü getirir; yasa dışı bulundurma ve ticaret ise cezai yaptırıma tabidir.
5.2. Meksika
Meksika’da ketamin:
- Yalnızca tıbbi amaçlarla yasaldır; lisanslı hekim ve kliniklerde, anestezi veya dirençli depresyon/kronik ağrı tedavisi için kullanılabilir.
- Reçetesiz bulundurma, diğer klasik psikedeliklerle benzer düzeyde cezai yaptırımlara tabidir; psilosibin veya LSD bulundurmayla kıyaslanabilir ceza skalaları uygulanır.
Son yıllarda Meksika’da ketamin bazlı ruh sağlığı klinikleri artmış, ancak bunlar da ulusal ilaç yasaları ve tıbbi etik çerçevesinde sıkı denetime tabi hâle gelmiştir.
5.3. Güney Afrika ve diğer Afrika ülkeleri
- Güney Afrika’da ketamin, ilaç otoritesi SAHPRA tarafından schedule 5 ilaç olarak sınıflandırılmıştır; bu, yalnızca hekim reçetesiyle ve çoğunlukla sağlık çalışanı gözetiminde uygulanabilecek, orta düzeyde bağımlılık potansiyeli olan ilaç kategorisidir. Özellikle depresyon tedavisinde ketamin infüzyonları, hastanın doğrudan klinikte gözetildiği protokollerle yapılmak zorundadır.
- Diğer birçok Afrika ülkesinde ketamin, ya ulusal “poisons and medicines” yasalarına göre reçeteli ilaç statüsünde ya da psikotrop maddeler listesinin alt kategorilerinde yer alır; kırsal bölgelerde anestezide vazgeçilmez oluşu nedeniyle, DSÖ ve çeşitli anestezi dernekleri bu ülkelerde aşırı cezai sıkılaştırmalara karşı uyarıda bulunmuştur.
6. Klinik kullanım – eğlence kullanımı – psikedelik terapi ekseni
Hukuki düzenlemeler yalnızca “yasak” boyutuyla değil, tıbbi ve araştırma amaçlı kullanımı düzenleme biçimi ile de ayrışır:
- Klasik anestezik kullanım:
- Hemen her ülkede ameliyathane ve acil tıp bağlamında ketaminin kullanımı, ulusal ruhsatlandırma otoritelerinin onayıyla yasaldır.
- Düşük ve orta gelirli ülkelerde, ketamin çoğu zaman tek genel anestezik seçenektir; bu nedenle özellikle uluslararası düzeyde çizelgelenmemiş olması hayati görülür.
- Depresyon ve diğer psikiyatrik endikasyonlar:
- ABD ve AB’de IV ketamin infüzyonları çoğu zaman “off-label” kullanıma dayanır; ama esketamin nazal sprey ruhsatlıdır ve sıkı risk yönetim programları altında uygulanır.
- Japonya gibi bazı ülkelerde ketaminin psikiyatrik endikasyonla kullanımına resmi onay yoktur; bu alan tamamen deneysel veya klinik araştırma çerçevesinde yürütülmek zorundadır.
- Psikedelik destekli psikoterapi ve “özel klinikler”:
- ABD, Kanada, Avrupa, Güney Afrika ve Latin Amerika’da çok sayıda özel ketamin kliniği ortaya çıkmıştır; bunlar ulusal ilaç ve sağlık mevzuatı kapsamında yasal olsa bile, düzenleyici otoriteler, kötüye kullanım ve uygunsuz endikasyonlar nedeniyle sık sık uyarılar yayımlar.
- Eğlence ve parti kullanımı:
- Hemen tüm ülkelerde, tıbbi/veteriner yetki olmaksızın ketamin bulundurmak, satmak veya ithal etmek suçtur; sınıf/schedule düzeyi (Class B vs C, Schedule I vs III vs psikotrop vb.) sadece ceza ağırlığını belirler.
7. Seyahat ve araştırma bağlamında pratik sonuçlar
Dünya çapındaki bu parçalı yapı, hem seyahat eden hastalar hem de araştırmacılar için özel dikkat gerektirir:
- Seyahat:
- Uluslararası Narkotik Kontrol Kurulu (INCB), kontrollü maddeleri içeren ilaçlarla seyahat edecek kişiler için ülke bazında farklı kuralları listeler; çoğu ülke, hekimin imzalı raporu ve sınırlı miktar taşıma koşuluyla ketamin içeren ruhsatlı ilaçlara izin verir, fakat bazı ülkelerde (özellikle Doğu Asya’da) ketaminle ülkeye giriş ciddi cezai sonuçlar doğurabilir.
- Araştırma:
- Birçok ülkede ketamin, laboratuvar ve klinik araştırmalarda kullanılmadan önce hem etik kurul izni hem de kontrollü madde lisansı gerektirir (özellikle Schedule I/Schedule II kategorilerinde bu gereklilik çok daha katıdır; ketamin genellikle Schedule III veya psikotrop kategorilerinde olsa da, kayıt ve depolama yükümlülükleri vardır).
Dünya ölçeğinde bakıldığında, ketamin için tek bir “hukuki statü”den söz etmek mümkün değildir; bunun yerine aynı molekülün, kimi ülkede esansiyel anestezik, kimi ülkede yüksek cezalı uyuşturucu, çoğu yerde ise her ikisi birden olduğu çok katmanlı bir düzenleme mozaiği vardır. Bu mozaik, hem tıbbi erişimi koruma hem de kötüye kullanımı sınırlandırma çabalarının, hukuk düzeyinde nasıl karmaşık bir dengeye dönüştüğünü oldukça çarpıcı biçimde gösterir.
İleri Okuma
- Nickerson JW, Siegel RK (1978). Phencyclidine and ketamine intoxication: a study of four populations of recreational users. NIDA Research Monograph 21:119–147.
- Ahmed SN, Petchkovsky L (1980). Abuse of ketamine. British Journal of Psychiatry 137(3):303. doi:10.1192/bjp.137.3.303b.
- Weiner AL, Vieira L, McKay CA Jr, Bayer MJ (2000). Ketamine abusers presenting to the emergency department: a case series. Journal of Emergency Medicine 18(4):447–451. doi:10.1016/S0736-4679(00)00162-1.
- González D, Ventura M (yaklaşık 2008). New trends of ketamine consumption in Europe. In: Pates R, Riley D (eds). Off-label Party Drugs: The New Drug Use Scenario in Europe. Monografías sobre drogodependencias. Gobierno Vasco, Vitoria-Gasteiz.
- European Monitoring Centre for Drugs and Drug Addiction (2011). The state of the drugs problem in Europe 2011. Annual Report. Luxembourg: Publications Office of the European Union.
- World Health Organization (2013). WHO Expert Committee on Drug Dependence: thirty-sixth report. WHO Technical Report Series 973. Geneva: World Health Organization.
- Nickerson JW, Attaran A (2015). The Commission on Narcotic Drugs’ attempt to restrict ketamine. Lancet 385(9971):e19. doi:10.1016/S0140-6736(15)60490-1.
- Dong TT, Mellin-Olsen J, Gelb AW (2015). Ketamine: a growing global health-care need. British Journal of Anaesthesia 115(4):491–493. doi:10.1093/bja/aev215.
- European Psychiatric Association (2015). EPA Position Statement on ketamine in psychiatric treatment and research. EPA Position Statement, 6 March 2015, Strasbourg: EPA.
- European Psychiatric Association (2015). Ketamine fact sheet. Brussels/Strasbourg: EPA.
- World Health Organization (2016). WHO Expert Committee on Drug Dependence: thirty-seventh report. WHO Technical Report Series 998. Geneva: World Health Organization.
- Taylor P (2016). Ketamine—the real perspective. Lancet 387(10037):1235–1236. doi:10.1016/S0140-6736(16)00681-4.
- Cottrell JE, Hartung J (2016). Ketamine versus Special K: a double-edged sword. Anesthesia & Analgesia 122(3):585–586. doi:10.1213/ANE.0000000000001101.
- Nickerson JW, Attaran A, Morrison A, Brown A, Fischer B, Uy J, Gelb AW (2017). Access to controlled medicines for anesthesia and surgical care in low-income countries: a narrative review of international drug control systems and policies. Canadian Journal of Anesthesia 64(3):296–307. doi:10.1007/s12630-016-0805-9.
- Liao Y, Tang Y-L, Hao W (2017). Ketamine and international regulations. American Journal of Drug and Alcohol Abuse 43(5):495–504. doi:10.1080/00952990.2016.1278449.
- Grégoire MC (2017). Ketamine: we need to continue to advocate against international restrictions. Canadian Journal of Anesthesia 64(3):259–263. doi:10.1007/s12630-017-0915-z.
- Nickerson JW, Chisholm D, Attaran A (2017). Access to controlled medicines for anesthesia and surgical care: the case of ketamine. Canadian Journal of Anesthesia 64(3):308–315.
- Nickerson JW, Chisholm D, Attaran A (2017). Access to controlled medicines and the threat of international ketamine control. In: Smith HS (ed). Current Topics in Anesthesiology. Springer, New York.
- Walsh Z, Mollaahmetoglu OM, Rootman J, Golsof S, Keeler J, Marsh B, Nutt DJ, Morgan CJA (2022). Ketamine for the treatment of mental health and substance use disorders: comprehensive systematic review. BJPsych Open 8(1):e19. doi:10.1192/bjo.2021.1067.
- European Monitoring Centre for Drugs and Drug Addiction (2024). EU Drug Market: new psychoactive substances – in-depth analysis. Module on ketamine (distribution and supply). Lisbon: EMCDDA/EUDA.
- Ooms GI, Usman MA, Reed T, van den Ham HA, Mantel-Teeuwisse AK (2024). The impact of scheduling ketamine as an internationally controlled substance on anaesthesia care in Sub-Saharan Africa: a case study and key informant interviews. BMC Health Services Research 24(1):598. doi:10.1186/s12913-024-11040-w.
- European Union Drugs Agency (2025). European Drug Report 2025: trends and developments – other drugs (LSD, mushrooms, ketamine, GHB, nitrous oxide). Luxembourg: Publications Office of the European Union.


Yorum yazabilmek için oturum açmalısınız.