“Lubiprostone “** adı, kimyasal yapısı ve farmakolojik etkisinin bir kombinasyonundan türetilmiştir:
- “Lubi-”: İlacın gastrointestinal sistemdeki klorür kanallarının (özellikle ClC-2 kanallarının) aktivasyonunu içeren, sıvı salgısının artmasına ve bağırsak hareketliliğinin iyileşmesine yol açan etki mekanizmasını ifade eder. “Lubi-” ön eki, dışkıyı yumuşatma ve geçişi kolaylaştırmadaki rolünü yansıtan yağlama (lubrikasyon) ile ilişkilidir. Kelimenin de kökü olan kaygan veya pürüzsüz anlamına gelen Latince ’lubricus ” kökünden esinlenmiştir.
- “-prostone ”: Bu son ek prostaglandin türevi ilaçlarda yaygındır. Lubiprostone bir prostaglandin E1 (PGE1) analoğudur ve “-prostone” eki bu bileşik sınıfıyla ilişkisini gösterir.
Dolayısıyla, lubiprostone esasen gastrointestinal sistemde kayganlaşmayı destekleyen prostaglandin türevi bir bileşik anlamına gelir. Öncelikle kronik kabızlık ile birlikte irritabl bağırsak sendromunu (IBS-C) tedavi etmek için kullanılır.
İçindekiler
1. Kimyasal Yapı ve Farmakolojik Sınıflandırma
Lubiprostone, bisiklik yağ asidi iskeletine sahip bir prostaglandin E₁ (PGE₁) türevidir; proston olarak adlandırılan yarı sentetik bileşikler grubuna girer. Bisiklik çerçeve, molekülün lipofilikliğini artırarak intestinal epitel hücresinin apikal membranına penetrasyonunu kolaylaştırır; aynı zamanda ClC-2 klorür kanallarına selektif bağlanmayı destekler. Sistemik emilimi minimal tutan bu yapısal özellikler, terapötik etkilerin lümende lokalize kalmasını sağlar ve advers olay riskini azaltır.
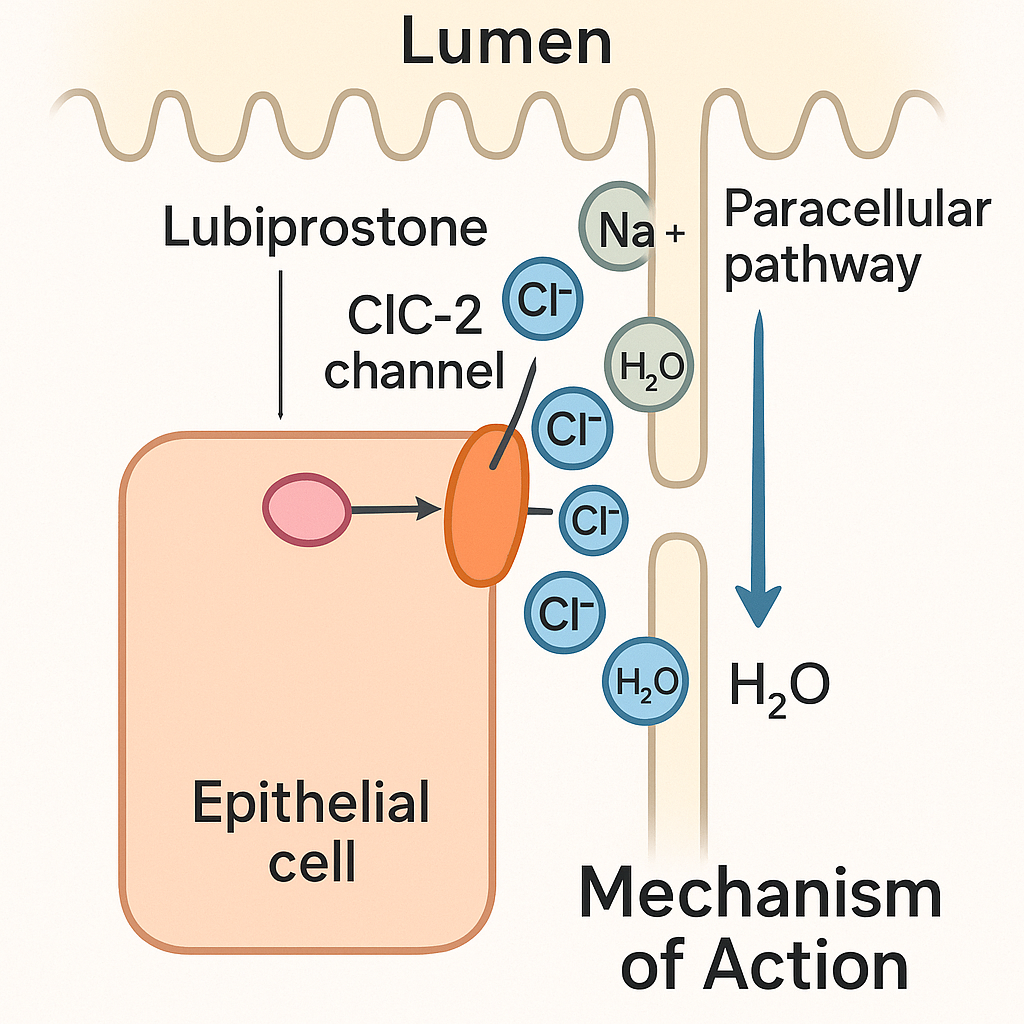
2. Etki Mekanizması
2.1 Klasik Paradigma: ClC-2 Kanal Aktivasyonu
Lubiproston, intestinal epitel hücrelerinin apikal membranındaki ClC-2 kanallarını doğrudan aktive eder. Klorür iyonlarının lümene sekresyonu, sodyumun paracellular geçişini ve osmotik su akışını tetikler; böylece dışkı hidrasyonu artar ve kolon transit süresi kısalır. Bu mekanizma, siklik AMP/PKA bağımlı yolları atlayarak iyon taşıma sisteminin tek bir bileşenini hedeflemesi bakımından benzersizdir.
2.2 Karmaşık Gerçeklik: CFTR ve EP4 Ara Katılımı
Yeni veriler, lubiproston’un etki spektrumunun ClC-2 ile sınırlı olmadığını göstermektedir. EP4 reseptörü antagonisti GW627368 ile yapılan inhibisyon deneylerinde salınımın ≈%40 azaldığı, ayrıca CFTR kanalının kısmen devreye girdiği gösterilmiştir. Böylelikle cAMP aracılı sinyalleme ve çoklu iyon kanalı etkileşimi, güncel mekanistik modelde yer almaktadır.
3. Farmakokinetik ve Farmakodinamik Özellikler
Oral alım sonrası sistemik biyoyararlanım <%2’dir. Lubiproston, karaciğerde enzimatik olmayan oksidatif açılma ve β-oksidasyon ile hızla metabolize olur; plazma yarı ömrü ≈1,4 saat olup klinik önem taşımayacak kadar kısadır. Terapötik etkiler çoğunlukla 24–48 saat içinde görülür.
4. Klinik Uygulamalar ve Endikasyonlar
| Endikasyon | Önerilen Dozaj | FDA Onay Yılı |
|---|---|---|
| KİK | 24 µg p.o. bid | 2006 |
| İBS-C (kadın) | 8 µg p.o. bid | 2008 |
| OİK | 24 µg p.o. bid | 2013 |
4.1 Kronik İdiyopatik Konstipasyon (KİK)
İki faz III çalışmada lubiproston, 4-haftalık tedavi sonunda plaseboya göre SBM sayısında haftalık +3,5 artış sağlamış; ıkınma, dışkı sertliği ve abdominal şişkinlik skorlarını anlamlı olarak iyileştirmiştir.
4.2 Kabızlıkla Seyreden İrritabl Barsak Sendromu (İBS-C)
Kadınlarda yürütülen randomize denemelerde, günde ≥50% semptom iyileşmesi elde eden hasta oranı plaseboya kıyasla anlamlı derecede yüksektir (RR ≈ 1,8). Karın ağrısı, rahatsızlık ve şişkinlik skorlarında da belirgin düşüşler rapor edilmiştir.
4.3 Opioid Kaynaklı Konstipasyon (OİK)
Günde iki kez 24 µg’lik doz, kronik non-malign ağrı nedeniyle opioid kullanan hastalarda SBM medyan artışı +3,1/hafta sağlamış; analjezi düzeylerinde veya opioid dozu gereksiniminde bozulma saptanmamıştır.
5. Dozaj ve Uygulama İlkeleri
İlaç yemekle ve suyla birlikte alınmalıdır; bu, bulantı insidansını azaltır. Kapsüller bütün yutulmalı, ezilmemeli veya çiğnenmemelidir. Hepatik veya renal yetersizlik genellikle doz ayarı gerektirmez, ancak Child-Pugh C olgularında klinik takibin sıklaştırılması önerilir.
6. Güvenlik Profili
- Yaygın (≥%10): Bulantı, ishal, baş ağrısı.
- Orta (%1–10): Karın ağrısı, abdominal distansiyon, gaz.
- Nadir (<%1): Dispne, hipotansiyon, alerjik reaksiyon.
- Kontrendikasyon: Mekanik intestinal obstrüksiyon şüphesi.
7. İlaç Etkileşimleri
Minimal sistemik emilim nedeniyle klinik olarak anlamlı CYP450 etkileşimi bildirilmemiştir. Bu, polifarmasili hastalarda tedaviyi kolaylaştırır.
8. Klinik Kanıtların Değerlendirilmesi
Lubiproston, üç ana konstipasyon fenotipinde plasebo kontrollü, randomize kanıt düzeyine sahip olup uzun-vadeli uzatma çalışmalarında ≥12 ay süresince sürdürülebilir etkinlik ve tolere edilebilirlik göstermiştir.
9. Gelecek Perspektifler ve Araştırma Alanları
- Pediatrik konstipasyon ve nörojenik barsak disfonksiyonlarında off-label denemeler.
- Dizbiyoz ve barier fonksiyonu üzerine etkiler (zonulin, claudin-1 ekspresyonu).
- Yüksek çözünürlüklü manometri ile hareketlilik paternlerine etkilerin karakterizasyonu.
10. Tarihsel Gelişim ve FDA Onayı
Lubiprostone (Amitiza®), düzenleyici onay alan ilk proston olarak 31 Ocak 2006’da FDA tarafından ≥18 yaş erişkinlerde kronik idiyopatik kabızlık için onaylanmıştır. Bu, klinik farmakolojide klorür kanal hedefli ilk onaylı ajan oluşu açısından önemlidir. 2008 yılında kadın hastalarda İBS-C endikasyonu eklenmiş, 2013’te ise OİK için onay genişletilmiştir. Her bir onay, randomize, çift kör faz III çalışmalarla desteklenmiş olup dozaj ve endikasyonlara göre farklı klinik profiller tanımlanmıştır.
Keşif
Lubiprostone, Amitiza marka adıyla yaygın olarak bilinir ve kronik idiyopatik kabızlık, kabızlıklı irritabl bağırsak sendromu (IBS-C) ve opioid kaynaklı kabızlığı tedavi etmek için tasarlanmış bir ilaçtır. Sucampo Pharmaceuticals tarafından geliştirilen ve ABD Gıda ve İlaç Dairesi (FDA) tarafından onaylanan bu ilacın keşiften pazara kadar olan yolculuğu, farmasötik inovasyonun ikna edici bir örneğidir. Aşağıda, tarihi kayıtlardan alınan lubiprostone keşfi ve geliştirilmesindeki önemli kilometre taşlarının bir zaman çizelgesi bulunmaktadır.

Erken Araştırma ve Keşif (1980’lerin Sonu – 1990’ların Başı):
Prostaglandin E1 türevi olan lubiprostone, prostaglandinlerin gastrointestinal hareketliliği nasıl düzenlediğine dair araştırmalardan ortaya çıkmıştır. Bilim insanları, bağırsaktaki klorür kanallarını uyarma yeteneğini belirleyerek terapötik kullanımı için temel oluşturmuştur. – 1996 yılında Dr. Ryuji Ueno ve Dr. Sachiko Kuno tarafından kurulan Sucampo Pharmaceuticals, geliştirilmesine öncülük ederken, ilk prostaglandin çalışmaları daha erken başladı ve bu atılım için sahneyi hazırladı.
Klinik Öncesi Geliştirme (1990’lar):
1990’larda, klinik öncesi çalışmalar lubiprostone’un bağırsak astarındaki CIC-2 klorür kanallarını aktive etme kapasitesini test etti. Sıvı salgılanmasını ve bağırsak hareketliliğini artırarak, bu deneyler kabızlıkla ilişkili durumlar için bir tedavi olarak vaadini doğruladı.
Patent Başvurusu (1990’ların sonu – 2000’lerin başı):
- Sucampo, 1999’da dosyalanan ve 2002’de verilen önemli bir patent (ABD Patenti No. 6.414.016) ile lubiprostone için fikri mülkiyet haklarını güvence altına aldı. Bu dönüm noktası, ilacın sentezini ve terapötik potansiyelini vurguladı.
Klinik Denemeler (2000’lerin Başları):
- Muhtemelen 1990’ların sonu veya 2000’lerin başında başlayan Faz I denemeleri, lubiprostone’un güvenliğini ve vücutta nasıl davrandığını değerlendirdi. Sonraki Faz II ve III denemeleri, kronik kabızlık ve IBS-C için etkinliğini kanıtladı ve minimal sistemik emilimle bağırsak fonksiyonunu iyileştirdiğini gösterdi.
FDA Başvurusu ve Onayı (2006):
- Sucampo, 2005 yılında FDA’ya Yeni İlaç Başvurusu (NDA) sundu. 31 Ocak 2006’da, lubiprostone (Amitiza) yetişkinlerde kronik idiyopatik kabızlık için onay aldı ve bu kullanım için yeşil ışık yakan ilk klorür kanal aktivatörü oldu.
Genişletilmiş Endikasyonlar (2008 – 2013):
- 29 Nisan 2008: FDA, daha fazla klinik kanıta dayanarak yetişkin kadınlarda IBS-C tedavisi için onayı uzattı.
- 23 Nisan 2013: Onay, kronik kanser dışı ağrısı olan yetişkinlerde opioid kaynaklı kabızlığı (OIC) da kapsayacak şekilde tekrar genişletildi ve klinik kapsamı genişletildi.
Ticari Lansman ve Ortaklıklar:
- 2006 onayından sonra, lubiprostone Sucampo ve Takeda Pharmaceuticals arasındaki bir ortaklık aracılığıyla ABD pazarına girdi. 2004’teki bir ortak tanıtım anlaşması, Takeda’nın pazarlama ve dağıtım çabalarına öncülük etmesini sağladı.
Küresel Genişleme ve Devam Eden Araştırma (2006 Sonrası):
- Lubiprostone, ABD dışında, özellikle 2012’de Japonya’da kronik kabızlık için onay aldı (Mylan ve Sucampo tarafından Amitiza olarak pazarlandı). Devam eden çalışmalar, gastroenterolojideki rolünü geliştirmeye devam etti.
İleri Okuma
- Cuppoletti, J., Malinowska, D. H., Tewari, K. P., Li, Q. J., Sherry, A. M., Patchen, M. L., & Ueno, R. (2004). SPI-0211 activates T84 cell chloride transport and recombinant human ClC-2 chloride currents. American Journal of Physiology-Cell Physiology, 287(5), C1173–C1183.
- Cryer, B., & Katz, S. (2005). A pilot study of the safety and efficacy of lubiprostone in patients with chronic constipation. Digestive Diseases and Sciences, 50(5), 873-878.
- Camilleri, M., Bharucha, A. E., Ueno, R., Burton, D., Thomforde, G. M., & Baxter, K. (2006). Effect of a chloride channel activator, lubiprostone, on gastrointestinal transit, gastric sensory, and motor functions in healthy subjects. American Journal of Physiology-Gastrointestinal and Liver Physiology, 290(5), G942–G947.
- Lacy, B. E., Levy, L. C. (2007). Lubiprostone: a chloride channel activator. The Journal of Clinical Gastroenterology, 41(4), 345-351.
- Johanson, J. F., Morton, D., Geenen, J., & Ueno, R. (2007). Multicenter, 4-week, double-blind, randomized, placebo-controlled trial of lubiprostone, a locally acting type-2 chloride channel activator, in patients with chronic constipation. American Journal of Gastroenterology, 102(12), 2827–2836.
- Fujita M. et al. (2009). Lubiprostone activates ClC-2 chloride channels in murine small intestinal epithelial cells. Journal of Pharmacological Sciences, 109(1), 91–94.
- Wilson J.D. et al. (2011). Mechanism of action of lubiprostone: a chloride channel activator. Current Gastroenterology Reports, 13(3), 211–218.
- Schey, R., Rao, S. S. C. (2011). Lubiprostone: Evaluation of the Pharmacology, Efficacy, and Safety in the Treatment of Chronic Constipation. Expert Opinion on Drug Metabolism & Toxicology, 7(4), 507–516.
- Fukudo, S., Hongo, M., Kaneko, H., Ueno, R. (2016). Efficacy and safety of lubiprostone in patients with chronic constipation: A phase III, randomized, double-blind, placebo-controlled study. Neurogastroenterology & Motility, 28(4), 589–597.
- Ford, A. C., Suares, N. C. (2011). Effect of laxatives and pharmacological therapies in chronic idiopathic constipation: Systematic review and meta-analysis. Gut, 60(2), 209–218.
- Bassotti, G., Blandizzi, C. (2014). Understanding and treating opioid-induced constipation. World Journal of Gastrointestinal Pharmacology and Therapeutics, 5(1), 1–16.
- Lembo, A. J., Kurtz, C. B., MacDougall, J. E., Lavins, B. J., Currie, M. G., Fitch, D. A., … & Johnston, J. M. (2016). Efficacy of linaclotide for patients with chronic constipation. Gastroenterology, 140(5), 1457–1464.
- Srinivasan S. et al. (2016). Lubiprostone targets prostaglandin receptors to activate CFTR in the intestine. American Journal of Physiology – Gastrointestinal and Liver Physiology, 310(11), G847–G856.