İçindekiler
Tanım ve Etimoloji
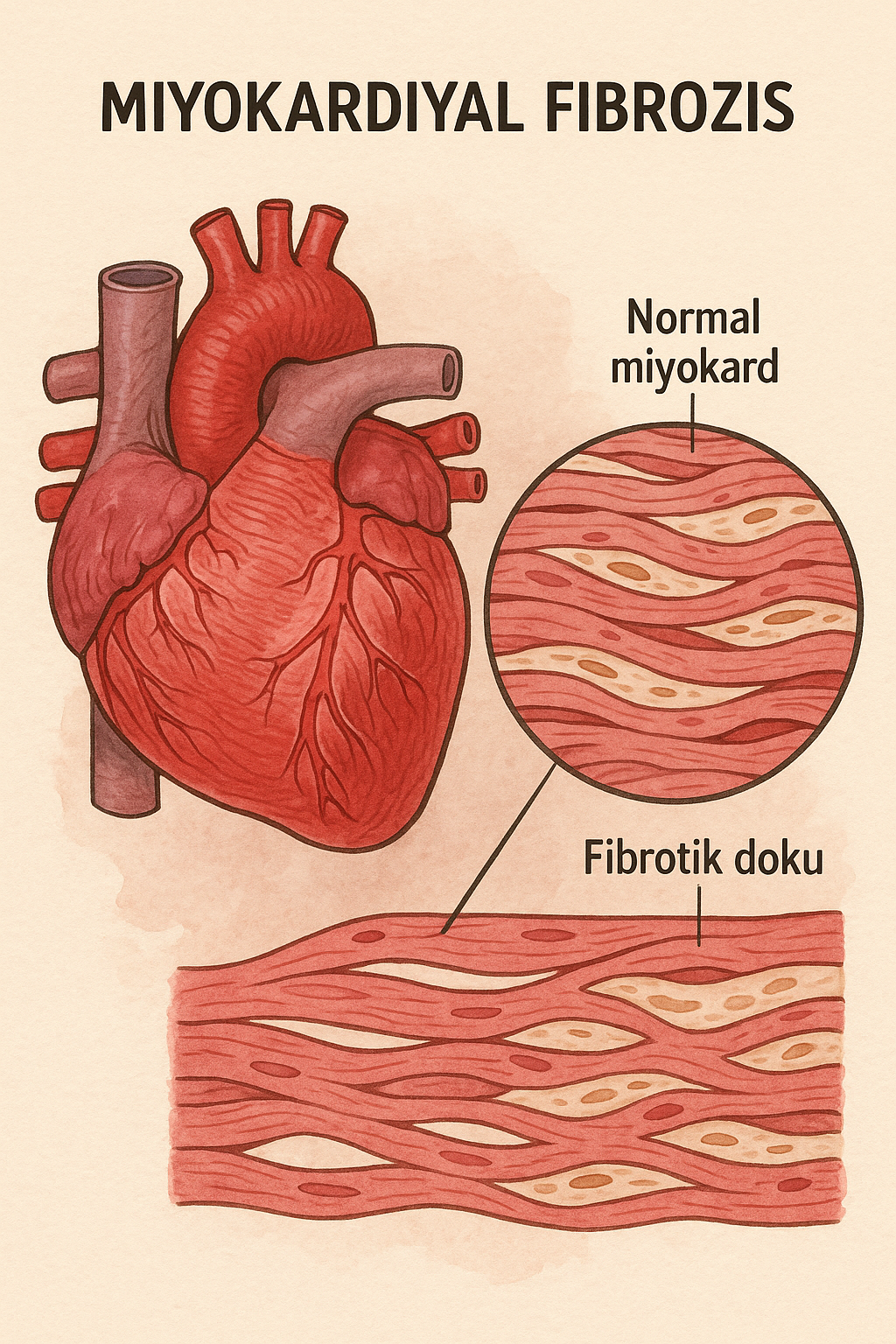
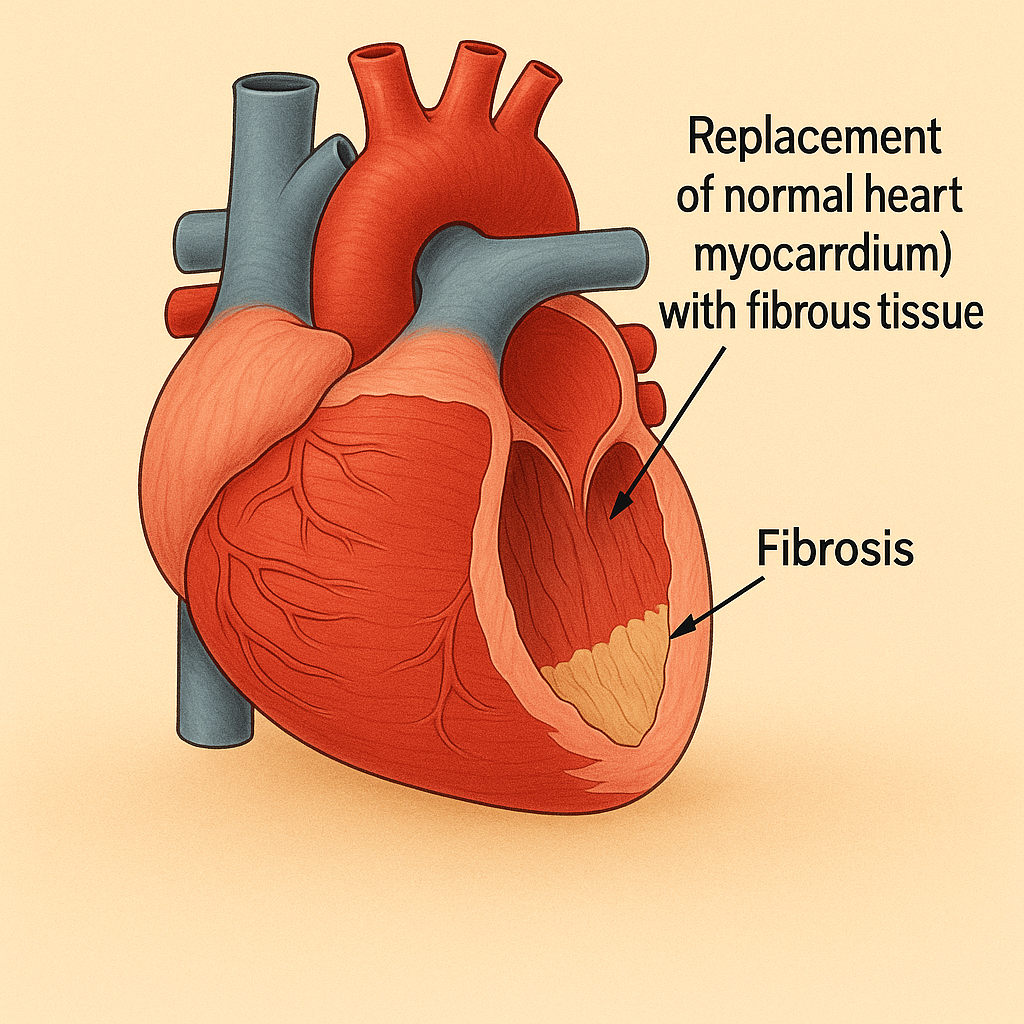
- Miyokardiyal fibrozis, kalp kası dokusunda (miyokard) normal kas hücrelerinin yerini fazla kollajen içeren bağ dokusunun almasıyla karakterize edilen patolojik bir durumdur.
- Bu süreç, kalp kasının elastikiyetini kaybetmesine, sertleşmesine ve sonuç olarak pompalama fonksiyonunun bozulmasına yol açabilir.
- Etimolojik olarak:
- Miyokardiyal kelimesi Yunanca “myo” (kas) ve “kardia” (kalp) kelimelerinden türetilmiştir.
- Fibrozis kelimesi Latince “fibrosus” (lifli) kökünden gelir.
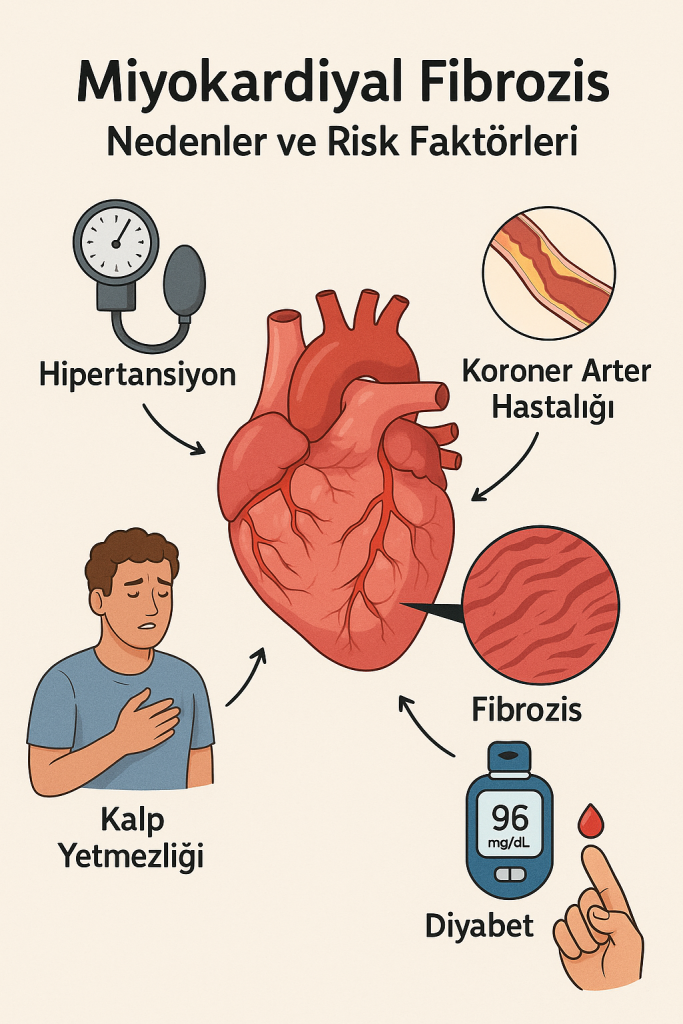
Nedenler ve Risk Faktörleri
Miyokardiyal fibrozis, kalp dokusunun çeşitli stres faktörleri veya hasarlar sonucunda verdiği fibrotik yanıtın bir parçasıdır. Başlıca nedenler şunlardır:
- İskemik kalp hastalığı
- Koroner arterlerin daralması veya tıkanması sonucu miyokard dokusuna yeterli oksijen gitmemesi
- Hipertansiyon (Yüksek Tansiyon)
- Sürekli yüksek basınç kalp kasının yapısal değişikliklere uğramasına neden olur
- Kardiyomiyopatiler
- Kalp kasının primer veya sekonder hastalıkları (örn. dilate, hipertrofik veya restriktif kardiyomiyopati)
- İnflamatuvar hastalıklar
- Özellikle miyokardit gibi kalp kası iltihapları
- Yaşlanma
- Yaşla birlikte kollajen üretimi artar ve elastikiyet azalır
- Radyasyon tedavisi
- Göğüs bölgesine uygulanan radyasyon fibrotik süreçleri tetikleyebilir
- Kalp krizi (Miyokard enfarktüsü)
- Nekroz sonrası fibrotik skar dokusu oluşur
- Kalp yetmezliği
- Hem neden hem de sonuç olabilir
Semptomlar ve Komplikasyonlar
Semptomların tipi ve şiddeti, fibrozun yaygınlığına ve kalbin hangi bölgesinin etkilendiğine bağlı olarak değişir:
- Nefes darlığı (özellikle eforla artan dispne)
- Tükenmişlik ve halsizlik
- Göğüs ağrısı
- Çarpıntı, düzensiz kalp atımları (aritmiler)
- Ödem (özellikle alt ekstremitelerde)
- Egzersiz intoleransı
Komplikasyonlar:
- Kalp yetmezliği (özellikle diyastolik disfonksiyon)
- Aritmiler (özellikle ventriküler aritmiler)
- Ani kardiyak ölüm
- Embolik olaylar (özellikle atriyal fibrilasyon varlığında)
Tanı Yöntemleri
Miyokardiyal fibrozis genellikle non-invaziv görüntüleme teknikleriyle tespit edilir:
- Ekokardiyografi
- Kalp boşlukları, duvar kalınlıkları ve ejeksiyon fraksiyonu hakkında bilgi verir
- Kardiyak Manyetik Rezonans Görüntüleme (Kardiyak MR)
- Geç Gadolinyum Geliştirme (Late Gadolinium Enhancement, LGE) yöntemiyle fibrotik alanları doğrudan görüntüleyebilir
- Kardiyak Bilgisayarlı Tomografi (BT)
- Özellikle diğer nedenleri dışlamak ve anatomik detayları değerlendirmek için
- Biyobelirteçler
- Bazen fibroza eşlik eden kalp hasarı veya inflamasyon düzeylerini yansıtan biyokimyasal testler eklenebilir (örn. NT-proBNP, troponin)
Tedavi ve Yönetim
Spesifik olarak fibrozis oluşumunu tamamen tersine çevirecek bir tedavi mevcut değildir. Yönetim, altta yatan nedenin kontrol altına alınması, semptomların hafifletilmesi ve ilerleyici hasarın durdurulması üzerine kuruludur.
1. Farmakolojik Tedaviler
- ACE inhibitörleri ve ARB’ler
- Fibrozis gelişimini yavaşlatabileceği düşünülmektedir
- Beta blokerler
- Kalp hızını kontrol altına alarak oksijen ihtiyacını azaltır
- Aldosteron antagonistleri (örn. spironolakton)
- Kollajen sentezini baskılayabilir
2. Yaşam Tarzı Değişiklikleri
- Tuz ve sıvı alımının düzenlenmesi
- Kalp sağlığına uygun diyet (örn. DASH diyeti)
- Düzenli egzersiz programları (hekim kontrolünde)
- Sigara ve alkolün bırakılması
- Stresin azaltılması
3. Girişimsel ve Cerrahi Yaklaşımlar
- İmplante edilebilir kardiyoverter defibrilatör (ICD)
- Ani ölüm riski yüksek hastalarda
- Kalp pili (Pacemaker)
- İleri derecede ileti bozukluğu olanlarda
- Kalp nakli
- Tedaviye yanıt vermeyen ileri evre kalp yetmezliğinde
Keşif
1. Kavramsal ve Terimsel İlk Gelişmeler (19. Yüzyıl)
- Miyokardiyal fibrozis teriminin kökeni, kalbin otopsi sonrası incelenmesiyle elde edilen patolojik gözlemlere dayanır.
- yüzyılın başlarında, özellikle Rudolf Virchow gibi patolojinin öncülerinin etkisiyle, kalp dokusunda gözlenen “lifli sertleşme” ve “skar benzeri oluşumlar”, “fibrozis” terimi altında sınıflandırılmaya başlanmıştır.
- Ancak bu dönemde, kalp kasındaki fibrotik değişikliklerin spesifik klinik etkileri ve fizyopatolojisi henüz net bir şekilde tanımlanmamıştır.
- Erken dönem tıbbi yazılarda, bu durum genellikle “induratio cordis” veya “fibra cordis” gibi Latince terimlerle anılmıştır.
2. Histopatolojik Anlamda Tanımlanması (20. Yüzyılın İlk Yarısı)
- 1920’ler–1940’lar arasında, formalin fikse doku örneklerinin mikroskobik analizinin standartlaşması ile miyokardiyal fibrozun histolojik varlığı açıkça ortaya konmuştur.
- Özellikle Masson’s Trichrome gibi özel boyama yöntemlerinin yaygınlaşması, kollajen liflerinin net olarak ayırt edilebilmesini sağlamıştır.
- 1930’lu ve 1940’lı yıllarda yapılan otopsi serilerinde, hipertansiyon, koroner arter hastalığı ve miyokard enfarktüsü sonrası kalp dokusunda oluşan skarlaşmalar tanımlanmış; bu yapılar ilk kez sistematik olarak “fibrozis” başlığı altında sınıflandırılmıştır.
3. Fonksiyonel Önemi ve Klinik Bağlantılarının Kurulması (1950–1970)
- 1950’lerden itibaren miyokardiyal fibrozisin sadece pasif bir doku değişimi değil, kalbin mekanik ve elektriksel işlevlerini doğrudan etkileyen bir süreç olduğu anlaşılmaya başlanmıştır.
- Löffler endomiyokarditi ve restrictive kardiyomiyopati gibi özel klinik tablolar, fibrozisin doğrudan hemodinamik sonuçlar doğurabileceğini göstermiştir.
- Aynı dönemde, miyokardiyal remodeling kavramı geliştirilmiş; fibrozis, kalp kası stresine cevaben gelişen maladaptif yeniden yapılanma sürecinin bir parçası olarak görülmeye başlanmıştır.
4. Görüntüleme Tekniklerinin Evrimi ve Fibrozisin Noninvaziv Tespiti (1980–2000)
- 1980’li yıllarda, ekokardiyografi ve ardından nükleer kardiyoloji teknikleri (örn. SPECT, PET) klinik pratiğe girmiştir. Bu araçlar başlangıçta fibrozisin neden olduğu ventrikül disfonksiyonunu değerlendirmede kullanılmıştır.
- 1990’lı yılların sonlarına doğru, kardiyak manyetik rezonans (CMR) görüntüleme gelişmiş, özellikle geç gadolinyum tutulumu (LGE) yöntemi sayesinde miyokardiyal fibrozis doğrudan ve yüksek çözünürlükte görüntülenebilir hale gelmiştir.
- Bu teknik, iskemik olmayan kardiyomiyopatilerde bile fibrozisin dağılımını ve yoğunluğunu nicel olarak değerlendirme olanağı sağlamıştır.
5. Moleküler ve Hücresel Mekanizmaların Aydınlatılması (2000–2020)
- Bu dönem, fibrozisin sadece bir “sonuç” değil, aynı zamanda hastalık yapıcı aktif bir süreç olduğunu ortaya koymuştur.
- Özellikle:
- Transforming Growth Factor Beta (TGF-β)
- Angiotensin II
- Endotelin-1
- MMP (Matrix Metalloproteinazlar)
gibi moleküllerle ilişkisi saptanmış; fibroblast aktivasyonu, matriks üretimi, inflamatuvar mediatörler gibi dinamiklerin rolü tanımlanmıştır.
- Bu moleküler bilgiler, anti-fibrotik ilaç geliştirme çabalarını da tetiklemiştir.
6. Geleceğe Yönelik Araştırmalar ve Gelişmeler (2020 ve Sonrası)
- Günümüzde miyokardiyal fibrozisin erken biyobelirteçlerle tespiti, reversibilitesi ve genetik temelleri yoğun araştırma konularıdır.
- Öne çıkan araştırma başlıkları:
- Fibrozisi gösteren serum belirteçleri (örn. PIIINP, Galectin-3)
- Yapay zekâ tabanlı CMR analizleri
- Fibroblast transdiferensiyonu ve genetik mühendislik yaklaşımları
- Epigenetik regülasyonun fibrozis üzerindeki etkileri
- Ayrıca, antifibrotik ilaçların (örn. pirfenidon, nintedanib) kalp hastalıklarında kullanımı klinik deneylerde test edilmektedir.
İleri Okuma
- Virchow, R. (1858). Cellular Pathology: As Based Upon Physiological and Pathological Histology. Berlin: August Hirschwald.
- Davies, M. J. (1959). The histology of cardiac fibrosis in hypertensive heart disease. British Heart Journal, 21(3), 265–272.
- Weber, K. T. (1989). Cardiac interstitium in health and disease: The fibrillar collagen network. Journal of the American College of Cardiology, 13(7), 1637–1652.
- Brilla, C. G., & Weber, K. T. (1992). Reactive and reparative myocardial fibrosis in arterial hypertension in the rat. Cardiovascular Research, 26(7), 671–677.
- Diez, J., & Laviades, C. (2000). Molecular mechanisms of myocardial fibrosis: perspectives for clinical treatment. Current Opinion in Cardiology, 15(4), 329–335.
- Zile, M. R., & Brutsaert, D. L. (2002). New concepts in diastolic dysfunction and diastolic heart failure: Part II: causal mechanisms and treatment. Circulation, 105(12), 1503–1508.
- Moon, J. C., et al. (2003). The role of cardiovascular magnetic resonance in heart failure. Journal of the American College of Cardiology, 42(4), 813–820.
- Basso, C., et al. (2009). Arrhythmogenic right ventricular cardiomyopathy: Dysplasia, dystrophy or myocarditis? Heart, 95(6), 519–524.
- Mewton N, Liu CY, Croisille P, Bluemke D, Lima JA. Assessment of myocardial fibrosis with cardiovascular magnetic resonance. Journal of the American College of Cardiology. 2011;57(8):891-903.
- Kong P, Christia P, Frangogiannis NG. The pathogenesis of cardiac fibrosis. Cellular and Molecular Life Sciences. 2014;71(4):549-574
- Gulati, A., Jabbour, A., Ismail, T. F., et al. (2013). Association of fibrosis with mortality and sudden cardiac death in patients with nonischemic dilated cardiomyopathy. JAMA, 309(9), 896–908.
- López, B., Querejeta, R., González, A., et al. (2015). Myocardial fibrosis in hypertensive patients: diagnosis and therapeutic implications. Journal of Hypertension, 33(3), 556–564.
- Schelbert, E. B., & Fonarow, G. C. (2017). Myocardial fibrosis and heart failure: the role of cardiac MRI and biomarkers. Current Heart Failure Reports, 14(3), 131–138.
- Frangogiannis, N. G. (2019). Cardiac fibrosis: Cell biological mechanisms, molecular pathways and therapeutic opportunities. Molecular Aspects of Medicine, 65, 70–99.
- Bai, W., Suzuki, H., Huang, J., et al. (2020). Revisiting the role of fibrosis in heart failure with preserved ejection fraction. Journal of Cardiovascular Translational Research, 13, 957–966.
- Kong, P., Christia, P., & Frangogiannis, N. G. (2021). The pathogenesis of cardiac fibrosis. Cellular and Molecular Life Sciences, 78(7), 3127–3153.
- Wong, T. C., Piehler, K., Meier, C. G., et al. (2022). Myocardial extracellular volume fraction quantified by cardiovascular magnetic resonance is increased in diabetes and associated with mortality and incident heart failure. JACC: Cardiovascular Imaging, 15(1), 12–22.
- Masci, P. G., & Pontone, G. (2022). Artificial intelligence and cardiac magnetic resonance imaging: Advancing diagnosis and management of myocardial fibrosis. Journal of Cardiovascular Magnetic Resonance, 24(1), 25.
- Weber, K. T. (1989). Cardiac interstitium in health and disease: the fibrillar collagen network. Journal of the American College of Cardiology, 13(7), 1637–1652.
Yorum yazabilmek için oturum açmalısınız.