İçindekiler
Tanım ve Patofizyoloji
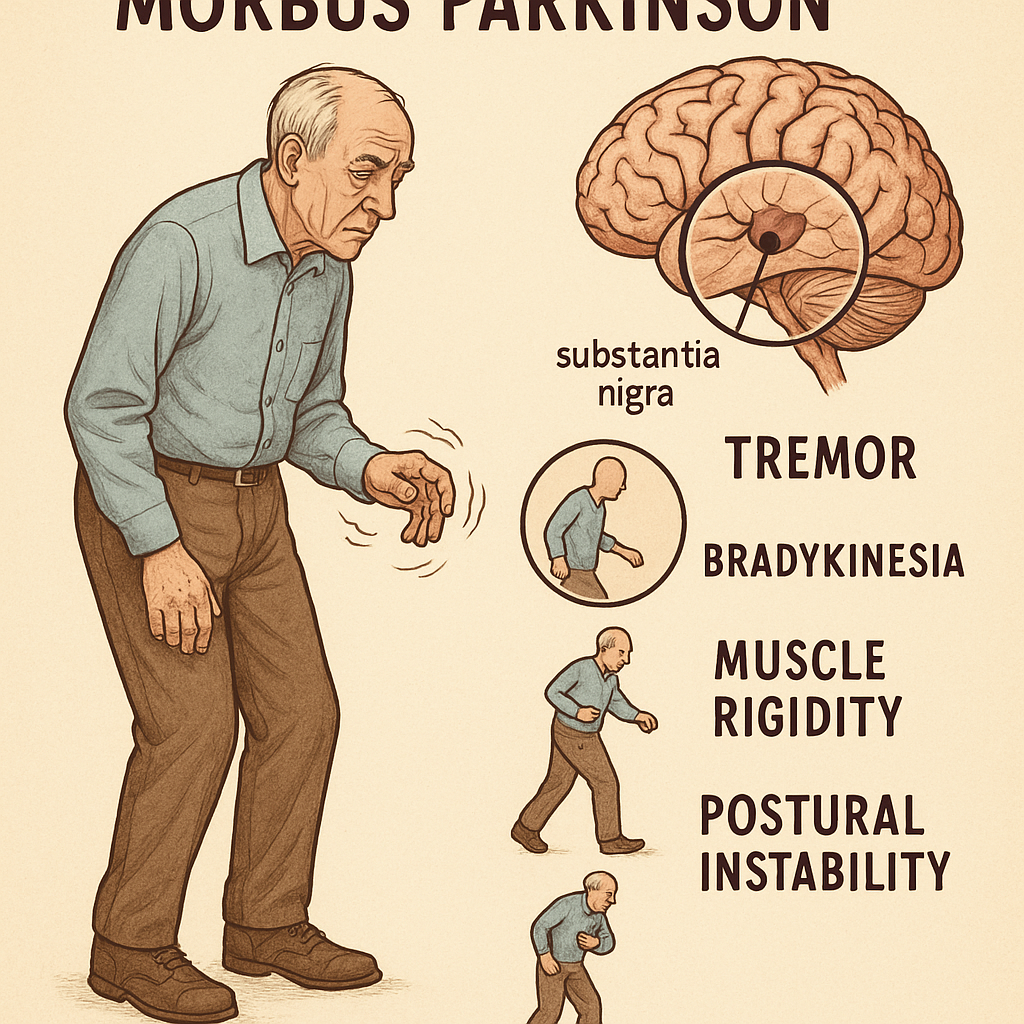
İdiyopatik Parkinson hastalığı (PH) progresif bir nörodejeneratif hareket bozukluğudur ve Alzheimer hastalığından sonra en sık görülen dejeneratif merkezi sinir sistemi hastalığı kabul edilir. Kesin nedeni tam olarak bilinmemekle birlikte genetik yatkınlık ile çevresel faktörlerin etkileşimi rol oynayabilir. Patolojik olarak, beyin sapındaki substantia nigra pars compacta bölgesindeki dopaminerjik nöronların dejenerasyonu ve hayatta kalan nöronlarda Lewy cisimcikleri denilen alfa-sinüklein protein birikimleri ile karakterizedir. Bu anormal birikimler nöronların normal işlevlerini bozarak hücre ölümüne yol açar; sonuçta bazal gangliyonlar düzeyinde dopamin eksikliği gelişir ve bu eksiklik motor semptomların temel nedenini oluşturur.

Parkinson hastalığı çok sistemli bir proteinopati olup beyinde patolojinin yayılımı belirli bir sıra izleyebilir (Braak evrelemesi). Lewy cisimciği birikimleri ilk olarak koklama yolları ve alt beyin sapında başlar, ardından orta beyin ve kortekse doğru ilerler. Bu modele göre erken dönemde hipozmi, REM uykusu davranış bozukluğu, kabızlık gibi non-motor semptomlar gözlenir; motor bulgular substantia nigra’nın etkilenmesiyle başlar.
Kardinal Motor Semptomlar ve Tanı Kriterleri
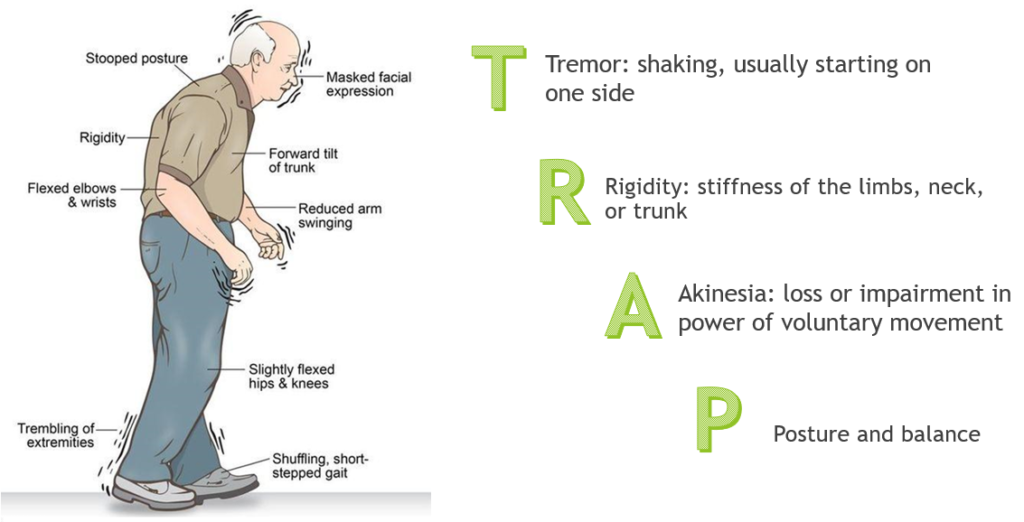
Parkinson hastalığının kardinal motor semptomları:
- Bradikinezi: Hareketlerin yavaşlaması ve küçülmesi. Hareketlerin başlatılmasında güçlük, ince motor hareketlerde zorluk (mikrografi, hipomimi).
- Akinezi: Ciddi veya tam hareketsizlik. Bradikinezinin şiddetli formu olarak tanımlanabilir.
- İstirahat Tremoru: Genellikle tek taraflı başlayan, düşük-orta frekansta (4–6 Hz) “para sayar” tarzında ritmik titreme. Genliği değişken olabilir.
- Rijidite: Kurşun boru veya dişli çark tarzı kas sertliği. Ekstremitelerde ve gövdede görülebilir.
- Postüral instabilite: Vücut dengesinin korunamaması, öne eğik postür, düşme eğilimi. Retro- ve lateropulsiyon testlerinde yetersizlik.
Tanı kriterleri: MDS 2015 kriterlerine göre tanı için bradikinezi + (istirahat tremoru veya rijidite) gereklidir. Levodopa’ya yanıt, tek taraflı başlangıç gibi destekleyici bulgular önemlidir. DAT-SPECT görüntüleme dopamin taşıyıcı yoğunluğundaki azalmayı gösterebilir.
Motor Semptomların Klinik Alt Tipleri
- Tremor-dominant tip: Düşük-orta frekanslı istirahat tremoru baskındır. Diğer semptomlar daha hafif.
- Akinezik-rijid tip: Hareket kısıtlılığı ve sertlik ön planda, tremor minimaldir. Duruş bozuklukları ve yürüme güçlüğü erken gelişebilir.
- Eşit ağırlıklı tip: Tüm motor bulgular eşit şiddette bulunur.
Erken Motor Belirtiler
- Tek taraflı bradikinezi ve/veya tremor
- Mikrografi (küçük ve düzensiz el yazısı)
- Hipomimi (maske yüz)
- Yürüyüş değişiklikleri (festinasyon, adım küçülmesi, omuzda ağrı)
- Postüral değişiklikler (öne eğilme)
- Kolların salınımında azalma
- Duruş ve yürüyüş değerlendirmelerinde “iki adım geride kalma” (geri çekilme testi)
Erken Motor Dışı Belirtiler
- Koku alma bozuklukları (hipozmi, anozmi)
- REM uyku davranış bozukluğu (rüya esnasında hareket)
- Kabızlık
- Hafif depresif ruh hali, apati
Geç Motor Dışı Semptomlar
- Demans (özellikle yürütücü işlevlerde bozulma)
- Depresyon ve anksiyete
- Ortostatik hipotansiyon (vejetatif otonomik sapma semptomu)
- Hipersalivasyon, siyalore
- Cinsel işlev bozuklukları
- Disfaji
- Konuşma bozuklukları (hipofoni, monotonluk)
Nöropsikiyatrik Bulgular
- Depresyon, kaygı bozuklukları, sosyal fobi, obsesif kompulsif belirtiler
- Psikotik belirtiler (halüsinasyonlar, sanrılar)
- İlgisizlik (apati)
- Düşük yaşam kalitesi ve sosyal geri çekilme
Yürüyüş ve Ekstremite Bulguları
- Festinasyon (adım hızının giderek artması)
- Ayakların yere yapışması hissi (freezing)
- Kolların yürürken sallanmaması
- Dirsek, kalça ve dizlerde fleksiyon
- Ekstremitelerde rijidite
- Postürün öne eğilmesi
Titreme Türleri ve İlaç İlişkisi
- Parkinson’da genellikle istirahat tremoru gözlenirken, niyet tremoru (hedefe yönelik hareketle artan) beyincik (serebellum) lezyonlarında görülür.
- Combivent (ipratropium/salbutamol) ve Sedacoron (amiodaron) gibi bazı ilaçlar tremor şiddetini artırabilir.
Hastalık Seyri ve İlerleyiş
- Akinetik-rijid form daha hızlı ilerler.
- Tremor-dominant tipte kognitif etkilenme daha geç ve daha az görülür.
- Yıllar içinde motor dalgalanmalar, “off” dönemleri, diskinezi ve akinetik kriz gibi komplikasyonlar gelişebilir.
Patofizyolojik Öz
- Temel süreç: Bazal gangliyonlarda dopaminerjik nöron kaybı
- Başlıca bölge: Substantia nigra pars compacta
- Sonuç: Dopamin eksikliği → Motor devrelerde disinhibisyon → Klinik motor semptomlar
Elbette. Parkinson hastalığında ilaç ve ilaç dışı tedavi seçenekleri, genetik etmenler ve güncel araştırmaları kapsayan akademik düzeyde genişletilmiş bir içerik oluşturacağım. Tedavi yaklaşımları ve genetik nedenlerle ilgili en güncel bilimsel literatüre dayalı bilgileri aktaracağım.
Araştırma tamamlandığında detaylı ve akademik biçimde referanslandırılmış bir metin sunacağım.
Parkinson Hastalığında Güncel Tedaviler ve Genetik Yönler
Farmakolojik Tedavi Yöntemleri
Parkinson hastalığının motor semptomlarını gidermede birincil yaklaşım dopaminerjik aktiviteyi artırmaya yöneliktir. Farmakolojik tedaviler, dopamin eksikliğini gidermeye veya asetilkolin fazlalığını dengelemeye çalışarak semptomları kontrol altına alır. Aşağıda güncel farmakolojik tedavi seçenekleri ve kullanımları detaylandırılmıştır.
Levodopa ve DOPA Dekarboksilaz İnhibitörleri
Levodopa (L-Dopa), Parkinson motor semptomlarının tedavisinde altın standart kabul edilir. Vücuda alınan levodopa, beyin kan-bariyerini geçerek dopamin nöronlarında dopamin nörotransmitterine dönüştürülür. Levodopa her zaman periferik DOPA dekarboksilaz inhibitörleri (örn. karbidopa veya benserazid) ile kombine edilir; bu sayede levodopanın periferik dönüşümü engellenerek beyne daha fazla geçmesi sağlanır ve gastrointestinal yan etkiler azalır ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Bu kombinasyon preparatları (örn. karbidopa/levodopa veya benserazid/levodopa) Parkinson hastalarında en etkili semptomatik tedaviyi sunar. NICE kılavuzları, motor semptomları yaşam kalitesini etkileyen erken evre Parkinson hastalarına doğrudan levodopa tedavisi başlanmasını önermektedir (Recommendations | Parkinson’s disease in adults | Guidance | NICE).
Levodopa tedavisinin avantajı, özellikle bradikinezi ve rijidite gibi motor bulgularda belirgin düzelme sağlamasıdır. Bununla birlikte, uzun süreli levodopa kullanımı motor komplikasyonlara yol açabilir. Yıllar içinde doza-bağımlı olarak motor dalgalanmalar (ilacın etkisinin dozlar arası dönemde azalması, “wearing-off” fenomeni) ve levodopa kaynaklı diskineziler (istem dışı anormal hareketler) gelişebilir. Yüksek doz ve aralıklı pulsatil levodopa stimülasyonunun genç hastalarda bu komplikasyonları daha erken ortaya çıkardığı gözlenmiştir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Bu nedenle, nispeten daha genç ve biyolojik olarak sağlıklı hastalarda başlangıç tedavisinde levodopayı geciktirme stratejisi uygulanabilir. Dopamin agonistleri veya MAO-B inhibitörleri, motor semptomlar hafif ise ve özellikle daha genç hastalarda, ilk tedavi olarak düşünülebilir; böylece levodopaya maruziyet geciktirilerek uzun vadede motor komplikasyon riskinin azaltılması amaçlanır ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Ancak, semptomları ciddi düzeyde olan veya ileri yaşlı hastalarda levodopa ilk basamak tedavi olarak gereklidir ve tercih edilmelidir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Levodopa, hızlı ve güçlü semptom kontrolü gereken durumlarda en etkili ajandır. Günümüzde erişkin hastalarda ilk tanı anından itibaren hastanın yaşam kalitesini bozan semptomlar varsa levodopa başlanması, aksi takdirde alternatiflerin değerlendirilmesi şeklinde bireyselleştirilmiş bir yaklaşım önerilmektedir (Recommendations | Parkinson’s disease in adults | Guidance | NICE) ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ).
Levodopa preparatlarının çeşitli farmasötik formları mevcuttur. Standart formülasyonlar gündüz kullanımında etkilidir. Kontrollü salınımlı (yavaş salınımlı) levodopa formları, gündüz motor dalgalanmaları yönetiminde tek başına yeterli olmadığından daha çok gece ortaya çıkan semptomlar için önerilir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Ayrıca gerektiğinde daha hızlı etki için suda eriyen tablet formülasyonları ve ileri evre off dönemlerinde kurtarma amaçlı inhaler levodopa formu geliştirilmiştir. İnhaler levodopa formu (ABD’de onaylı) hızlı etki başlangıcı sağlamakla birlikte periferik decarboxylase inhibitörü içermediği için tek başına yeterli olmadığından oral levodopa tedavisine ek olarak kullanılmalıdır ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ).
Yan etkiler: Levodopanın en sık görülen erken dönem yan etkileri bulantı, kusma ve ortostatik hipotansiyondur; bu nedenle genellikle decarboksilaz inhibitörü ile kombinasyon bu etkileri azaltır. Uzun dönemde ise yukarıda bahsedilen motor dalgalanmalar ve diskineziler başlıca sorunlardır. Ayrıca levodopa tedavisi sırasında halüsinasyonlar veya psikoz gibi dopamin fazlalığına bağlı yan etkiler özellikle yüksek dozlarda ve ileri hastalıkta ortaya çıkabilir. Bu tür durumlarda antipsikotik tedavi gerekebileceğinden, hastalar yakın takip edilmelidir.
Dopamin Agonistleri
Dopamin reseptör agonistleri, beyinde dopamin reseptörlerini doğrudan uyararak etkili olan ilaç grubudur. Bu sınıfta ergot türevleri (örn. bromokriptin, kabergolin, pergolid) ve non-ergot türevleri (örn. pramipeksol, ropinirol, rotigotin, apomorfin) bulunur. Ergot türevi agonistler kardiyak kapak fibrozisi ve pulmoner fibrozis gibi ciddi yan etkilere yol açabildiğinden güncel kılavuzlar tarafından kullanımları önerilmemektedir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Non-ergolin dopamin agonistleri ise günümüzde tercih edilen ajanlardır; pramipeksol, ropinirol ve rotigotin (transdermal bant formunda) sık kullanılanlardandır ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Apomorfin ise güçlü bir dopamin agonisti olmakla birlikte oral biyoyararlanımı düşük olduğu için subkutan infüzyon veya enjeksiyon yoluyla, özellikle ileri evrede pompa tedavisi şeklinde kullanılır (aşağıda değinilecektir).
Dopamin agonistleri, özellikle göreceli olarak genç hastalarda başlangıç tedavisi olarak değerlidir. Bu ilaçlar levodopaya kıyasla motor komplikasyonları geciktirebilir; örneğin genç bir hastada ilk tedavi olarak dopamin agonisti verilmesi, levodopanın birkaç yıl ertelenmesine yardımcı olabilir. Bununla birlikte, dopamin agonistlerinin semptomatik etkisi levodopa kadar güçlü değildir ve ileri yaşlı hastalarda genelde levodopa kadar iyi tolere edilmez. Güncel uygulamada, 60 yaş altı hastalarda semptomlar çok ağır değilse dopamin agonistiyle başlamak, 60 yaş üzeri veya ciddi semptomlu hastada doğrudan levodopa ile başlamak sık kullanılan bir stratejidir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ).
Yan etkiler: Dopamin agonistlerinin en önemli dezavantajlarından biri yan etki profilleridir. Bu grup ilaçlar, impuls kontrol bozuklukları (patolojik kumar, hiperseksüalite, kompülsif alışveriş veya yeme gibi dürtü kontrol sorunları) riskini belirgin şekilde artırabilir (Recommendations | Parkinson’s disease in adults | Guidance | NICE). Bu nedenle hastalar ve yakınları, dopaminerjik tedavi özellikle de agonist başlanırken bu riskler konusunda bilgilendirilmelidir (Recommendations | Parkinson’s disease in adults | Guidance | NICE). Ayrıca dopamin agonistleri aşırı gündüz uykululuğu ve ani uyku ataklarına yol açabilir, araç kullanma gibi aktivitelerde dikkatli olunması gerekir. Diğer yaygın yan etkiler arasında ortostatik hipotansiyon, bacak ödemi, bulantı ve halüsinasyonlar sayılabilir. Pramipeksol ve rotigotin gibi ajanlar özellikle somnolans (uyku hali) yapabileceğinden hastalar sedasyon konusunda uyarılmalıdır. Bu ilaçlar böbrek ve karaciğer fonksiyonlarına göre doz ayarlaması gerektirebilir; örneğin pramipeksol esas olarak böbrekten atıldığı için böbrek yetmezliğinde dikkatli olunmalı, ropinirol ise karaciğer metabolizmasıyla atıldığı için karaciğer yetmezliğinde tercih edilmemelidir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Ergolin olmayan agonistler genel olarak daha güvenli kabul edilirken, apomorfin tedavisi özellikle pompa infüzyonu şeklinde uygulandığında bulantı için ön tedavi (domperidon gibi) ve cilt nodülleri gibi lokal yan etkiler açısından özel önlemler gerektirir.
MAO-B İnhibitörleri
Monoamin oksidaz-B (MAO-B) inhibitörleri, beyinde dopaminin yıkımından sorumlu MAO-B enzimini geri dönüşümsüz (selegilin, rasajilin) veya geri dönüşümlü (safinamid) olarak inhibe ederek dopamin düzeylerini artıran ilaçlardır. Bu sayede endojen dopaminin veya verilen levodopanın etkisini uzatır ve motor semptomları bir miktar iyileştirirler. Selegilin ve rasajilin, hafif-orta dereceli semptomları olan özellikle erken evre hastalarda monoterapi olarak kullanılabilir; etkileri levodopa kadar güçlü olmamakla birlikte hastalık seyrinin erken döneminde birkaç yıllık süreyle semptom kontrolü sağlayabilirler ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Ayrıca bu ilaçlar, levodopa tedavisine ek olarak da verilebilir; motor dalgalanmaların başladığı evrede levodopanın yanına eklendiklerinde “wearing-off” süresini kısmen azaltabilirler ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ).
Safinamid, daha yeni bir MAO-B inhibitörüdür ve farklı olarak geri dönüşlü inhibisyon yapar. Safinamidin ayrıca glutamat salınımını azaltıcı etkisi de tanımlanmıştır (voltaja bağlı sodyum kanallarını ve N-tip kalsiyum kanallarını bloke ederek glutamat salımını inhibe eder) ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). Bu nedenle hem dopaminerjik hem de nondopaminerjik etki gösterir. Safinamid monoterapi indikasyonuna sahip değildir; orta-ileri evrede motor dalgalanmaları olan hastalarda levodopaya adjuvan tedavi olarak onay almıştır ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Klinik pratikte, rasajilin ve selegiline benzer şekilde “wearing-off” dönemlerini azaltmak için levodopaya eklenir.
Yan etkiler: MAO-B inhibitörleri genelde iyi tolere edilir. En sık görülen yan etkiler arasında bulantı, baş ağrısı, ağız kuruluğu ve uyku bozuklukları sayılabilir. Selegilin amfetamin benzeri metabolitlere dönüştüğü için uykusuzluk ve ajitasyon yapabileceğinden mümkünse günün erken saatlerinde (öğleden önce) alınması önerilir. Rasajilin böyle metabolitlere sahip değildir ve genelde iyi tolere edilir. Safinamid de benzer şekilde iyi tolere edilen bir ilaçtır; ancak yüksek dozlarda geri dönüşlü MAO-A inhibisyonu da yapabileceğinden tiramin içeren gıdalarla veya diğer serotonerjik ilaçlarla (SSRI, trisiklik antidepresanlar gibi) ciddi etkileşimler olabileceği konusunda dikkatli olunmalıdır. MAO-B inhibitörleri tek başına kullanıldıklarında belirgin hipotansiyon veya impuls kontrol sorunları yapmazlar; dopaminerjik yan etkiler, eşzamanlı levodopa kullanımıyla ilişkili olarak ortaya çıkabilir.
COMT İnhibitörleri
Katekol-O-metil transferaz (COMT) inhibitörleri, periferik sinir sisteminde levodopanın metabolizmasını engelleyen ve böylece levodopa tedavisinin etkinliğini uzatan ajanlardır. Levodopa, periferide DOPA dekarboksilaz haricinde COMT enzimiyle de inaktive edilebilir; COMT inhibitörleri bu yolu engelleyerek daha fazla levodopanın beynin dopaminerjik nöronlarına ulaşmasını sağlar ve plazma levodopa seviyelerini daha stabil hale getirir ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). Entakapon, tolkapon ve opikapon bu sınıftaki onaylı ilaçlardır. Bu ilaçların tek başına klinik etkileri yoktur; mutlaka levodopa ile eş zamanlı kullanılmaları gerekir ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). Entakapon, her levodopa dozuyla birlikte (100 mg levodopaya karşılık tipik olarak 200 mg entakapon) alınır ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). Opikapon ise daha uzun etkili bir COMT inhibitörü olup günde tek doz (genellikle gece) verilmesi yeterlidir.
COMT inhibitörleri, motor dalgalanmaların yönetiminde adjuvan olarak önemli bir yere sahiptir. Parkinson hastalığının orta-ileri evresinde, levodopa dozlarının etkisinin kısaldığı “wearing-off” durumunda, levodopa doz aralıklarını kısaltmak veya kontrollü salınımlı formlara geçmek yeterli olmadığında COMT inhibitörü eklenmesi önerilir (Recommendations | Parkinson’s disease in adults | Guidance | NICE). Bu ilaçlar, ortalama olarak günlük “off” sürelerinde azalma ve “on” sürelerinde uzama sağlayabilir. Örneğin, çift-kör kontrollü çalışmalar COMT inhibitörü eklenmesinin günlük off süresini 1-2 saat azaltarak on dönemini uzattığını göstermiştir ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). Bu iyileşme, hastaların daha uzun süre hareket kabiliyetini korumasına yardımcı olur. Klinik pratikte entakapon, yaygın ve etkili bir seçenektir; opikapon ise benzer etkiyi tek doz rejimiyle sağladığı için hasta uyuncunu artırıcı bir alternatiftir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ).
Tolkapon, sınıfın daha eski bir üyesidir ve merkezi sinir sisteminde de COMT inhibisyonu yaparak güçlü bir etki gösterebilir. Ancak tolkapon kullanımına şiddetli hepatotoksisite vakaları nedeniyle kısıtlamalar getirilmiştir. Karaciğer enzimlerinde yükselmeye ve akut karaciğer hasarına yol açabileceği için tolkapon günümüzde ikinci basamak bir seçenek olarak, entakapon veya opikaponun yetersiz kaldığı durumlarda ve sıkı karaciğer fonksiyon takibi ile kullanılır ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Güncel kılavuzlar tolkaponun rutin kullanımını önermemekte, ancak diğer COMT inhibitörleri ile yeterli yanıt alınamazsa ve sıkı laboratuvar takibi sağlanabilirse tolkapon düşünülebilir demektedir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ).
Yan etkiler: COMT inhibitörlerinin en sık görülen yan etkileri diskinezi artışı, ishal, bulantı ve turuncu renkli idrar çıkarılmasıdır. Diskineziler, levodopanın artan biyoyararlanımı ile ilişkili olarak şiddetlenebilir; bu nedenle COMT inhibitörü başlandığında gerekirse levodopa dozu bir miktar azaltılabilir. Entakapon ayrıca bazı hastalarda hipotansiyon, halüsinasyon veya uyuşukluk yapabilir, bu dopaminerjik yan etkiler genellikle levodopanın etkilerinin potansiyelizasyonu ile ilgilidir. Opikaponun yan etki profili entakaponunkine benzerdir; ancak tek doz alımı nedeniyle gastrointestinal yan etkiler daha az epizodik olabilir. Tolkapon kullanımı ise hepatotoksisite riski nedeniyle yalnızca diğer seçenekler başarısız olursa ve karaciğer enzim kontrolleri düzenli yapılabiliyorsa düşünülmelidir.
Güncel tedavi kılavuzları, levodopa ile motor dalgalanma yaşayan hastalarda ek tedavi ihtiyacı doğduğunda COMT inhibitörleri, MAO-B inhibitörleri veya dopamin agonistlerinin eklenebileceğini belirtmektedir (Recommendations | Parkinson’s disease in adults | Guidance | NICE). Hangi sınıfın seçileceği, hastanın bireysel özelliklerine, yan etki profiline ve tercihlere göre belirlenir. Örneğin, bazı hastalarda hafif kognitif etkiler nedeniyle dopamin agonisti yerine entakapon tercih edilebilirken, bazılarında ise dopamin agonisti tercih edilip gerekirse entakapon eklenebilir. Entakapon ve opikapon etkiliğinde büyük ölçüde benzerdir ve seçimi sıklıkla dozaj sıklığı ve maliyet gibi faktörlere bağlıdır ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ).
Antikolinerjik İlaçlar
Antikolinerjikler, merkezi sinir sisteminde acetilkolin reseptörlerini bloke ederek çalışan ilaçlardır. Parkinson hastalığında dopamin eksikliğine ikincil olarak striatumda göreceli bir kolinerjik aşırı aktivite geliştiği düşünülür; antikolinerjik ilaçlar bu dengesizliği düzeltmeye yardımcı olabilir ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). Tarihsel olarak, antikolinerjik ilaçlar (örn. triheksifenidil, biperiden, benztropin) Parkinson tremorunun tedavisinde sıkça kullanılmıştır ve özellikle genç hastalarda istirahat tremoru belirgin olan vakalarda etkili bulunmuştur ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). Ancak bu yararlı etkilerine rağmen, antikolinerjiklerin yan etki profili ciddi kısıtlılıklar getirmektedir.
Güncel kılavuzlar, antikolinerjiklerin Parkinson tedavisinde rutin kullanımının terk edilmesini önermektedir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Bunun başlıca nedeni, özellikle yaşlı hastalarda kognitif yan etkiler ve demans riskinde artış yapmalarıdır ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). Antikolinerjikler, konfüzyon, sedasyon, hafıza bozukluğu gibi santral sinir sistemi yan etkileri yanında ağız kuruluğu, görme bulanıklığı, idrar retansiyonu ve konstipasyon gibi periferik antikolinerjik yan etkiler de oluşturur. Bu yan etkiler, ileri yaştaki hastalarda tolere edilemez düzeyde olabilir ve bilişsel fonksiyonları bozarak yaşam kalitesini düşürebilir ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). Yapılan çalışmalar, antikolinerjik kullanan Parkinson hastalarında demans gelişimi riskinin artabileceğine işaret etmektedir ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ).
Bu nedenlerle antikolinerjik tedavinin yeri oldukça sınırlıdır. Sadece genç ve bilişsel olarak sağlam hastalarda, belirgin tremor dominansı olan olgularda diğer tedavilere ek olarak düşük doz antikolinerjik düşünülmesi kabul edilebilir bulunmaktadır ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). Bu durumda bile, tedaviye yanıt ve yan etkiler yakından izlenmeli, en düşük etkili doz kullanılmalıdır. Antikolinerjikler hiçbir zaman ilk basamak tedavi olarak tercih edilmemelidir ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). Birden fazla motor bulgunun bulunduğu hastalarda faydaları sınırlı olduğundan, ana endikasyonları tremorla sınırlıdır. Kılavuzlar, ancak çok özel durumlarda (örn. genç, tremoru şiddetli ve diğer tedavilere yanıt vermeyen hasta) antikolinerjiklerin kısa süreliğine denenebileceğini, genel olarak risk-fayda dengesinin olumsuz olması nedeniyle uzak durulması gerektiğini vurgular ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ).
Diğer Farmakolojik Tedaviler
Parkinson hastalığında yukarıda sayılan temel ilaç gruplarının dışında da bazı farmakolojik ajanlar özel durumlar için kullanılır:
- Amantadin: Orijinalde antiviral bir ilaç olan amantadin, NMDA reseptör antagonisti ve dolaylı dopaminerjik etkileri sayesinde Parkinson’da benzersiz bir yere sahiptir. Amantadinin dopaminerjik etkisi, dopamin salınımını artırma ve geri alımını inhibe etme şeklinde açıklanır; ayrıca subtip-NMDA reseptörlerine antagonizma yaparak glutamaterjik transmisyonu modüle eder ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). Klinik olarak en önemli kullanımı, levodopa kaynaklı diskinezilerin tedavisidir. İleri evrede levodopa kullanan ve diskinezi geliştiren hastalarda amantadin, diskinezileri azaltan kanıta dayalı tek oral tedavi seçeneğidir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Çalışmalar amantadinin diskinezi süresini ve şiddetini azaltabildiğini göstermiştir. Ayrıca amantadin, hafif bir antiparkinsonian etkisi nedeniyle erken evrede monoterapi veya adjuvan olarak da zaman zaman kullanılır, ancak etkisi sınırlıdır. Yan etkileri arasında konfüzyon, halüsinasyon, ciltte livedo retikülaris (morumsu ağsı döküntü) ve ayak bileklerinde şişme bulunur ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). Özellikle yaşlı hastalarda kognitif yan etkiler kısıtlayıcı olabilir.
- Apomorfin: Güçlü bir dopamin agonisti olan apomorfin, özellikle ileri evre Parkinson hastalarında, oral tedavi ile kontrol edilemeyen motor dalgalanmalarda kurtarıcı tedavi olarak kullanılır. Subkutan enjeksiyon formu, ani “off” ataklarında hızlı bir şekilde etki ederek hastayı yeniden “on” duruma getirebilir. Ayrıca apomorfin, sürekli subkutan infüzyon (pompa) yoluyla verildiğinde, gün boyu dopaminik uyarı sağlayarak motor dalgalanmaları belirgin ölçüde azaltabilir. Apomorfin tedavisi başlamadan önce hastaya antiemetik (genellikle domperidon) başlanması gerekir, zira güçlü bir emetik etkisi vardır. Ayrıca ciltte nodül gelişimi, hipotansiyon ve sedasyon gibi yan etkiler takip edilmelidir. Apomorfin pompası, invaziv bir tedavi seçeneği olarak, oral tedavi ile yeterli kontrol sağlanamayan dalgalanmaları olan hastalarda gündeme gelir (invaziv tedavilere aşağıda ayrıca değinilecektir).
- Diğer ajanlar: Parkinson hastalığında denenmiş veya özel durumlarda kullanılan başka ilaçlar da mevcuttur. Adenozin A2A reseptör antagonisti istradefylline bazı ülkelerde (örneğin Japonya ve ABD) off dönemleri azaltmak amacıyla onaylanmış olup dopaminerjik tedaviye eklenebilir; ancak ülkemizde henüz rutin kullanımda değildir. Ayrıca eser miktarda dopaminerjik etki gösteren ilaçlar (ör. droxidopa, Northera® adıyla ortostatik hipotansiyonu tedavi için onaylı), veya kolinerjik sistemi modüle eden ajanlar (örn. rivastigmin, donepezil gibi demans gelişen hastalarda) Parkinson’un bazı özel sorunlarında kullanılır ancak bunlar doğrudan temel motor semptom tedavisi değildir.
Yukarıdaki farmakolojik tedavi seçeneklerinin özet bir karşılaştırması aşağıdaki tabloda sunulmuştur:
| İlaç Sınıfı | Örnek İlaçlar | Etkisi/Mekanizma | Kullanım Yeri | Başlıca Yan Etkiler |
|---|---|---|---|---|
| Levodopa + DDC inhibitörü | Levodopa + Karbidopa/Benserazid (Sinemet®, Madopar®) | Dopamin prekürsörü, DOPA dekarboksilaz inhibitörü ile periferik dönüşümü engellenir. | En etkili semptomatik tedavi; orta-ileri yaş veya şiddetli semptomlu hastalarda ilk tercih ([Recommendations | Parkinson’s disease in adults |
| Dopamin agonistleri | Pramipeksol, Ropinirol, Rotigotin (TD bant), Apomorfin (SC enjeksiyon/pompa) | Dopamin reseptörlerini doğrudan uyarır. | Genç hastalarda monoterapi alternatif; levodopa ihtiyacını geciktirme amacıyla kullanılabilir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). İleri evrede levodopaya adjuvan (dalgalanmaları azaltmak için) veya apomorfin ile kurtarma/pompa tedavisi. | İmpuls kontrol bozuklukları (özellikle kumar, hiperseksüalite) (Recommendations | Parkinson’s disease in adults | Guidance | NICE), somnolans, ortostatik hipotansiyon, halüsinasyon, periferal ödem. Ergolin türevlerinde fibrozis riski ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ) (bu nedenle artık kullanılmıyor). | | MAO-B inhibitörleri | Selegilin, Rasajilin, Safinamid | MAO-B enzim inhibisyonu ile dopamin yıkımını azaltır (Safinamid geri dönüşlüdür ve glutamat salımını da azaltır) ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). | Erken evrede monoterapi (hafif semptomlarda) veya levodopaya adjuvan (motor dalgalanmalarda) ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Safinamid sadece adjuvan olarak (monoterapi değildir). | Genelde iyi tolere edilir. Bulantı, baş ağrısı, insomnia (selegilinde amfetamin metabolit nedeniyle) görülebilir. Yüksek tiramin içerikli gıdalarla hipertansiyon (tiramin reaksiyonu) teorik risk. | | COMT inhibitörleri | Entakapon, Opikapon, Tolkapon | Periferik (± santral) COMT enzimini inhibe ederek levodopanın metabolizmasını engeller; levodopa etkisini uzatır ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). | Monoterapi değil, daima levodopa ile birlikte verilir ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). Orta-ileri evrede levodopa “wearing-off” tedavisinde adjuvan; entakapon her levodopa dozu ile, opikapon günde 1 doz. Tolkapon dirençli vakalarda ikinci basamak (hepatotoksisite nedeniyle) ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). | Diskinezilerde artış, bulantı, ishal, idrarda renk değişimi. Tolkapon: Ciddi karaciğer toksisitesi riski ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). | | Antikolinerjikler | Triheksifenidil, Biperiden, Benztropin | Merkezi ve periferik muskarinik reseptör blokajı; striatal dopamin/asetilkolin dengesini düzenler ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). | Sınırlı kullanım alanı: Genç hastada belirgin tremor varsa ve diğer tedavilere yanıt yetersizse ek olarak düşünülebilir. Rutin kullanımı önerilmez (risk-fayda düşüktür) ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). | Kognitif bozukluk, konfüzyon, sedasyon ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ); ağız kuruluğu, bulanık görme, idrar retansiyonu, konstipasyon. Yaşlılarda tolere edilemez yan etkilere yol açabilir. | | NMDA antagonistleri | Amantadin | NMDA tipi glutamat reseptör antagonizması; dolaylı dopamin artırıcı etki (dopamin salınımını artırır) ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ). | İleri evrede levodopa ile ortaya çıkan diskinezilerin tedavisi ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Ayrıca erken evrede hafif semptomlarda ek fayda için veya akinetik kriz gibi durumlarda denenebilir. | Halüsinasyon, ajitasyon, livedo retikülaris (deride mor ağ deseni), ödem. Böbrek yetmezliğinde birikime dikkat (doz ayarı gerekir). |
Tablo 1: Parkinson hastalığında kullanılan başlıca farmakolojik tedavilerin sınıfları, mekanizmaları, endikasyonları ve önemli yan etkilerinin özeti.
İlaç Dışı Müdahaleler (Rehabilitasyon ve Destekleyici Tedaviler)
Parkinson hastalığında ilaç tedavisine ek olarak ilaç dışı müdahaleler, hastaların yaşam kalitesini yükseltmede, semptomlarla baş etmede ve hastalığın getirdiği sakatlıkları azaltmada kritik öneme sahiptir. Multidisipliner bir yaklaşımın parçası olan bu müdahaleler, hastalığın her evresinde tıbbi tedaviyi tamamlayıcı rol oynar ( Exercise for People with Parkinson’s Disease: Updates and Future Considerations – PMC ). Özellikle Dünya Sağlık Örgütü ve çeşitli ulusal kılavuzlar, Parkinson hastalarının tanı anından itibaren uzman bir multidisipliner bakım ekibine erişimini vurgulamaktadır ( Exercise for People with Parkinson’s Disease: Updates and Future Considerations – PMC ). Bu kapsamda fizyoterapi, ergoterapi, konuşma terapisi ve psikososyal destek gibi yaklaşımlar standard bakımın parçası olmalıdır.
Psikoeğitim ve Psikososyal Destek
Psikoeğitim, hastanın ve ailesinin Parkinson hastalığı hakkında kapsamlı bilgi edinmesini, hastalığın seyri, tedavi seçenekleri, ilaç kullanımının önemi ve olası yan etkiler gibi konularda bilinçlenmesini sağlar. Hastalığa uyum sürecinde bilgi sahibi olmak, belirsizliği azaltarak hastanın kontrol duygusunu artırır ve baş etme becerilerini kuvvetlendirir. Kılavuzlar, tedaviye başlarken hasta ve bakımverenlerine hastalığın gidişatı, tedavi planı ve ortaya çıkabilecek sorunlar hakkında sözlü ve yazılı bilgiler verilmesini ve bu bilginin verildiğinin kaydedilmesini önermektedir (Recommendations | Parkinson’s disease in adults | Guidance | NICE). Bu eğitim, ilaçların düzenli kullanımı, egzersizin önemi, beslenme ve uyku düzeni gibi konuları da içerir. Psikoeğitim sayesinde hasta, kendi belirtilerini tanımayı, ne zaman doktora başvurması gerektiğini ve günlük yaşamda hangi uyarlamaları yapabileceğini öğrenir.
Destek grupları ve sosyal destek de Parkinson hastalarının ruhsal iyilik hali için büyük önem taşır. Hasta destek grupları, benzer deneyimleri yaşayan bireyleri bir araya getirerek tecrübe paylaşımını mümkün kılar ve hastalıkla yaşam konusunda birbirlerine moral desteği verir. Bu gruplar, hastaların yalnızlık duygusunu azaltır, sosyal etkileşimi artırır ve depresyon/anksiyete gibi psikiyatrik eşliklerin hafifletilmesine katkıda bulunur. Aile ve bakım verenler için de destek grupları mevcuttur; böylece hasta yakınları da hastalıkla baş etme yöntemleri, bakım verme becerileri ve kendi psikolojik dayanıklılıklarını artırma konusunda bilgi ve destek alabilir.
Hastalar ve aileleri için ayrıca profesyonel psikolojik danışmanlık veya terapi de gerekebilir. Parkinson hastalığı kronik ve ilerleyici bir durum olduğu için, tanı alındıktan sonra oluşabilecek uyum sorunları, yas reaksiyonu, depresyon veya anksiyete bozuklukları profesyonel müdahale gerektirebilir. Bireysel psikoterapi veya aile terapisi, hastalığın duygusal yükünü hafifletmeye yardımcı olabilir.
Sağlık ekibinin bir üyesi olarak Parkinson hemşireleri veya sosyal hizmet uzmanları da psikososyal desteğin sağlanmasında kritik rol oynar. Bu profesyoneller, hastaların bakım koordinasyonunu, eğitimini ve gerektiğinde ev ziyaretlerini yaparak bütüncül bir destek sunar. NICE kılavuzları, Parkinson hastalarının güvenilir bir bilgi kaynağına ve ihtiyaç halinde sosyal-hukuki konularda danışmanlığa erişiminin önemini vurgular (Recommendations | Parkinson’s disease in adults | Guidance | NICE). Sonuç olarak, psikoeğitim ve psikososyal destek, Parkinson hastalarının kendi hastalıklarını daha iyi yönetmelerine ve ruhsal olarak daha güçlü olmalarına katkıda bulunur.
Fizyoterapi ve Egzersiz
Fizyoterapi, Parkinson hastalarının hareket kabiliyetini koruma ve geliştirmede en temel destekleyici tedavilerden biridir. Parkinson’da görülen bradikinezi (hareketlerde yavaşlama), rijidite (kas sertliği), postüral instabilite (duruş bozukluğu ve denge kaybı) ve yürüyüş bozuklukları gibi motor sorunlar, özel fizyoterapi programları ile belirli ölçüde düzeltilebilir. Güncel uluslararası öneriler, Parkinson hastalarının tanı aldıkları andan itibaren fizyoterapist rehberliğinde düzenli egzersiz ve fizik tedavi programlarına yönlendirilmesini desteklemektedir ( Exercise for People with Parkinson’s Disease: Updates and Future Considerations – PMC ). Özellikle son yıllarda artan kanıtlar, egzersizin hem motor hem de non-motor belirtiler üzerine olumlu etkileri olduğunu göstermiştir ( Exercise for People with Parkinson’s Disease: Updates and Future Considerations – PMC ).
Fizyoterapinin Parkinson’daki amaçları arasında: kas kuvvetini ve esnekliğini artırmak, dengenin geliştirilmesi, yürüme hızının ve yürüyüş düzeninin iyileştirilmesi, duruşun düzeltilmesi ve düşme riskinin azaltılması bulunur. 2023 yılında yayımlanan kapsamlı bir Cochrane derlemesi, Parkinson’da fiziksel egzersizin etkinliğini değerlendiren 154 randomize kontrollü çalışmayı analiz etmiş ve çok çeşitli egzersiz türlerinin motor fonksiyonlarda ve yaşam kalitesinde anlamlı iyileşmeler sağladığını teyit etmiştir ( Exercise for People with Parkinson’s Disease: Updates and Future Considerations – PMC ). Bu analizde dans, su içi terapi (havuz egzersizleri), yürüyüş/denge fonksiyonel egzersizleri, zihin-beden egzersizleri (örneğin Tai Chi, yoga), direnç (kuvvet) antrenmanları ve endurans (dayanıklılık) antrenmanları gibi farklı modalitelerin hepsinin faydalı olabildiği gösterilmiştir ( Exercise for People with Parkinson’s Disease: Updates and Future Considerations – PMC ). Önemli bir bulgu, farklı egzersiz türleri arasında etkinlik açısından büyük farklar olmamakla birlikte, düzenli ve sürekli egzersiz yapmanın esas olduğudur ( Exercise for People with Parkinson’s Disease: Updates and Future Considerations – PMC ). Yani hastanın zevk aldığı ve sürdürebileceği herhangi bir egzersiz tipi, yapmayıp hareketsiz kalmasından çok daha iyidir.
Klinik uygulamada fizyoterapi; bireysel egzersiz programları, grup egzersizleri ve cihaz destekli rehabilitasyon şeklinde olabilir. Bireysel fizyoterapi, hastanın spesifik ihtiyaçlarına göre tasarlanır: Denge sorunu ön planda olan bir hastada denge egzersizleri ve ayak koordinasyon çalışmaları, donma (freezing) yaşayan hastada ritmik uyarılarla yürüyüş eğitimi (metronom veya görsel çizgi kullanımı gibi), genel hareketsizlik sorunu olan hastada aerobik egzersizler planlanır. Grup egzersizleri sosyal motivasyonu artırarak egzersize devamlılığı sağlayabilir; Parkinson dans sınıfları veya Tai Chi grupları bu konuda popülerdir. Cihaz destekli rehabilitasyon kapsamında ise koşu bandı üzerinde yürüyüş eğitimi (gerekirse vücut ağırlığı destekli), sanal gerçeklik uygulamaları veya robotik yürüme cihazları kullanılabilir. Her hastanın gereksinimine göre, fizyoterapide çeşitli teknikler (PNF teknikleri, LSVT BIG gibi özel Parkinson egzersiz programları, gevşeme teknikleri, germe egzersizleri vb.) kombine edilir.
Kılavuzlar, Parkinson hastalarında haftada en az 2-3 kez, toplamda haftada 150 dakikaya varan (haftada ~3 saat) orta yoğunluklu fiziksel aktiviteyi hedeflemeyi önermektedir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Alman Parkinson uzmanlık kılavuzu, mümkünse haftada 3 saat olacak şekilde fizyoterapi uygulanmasını, bu devamlılık sağlanamıyorsa hastanın kendi kendine ev programıyla egzersiz yapmasının teşvik edilmesini belirtmiştir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Egzersizin sürekliliği, hastalığın ilerlemesini yavaşlatmasa bile hastanın fonksiyonel kapasitesini daha uzun süre muhafaza etmesini sağlar. Ayrıca fiziksel egzersiz, yalnızca motor belirtilere değil, kognitif fonksiyonlara, depresif belirtilere ve yorgunluk gibi non-motor semptomlara da olumlu etkiler yapabilir. Araştırmalar düzenli egzersiz yapan Parkinson hastalarında düşme sıklığının azaldığını, yürüme hızının arttığını ve günlük yaşam aktivitelerini daha bağımsız yapabildiklerini göstermektedir ( Exercise for People with Parkinson’s Disease: Updates and Future Considerations – PMC ) ( Exercise for People with Parkinson’s Disease: Updates and Future Considerations – PMC ).
Mesleki Terapi (Ergoterapi)
Mesleki terapi (ergoterapi), Parkinson hastalarının günlük yaşam aktivitelerinde karşılaştıkları güçlükleri aşmalarına yönelik beceri geliştirme ve adaptasyon tekniklerini içerir. Hastalığın ilerlemesiyle birlikte giyinme, yemek yeme, kişisel bakım, yazı yazma gibi günlük işler zorlaşabilir. Ergoterapistler, hastanın bu aktiviteleri mümkün olan en bağımsız şekilde yapabilmesi için çevresel düzenlemeler ve egzersizler planlar. Örneğin, ince motor beceriler azaldığında özel kalemler veya çatal-kaşıklar kullanmak, giyinmeyi kolaylaştıracak cırtcırtlı ayakkabı, tutacaklı bardak gibi yardımcı araçlar sağlamak ergoterapinin alanına girer.
Güncel öneriler, Parkinson hastalarında el becerilerinde bozulma, yazı yazmada zorluk (mikrografi), ev içi işlerde veya iş yaşamında aksama varsa ergoterapi desteği verilmesini öngörür ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Ergoterapi seanslarında el-göz koordinasyonu, ince motor beceri egzersizleri, el kuvvetini koruyucu aktiviteler uygulanabilir. Ayrıca ergoterapistler, hastanın ev ve iş ortamında düzenlemeler yaparak güvenliği artırır (örn. banyoda kaymaz paspas, evde düzgün aydınlatma, merdivenlere tırabzan eklenmesi gibi). Amaç, hastanın günlük yaşamında mümkün olan en az yardımla, en güvenli ve verimli şekilde işlev görebilmesidir.
Erken dönemde ergoterapi, hastaya hastalığın getirebileceği zorluklara karşı proaktif stratejiler öğretebilir. Örneğin, “dona kalma” (freezing) yaşayan bir hastaya, yerdeki karo çizgilerini adımlama veya bir metronom sesiyle adım atma yöntemi öğretilebilir ki takılma anlarında hareketi yeniden başlatabilsin. Yazı yazarken harfleri büyük ve belirgin yazma alıştırmaları (LSVT BIG programının bir parçası olarak) yapılabilir. İleri evrede ise yardımcı cihazların kullanımı (yürüteç, tekerlekli sandalye, özel duş sandalyesi vb.) konusunda eğitim verilebilir.
Konuşma ve Yutma Terapisi
Parkinson hastalığı, motor belirtilerin yanı sıra konuşma ve yutma fonksiyonlarını da etkileyebilir. Hastalarda sıklıkla hipofoni (konuşma sesinin kısık ve tekdüze olması), dizartri (artikülasyon bozukluğu) ve konuşma hızının artması gibi konuşma problemleri görülür. Ayrıca ilerleyen hastalıkla birlikte yutma güçlüğü (disfaji) de ortaya çıkabilir ki bu aspirasyon pnömonisi riskini artıran ciddi bir sorundur.
Bu nedenle konuşma terapisi (logopedi), Parkinson hastalarının rehabilitasyonunda önemli bir yer tutar. Özellikle Lee Silverman Voice Treatment (LSVT LOUD) gibi özel konuşma terapisi programlarının Parkinson hastalarında ses yüksekliğini ve anlaşılabilirliği artırdığı gösterilmiştir. Konuşma terapistleri hastayla diyafragmatik solunum, yüksek sesle konuşma egzersizleri, yavaş ve vurgulu konuşma pratikleri yaparlar. Amaç, hastanın iletişim becerisini koruması, sosyal etkileşimini sürdürebilmesidir. Kılavuzlar, Parkinson’a bağlı konuşma bozukluğu gelişen tüm hastalara konuşma terapisi önerilmesi gerektiğini belirtir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Bu terapiler mümkünse hastalığın erken döneminde başlatılmalı, hastaya sesini nasıl projekte edeceği ve konuşurken nelere dikkat edeceği öğretilmelidir.
Yutma terapisi de multidisipliner yaklaşımın bir parçasıdır. Parkinson hastalarında yutma refleksinin yavaşlaması, faringeal kasların koordinasyonunun bozulması ile disfaji görülebilir. Yutma terapisi, konuşma terapistleri veya yutma konusunda uzmanlaşmış fizyoterapistler tarafından yapılabilir. Hastaya uygun yutma teknikleri (örn. chin-tuck manevrası gibi), yutma egzersizleri ve diyet modifikasyonları (kıvamlı gıdalar, küçük lokmalar, dik pozisyonda yeme vb.) öğretilir. Videofloroskopik yutma çalışmaları ile aspirasyon riski değerlendirilebilir ve terapinin hedefleri belirlenebilir. Yutma güçlüğü olan hastalarda, aspirasyonu önlemek için gerekirse beslenme şekli (örneğin PEG ile beslenme) yeniden düzenlenir, ancak bu en son çare olarak düşünülür.
Konuşma ve yutma terapileri, hastanın hem yaşam kalitesini yükseltir hem de aspirasyon pnömonisi gibi hayati riskleri azaltır. Bu nedenle Parkinson hastalığının ilerleyen evrelerinde bu alanlarda sorun yaşayan hastalar düzenli olarak değerlendirilmeli ve gerekli rehabilitatif müdahaleler yapılmalıdır ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ).
Diğer Destekleyici Yaklaşımlar
Parkinson hastalarının ihtiyaçlarına göre ek bazı destekleyici yöntemler de uygulanabilir:
- Beslenme düzeni: Özellikle levodopa kullanan hastalarda proteinlerin ilacın emilimini etkileyebileceği göz önüne alınarak, diyette protein alımının gün içine dağıtılması veya proteinlerin akşam saatine bırakıldığı “Protein redistribüsyon diyeti” gibi yaklaşımlar önerilebilir. Kabızlık Parkinson’da yaygın bir sorundur; liften zengin diyet ve yeterli sıvı alımı konusunda diyetisyen desteği faydalı olur. Ayrıca kilo kaybı yaşayan ileri evre hastalarda kalori alımını artırmaya yönelik beslenme planları yapılır.
- Uyku hijyeni ve dinlenme: Parkinsonda gece uykusunu bozan sıkıntılar (gece akinezi, sık idrara çıkma, REM uykusu davranış bozukluğu vb.) olabildiğinden, nörolog ve gerekiyorsa uyku uzmanları ile iş birliği yapılarak hastaya uygun uyku hijyeni ve gerekirse ilaç tedavileri düzenlenir. Gündüz şekerlemelerinin sınırlandırılması, düzenli uyku alışkanlıkları teşvik edilir.
- Mesleki ve sosyal uyum: Hastalığın ilk evrelerinde çalışan hastalar için işyerinde bazı uyarlamalar (esnek çalışma saatleri, iş yükünün azaltılması gibi) gerekebilir. Hastaların sosyal hayattan kopmamaları için hobilerini sürdürmeleri, Parkinson dansları, müzik terapi, resim gibi sanatsal terapiler ile uğraşmaları teşvik edilir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Bu tür uğraşılar hem fiziksel aktivite sağlar hem de ruhsal açıdan destek olur.
- Bakım veren desteği: Hastaların yanı sıra onlara bakım veren aile üyelerinin de eğitimi ve psikolojik desteği unutulmamalıdır. Bakıcıların doğru transfer teknikleri, ev içinde güvenliği artırma, hastanın ilaç takibini yapma konularında bilgilenmesi sağlanır. Ayrıca bakım verene gerektiğinde dinlenme (respite) hizmetleri veya evde bakım desteği sunulması, tükenmişlik sendromunu önlemek açısından değerlidir.
- İnvaziv girişimler (Cerrahi tedavi): Her ne kadar soruda özellikle ilaç dışı cerrahi olmayan müdahaleler vurgulanmış olsa da, kısaca değinmek gerekirse, Parkinson hastalığının ileri evrelerinde medikal tedavi ile kontrol edilemeyen motor komplikasyonlarda derin beyin stimülasyonu (DBS) gibi cerrahi tedaviler veya ilaç infüzyon pompaları (örn. duodopa intestinal jel pompası, apomorfin pompası) gündeme gelebilir. Bu tedaviler uygun hasta grubunda motor fonksiyonları belirgin ölçüde iyileştirebilir. Cerrahi tedavi adayları multidisipliner bir değerlendirmeden geçirilmeli ve her merkezin kriterlerine uygun olarak seçilmelidir.
Özetle, Parkinson hastalığında ilaç dışı müdahaleler, hastalığın getirdiği çok boyutlu zorluklarla başa çıkmada vazgeçilmezdir. Düzenli egzersiz ve fizyoterapi, hastaların daha uzun süre bağımsız kalmalarına yardımcı olurken; konuşma ve yutma terapileri iletişim ve beslenme güvenliğini sağlar. Mesleki terapi günlük işlevselliği artırır, psikososyal destek ise ruh sağlığını korur. Bu destekleyici tedaviler, farmakolojik tedaviyle entegre bir şekilde uygulanmalı ve her hasta için bireyselleştirilmelidir.
Parkinson Hastalığında Genetik Nedenler ve Kalıtım
Parkinson hastalığı uzun yıllar idiopatik (sebebi bilinmeyen) kabul edilmiş olsa da, son birkaç onyılda yapılan araştırmalar genetik faktörlerin önemli bir rol oynadığını ortaya koymuştur. Hem nadir görülen yüksek penetranslı gen mutasyonları (ailesel Parkinson vakalarından sorumlu olan monogenik formlar) hem de yaygın fakat düşük risk artışı sağlayan gen varyantları (spontan/sporadik Parkinson riskini bir miktar artıran poligenik faktörler) tanımlanmıştır (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease). Ayrıca erken başlangıçlı Parkinson olgularının önemli bir kısmında otozomal resesif kalıtım söz konusudur, yani her iki ebeveynden geçen hatalı gen kopyaları hastalığa yol açmaktadır (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease). Bu bölümde Parkinson hastalığında en iyi tanımlanmış genetik nedenler olan LRRK2 ve SNCA (alfa-sinüklein) genlerindeki varyantlar ile erken başlangıçlı formlara yol açan otozomal resesif genler ele alınacaktır.
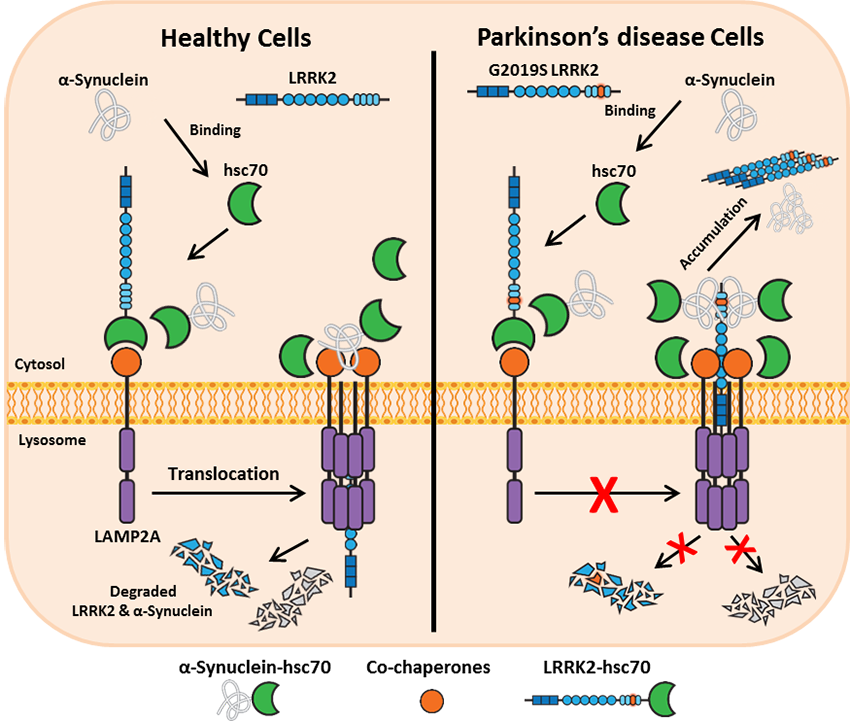
LRRK2 Genindeki Varyantlar (Leucine-Rich Repeat Kinase 2)
LRRK2 geni (12. kromozom üzerinde, “dardarina” olarak da bilinir), Parkinson hastalığında tanımlanmış en önemli genlerden biridir. LRRK2 proteini, kinaz aktivitesi olan büyük bir enzimdir ve hücre içinde sinyal yollarında, veziküler transportta ve otofajide rol oynar. LRRK2 genindeki mutasyonlar ilk olarak 2004 yılında tespit edilmiş ve otozomal dominant kalıtımla Parkinson hastalığına neden olduğu gösterilmiştir. LRRK2 mutasyonları, özellikle ailesel (ailesinde birden çok Parkinson vakası olan) hastalarda görece sık görülür. Dünya genelinde en yaygın görülen monogenik Parkinson nedeni LRRK2 mutasyonlarıdır denilebilir (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease). Araştırmalara göre, farklı popülasyonlarda Parkinson hastalarının %1 ile %10 kadarı LRRK2 genindeki patojenik varyantları taşır (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease). Özellikle G2019S mutasyonu, LRRK2 geninde en sık rastlanan hastalık yapıcı değişimdir ve bazı etnik gruplarda oldukça yüksek oranda görülür: Aşkenazi Yahudi kökenli Parkinson hastalarında yaklaşık %20-30 oranında, Kuzey Afrika Berberi kökenli hastalarda %30-40 oranında G2019S mutasyonu saptanmıştır ( LRRK2 and Parkinson’s disease: from genetics to targeted therapy – PMC ). Buna karşın Doğu Asya popülasyonunda G2019S hemen hemen hiç görülmez; bu da genetik riskin etnik kökene göre büyük değişkenlik gösterebildiğini yansıtmaktadır ( LRRK2 and Parkinson’s disease: from genetics to targeted therapy – PMC ).
LRRK2 mutasyonlarının penetransı (belirli bir mutasyonu taşıyan bireylerin hastalığı geliştirme olasılığı) tam değildir, yani mutasyonu taşıyan herkes Parkinson hastası olmaz. Penetransın yaşa bağımlı olduğu, ileri yaşlarda arttığı bilinmektedir. Örneğin LRRK2 p.G2019S mutasyonunu taşıyan bireylerde yaşam boyu hastalık gelişme riski ortalama ~%25 civarında rapor edilmiştir (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease). Başka bir deyişle, G2019S taşıyan her dört kişiden biri yaşam süresi içinde Parkinson belirtileri geliştirmektedir (farklı çalışmalarda %17 ila %85 gibi geniş aralıklar bildirilmiş olup, penetrans üzerinde diğer genlerin ve çevresel faktörlerin etkisi olabileceği düşünülmektedir) ( LRRK2 and Parkinson’s disease: from genetics to targeted therapy – PMC ). Bu penetrans oranı, klasik yüksek penetranslı genetik hastalıklardan düşüktür ve LRRK2 taşıyıcılarının önemli bir kısmının yaşam boyu sağlıklı kalabileceğini gösterir; dolayısıyla LRRK2 genindeki patojen mutasyonlar tam penetrant olmayan dominant mutasyonlar olarak sınıflandırılır. Penetransı etkileyebilecek modifiye edici faktörler arasında diğer gen varyantları (ör. MAPT, GBA, PARK16 lokusu gibi) ve çevresel riskler incelenmiştir ( LRRK2 and Parkinson’s disease: from genetics to targeted therapy – PMC ) ( LRRK2 and Parkinson’s disease: from genetics to targeted therapy – PMC ), ancak henüz net bir belirleyici tanımlanmamıştır.
LRRK2 geninde tanımlanmış yüksek penetranslı mutasyonlar arasında p.G2019S dışında p.R1441C/G/H mutasyonları, p.Y1699C ve p.I2020T sayılabilir. Özellikle R1441H mutasyonunun penetransının %70’in üzerinde olabileceği bazı aile çalışmalarında öne sürülmüştür (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease). Bu mutasyonlar nadir olmakla birlikte taşıyıcılarında Parkinson hastalığı gelişme ihtimali oldukça yüksektir ve genellikle ailesel Parkinson fenotipine yol açarlar. LRRK2 ilişkili Parkinson hastalığı (LRRK2-PD), klinik olarak idiopatik Parkinson’dan büyük ölçüde ayırt edilemez; tipik olarak orta-ileri yaş başlangıçlı, klasik motor bulgularla seyreden bir tablodur. İlginç bir bulgu, LRRK2 mutasyonlu hastaların patolojik incelemesinde her zaman Lewy cisimciklerinin bulunmayabileceğidir – bazı LRRK2-PD vakalarında Alzheimer benzeri patoloji veya hiç tipik patoloji olmadan sadece substantia nigra dejenerasyonu rapor edilmiştir ( LRRK2 and Parkinson’s disease: from genetics to targeted therapy – PMC ). Yani LRRK2 mutasyonu, Parkinson fenotipine yol açsa da altta yatan mekanizma ve patoloji çeşitlilik gösterebilir (örn. LRRK2 mutasyonu hem Lewy cisimcikli Parkinson hem de Lewy cisimciksiz saf nigral dejenerasyon yapabilir). Bu da LRRK2-Parkinson’un biyolojik olarak heterojen bir alt grup olduğunu düşündürür.
LRRK2 geninde ayrıca düşük penetranslı veya risk artırıcı varyantlar da tanımlanmıştır. Bu varyantlar tek başlarına hastalığa yol açmaz ancak taşıyıcılarda Parkinson gelişme ihtimalini genel popülasyona kıyasla istatistiksel olarak artırır. En iyi bilinen örnekler, Doğu Asya popülasyonlarında sık görülen p.G2385R ve p.R1628P varyantlarıdır. Bu değişimler LRRK2 proteininde işlev kaybına yol açmayan, ancak yapısal farklılık oluşturan tek nükleotid polimorfizmleridir. Çin ve diğer Uzak Doğu kökenli bireylerde yapılan çalışmalar, G2385R ve R1628P taşıyan kişilerde Parkinson riskinin yaklaşık 2 kat arttığını ortaya koymuştur ( LRRK2 and Parkinson’s disease: from genetics to targeted therapy – PMC ). Ancak bu risk artışı mutasyonu taşıyan herkesin hasta olacağı anlamına gelmez; çoğu taşıyıcıda hastalık gelişmez. Bu nedenle G2385R ve R1628P, LRRK2’nin düşük penetranslı risk alelleri olarak kabul edilir. İlginç olarak LRRK2 geninde koruyucu etkisi olabilecek bazı polimorfizmler de saptanmıştır; örneğin p.N551K–p.R1398H–p.K1423K haplotipinin farklı popülasyonlarda Parkinson riskini azalttığı bildirilmiştir ( LRRK2 and Parkinson’s disease: from genetics to targeted therapy – PMC ). Bu bulgu, LRRK2 genetik spektrumunun hem risk artırıcı hem de azaltıcı varyantlar içerdiğini göstermektedir.
Özetle, LRRK2 mutasyonları Parkinson hastalığında önemli bir genetik faktördür. Yüksek penetranslı formları otozomal dominant ailesel Parkinson’a yol açabilir (özellikle G2019S ve R1441 mutasyonları sık görülür), ancak bu mutasyonlar bile tam penetransa sahip değildir ve çevresel/genetik diğer faktörlerin etkileşimiyle hastalık ortaya çıkar. Düşük penetranslı varyantlar ise toplumda daha yaygın olup (özellikle Doğu Asya’da), bireysel riskte küçük artışlar yaratır. Bu nedenle LRRK2, hem monogenik hastalık nedeni hem de poligenik risk faktörü olarak iki yönlü bir öneme sahiptir.
SNCA Genindeki Varyantlar (Alfa-sinüklein)
SNCA (alfa-sinüklein) geni, Parkinson hastalığı ile ilişkilendirilen ilk gendir ve hastalığın patogenezinde kilit rol oynayan alfa-sinüklein proteininin kodunu taşır. SNCA genindeki anormallikler nadir olmakla birlikte, tespit edildikleri ailelerde yüksek penetrans ile otozomal dominant Parkinson hastalığına yol açar. 1997 yılında İtalya’daki Contursi ailesinde keşfedilen A53T mutasyonu, Parkinson hastalığında tanımlanan ilk genetik defekttir ve alfa-sinüklein proteininde bir amino asit değişimine neden olarak erken başlangıçlı, ailesel bir parkinsonizm tablosu oluşturur ( Four Copies of SNCA Responsible for Autosomal Dominant Parkinson’s Disease in Two Italian Siblings – PMC ). Bunu takiben SNCA geninde başka nadir missense mutasyonlar da tanımlanmıştır: Örneğin A30P, E46K, H50Q mutasyonları farklı ailelerde Parkinson’a neden olmuştur ( Genetic Variants in SNCA and the Risk of Sporadic Parkinson’s Disease and Clinical Outcomes: A Review – PMC ). Bu mutasyonların taşıyıcılarında hastalık genelde orta yaş civarında başlar ve klasik parkinsonizm belirtilerine ek olarak daha belirgin nöropsikiyatrik bulgular (daha erken ve şiddetli demans, psikiyatrik semptomlar) görülebilir (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease). SNCA gen mutasyonları, yüksek penetranslı kabul edilir; örneğin A53T mutasyonunu taşıyan hemen herkeste yaşam boyu Parkinson hastalığı veya benzer bir sinükleopati (Lewy cisimcikli demans gibi) gelişmektedir. Ancak H50Q gibi bazı varyantların patojenik olup olmadığı tartışmalıdır; H50Q taşıyan bazı hastalar tanımlansa da genel popülasyonda da nadiren görülebilen bu varyantın tek başına hastalık yapıcı olmadığı görüşü vardır (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease) (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease). Dolayısıyla, SNCA geninde kesin olarak hastalık yapıcı kabul edilen mutasyonlar A53T, E46K, A30P gibi birkaç mutasyonla sınırlıdır ve bunlar oldukça nadirdir.
SNCA geninin Parkinson ile ilişkisindeki bir diğer mekanizma, gen çoğalması (duplikasyon veya triplikasyon) şeklindedir. SNCA geninin genomda normalde 2 kopyası bulunurken, duplikasyon ile 3 kopya, triplikasyon ile 4 kopya oluşabilir. Bu durum, gen ürününün (alfa-sinüklein proteininin) aşırı ekspresyonuna yol açar. Dikkat çekici bir şekilde, SNCA triplikasyonu taşıyan ailelerde mutasyon taşıyan bireylerin hepsi hemen hemen Parkinson hastalığı geliştirir – yani tam penetranslıdır ( Four Copies of SNCA Responsible for Autosomal Dominant Parkinson’s Disease in Two Italian Siblings – PMC ). Üstelik SNCA kopya sayısı arttıkça hastalığın başlangıç yaşı erken ve seyri daha kötü olmaktadır; triplikasyon taşıyan bireylerde hastalık genellikle genç yaşlarda başlar ve hızlı ilerler, ağır demans ve otonomik disfonksiyon gibi belirtiler sık eşlik eder ( Four Copies of SNCA Responsible for Autosomal Dominant Parkinson’s Disease in Two Italian Siblings – PMC ). SNCA duplikasyonları ise gen ekspresyonunu orta düzeyde artırır ve hastalığa yol açabilir; ancak duplikasyon taşıyan her bireyde hastalık gelişmeyebilir, yani duplikasyonlar değişken penetransa sahiptir ( Four Copies of SNCA Responsible for Autosomal Dominant Parkinson’s Disease in Two Italian Siblings – PMC ). Bazı duplikasyon taşıyan geniş ailelerde, mutasyonu taşıyan bireylerin bir kısmının ileri yaşlara gelmesine rağmen hasta olmadığı bildirilmiştir (Disease Penetrance of Late-Onset Parkinsonism: A Meta-analysis) (Clinical heterogeneity of α‐synuclein gene duplication in …). Gen dozu etkisi, SNCA çoğalmalarında net olarak gözlemlenmiştir: Dört kopya (triplikasyon veya iki alelde duplikasyon) taşıyanlar üç kopya (tek duplikasyon) taşıyanlara göre daha erken ve ağır hastalık seyrine sahiptir ( Four Copies of SNCA Responsible for Autosomal Dominant Parkinson’s Disease in Two Italian Siblings – PMC ).
SNCA geninin düşük riskli varyantları da Parkinson hastalığında önemli bir yer tutar. Özellikle genom-düzeyinde tarama çalışmalarında (GWAS), SNCA gen bölgesindeki bazı yaygın polimorfizmlerin sporadik Parkinson hastalığı riskini artırdığı tutarlı şekilde bulunmuştur ( Genetic Variants in SNCA and the Risk of Sporadic Parkinson’s Disease and Clinical Outcomes: A Review – PMC ) ( Genetic Variants in SNCA and the Risk of Sporadic Parkinson’s Disease and Clinical Outcomes: A Review – PMC ). Bu polimorfizmler genel popülasyonda sık görülen tek nükleotid değişiklikleri veya kısa tekrar varyasyonları olabilir. Örneğin, SNCA geninin promotör bölgesindeki Rep1 polimorfizmi ve intronik bölgedeki rs356219 gibi SNP’ler, Parkinson riskini istatistiksel olarak artıran varyantlar olarak tanımlanmıştır (A systematic review of associations between common SNCA …). Bu tür varyantlar, herhangi bir belirtiye yol açmaz ancak popülasyon bazında bakıldığında belirli alleli taşıyan kişilerde Parkinson görülme olasılığı bir miktar yüksektir. Her bir polimorfizmin riske katkısı küçük olsa da, SNCA lokusundaki bu varyantlar Parkinson için en güçlü genetik risk faktörlerinden biri olarak kabul edilir ( Genetic Variants in SNCA and the Risk of Sporadic Parkinson’s Disease and Clinical Outcomes: A Review – PMC ). Örneğin bazı çalışmalarda SNCA risk alellerini taşıyan bireylerde yaşam boyu Parkinson gelişme riskinin ~1.5 kat arttığı rapor edilmiştir. Bu, bireysel düzeyde çok büyük bir risk artışı olmasa da, toplum düzeyinde SNCA bölgesinin hastalık yüküne anlamlı katkı yaptığını gösterir. Nitekim, 90’dan fazla ortak varyantın ilişkilendirildiği son geniş kapsamlı GWAS analizlerinde bile SNCA lokusu en güçlü sinyallerden biri olmaya devam etmektedir (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease).
SNCA gen varyantlarının klinik etkilerine bakıldığında, yüksek penetranslı mutasyon/çoğalmaların yol açtığı hastalık genelde daha yaygın kognitif bozukluk ve demans ile seyretme eğilimindedir. Alfa-sinüklein proteini, Parkinson patolojisinin temelini oluşturan Lewy cisimciklerinin majör bileşenidir. SNCA mutasyonu veya çoğalması taşıyan hastaların post-mortem incelemelerinde, yaygın alfa-sinüklein birikimi ve Lewy cisimciklerine ek olarak sıklıkla Alzheimer benzeri patolojiler (amiloid plaklar, tau nörofibriler yumaklar) da bulunabilmektedir (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease). Örneğin SNCA mutasyon taşıyıcılarında motor semptomların başlamasından 5-15 yıl sonra yaklaşık hastaların %50’sinde demans geliştiği, oysa idiyopatik Parkinson’da benzer süre sonunda demans oranının %30’larda olduğu bildirilmiştir (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease). Bu veriler, alfa-sinüklein patogenezindeki değişikliklerin (mutasyon veya aşırı üretim yoluyla) hastalığın fenotipini de etkileyebildiğini göstermektedir.
Özetlemek gerekirse, SNCA genindeki anormallikler nadir fakat önemlidir. Yüksek penetranslı formları (nokta mutasyonlar ve gen çoğalmaları) klasik otozomal dominant Parkinson tabloları oluşturur ve genellikle erken başlangıçlı, hızlı seyirli ve bilişsel tutulumun belirgin olduğu bir klinik fenotipe yol açar. Düşük riskli SNCA varyantları ise toplumda yaygın olup, tek başlarına hastalık yapmazlar ancak sporadik Parkinson hastalığı için genetik yatkınlığı artırırlar. Bu nedenle SNCA, bir yandan ailesel Parkinson nedenlerinden biri, diğer yandan da sporadik vakalarda risk faktörü olması açısından çifte öneme sahip bir gendir.
Erken Başlangıçlı Otozomal Resesif Parkinson (Parkin, PINK1, DJ-1 ve Diğerleri)
Parkinson hastalığı tipik olarak 60’lı yaşlarda ortaya çıksa da, 40 yaşından önce başlayan olgular erken başlangıçlı Parkinson olarak adlandırılır ve bu grup içinde genetik nedenlerin payı daha yüksektir. Özellikle otozomal resesif kalıtım gösteren bazı genetik bozukluklar, 20’li, 30’lu yaşlarda Parkinson semptomlarının başlamasına yol açabilir. Bu durumlarda anne ve babanın her ikisinden alınan birer hatalı gen kopyasının birleşmesi sonucu hastalık ortaya çıkar; ebeveynler genellikle hastalık belirtisi göstermez (taşıyıcıdır).
Erken başlangıçlı ailesel Parkinsonun en sık nedeni Parkin (PARK2, PRKN) gen mutasyonlarıdır (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease). Parkin, bir E3 übiquitin ligaz enzimini kodlar ve hücre içi protein yıkımı (proteazomal yol) ile mitokondri fonksiyonlarında rol oynar. Parkin genindeki bialelik (iki alelde) mutasyonlar, genellikle 20-40 yaş arasında başlayan, yavaş progresyonlu bir parkinsonizm tablosu oluşturur. Klinik olarak tremor belirgin olabilir, alt ekstremitelerde distroni (özellikle ayaklarda içe dönük postür) genç başlangıçlı Parkin-Parkinson’da sık görülen bir belirtidir. Parkin mutasyonlu hastalar levodopaya genellikle çok iyi yanıt verirler ve “levodopa duyarlı juvenil parkinsonizm” olarak tanımlanan tabloyu oluştururlar. İlginç olarak, Parkin ilişkili Parkinson’da patolojik incelemelerde tipik Lewy cisimcikleri bulunmayabilir; substantia nigra dejenerasyonu görülmekle beraber klasik Lewy patolojisi olmadan saf dopaminerjik nöron kaybı rapor edilmiştir. Bu da Parkin mutasyonlu hastalığın patofizyolojik olarak klasik idiopatik Parkinson’dan farklılık gösterebileceğini akla getirmektedir.
Bir diğer otozomal resesif gen olan PINK1 (PARK6) genindeki mutasyonlar da erken başlangıçlı Parkinson’a yol açar (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease). PINK1, mitokondriyal bir kinazdır ve hasarlı mitokondrilerin ortadan kaldırılması (mitofaji) sürecinde Parkin ile birlikte işlev görür. PINK1 mutasyonları genellikle Parkin’e kıyasla biraz daha geç (30’lu yaşların sonu veya 40’lı yaşlar) başlangıçlı bir parkinsonizm yapar, ancak klinik olarak benzerdir ve yavaş ilerler. PINK1 mutasyonlu hastalarda da genç yaşta başlayıp klasik motor bulguların görüldüğü, levodopaya iyi yanıt veren bir tablo söz konusudur. Bazı çalışmalarda PINK1 mutasyonlu hastalarda alt ekstremite distonilerinin ve reflekslerde hiperrefleksinin daha sık olabileceği not edilmiştir, ancak genel olarak ayırt etmek zordur.
DJ-1 (PARK7) geni mutasyonları da nadir bir otozomal resesif Parkinson nedenidir (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease). DJ-1 proteini hücresel stres yanıtında rol alan bir proteindir. DJ-1 mutasyonlu hastalar tipik olarak 20’li-30’lu yaşlarda başlayan, yavaş ilerleyen Parkinson semptomlarına sahiptir. Klinik tablo yine levodopaya duyarlıdır. DJ-1 mutasyonları dünya genelinde oldukça nadirdir ve genellikle akraba evliliği olan ailelerde tespit edilmiştir.
Yukarıda bahsedilen Parkin, PINK1 ve DJ-1, erken başlangıçlı otozomal resesif Parkinson hastalığının başlıca genleri olarak kabul edilir. Günümüzde genetik tanı panellerinde, 50 yaş altı Parkinson hastalarında bu genlerin taranması önerilmektedir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Nitekim ilgili kılavuzlar, 50 yaşından önce başlayan Parkinson’da hasta talep ederse genetik testte PRKN (Parkin), PINK1, DJ-1 genlerinin yanı sıra dominant genler olan LRRK2, SNCA ve VPS35’in de incelenmesini önermiştir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Parkin, PINK1 veya DJ-1 mutasyonu saptanan ailelerde, kardeşler arası benzer hastalık öyküsü tipiktir ve genellikle her iki cinste de benzer oranlarda görülür (cinsiyet farkı yoktur).
Bunların dışında, ATP13A2 (PARK9), PLA2G6 (PARK14), FBXO7 (PARK15), DNAJC6 (PARK19), SYNJ1 (PARK20), VPS13C (PARK23) gibi başka otozomal resesif ya da atipik kalıtım gösteren genler de nadir parkinsonizm tablolarına yol açabilir (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease). Ancak bu durumlar genellikle klasik Parkinson’dan sapmalar gösterir (çok erken başlangıç, ek nörolojik bulgular, hızlı progresyon, nöropati, bilişsel gerilik vb. gibi). Örneğin ATP13A2 mutasyonları Kufor-Rakeb sendromu adı verilen, erken yaşta başlayan parkinsonizm ile bunama ve göz hareket bozukluklarıyla giden bir tabloya neden olur. PLA2G6 mutasyonları ise PARK14 olarak adlandırılır ve bazen çocukluk çağında başlayan, bunama ve spastisite ile seyreden bir parkinsonizme yol açar. Bu nadir sendromik durumlar Parkinson hastalığının tipik formundan ayrılır.
Genetik geçişli Parkinson formlarının önemli bir örneği de GBA1 gen mutasyonlarıdır (glukoserebrozidaz enzim geni). GBA mutasyonları otozomal resesif bir hastalık olan Gaucher hastalığına neden olur; tek kopya (taşıyıcı) mutasyon ise Parkinson riskini yükseltir. Aslında GBA1, tam anlamıyla ne yüksek penetranslı monogenik bir neden ne de düşük riskli bir polimorfizm olarak kategorize edilir; ikisinin arasında, orta düzey penetransa sahip bir risk faktörüdür. GBA1 taşıyıcılarında yaşam boyu Parkinson gelişme riski ~%10-30 civarındadır ( LRRK2 and Parkinson’s disease: from genetics to targeted therapy – PMC ). GBA1 bu soruda özellikle istenmemiş olsa da, LRRK2 ile birlikte en sık görülen genetik risk faktörlerinden biri olduğu not edilmelidir (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease).
Genetik formu olsun veya olmasın, Parkinson hastalığında genetik test yaptırmak isteyen hastalara genetik danışma verilmelidir. Örneğin LRRK2 veya SNCA mutasyonu saptanan bir kişide, çocuklarında hastalık olasılığı ve penetrans belirsizliği gibi konular anlaşılır şekilde açıklanmalıdır. Kılavuzlar, genetik testlerin hasta istemedikçe rutin uygulanmasını önermemekle birlikte, genç başlangıçlı veya aile öykülü vakalarda hastanın bilgilendirilmiş onamı ile genetik analiz yapılabileceğini belirtmektedir ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ) ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ).
Günümüzde genetik bulgular, henüz Parkinson hastalığının rutin tedavisini değiştirmemektedir. Yani monogenik Parkinson’u olan hastalar (örneğin LRRK2, Parkin veya SNCA mutasyonu taşıyanlar) için hastalığı durduran veya bu gene yönelik özel bir tedavi henüz bulunmamaktadır ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ). Ancak ufukta, özellikle LRRK2 ve GBA gibi yaygın mutasyonlar için hedefe yönelik tedaviler belirmektedir. Örneğin LRRK2 kinaz inhibitörleri üzerine klinik araştırmalar sürmektedir ( LRRK2 and Parkinson’s disease: from genetics to targeted therapy – PMC ). Genetik bilgi, gelecekte kişiselleştirilmiş tedavi yaklaşımlarının gelişmesine öncülük edebilir. Ayrıca genetiğin anlaşılması, Parkinson patogenezinin çözülmesine katkı sunarak yeni ilaç hedeflerinin bulunmasına yardımcı olmaktadır.
Sonuç: Parkinson hastalığı genetik ve çevresel faktörlerin etkileşimi sonucu ortaya çıkan karmaşık bir hastalıktır. LRRK2 ve SNCA gibi genlerdeki yüksek penetranslı mutasyonlar, nadir görülen ailesel Parkinson formlarından sorumlu olup hastalığın mekanizmaları hakkında önemli ipuçları vermiştir. Bu mutasyonları taşıyan bireylerde Parkinson gelişme olasılığı oldukça yüksektir ve genellikle otozomal dominant kalıtım paternine uyar. Buna karşılık, aynı genlerdeki düşük riskli varyantlar (ör. LRRK2 G2385R, SNCA intronik polimorfizmleri), genel popülasyonda yaygın olup tek başlarına hastalık yapmamakla birlikte, hastalığa yatkınlığı bir miktar artırır. Erken başlangıçlı Parkinson olgularında ise sıklıkla otozomal resesif geçiş saptanır; Parkin, PINK1, DJ-1 genlerindeki mutasyonlar genç yaşta başlayan, yavaş seyirli Parkinson tablolarına yol açar. 2023-2025 yıllarında yapılan güncel araştırmalar, genetik faktörlerin Parkinson riskini belirlemedeki ağırlığını vurgulamakta ve 90’dan fazla genetik risk varyantının tanımlandığını ortaya koymaktadır (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease). Bu bilgiler ışığında, Parkinson hastalığında genetik analiz ve danışmanlık, özellikle genç ve aile öykülü vakalarda bakımın bir parçası haline gelmiştir. Genetik bilimindeki ilerlemeler, gelecekte Parkinson’un hem erken tanısında (ör. yüksek riskli bireylerin belirlenmesi) hem de tedavisinde (ör. mutasyona özel tedavi geliştirilmesi) devrim niteliğinde uygulamalara zemin hazırlayabilir.
Keşif
Morbus Parkinson (Parkinson hastalığı), modern nörolojinin kurucu alanlarından biri olarak kabul edilen motor sistem hastalıklarının tarihçesinde özel bir yere sahiptir. Aşağıda Parkinson hastalığının tıbbi tanımının, isimlendirilmesinin ve nörobiyolojik mekanizmalarının keşfine dair ayrıntılı tarihsel bir çerçeve sunulmuştur.
1. Antik ve Ortaçağ Gözlemleri
Parkinson hastalığına benzer motor bozuklukların tarihçesi, modern tıbbın öncesine dek uzanır:
- M.Ö. 12. yüzyıl: Ayurvedik metinlerde, özellikle “Vāta Roga” kategorisinde, tremor, hareketlerde yavaşlama ve duruş bozukluğu ile tanımlanan semptomlara yer verilmiştir. Bu durumlar muhtemelen Parkinson hastalığının tarihsel gözlemleridir.
- Galen (M.S. 129–210): Antik Yunan tıbbının en büyük figürlerinden biri olan Galen, tremorun farklı tiplerini sınıflandırmıştır. Ancak Parkinson hastalığına özgü bir sendrom tanımlamamıştır.
- Avicenna (İbn Sînâ, 980–1037): El-Kanun fi’t-Tıbb adlı eserinde, “titremeli felç” (al-racfa) tabirini kullanarak tremor ve hareketsizlikle seyreden motor hastalıkları tanımlar. Parkinson’a benzer olgulara işaret etmiş olabilir.
2. James Parkinson ve 1817 Yayını
📌 James Parkinson (1755–1824):
İngiliz hekim, cerrah, eczacı ve doğa bilimcisi.
- 1817 yılında yayımladığı başyapıtı:
“An Essay on the Shaking Palsy” (Titrek Felç Üzerine Bir İnceleme) Bu eser, hastalığın sistematik klinik tanımını ilk kez yapar. - Parkinson, tanımını yaptığı hastalıkta şu temel semptomlara dikkat çekmiştir:
- İstirahat tremoru
- Kas rijiditesi
- Hareketlerin yavaşlaması (bradikinezi)
- Duruş bozukluğu
- Bilişsel değişikliklere dair herhangi bir açıklama yoktur.
- Parkinson, bu hastalığa spesifik bir isim vermemiş, yalnızca “titrek felç” (shaking palsy) terimini kullanmıştır. Ayrıca kendisi doğrudan hastaları gözlemlememiş, hastaların sokakta gözlemlenmesi ve ailelerinden alınan bilgilerle tabloyu tanımlamıştır.
3. Jean-Martin Charcot ve Hastalığın Adlandırılması
📌 Jean-Martin Charcot (1825–1893):
- yüzyılın en önemli nörologlarından biri, Paris’teki Salpêtrière Hastanesi’nin başında bulunmuştur.
- 1870’lerde, Parkinson’un “titrek felç” olarak adlandırdığı sendromu detaylandırmış ve bu durumu farklı motor bozukluklardan ayırt etmiştir.
- Charcot’un katkıları:
- Kas rijiditesi ve tremoru ayrı motor bileşenler olarak tanımlar.
- Parkinson hastalığını diğer parkinsonian bozukluklardan ayırır.
- Hastalığı ilk kez “Maladie de Parkinson” yani “Parkinson Hastalığı” olarak adlandıran kişidir.
4. 20. Yüzyıl: Patoloji ve Biyokimyanın Keşfi
a. Lewy cisimciklerinin keşfi (1912)
- Friedrich Heinrich Lewy, Berlin’de çalışırken Parkinson hastalarının beyninde nöronal inklüzyon cisimcikleri tanımlar.
- Bu yapılar daha sonra “Lewy cisimcikleri” olarak adlandırılır (1938’de Tretiakoff tarafından).
b. Substantia nigra dejenerasyonunun tanımlanması (1919)
- Konstantin Tretiakoff, Paris’teki çalışmalarında substantia nigra’nın Parkinson’da özgül olarak hasarlandığını belirtir. Bu, Parkinson’un patoanatomisinin temel taşıdır: dopaminerjik hücre kaybı.
c. Dopaminin rolünün keşfi (1957–1960)
- Arvid Carlsson (1957): Dopaminin merkezi sinir sisteminde önemli bir nörotransmitter olduğunu gösterdi.
- Oleh Hornykiewicz (1960): Parkinson hastalarının beyninde dopamin düzeyinin düşmüş olduğunu keşfetti.
- Dopamin eksikliğinin hastalığın motor semptomlarıyla ilişkili olduğu gösterildi.
5. Levodopa Tedavisinin Gelişimi (1960–1970’ler)
- 1961: George Cotzias, levodopa’nın (L-DOPA) yüksek dozlarda kullanılarak Parkinson semptomlarını belirgin şekilde azalttığını keşfetti.
- 1970’ler: Levodopa, Parkinson’un tedavisinde altın standart haline geldi. Bu buluş, Parkinson hastaları için dramatik bir tedavi devrimi yarattı.
6. Geç 20. yüzyıl – Nörogenetik ve Derin Beyin Stimülasyonu
- 1990’lar:
- SNCA (alfa-sinüklein) gen mutasyonları Parkinson hastalığı ile ilişkilendirildi.
- Lewy cisimciklerinin ana bileşeninin alfa-sinüklein proteini olduğu ortaya çıktı.
- 1997: Genetik Parkinson’un ilk moleküler açıklaması.
- 1987–2000:
- Derin Beyin Stimülasyonu (DBS) tekniği geliştirildi ve Parkinson’un ileri evre motor komplikasyonlarının tedavisinde klinik kullanıma girdi.
7. 21. Yüzyıl – Biyobelirteçler, Mikrobiyota, ve Kişiselleştirilmiş Tıp
- Parkinson’un bağırsak kaynaklı olabileceğine dair hipotezler (Braak hipotezi, 2003) geliştirilmiştir.
- Genetik araştırmalar 90’dan fazla risk lokusu tanımlamış, LRRK2 ve GBA mutasyonları ön plana çıkmıştır.
- Alpha-synuclein PET görüntüleme, kan-beyin bariyeri biyobelirteçleri, likör testleri gibi tanı yöntemleri araştırılmaktadır.
- Kök hücre tedavisi, gen tedavisi, bağırsak mikrobiyotasını hedefleyen stratejiler güncel deneysel alanlardır.
İleri Okuma
- Parkinson, J. (1817). An Essay on the Shaking Palsy. Sherwood, Neely, and Jones.
- Charcot, J.M., & Vulpian, A. (1872). Leçons sur les maladies du système nerveux. Paris: Delahaye.
- Lewy, F.H. (1912). Zur pathologischen Anatomie der Paralysis agitans. Zentralblatt für Allgemeine Pathologie, 23, 50–55.
- Tretiakoff, C. (1919). Contribution à l’étude de l’anatomie pathologique du locus niger de Soemmering. Thèse de médecine, Paris.
- Hornykiewicz, O. (1966). Dopamine deficiency in the basal ganglia of Parkinsonian patients. Pharmacology of Parkinsonism. Pergamon Press, 171–187.
- Carlsson, A. (1959). Presence of dopamine in brain and its role as a neurotransmitter. Pharmacological Reviews, 11(2), 490–493.
- Cotzias, G.C., Papavasiliou, P.S., & Gellene, R. (1969). Modification of Parkinsonism—chronic treatment with L-dopa. New England Journal of Medicine, 280(7), 337–345.
- Polymeropoulos, M.H. et al. (1997). Mutation in the alpha-synuclein gene identified in families with Parkinson’s disease. Science, 276(5321), 2045–2047.
- Braak, H., et al. (2003). Staging of brain pathology related to sporadic Parkinson’s disease. Neurobiology of Aging, 24(2), 197–211.
- Kalia, L.V., & Lang, A.E. (2015). Parkinson’s disease. The Lancet, 386(9996), 896–912.
- Klein C, Westenberger A. Genetics of Parkinson’s disease. Cold Spring Harb Perspect Med. 2012;2(1):a008888. (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease)
- Ferese R, vd. Four copies of SNCA responsible for autosomal dominant PD in two Italian siblings. Case Rep Genet. 2015;2015:459568. ( Four Copies of SNCA Responsible for Autosomal Dominant Parkinson’s Disease in Two Italian Siblings – PMC )
- NICE Ulusal Kılavuzu. Parkinson’s Disease in Adults (NG71). 2017, günc. 2020. (İngiltere Parkinson hastalığı yönetimi kılavuzu) (Recommendations | Parkinson’s disease in adults | Guidance | NICE) (Recommendations | Parkinson’s disease in adults | Guidance | NICE)
- Campêlo CLL, Silva RH. Genetic variants in SNCA and the risk of sporadic Parkinson’s disease. J Mol Neurosci. 2017;63(2):239-248. ( Genetic Variants in SNCA and the Risk of Sporadic Parkinson’s Disease and Clinical Outcomes: A Review – PMC )
- Rodrigues Pinto RAS, vd. Guidelines for Parkinson’s disease treatment – Brazilian Academy of Neurology. Arq Neuropsiquiatr. 2022. ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC ) ( Guidelines for Parkinson’s disease treatment: consensus from the Movement Disorders Scientific Department of the Brazilian Academy of Neurology -motor symptoms – PMC )
- Ferreira MFB, vd. Exercise for People with Parkinson’s Disease: Updates and Future Considerations. J Nov Physiother Rehabil. 2023.) ( Exercise for People with Parkinson’s Disease: Updates and Future Considerations – PMC ) ( Exercise for People with Parkinson’s Disease: Updates and Future Considerations – PMC )
- Blauwendraat C, vd. Analysis of rare Parkinson’s disease variants in millions of people. NPJ Parkinson’s Dis. 2023;9:134. (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease) (Analysis of rare Parkinson’s disease variants in millions of people | npj Parkinson’s Disease)
- Gan-Or Z. LRRK2 and Parkinson’s disease: from genetics to targeted therapy. Ann Clin Transl Neurol. 2023;10(6):665-677. ( LRRK2 and Parkinson’s disease: from genetics to targeted therapy – PMC ) ( LRRK2 and Parkinson’s disease: from genetics to targeted therapy – PMC )
- Stowe R, vd. Clinical pharmacology of Parkinson’s therapies. Pract Neurol. 2023. (Recommendations | Parkinson’s disease in adults | Guidance | NICE) (Recommendations | Parkinson’s disease in adults | Guidance | NICE)
- Trenkwalder C, vd. Diagnosis and treatment of Parkinson’s disease (German Society for Neurology Guideline). Neurol Res Pract. 2024. (Güncel Alman kılavuzunda tanı ve tedavi önerileri) ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC ) ( Diagnosis and treatment of Parkinson´s disease (guideline of the German Society for Neurology) – PMC )