Myastenia gravis, çeşitli derecelerde kas güçsüzlüğü ile karakterize kronik otoimmün nöromüsküler bir hastalıktır. “Miyasteni” terimi kas güçsüzlüğünü, “gravis” ise durumun ciddiyetini ifade eder. Hastalık, esas olarak nöromüsküler kavşakta nikotinik asetilkolin reseptörlerini (AChR) bloke eden veya yok eden ve kas kasılmasını önleyen otoantikorların varlığı nedeniyle sinir uyarılarının kaslara iletilmesinde bir bozulmadan kaynaklanır.
İçindekiler
Epidemiyoloji
Myastenia gravis prevalansının 100.000 kişide 4 ila 10 arasında olduğu ve yıllık insidansının yaklaşık 100.000 kişide 1 olduğu tahmin edilmektedir. Hastalık her yaşta ortaya çıkabilir ancak en sık 30 ila 40 yaş arasındaki bireylerde teşhis edilir. Erken başlangıçlı formun (40 yaşından önce) ağırlıklı olarak kadınları etkilediği ve geç başlangıçlı formun (50 yaşından sonra) daha çok erkeklerde görüldüğü bimodal bir yaş dağılımı vardır.
Patofizyoloji
Myastenia gravis öncelikle iskelet kaslarının postsinaptik membranında bulunan asetilkolin reseptörlerini hedef alan otoantikorlardan kaynaklanır. Bu antikorlar, kas kasılması için gerekli bir nörotransmitter olan asetilkolinin bağlanmasını inhibe ederek nöromüsküler iletimi bozar. Ayrıca, bu otoantikorların bağlanması kompleman sistemini aktive ederek postsinaptik membranın yıkımına katkıda bulunur ve fonksiyonel asetilkolin reseptörlerinin sayısında azalmaya yol açar.
Hastaların çoğunda timus bezi myastenia gravis patogenezinde rol oynar. Hastaların yaklaşık %65’inde timik hiperplazi ve yaklaşık %10-15’inde timoma görüldüğü için timusun otoantikorların gelişiminde rol oynadığı düşünülmektedir. Timik anormalliklerin asetilkolin reseptörlerine karşı otoimmün yanıtı tetiklediği veya sürdürdüğü düşünülmektedir.
Klinik Sunum ve Sınıflandırma
Myastenia gravis klinik olarak tipik olarak aktivite ile kötüleşen ve dinlenme ile düzelen kas güçsüzlüğü ile karakterizedir. Kas güçsüzlüğünün şiddeti ve dağılımı büyük ölçüde değişebilir ve farklı klinik alt tiplere yol açabilir:
- Genelleştirilmiş Myastenia Gravis: Belirtiler genellikle pitoz (göz kapaklarının düşmesi) ve diplopi (çift görme) gibi göz tutulumu ile başlar. Zamanla güçsüzlük yüz, bulber ve ekstremite kasları da dahil olmak üzere diğer kas gruplarına yayılarak genel güçsüzlüğe neden olabilir.
- Oküler Myastenia Gravis: Bu formda, kas zayıflığı öncelikle göz kaslarıyla sınırlıdır ve diğer kas gruplarında önemli bir tutulum olmaksızın pitoz ve diplopiye yol açar.
- Juvenil Myastenia Gravis: Bu alt tip çocukluk veya ergenlik döneminde ortaya çıkar ve genel veya oküler semptomlarla kendini gösterebilir.
- Geç Başlangıçlı Myastenia Gravis: Bu form 50 yaşından sonra ortaya çıkar ve erkeklerde daha yüksek prevalansa sahiptir. Genellikle erken başlangıçlı formlara kıyasla daha şiddetli ve yaygın kas güçsüzlüğü ile kendini gösterir.
Klinik Özellikler ve Şiddet
Osserman sınıflandırması, myastenia gravis’in şiddetini tanımlamak için yaygın olarak kullanılmaktadır:
- Sınıf I: Göz kaslarıyla sınırlı güçsüzlüğe sahip oküler miyasteni.
- Sınıf II: Sadece gözler dışındaki kasları etkileyen hafif genel güçsüzlük.
- Sınıf III: Bulber tutulumu olan veya olmayan orta derecede yaygın güçsüzlük.
- Sınıf IV: Bazı vakalarda ventilasyon desteği gerektiren, genellikle solunum kaslarını içeren şiddetli genel güçsüzlük.
Hastalar yutma güçlüğü (disfaji), konuşma güçlüğü (dizartri), yüz kaslarında güçsüzlük ve uzuvlarda güçsüzlük gibi semptomlar yaşayabilir ve bu semptomlar ağır vakalarda solunum kaslarında güçsüzlüğe kadar ilerleyebilir.
Miyastenia gravisin ayırt edici özelliği, kas gücünün gün boyunca dalgalanmasıdır; semptomlar tipik olarak günün ilerleyen saatlerinde veya uzun süreli aktiviteden sonra kötüleşir. Sıcak banyolar veya saunalar gibi ısı, semptomları daha da kötüleştirebilir.
Teşhis
Myastenia gravis tanısı klinik değerlendirme, serolojik testler ve elektrofizyolojik çalışmaların bir kombinasyonuna dayanır:
- Klinik Muayene: Hızlı el açma ve kapama gibi tekrarlanan kullanımla kötüleşen kas güçsüzlüğü miyastenia gravise işaret edebilir. Uzun süreli yukarı bakışın pitozu artırdığı Simpson testi de hastalığın göstergesidir.
- Tensilon Testi: Kısa etkili bir asetilkolinesteraz inhibitörü olan edrofonyum klorür uygulaması kas gücünü geçici olarak artırabilir ve bu da myastenia gravis varlığını düşündürür. Ancak bu test spesifik değildir ve yanlış pozitif veya yanlış negatif sonuçlar verebilir.
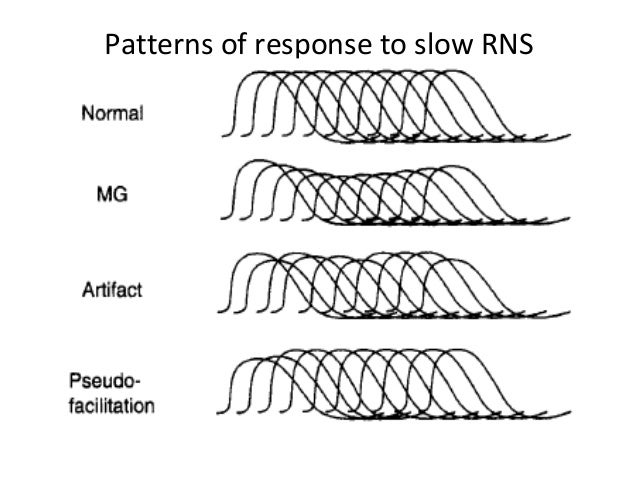
- Elektrofizyolojik İnceleme: Düşük frekanslarda (2-3 Hz) tekrarlayan sinir stimülasyonu, kas aksiyon potansiyellerinde karakteristik bir azalma yanıtı ortaya çıkarabilir. Birinci ve beşinci uyarım arasında kas yanıtının genliğinde en az %10’luk bir azalma myastenia gravis için tipiktir.
- Serolojik Testler: Asetilkolin reseptör antikorlarının (AChR-Ab) varlığı, jeneralize miyastenia gravis hastalarının yaklaşık %80-90’ında bulunan önemli bir tanısal belirteçtir. Ayrıca, bazı hastalarda, özellikle AChR antikorları için seronegatif olanlarda, kas spesifik tirozin kinaza (MuSK) karşı antikorlar mevcut olabilir.
- Asetilkolin reseptör antikorları (AChR-Ab) için serolojik testlerin negatif çıktığı ve seronegatif miyastenia gravisi gösteren durumlarda, kas spesifik tirozin kinaza (MuSK) karşı antikorların varlığını araştırmak çok önemlidir. MuSK antikoru pozitif miyastenia gravis genellikle daha şiddetli bir klinik seyir gösterir ve sıklıkla hızlı ve agresif tedavi gerektiren miyastenik krizlerle ilişkilidir.
- Çift seronegatif olan, yani hem AChR hem de MuSK antikorlarından yoksun olan hastalar için araştırmalar düşük yoğunluklu lipoprotein reseptörüyle ilişkili protein 4’e (Lrp4) karşı antikorlar tanımlamıştır. Bu antikorlar, AChR antikoru pozitif miyastenia gravise benzer bir klinik tabloya neden olmakta ve birincil belirti olarak kas güçsüzlüğü görülmektedir.
- Miyastenia gravisli hastalar yaşlandıkça, ‘anti-striat antikorlar’ olarak adlandırılan çizgili kas proteinlerini hedefleyenler gibi ek antikorlar geliştirebilirler. Bu antikorların klinik önemi henüz tam olarak anlaşılamamıştır, ancak devam eden araştırmalar hastalığın patogenezine katkıda bulunabileceklerini düşündürmektedir.
- Sarkomer yapısını korumak için çok önemli bir protein olan titin, myastenia gravis’te otoantikorlar için başka bir hedeftir. Titin antikorlarının, özellikle de MGT30 fragmanına karşı olanların varlığı, timoma varlığını düşündürebileceği için genç hastalarda (40 yaşın altında) özellikle endişe vericidir. Yaşlı hastalarda titin antikorları daha şiddetli bir hastalık seyrine işaret edebilir.
- Myastenia gravis’te ilgi çeken bir diğer antikor, voltaj kapılı potasyum kanalı Kv1.4’e karşı yönlendirilmiştir. Bu antikor erken başlangıçlı miyastenia gravis ile ilişkilendirilmiştir ve daha kritik ve hızlı ilerleyen bir hastalık seyri ile bağlantılıdır.
- Timus Görüntüleme: Timik hiperplazi veya timoma dahil timik anormallikleri değerlendirmek için BT taraması veya MRI gibi görüntüleme çalışmaları yapılabilir.
- Ayrıca, timomalı hastalarda sarkoplazmik retikulumda bulunan bir kalsiyum kanalı olan ryanodin reseptörüne (RyR) karşı antikorlar tespit edilmiştir. Bu antikorların seviyesi genellikle hastalığın ciddiyeti ile ilişkilidir ve hastalığın ilerlemesi için potansiyel bir belirteç sağlar.
Tanısal Görüntüleme ve Biyopsi
- Timik değişiklikleri, özellikle de timoma varlığını değerlendirmek için toraksın bilgisayarlı tomografisi (BT) önerilir. Timoma saptanması, malign transformasyon potansiyeli nedeniyle cerrahi olarak çıkarılması için mutlak bir endikasyondur. Bununla birlikte, sadece oküler miyastenisi olan hastalarda timektominin rolü tıp camiasında tartışma konusu olmaya devam etmektedir.
- Bazı durumlarda, özellikle de myastenia gravis’i konjenital myastenik sendromlardan ayırmak gerektiğinde kas biyopsisi gerekli olabilir. Kas uç plakasından yapılacak bir biyopsi, karakteristik patolojik özellikleri göstererek tanının doğrulanmasına yardımcı olabilir.
Tedavi Yaklaşımları
- Hafif miyastenia gravisin ilk tedavisi genellikle bir gözlem dönemini içerir, çünkü hastalığın başlangıcından sonraki ilk yıl içinde spontan remisyon meydana gelebilir. Remisyon gerçekleşmezse, antikor üretiminde rol oynadığına inanılan timusun çıkarılması amaçlandığından, özellikle jeneralize miyasteni vakalarında timektomi düşünülür. Timektomi yaklaşık %70’lik bir başarı oranı göstermiştir, ancak ameliyattan sonra klinik iyileşmenin ortaya çıkması zaman alabilir.
- Miyastenia gravis için farmakoterapi öncelikle otoimmün yanıtı azaltmak için immünosupresif tedaviyi içerir. Glukokortikoidler enflamasyonu kontrol etmek için yaygın olarak kullanılır ve uzun süreli tedavi gerektiren durumlarda sitostatik ilaç azatioprin sıklıkla reçete edilir.
- Özellikle miyastenik kriz sırasında şiddetli semptomlar yaşayan hastalar için, dolaşımdaki otoantikorları kandan hızla uzaklaştırmak için plazmaferez uygulanabilir. Geleneksel tedavilerin etkisiz kaldığı dirençli myastenia gravis vakalarında, kompleman sistemini inhibe eden monoklonal bir antikor olan eculizumab denemesi düşünülebilir. Bu tedavi, nöromüsküler kavşağın daha fazla tahrip olmasını önleyerek semptomların şiddetini azaltmada özellikle yararlıdır.
- Piridostigmin, distigmin ve neostigmin gibi asetilkolinesteraz inhibitörleri semptomatik tedavinin merkezinde yer alır. Bu ilaçlar, sinaptik yarıkta asetilkolin mevcudiyetini artırarak, böylece nöromüsküler iletimi artırarak ve kas gücünü geliştirerek çalışır. Bununla birlikte, etkileri tipik olarak kısa sürelidir, sadece 1-2 saat sürer ve terapötik seviyeleri korumak için gün boyunca sık dozlama gerektirir.
- Asetilkolinesteraz inhibitörlerinin uygulanması, kas seğirmesi, aşırı terleme, gastrointestinal kramplar ve ishali içerebilen yan etkilerden yoksun değildir. Bu yan etkileri hafifletmek için bazen Belladonna gibi antikolinerjik ajanlar birlikte uygulanır.
Tarihçe
Myastenia gravis, insanlar tarafından 17. yüzyıldan beri bilinmektedir. 1644’ten belgelenen ilk vaka, Kuzey Amerika’dan İngiliz kolonyal postasında bulundu. Orada, Hintli şef Opechankanough’un ani bir zayıflık nedeniyle artık nasıl yürüyemediği anlatılıyor.

Konuşma bozuklukları, çift görme ve hızlı yorgunluk şeklinde miyastenik ana semptomları olan vakaların ilk ayrıntılı tıbbi tanımını, birkaç yıl sonra 1672’de Oxford doktoru Thomas Willis Latince “De Anima Brutorum” da izledi. Bununla birlikte, Willis’in çalışması 200 yıldan fazla bir süredir tıp biliminde fark edilmeden kalmıştır veya bunu miyastenik semptomların doğrulanabilir başka bir gözlemi izlememiştir.
1877 yılına kadar Londralı doktor Samuel Wilks, konuşma bozukluğu olan bir kızın bir sonraki vaka tanımını yazdı ve hastalığı bulber felci olarak tanımladı.

İlk Almanca raporu, 1879’da Heidelberg Friedreich Kliniği’nde çalışan Wilhelm Erb tarafından üç hastada “Bulbar felç vakaları üzerine” çalışmasıyla yayınlandı.
Berlin Charité’den nörolog Hermann Oppenheim, 1887’de bir vaka sundu.
1893’te Samuel Goldflam, bugüne kadarki en kapsamlı yayınla Varşova’yı takip etti. Bu nedenle (eski) adı Erb-Goldflam Sendromu. Ne yazık ki, o zaman bile, miyastenik semptomlar, günümüze kadar psikosomatik semptomlarla karıştırılmasına benzer şekilde, nevrotik bir hastalığın, histerinin bir işareti olarak sıklıkla yanlış yorumlandı.

Friedrich Jolly, gösterici elektrofizyolojik incelemeler gerçekleştirdi ve 1895’te aynı adlı çalışmasıyla bugün hala yaygın olan “Myasthenia gravis pseudoparalytica” adını icat etti. 20. yüzyılın başında timusla bağlantıya ilişkin ilk yeni bulguların ardından Sauerbruch, 1912’de ilk timektomiyi gerçekleştirdi.

Myastenia gravisi tedavi etmek için ilk başarılı ilaç girişimleri iki doktor tarafından yapılmıştır. Miyastenik semptomlardan etkilenen Amerika Birleşik Devletleri’nden Harriet Edgeworth, efedrinin kas gücünü artırdığını buldu. 1933’te, bir ilkinin ardından, uzun vadeli deneyleri hakkında daha kapsamlı bir ikinci rapor yayınladı.

Bir yıl sonra, 1934’te, Greenwich’teki St. Alfege Hastanesinde çalışan İngiliz Mary Broadfoot Walker, Myastenia gravis’in fizostigmin ile tedavisi adlı makalesini yayınladı. İçinde myastenia gravis’in semptomlarının zehirli şifa ile zehirlenmeye benzediği gözlemini anlattı. Bu, kolinesteraz inhibitörleri ile tedavi edilebilir. Bu, bugüne kadarki en etkili ilaç tedavisidir. Aktif bileşen piridostigmindir. Walker, sinir ve kas arasında bozuk bir aktarım olduğuna dair bir işaret buldu ve bu şekilde kanıtladı. Bununla birlikte, bu nedensel ilişki ancak 1960’tan sonra deneysel olarak kanıtlandı.
1960 gibi erken bir tarihte, John Alexander Simpson varsayımsal olarak bir otoimmün patogeneze işaret etti. AChR antikorları ancak 1974’te tespit edilebildi. MuSK antikorları ilk olarak 2001 yılında tanımlanmıştır.

İleri Okuma
- Drachman, D. B. (1994). Myasthenia Gravis. The New England Journal of Medicine, 330(25), 1797-1810.
- Lindstrom, J. M. (2000). Acetylcholine receptors and myasthenia gravis: the nicotinic receptor. The Journal of Biological Chemistry, 275(17), 12561-12564.
- Phillips, L. H. (2003). The epidemiology of myasthenia gravis. Annals of the New York Academy of Sciences, 998(1), 407-412.
- Mantegazza, R., Antozzi, C., & Bernasconi, P. (2003). Myasthenia gravis. Autoimmunity, 36(1), 23-27.
- Vincent, A., & Newsom-Davis, J. (2004). Myasthenia gravis. The Lancet, 363(9426), 2086-2098.
- Engel, A. G., & Shen, X. M. (2006). Acquired autoimmune myasthenia gravis in the 21st century. Muscle & Nerve, 33(6), 858-877.
- Conti-Fine, B. M., Milani, M., & Kaminski, H. J. (2006). Myasthenia gravis: past, present, and future. The Journal of Clinical Investigation, 116(11), 2843-2854.
- Hughes, B. W., Moro De Casillas, M. L., & Kaminski, H. J. (2006). Pathophysiology of myasthenia gravis. Seminars in Neurology, 24(1), 21-30.
- Benatar, M., & Kaminski, H. J. (2009). Quality standards subcommittee of the American Academy of Neurology. Evidence-based guideline: treatment of ocular myasthenia. Neurology, 72(1), 18-22.
- Gilhus, N. E., & Verschuuren, J. J. (2015). Myasthenia gravis: subgroup classification and therapeutic strategies. The Lancet Neurology, 14(10), 1023-1036.
- Wolfe, G. I., Kaminski, H. J., Aban, I. B., Minisman, G., Kuo, H. C., Marx, A., … & Myasthenia Gravis Foundation of America Task Force. (2016). Randomized trial of thymectomy in myasthenia gravis. The New England Journal of Medicine, 375(6), 511-522.
- Sanders, D. B., Wolfe, G. I., Benatar, M., Evoli, A., Gilhus, N. E., Illa, I., … & Verschuuren, J. J. (2016). International consensus guidance for management of myasthenia gravis: 2016 update. Neurology, 87(4), 419-425.
- Mahoney, J. A., & Nowak, R. J. (2021). Immunosuppressive therapies for myasthenia gravis: past, present, and future. Journal of Clinical Medicine, 10(2), 287.
