“Küçük kalkan bezi” ifadesi, paratiroid bezlerini (Latince: glandulae parathyroideae) anlatır. Buradaki “kalkan” vurgusu, komşu olduğu tiroid bezinin (eski adlandırmayla “kalkan bezi”, Latince: glandula thyroidea) şekil ve tarihsel isim geleneğine dayanır. “Para-” öneki ise Yunanca kökenli olup “yanında, bitişiğinde, yakınında” anlamını taşır; bu nedenle paratiroid, kelime kökeni bakımından “tiroidin yanında yer alan bez” demektir. Bu adlandırma, bezlerin hem topografik yakınlığını hem de tarihsel olarak tiroidle karıştırılabilecek derecede “gölge” bir anatomik konumda bulunmasını yansıtır.
Klasik anatomi dilinde tekil kullanım glandula parathyroidea, çoğul kullanım glandulae parathyroideae biçimindedir. Klinik pratikte ise çoğu zaman “paratiroid” tek başına yeterli olur; ancak akademik metinlerde “paratiroid bezleri” ifadesi, hem çoğulluğu hem de endokrin organ niteliğini daha net gösterir.
Genel tanım ve sayısal düzen: “dört küçük bez” kalıbı ve istisnaları
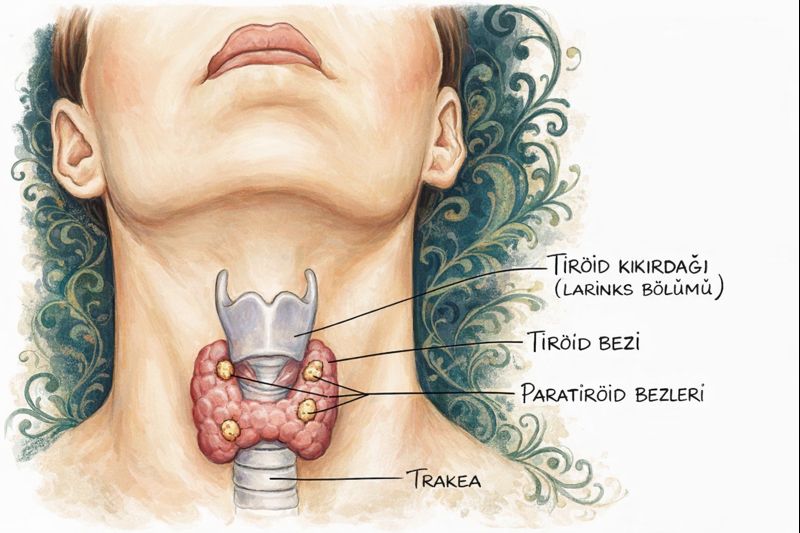
Paratiroid bezleri, tipik olarak dört adet küçük endokrin organdan oluşur ve tiroid bezinin arka yüzüne komşu yerleşimleriyle tanınır. Klasik şema şudur:
- Üst küçük kalkan bezi: Glandula parathyroidea superior
- Alt küçük kalkan bezi: Glandula parathyroidea inferior
Bu ikili, her iki tarafta (sağ ve sol) tekrarlanır; böylece toplamda “2 üst + 2 alt = 4” düzeni oluşur.
Bununla birlikte, ansiklopedik düzeyde gerçekçi bir ifade kurmak gerekir: Paratiroid bezlerinin sayısı ve yerleşimi, embriyolojik göç nedeniyle değişkenlik gösterebilir. Bazı bireylerde 3, bazılarında 5–6 bez görülebilir; nadiren daha fazla sayılar bildirilmiştir. Bu değişkenlik, özellikle cerrahi sırasında “eksik bez mi kaldı?” ya da “fazladan bez mi var?” sorularını doğurur ve paratiroid anatomisini, küçük boyutuna rağmen klinik açıdan “yüksek dikkat isteyen” bir alan hâline getirir.
Makroskopik anatomi: boyut, renk, kapsül, ağırlık
Paratiroid bezleri, çıplak gözle bakıldığında çoğu zaman:
- Sarımsı–kahverengi, bazen kehribar tonlarında,
- Yumuşak kıvamlı,
- İnce bir kapsülle çevrili,
- Çoğunlukla oval veya mercimeksi
görünümdedir. Yağ dokusuyla yakın komşulukları, özellikle erişkinde, ayırt edilmelerini zorlaştırabilir.
Ağırlık konusunda verilen bilgi (toplam 0,1–0,2 g) geleneksel anatomi metinleriyle uyumludur ve “çok küçük ama fizyolojik etkisi çok büyük” endokrin organ örneklerinin en çarpıcılarındandır. Dört bezin toplamı bu aralıkta seyreder; tek tek bezler çoğunlukla birkaç on miligram mertebesindedir.
Topografya: tiroidin arka yüzünde “gizlenen” endokrin halkalar
Paratiroid bezlerinin en tipik yerleşimi, tiroid loblarının arka yüzünde, kapsül ve çevre bağ dokusu düzeyinde tarif edilir. Ancak burada ince bir anatomik nüans vardır:
- Bezler “tiroidin içinde” değil,
- Çoğunlukla tiroid kapsülüne bitişik ya da kapsül çevresindeki bağ dokusu planlarında,
- Nadiren tiroid parankimine yakın/komşu görünümlerde
bulunur.
Üst paratiroid (parathyroidea superior)
Üst paratiroidler genellikle daha sabit yerleşimlidir. Sıklıkla tiroid lobunun üst–orta bölümünün arka tarafında, krikotiroid bölgeye daha yakın bir düzlemde aranır. Bu “görece sabitlik”, embriyolojik kökenleriyle doğrudan ilişkilidir (aşağıda ayrıntılandırılacaktır).
Alt paratiroid (parathyroidea inferior)
Alt paratiroidler ise daha “gezgin” olarak bilinir. Yerleşimleri:
- Tiroidin alt polüne komşu,
- Timus yolu boyunca daha aşağı,
- Nadiren mediastene kadar uzanan ektopik bölgelerde
görülebilir. Bu değişkenliğin ana nedeni, alt bezlerin embriyolojik göç rotasının daha uzun ve değişken olmasıdır.
Komşuluklar: küçük bez, büyük cerrahi anlam
Paratiroid anatomisinin cerrahi ve klinik değeri, yakın komşu yapılar nedeniyle dramatik biçimde artar. Özellikle:
- N. laryngeus recurrens (rekürren laringeal sinir): Tiroid cerrahisinin kritik siniri olup paratiroidlerin bulunduğu planlara yakın seyreder.
- A. thyroidea inferior ve dalları: Paratiroidlerin kanlanması çoğunlukla bu damar sistemiyle ilişkilidir.
- Tiroid kapsülü ve Berry ligamanı çevresi: Diseksiyon planlarının “ince ayarlı” yapılmasını gerektiren bölgelerdendir.
Klinik dilde paratiroidler, “yanlış yerde aranırsa bulunamayan, doğru yerde aranırsa aniden ortaya çıkan” bezler olarak esprili biçimde anılsa da, bu ifade aslında embriyolojiyle yoğrulmuş bir gerçeğe temas eder: Paratiroidi bulmak, çoğu zaman embriyolojik haritayı okumayı gerektirir.
Embriyoloji ve evrimsel bakış: göçün anatomiyi yazdığı bez
Paratiroid bezleri, farinks bölgesindeki faringeal poş sisteminden gelişir. Klasik anlatıda:
- Üst paratiroidler daha çok 4. faringeal poş kökeniyle,
- Alt paratiroidler ise 3. faringeal poş kökeniyle
ilişkilendirilir.
Alt paratiroidlerin hikâyesi daha “dramatiktir”: 3. poştan gelişen yapı kompleksi, aynı embriyolojik pakette timus ile birlikte hareket eder. Timus aşağı doğru inerken, alt paratiroidler de bu göçten etkilenir. Sonuç: Alt bezlerin yerleşimi daha değişken, ektopik bulunma olasılığı daha yüksektir.
Evrimsel pencere
Evrimsel perspektiften bakıldığında paratiroidler, kara yaşamına uyum sürecinin “kalsiyum ekonomisi”yle ilişkili organları arasında düşünülür. Su–kara geçişiyle birlikte:
- Kalsiyumun iskelet deposu olarak daha stratejik hâle gelmesi,
- Sinir–kas iletimi için dar aralıkta tutulması gereken plazma kalsiyum düzeyi,
- Üreme, kabuk/iskelet mineralizasyonu ve metabolik talepler
gibi etkenler, kalsiyum–fosfat dengesini “ince ayar” gerektiren bir sistem düzeyine taşır. Bu bağlamda paratiroid bezleri, organizmanın mineral homeostazını anlık ve hızlı biçimde düzenleyen bir “endokrin denetim düğümü” olarak yorumlanabilir.
Mikroskopik yapı: baş hücre, oksifil hücre ve stromanın dili
Histolojik düzeyde paratiroid parankimi, temel olarak:
- Baş (chief/principal) hücreler: Paratiroid hormonunun (PTH) ana üreticisi.
- Oksifil hücreler: Daha iri, daha eozinofilik sitoplazmalı; fonksiyonel anlamı baş hücre kadar doğrudan olmamakla birlikte yaşla artma eğilimindedir.
Erişkin paratiroid dokusunda yağ dokusu oranı artabilir; bu da bezin hem görüntülemede hem cerrahi diseksiyonda seçilmesini güçleştirir. Kapsül ve ince septalar, damar–sinir ağını taşır ve parankimi lobüler bir izlenime kısmen yaklaştırabilir.
Fizyoloji: PTH’nin “kalsiyum–fosfat dramaturjisi”
Paratiroid bezlerinin temel görevi, PTH (parathormon) salgılayarak kalsiyum–fosfat homeostazını düzenlemektir. Bu düzenleme, üç hedef organ ekseninde okunur:
1) Kemik: hızlı mobilizasyon, yavaş yeniden şekillenme
PTH, kemikte mineral dengesini dolaylı yollarla etkiler. Kısa vadede kalsiyumu dolaşıma kazandırma eğilimi baskınken, kronik yüksek PTH durumunda kemik yeniden şekillenmesi “kayıp lehine” kayabilir. Bu nedenle hiperparatiroidi, kemik mineral yoğunluğunda azalma ve kırık riskinde artışla ilişkilenebilir.
2) Böbrek: geri emilim ve fosfat atılımı
PTH’nin böbrekte iki kritik etkisi vardır:
- Kalsiyum geri emilimini artırma (özellikle distal tübül düzeyinde),
- Fosfat geri emilimini azaltma (proksimal tübülde fosfatüri eğilimi).
Bu çift yönlü ayar, serum kalsiyumu yükseltirken serum fosfatını düşürmeye meyillidir.
3) Vitamin D aktivasyonu: dolaylı bağırsak etkisi
PTH, böbrekte 1-alfa hidroksilaz aktivitesi üzerinden aktif vitamin D (kalsitriol) oluşumunu destekler. Kalsitriol ise bağırsaktan kalsiyum emilimini artırarak sisteme “uzun kollu” bir destek verir.
Ana kontrol mekanizması: kalsiyum-duyarlı reseptör (CaSR)
Paratiroid hücreleri, serum iyonize kalsiyum düzeyini algılayan CaSR aracılığıyla PTH salgısını anlık biçimde ayarlar. Kalsiyum düşünce PTH artar; kalsiyum yükselince PTH baskılanır. Bu, endokrin fizyolojide “en hızlı geri bildirim” örneklerinden biridir.
Klinik önem: küçük bezin büyük sendromları
1) Hiperparatiroidi
- Primer hiperparatiroidi: En sık tek adenom; daha nadir hiperplazi veya karsinom. Klinik olarak hiperkalsemi, böbrek taşı, kemik ağrısı/osteoporoz, gastrointestinal ve nöropsikiyatrik belirtilerle seyredebilir.
- Sekonder hiperparatiroidi: Sıklıkla kronik böbrek yetmezliği veya vitamin D eksikliği zemininde; hipokalsemi/hiperfosfatemiye yanıt olarak gelişen kompansatuvar PTH artışı.
- Tersiyer hiperparatiroidi: Uzun süreli sekonder hiperparatiroidinin özerkleşmesiyle PTH’nin kontrol dışına çıkması.
2) Hipoparatiroidi
Genellikle tiroid/paratiroid cerrahisi sonrası veya otoimmün süreçlerde görülür. Hipokalsemiye bağlı:
- Perioral uyuşma,
- Tetani,
- Kas krampları,
- Nöromüsküler irritabilite artışı
gibi bulgular öne çıkabilir. Klinik tabloda “ince ayar kaçtığında sistemin ne kadar hassas olduğu” hemen anlaşılır.
3) Ektopik paratiroid ve cerrahi strateji
Alt paratiroidlerin göç yolu nedeniyle ektopik yerleşim olasılığı, özellikle primer hiperparatiroidide adenom arayışında önem kazanır. Cerrahi plan, çoğu zaman:
- Görüntüleme (USG, sintigrafi, SPECT/CT, 4D-CT gibi),
- İntraoperatif PTH ölçümleri,
- Embriyolojik olası yerleşim haritaları
üzerine kuruludur. Bu süreç, paratiroid cerrahisini “mikroanatomi + fizyoloji + zaman” disiplinlerinin kesiştiği özgün bir alan hâline getirir.
Terminolojik netlik: “küçük kalkan bezi” ifadesi neyi doğru yapar?
“Küçük kalkan bezi” söylemi, iki şeyi aynı anda başarır:
- Tiroidle komşuluğu sezdirir (“kalkan bezinin üstünde/yanında” fikri),
- Boyut farkını vurgular (“küçük” sözcüğüyle).
Ancak akademik kesinlik açısından şunu eklemek yerinde olur: Bezler her zaman “tiroidin üstünde” değil; daha doğru ifade “tiroidin arka yüzünde ve çevresel bağ dokusunda, genellikle dört adet küçük endokrin bez” olur. “Üst–alt” sınıflaması, tiroidin pol referansları ve embriyolojik köken ayrımıyla birlikte düşünüldüğünde anlam kazanır.
Keşif
Paratiroid bezleri, anatominin tuhaf bir ironisi gibi durur: dört küçük doku adacığı, çoğu zaman tiroidin arka yüzünde yağ dokusuna karışmış, cerrahın ışığında bir an parlayıp bir an kaybolan, fakat yokluğu dakikalar–saatler içinde bütün organizmayı altüst edebilen bir endokrin kumanda merkezi.
1) Sahne hazırlanıyor: tiroid cerrahisi, tetani ve “anlaşılamayan felaket”
19. yüzyılın ikinci yarısında tiroid cerrahisi hızla yaygınlaşırken hekimler aynı ürkütücü tabloyu tekrar tekrar görmeye başladı: bazı hastalar ameliyattan kısa süre sonra kasılmalar, paresteziler, spazmlar ve bazen ölümle sonuçlanan nöromüsküler bir fırtınaya giriyordu. Bu tabloya “tetani” deniyor, fakat nedenini kimse kesin olarak açıklayamıyordu. Bazıları bunun “kanda biriken toksinler” ya da tiroidin “temizleyici” bir işlevinin kaybı olduğunu düşünüyordu. Sorun şuydu: ameliyat edilen organ tiroiddi; klinik felaket ise sanki sinir–kas sistemini hedef alıyordu. Bu çelişki, tıp tarihinde sık görülen o dönüm noktalarından birini yaratacaktı: anatomik bir ayrıntı, fizyolojik bir kanuna dönüşecekti.
2) “Küçük, ayrı, inatçı”: Sandström ve paratiroidin anatomik keşfi
Bu düğümün ilk somut ipliği, Uppsala’da genç bir anatomistin disseksiyon masasından çıktı. Ivar Sandström, tiroidin yakınında, ondan belirgin biçimde farklı, küçük bezsel yapılar tarif etti. Önemli olan yalnızca “bir şey bulmuş” olması değildi; onu asıl ayırt eden, bu dokuların tiroidin bir parçası olmadığını ısrarla göstermesiydi: ayrı bir kapsül, ayrı bir doku karakteri, ayrı bir topografik kimlik… Bu nedenle paratiroid bezleri, modern anatomi literatüründe sık sık “son büyük anatomik keşif” diye anılır. Keşif, ilk bakışta sessizdi; fakat cerrahi sahnede tetani gibi bir dram varken bu sessizlik uzun sürmeyecekti.
Sandström, insan ve çeşitli memelilerde bu küçük bezleri tanımladı. Adlandırma da bu “yanında olma” gerçeğini taşıdı: para- (yanında) + thyroidea (tiroid). Böylece “paratiroid” kelimesi, hem yerleşimi hem de tarihsel kaderi içinde bir tür gölge kavram oldu: hep tiroidin yanında, hep tiroidin gölgesinde, ama sonunda tiroidin ötesine geçen bir fizyolojiyle.
3) İlk işlev arayışı: Gley, Vassale, Generali ve tetaninin izi
Anatomik keşif, tek başına klinik felaketi açıklamaz. İşlev bulunmadan organ “susar”. 1890’larda fizyologlar, özellikle hayvan deneyleri üzerinden, tiroid ameliyatlarından sonra görülen tetaninin aslında tiroidin değil, bu küçük bezlerin zedelenmesiyle bağlantılı olabileceğini düşündüler.
Eugène Gley’nin çalışmaları burada kritik bir eşik oluşturdu. Farklı deney düzenekleriyle, tetaninin yalnızca tiroidin alınmasına bağlı olmadığını; paratiroid dokusunun kaybı veya hasarıyla belirginleştiğini işaret eden bulgular ortaya koydu. Gley’nin dönemi için zorluk şuydu: paratiroid bezleri çok küçüktü, sayıları ve yerleri değişkendi, disseksiyon ve cerrahi teknikler bugünkü kadar rafine değildi. Bu nedenle aynı deneyin farklı laboratuvarlarda farklı sonuçlar vermesi şaşırtıcı değildi. Yine de tablo giderek netleşti: “tetani” denen şey, büyük olasılıkla bu küçük bezlerin kaybıyla ilgiliydi.
Giuillo Vassale ve Francesco Generali’nin deneyleri ise paratiroidin “hayati” bir işlev taşıdığı fikrini güçlendirdi. Dönemin kavramsal çerçevesi henüz kalsiyum fizyolojisini bugünkü gibi merkezde görmüyordu; bu yüzden bazı yorumlar “antitoksik” bir görev gibi bugün tarihsel bir ara durak saydığımız hipotezlere yaslandı. Fakat bilim tarihinde sık görülen bir durum tekrarlandı: yanlış açıklama bile doğru gözlemi ileri taşır. Paratiroid çıkarılınca tetani oluyordu; bunun neden olduğu daha sonra bulunacaktı.
4) Kalsiyum sahneye giriyor: MacCallum–Voegtlin ve tetaninin kimyası
- yüzyılın başında bir şey değişti: tetani artık yalnızca bir klinik “belirti” değil, ölçülebilir bir metabolik dengesizlik olarak düşünülmeye başlandı. William G. MacCallum ve çalışma arkadaşları, paratiroidin kalsiyum metabolizmasıyla ilişkisini deneysel olarak daha açık biçimde kuran çizgiyi temsil eder. Tetani ile hipokalsemi arasındaki bağlantının netleşmesi, paratiroidin işlevini modern homeostaz diliyle yazmaya başladı.
Bu aşama, hikâyenin en dramatik dönüşlerinden biridir: Bir organın işlevi, “organın ne yaptığı” sorusundan, “organizmanın neyi sabit tuttuğu” sorusuna taşınır. Paratiroid, artık “bir bez” değil, kalsiyumun kan düzeyini dar bir aralıkta koruyan bir kontrol düğümü olarak görülmeye başlanır. Bu, endokrinolojinin olgunlaşma anıdır: küçük bir doku parçası, bütün sinir–kas eksitabilitesinin kimyasal zeminini belirler.
5) Patoloji ve cerrahi kahramanlığı: Erdheim’in düşüncesi, Mandl’in ameliyatı
Paratiroidin yalnızca “yokluğu” değil, “fazlalığı” da bir hastalık üretir. Kemiklerde ağrı, deformite, kırıklar; böbrek taşları; kas güçsüzlüğü; psikiyatrik dalgalanmalar… Bu tablo, daha sonra primer hiperparatiroidizm olarak kavramsallaşacak olan hastalık spektrumunun erken yüzleridir. O dönemde kemik lezyonları “osteitis fibrosa cystica” gibi adlarla tariflenir; paratiroidin kemik üzerindeki etkisi yavaş yavaş anlaşılır.
Felix Mandl’in 1925’te yaptığı paratiroid adenomu çıkarımı, yalnızca bir ameliyat başarısı değildir; aynı zamanda bir “neden–sonuç” iddiasıdır: Eğer bu küçük bezin aşırı çalışması kemik yıkımına yol açıyorsa, o bezi çıkarınca hastalık gerilemelidir. Mandl’in girişimi, paratiroid cerrahisinin tarihini başlatan temel dramatik hamlelerden biri olarak kabul edilir. Cerrah burada, anatomiyi ve yeni doğan fizyoloji bilgisini tek bir noktada birleştirir: boynu açar, küçük bir dokuyu bulur ve bir sistem hastalığını geri çevirir.
6) Hormonun doğuşu: Collip ve “parathormone” fikrinin kesinleşmesi
Bir organın işlevinin “hormonla” anlatılması, endokrinolojinin dilini tamamlar. James B. Collip’in 1920’lerde paratiroid özütleriyle yaptığı çalışmalar, paratiroidin etkisinin bir “kimyasal haberci” üzerinden yürüdüğünü netleştiren dönüm noktalarındandır. Buradaki zorluk, o dönemin biyokimya teknikleri düşünüldüğünde büyüktür: proteinler kırılgandır, özütler inaktiftir, doz–yanıt ilişkisi belirsizdir ve deney hayvanlarında tetani gibi dramatik bir sonlanım, küçük hataları bile büyütür.
Collip’in başarısı, yalnız “aktif madde” elde etmek değil, aynı zamanda şu fikri sağlamlaştırmaktır: Paratiroidin etkisi, kanla taşınan bir hormon aracılığıyla olur; bu hormon kalsiyum düzeyini düzenler ve tetaniyi önler. Böylece “parathormone / parathyroid hormone (PTH)” kavramı, anatomi ve fizyoloji arasındaki köprüyü tamamlar.
7) Moleküler arınma: Rasmussen–Craig ve PTH’nin biyokimyasal saflaşması
Hormon kavramı yerleşse bile, hormonun kendisini saflaştırmak ve tanımlamak ayrı bir çağ gerektirir. 1950’ler–1960’larda Howard Rasmussen ve Lyman C. Craig’in çalışmaları, paratiroid hormonunun biyokimyasal saflaştırılmasına giden yolu temsil eder. Bu dönem, endokrinolojinin “özütlerden moleküllere” geçiş dönemidir. Artık soru şudur: Hangi peptid? Hangi parça aktif? Hangi sekans hangi reseptörü uyarır?
Bu çizgi ilerledikçe PTH’nin parçaları, fragmanlarının farklı biyolojik etkileri ve özellikle PTH(1–34) gibi biyolojik olarak güçlü bölümler klinik farmakolojide giderek önem kazanacaktır. Modern osteoporoz tedavilerinin bir kısmı da bu moleküler parçalanmış bilginin ürünüdür.
8) Hücrenin kulağı: Kalsiyum-duyarlı reseptör (CaSR) ve geri bildirim devrimi
Paratiroid hikâyesinin en zarif bölümlerinden biri, bezin “neyi dinlediğinin” bulunmasıdır. Çünkü paratiroid yalnız hormon salgılayan bir fabrika değil, aynı zamanda kanın iyonik kompozisyonunu anbean izleyen bir sensördür. 1990’larda kalsiyum-duyarlı reseptörün (CaSR) tanımlanmasıyla şu muhteşem fikir moleküler bir gerçekliğe dönüşür: Paratiroid hücresi, kandaki iyonize kalsiyumda çok küçük değişimleri algılar ve PTH salgısını saniyeler–dakikalar ölçeğinde ayarlar.
Bu keşif, klinikte iki büyük kapı açar:
- Genetik hastalıkların anlaşılması: CaSR yolundaki bozukluklar, kalsiyum set noktalarını kaydırarak hipokalsemi–hiperkalsemi spektrumlarında ailevi tablolar oluşturabilir.
- Hedefe yönelik ilaçlar: Calcimimetic (ör. cinacalcet, bazı intravenöz ajanlar) gibi tedaviler, paratiroidin “duyma” mekanizmasını farmakolojik olarak modüle ederek PTH salınımını düşürebilir.
Böylece paratiroid artık yalnızca “PTH üreten bez” değil, “kalsiyumu algılayan ve buna göre PTH üreten bez” olarak tam bir geri bildirim sistemi şeklinde anlaşılır.
9) Görüntüleme ve operasyonun incelmesi: minimal invaziv paratiroidektomi, intraoperatif PTH ve NIRAF
Paratiroid cerrahisi, tarihte en çok “küçük organı bulma sanatı”yla anılır. Klasik bilateral boyun eksplorasyonu, yıllarca standart yaklaşım oldu. Zamanla görüntüleme teknikleri ve intraoperatif biyokimya oyunu değiştirdi:
- İntraoperatif PTH ölçümü ile, çıkarılan dokunun gerçekten “sorunlu paratiroid” olup olmadığı dakikalar içinde biyokimyasal olarak teyit edilebilir hâle geldi.
- Sestamibi temelli nükleer görüntüleme ve SPECT/CT, özellikle tek adenom olgularında hedefe yönelik cerrahiyi kolaylaştırdı.
- 4D-CT ve gelişmiş kesitsel yöntemler, özellikle reoperasyon ve ektopik bez arayışında önemli rol üstlendi.
Daha yeni ve görsel olarak da etkileyici bir kırılma ise yakın kızılötesi otofloresans (NIRAF) teknolojileriyle geldi. Paratiroid dokusunun, bazı dalga boylarında kendine özgü bir otofloresans sinyali vermesi, cerrahın ameliyat sırasında “bu doku paratiroid olabilir” sezgisini bir optik geri bildirimle güçlendiriyor. Bu yaklaşımın hedefi yalnız bezleri bulmak değil; tiroid cerrahisinde paratiroidlerin korunmasını artırarak postoperatif hipokalsemi riskini azaltmak. Son yıllarda bu alanda klinik çalışmaların belirgin biçimde hızlandığı görülüyor; fiber tabanlı sistemlerden kamera tabanlı platformlara uzanan bir teknoloji ekosistemi oluşmuş durumda.
10) Paratiroidin yeni dili: tek-hücre atlasları, epigenetik haritalar ve oksifil hücrenin sırrı
Paratiroid histolojisi, uzun süre iki ana hücre tipinin (chief ve oksifil) “klasik” betimlemesiyle yetindi. Fakat modern biyoloji artık dokuları “hücre kümeleri” değil, hücrelerin durumları ve geçişleri olarak okuyor. Son yıllarda:
- Tek-hücre RNA dizileme ile insan paratiroid dokusunun hücre atlasları çıkarılmaya, chief–oksifil ayrımının dinamikleri anlaşılmaya başlandı. Oksifil hücrelerin yalnız “yaşla artan” pasif bir fenomen olmayabileceği; metabolik, mitokondriyal ve farklılaşma eksenlerinde belirli geçişlerle oluşabileceği fikri güçleniyor.
- Epigenetik ve kromatin mimarisi haritaları, paratiroidin gen düzenleyici ağlarını, hastalık durumlarında hangi düğümlerin kırıldığını, hangi enhancer bölgelerinin aktifleştiğini daha sistematik biçimde göstermeye başladı.
Bu çizgi, hiperparatiroidizm adenomlarının neden belirli gen ağlarına saplandığı, neden bazı olguların agresifleştiği ve neden bazı bezlerin “set noktası” değiştirdiği gibi soruları artık daha sofistike bir düzlemde tartışmaya imkân veriyor.
11) Yeniden yapım hayali: organoidler, kök hücreler, hücre nakli ve “işlevsel bez” üretimi
Paratiroidin biyoteknolojideki en heyecan verici cephesi, son birkaç yılda giderek belirginleşti: Paratiroid dokusunu kültürde uzun süre yaşatmak, hatta organoid düzeyinde “bez benzeri” yapılar üretmek. Bu alanın itici gücü özellikle kronik hipoparatiroidi: yaşam boyu kalsiyum–D vitamini dengesiyle yürüyen, böbrek taşı ve hiperkalsiüri riskiyle uğraşan, kalite-of-life yükü yüksek bir hastalık alanı.
Kök hücre kökenli paratiroid organoidleri ve deneysel modellerde fonksiyon gösteren “bez üretimi” çalışmaları, endokrin replasmanın bir sonraki aşamasını ima ediyor: yalnız hormon vermek değil, hormon üreten ve geri bildirim kuran bir doku sistemini geri kazandırmak. Bugün için bunlar çoğunlukla araştırma düzeyinde; fakat yön net: endokrinoloji, doku mühendisliğiyle birleşiyor.
12) Klinik tedavide güncel eşik: PTH replasmanında uzun etkili moleküller ve Yorvipath dönemi
Hipoparatiroidi tedavisinde uzun yıllar temel yaklaşım, kalsiyum ve aktif D vitaminiyle “yerine koyma”ydı; fakat bu yaklaşım, fizyolojik PTH dalgalanmasını ve böbrek kalsiyum işlenmesini tam taklit edemez. Rekombinant PTH tedavileri bu nedenle önemli bir paradigmaydı.
Son dönemde ise uzun etkili PTH prodrug stratejileri öne çıktı. Palopegteriparatide (TransCon PTH) bu hattın en görünür örneklerinden biri hâline geldi ve düzenleyici onaylarla klinik pratiğe güçlü bir giriş yaptı. Bu gelişme, paratiroid hikâyesinin modern çağdaki simgesel tamamlanması gibi okunabilir: 19. yüzyılda “küçük bez kaybolduğunda tetani oluyor” gözlemiyle başlayan yol, 21. yüzyılda “fizyolojiye yakın PTH replasmanı”na doğru rafine bir terapötik mimariye evrildi.
İleri Okuma
- Sandström I. (1880) Om en ny körtel hos menniskan och åtskilliga däggdjur. Upsala Läkareförenings Förhandlingar.
- Sandström I. (1880) On a new gland in man and several mammals (glandulae parathyroideae). Upsala Läkareförenings Förhandlingar.
- Gley E. (1891) On the effects of extirpation of the thyroid gland – comments on the notes of Arthaud and Magon. Comptes rendus des séances de la Société de biologie et de ses filiales, 3:551–554.
- Vassale G., Generali F. (1896) On the effects of extirpation of the parathyroid glands. Rivista di Patologia Nervosa e Mentale, 1:249–252.
- MacCallum W.G., Voegtlin C. (1909) The relation of the parathyroid to calcium metabolism and the nature of tetany. Journal of Experimental Medicine, 11:118–151.
- Mandl F. (1925) Parathyroid adenoma surgery in osteitis fibrosa cystica. (Tarihsel kaynaklarda farklı bibliyografik varyantlarla anılmaktadır).
- Collip J.B. (1925) Extraction of parathyroid hormone which will prevent or control parathyroid tetany and regulates level of blood calcium. Journal of Biological Chemistry, 63:395–438.
- Rasmussen H., Craig L.C. (1962) Purification of bovine parathyroid hormone by gel filtration. Biochimica et Biophysica Acta, 56:332–338.
- DeGroot L.J., Chrousos G., Dungan K., et al. (eds.) (2000– ) Endotext. MDText.com, Inc., South Dartmouth (MA), online reference work.
- Alfadda T.I., Saleh A.-M. (2014) The calcium-sensing receptor 20 years later. American Journal of Physiology – Cell Physiology.
- Kim E.S. (2015) Recombinant Human Parathyroid Hormone (1–84). Drugs, 75:1293–1303.
- Rubin M.R., Dempster D.W., Zhou H., et al. (2016) Therapy of Hypoparathyroidism With PTH(1–84). Journal of Clinical Endocrinology & Metabolism, 101(7):2742–2750.
- Moore K.L., Persaud T.V.N., Torchia M.G. (2019) The Developing Human: Clinically Oriented Embryology. Elsevier, 11th ed., ISBN: 978-0-323-61154-1.
- Standring S. (2021) Gray’s Anatomy: The Anatomical Basis of Clinical Practice. Elsevier, 42nd ed., ISBN: 978-0-7020-7705-0.
- Guyton A.C., Hall J.E. (2021) Textbook of Medical Physiology. Elsevier, 14th ed., ISBN: 978-0-323-59712-8.
- Boron W.F., Boulpaep E.L. (2022) Medical Physiology. Elsevier, 4th ed., ISBN: 978-0-323-90820-7.
- Jameson J.L., Fauci A.S., Kasper D.L., Hauser S.L., Longo D.L., Loscalzo J. (2022) Harrison’s Principles of Internal Medicine. McGraw-Hill Education, 21st ed., ISBN: 978-1-259-64126-8.
- Jung Y.L., et al. (2024) Epigenetic profiling reveals key genes and cis-regulatory networks specific to human parathyroids. Nature Communications.
- Mao J., et al. (2024) Single-cell RNA sequencing reveals transdifferentiation of human parathyroid oxyphil cells. [PubMed indexed journal record].
- Ascendis Pharma. (2024) FDA Approves YORVIPATH® (Palopegteriparatide) as the First and Only Treatment for Hypoparathyroidism in Adults. Company news release, Aug 12, 2024.
- Clarke B.L., et al. (2025) Efficacy and Safety of TransCon PTH in Adults With Hypoparathyroidism. Journal of Clinical Endocrinology & Metabolism, 110(4):951–.
- Cousart A.G., et al. (2025) Near-Infrared Autofluorescence for Parathyroid Detection. JAMA Surgery.
- Kano M., et al. (2025) Generation of parathyroid glands from pluripotent stem cells. [PubMed Central indexed journal record].