Propiverin, modern ürolojinin sessiz “arka plan oyuncularından” biri gibi görünse de, farmakolojik açıdan son derece ilginç, çok katmanlı etki mekanizmaları olan bir ajandır. Aşırı aktif mesane tedavisinde antimuskarinikler sınıfına yerleşir; ancak yalnızca muskarinik reseptör antagonizmasıyla değil, aynı zamanda voltaj bağımlı kalsiyum kanallarını da hedef alarak iki eksenli bir etki profili sergiler.
Propiverin, kimyasal tasarımından klinik kullanımına kadar uzanan yelpazede, hem muskarinik reseptör antagonizması, hem de L-tipi kalsiyum kanalı blokajı ile idrar kesesi üzerindeki aşırı aktiviteyi baskılayan, çift eksenli etkisiyle dikkat çeken bir ajandır. Antikolinerjik sınıfın tipik yan etkilerini taşısa da, dikkatli hasta seçimi, doz titrasyonu ve ilaç–ilaç etkileşimlerinin gözetilmesi ile aşırı aktif mesane tedavisinde önemli bir seçenek olarak yerini korur.
1. Etimoloji ve tarihsel bağlam
1.1. İlaç adının kökeni
“Propiverin” ismi, klasik organik kimya adlandırma kalıpları ile farmasötik isimlendirme geleneklerinin bir bileşimidir:
- “Propi- / propi-” öneki, çoğu kez propil (C₃H₇–) yan zincirini veya propionik asit türevlerini çağrıştıran bir yapı öğesine atıfta bulunur.
- “-verin” son eki, çeşitli spazmolitik ve düz kas gevşetici bileşiklerde görülen (örn. papaverin gibi) farmakolojik isimlendirme motiflerine göndermede bulunur. Bu tür son ekler genellikle doğrudan sistematik IUPAC adını değil, kimyasal yapı–farmakolojik etki ilişkisini çağrıştıran, markaya elverişli ve telaffuzu kolay sentetik adları ifade eder.
Bu bağlamda “Propiverin”, propil içeren, papaverin-benzeri spazmolitik/antispazmodik bir bileşen çağrışımı yaratır. Farmasötik geliştirme çizgisinde antikolinerjik-antispazmodik ilaçlar, 20. yüzyıl ortalarından itibaren, özellikle düz kas tonusunu azaltmak ve parasempatik hiperaktiviteyi baskılamak üzere evrilmiş bir ilaç grubu oluşturur. Propiverin de, bu tarihsel çizgi içinde idrar kesesi üzerindeki seçici antimuskarinik etkiye ve ek olarak kalsiyum kanal blokajına ağırlık veren “ikinci nesil” denebilecek bir tasarım yaklaşımının ürünüdür.
1.2. Klinik bağlamın evrimi: Aşırı aktif mesane
Aşırı aktif mesane (overactive bladder, OAB) ve irritabl mesane kavramları, ürolojide semptom temelli klinik sendromların giderek daha net tanımlanmasıyla öne çıkmıştır. Aşırı aktif mesane:
- Sıklık artışı (frequency),
- Noktüri (gece idrara kalkma),
- Urge (ani, baskılanması güç işeme isteği),
- Urge inkontinans (idrar kaçırma ile seyreden urg’lar),
ile karakterize bir durumdur ve genellikle altta yatan yapısal bozukluk olmaksızın detrüsor aşırı aktivitesi ile ilişkilidir. Propiverin gibi ajanlar, bu fonksiyonel hiperaktivitenin farmakolojik kontrolünde, özellikle yaşam kalitesi odaklı tedavi paradigmasının bir parçası olarak geliştirilmiştir.
2. Kimyasal yapı ve farmasötik özellikler
2.1. Temel kimyasal veriler
- Etkin madde: Propiverin
- Molekül formülü: C₂₃H₂₉NO₃
- Molekül ağırlığı (Mr): 367.5 g/mol
- Farmasötik form: Genellikle propiverin hidroklorür tuzu şeklinde formüle edilir (suda çözünürlüğü ve stabilitesi daha elverişlidir).
Tıbbi ürünlerde (örneğin Mictonorm®, Mictonet® gibi) modifiye salımlı sert kapsüller veya draje/tablet formunda bulunur. Modifiye salım, ilacın plazma konsantrasyonundaki dalgalanmaları azaltmayı ve gün içi semptom kontrolünü daha homojen hale getirmeyi hedefler.
2.2. Yapısal özellikler ve atropin ile ilişkisi
Metinde de belirtildiği gibi, ana referans bileşik atropindir. Atropin, doğal bir tropan alkaloid olup güçlü ve non-selektif bir muskarinik reseptör antagonistidir. Propiverin:
- Yapısal olarak tam bir tropan alkaloidi değildir, ancak antimuskarinik farmakoforu taklit eder.
- Atropin ile bazı yapısal ve farmakoforik benzerlikler taşır:
- Aromatik/heteroaromatik bir halka sistemi,
- Ester/eter bağları,
- Protonlanabilir bir amin grubu (fizyolojik pH’da kısmen veya tamamen katyonik).
Bu özellikler, muskarinik reseptör bağlanmasına ve düz kas düzeyinde etkili olmasına katkıda bulunur. Ek olarak, lipofilik yan zincirleri ve aromatik çekirdeği, membranlardan geçişi ve iyon kanalları üzerinde etkiyi kolaylaştırır.
2.3. Aktif metabolitler
Propiverin’in farmakodinamik etkisinde aktif metabolitler de rol oynar. Bu durum, sadece ana bileşiğin değil, metabolitlerinin de mesane düz kası ve muskarinik reseptörler üzerindeki katkısını içerir. Bu sayede:
- Etki süresi uzayabilir,
- Doz–yanıt ilişkisi, yalnızca ana molekülün plazma konsantrasyonuna indirgenemeyecek daha kompleks bir kinetik-dinamik ilişkiye dönüşür.
Bu farmakolojik “evrim”, özellikle modifiye salımlı formüllerde, tedavi etkinliğini gün boyu sürdürme stratejisinin bir parçası olarak görülebilir.
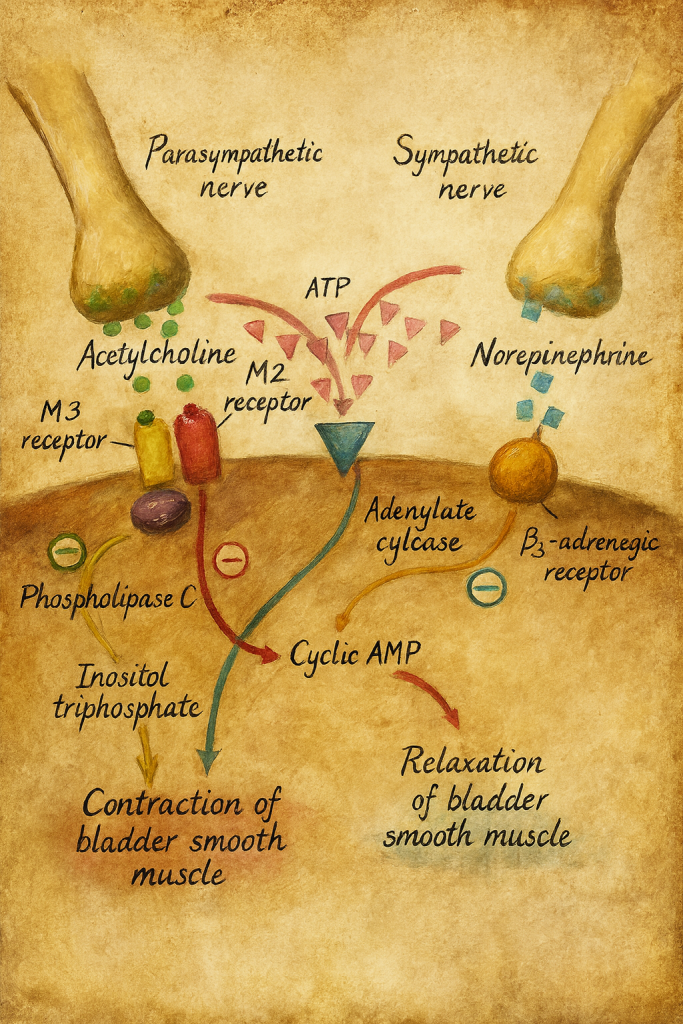
3. Farmakodinami: Etki mekanizmasının iki ekseni
Propiverin’in etkisi, iki ana farmakolojik eksen üzerinde açıklanır:
- Antikolinerjik (antimuskarinik) etki
- Voltaja bağlı L-tipi kalsiyum kanal blokajı
3.1. Antimuskarinik etki
Mesane fonksiyonu açısından en kritik reseptörler, detrüsor düz kas hücrelerindeki muskarinik M₂ ve özellikle M₃ reseptörleridir. Parasempatik sinir uçlarından salınan asetilkolin, bu reseptörleri aktive ederek:
- Detrüsor kasılmasını,
- İşeme refleksinin efferent kolunu
düzenler. Antimuskarinik bir ajan olan propiverin:
- Muskarinik asetilkolin reseptörlerine bağlanarak agonist (asetilkolin) ile rekabet eder.
- Bu bağlanma sonucunda:
- Detrüsor kasılabilirliği azalır,
- Mesanenin istemsiz kasılmaları baskılanır,
- Urge hissi ve urge inkontinansı azaltılır.
Fonksiyonel düzeyde bu, mesane kapasitesinde artış, işeme sıklığında azalma ve idrar kaçırma epizodlarında azalma olarak klinik tabloda ortaya çıkar.
3.2. Voltaj bağımlı L-tipi kalsiyum kanallarının blokajı
Düz kas kasılması, hücre içine kalsiyum girişine son derece bağımlıdır. Propiverin:
- L-tipi voltaj bağımlı kalsiyum kanallarını inhibe eder.
- Bu sayede:
- Detrüsor düz kas hücresi membranından Ca²⁺ girişi azalır,
- Hücre içi Ca²⁺ konsantrasyonu düşer,
- Aktin–miyozin etkileşimi ve kontraktilite zayıflar.
Bu mekanizma, antimuskarinik etkiden bağımsız, doğrudan miyojenik/iyon-kanalı düzeyinde bir gevşemeyi mümkün kılar. Böylece:
- Hem nörojenik (parasempatik aracılı) kasılma,
- Hem de düz kasın kendi elektriksel aktivitesine bağlı kasılma
üzerine çift yönlü bir baskı sağlanır. Bu “iki eksenli” mekanizma, propiverin’i yalnızca saf reseptör blokajı yapan klasik antimuskariniklerden bir miktar ayırır.
4. Farmakokinetik özellikler
Metniniz doğrudan farmakokinetik ayrıntı vermiyor, fakat sınıf özellikleri ve bilinen veriler ışığında, kısaca çerçevelemek yararlı olur:
- Emilim: Oral alımdan sonra iyi emilir; modifiye salımlı formlar, emilimin ve plazma piklerinin zamansal dağılımını “yumuşatır”.
- Dağılım: Lipofilik yapısı nedeniyle dokulara, özellikle düz kas içeren organlara yayılım gösterir. Plazma proteinlerine orta-yüksek oranda bağlanma beklenir.
- Metabolizma:
- Karaciğerde yoğun metabolizmaya uğrar.
- Özellikle CYP3A4 başta olmak üzere, flavin içeren mono-oksijenazlar (FMO1 ve FMO3) aracılığıyla metabolize edilir.
- Aktif metabolitleri klinik etkinliğe katkıda bulunur.
- Atılım: Metabolitler esas olarak idrar ve kısmen feçes yoluyla atılır.
Bu metabolik profil, ilaç–ilaç etkileşimlerinin anlaşılması açısından kritiktir (aşağıda ayrıntılandırılacaktır).
5. Endikasyonlar
Propiverin, temel olarak aşırı aktif mesanenin semptomatik tedavisinde kullanılır. Bu kapsamda:
- Urge inkontinans (ani sıkışma ile birlikte idrar kaçırma),
- Artmış işeme sıklığı,
- Urge (idrar yapma zorunluluğu, ani ve baskılanması güç işeme isteği)
tablosunun kontrolü hedeflenir.
Burada vurgulanması gereken nokta:
- Propiverin nedensel bir tedavi değildir; altta yatan organik nedeni ortadan kaldırmaktan çok, semptom kontrolüne yöneliktir.
- Bu nedenle:
- Altta yatan nörolojik, yapısal veya enfeksiyöz nedenler araştırılmalı,
- Gerekli olduğunda kombine tedavi (davranışsal tedaviler, pelvik taban egzersizleri, yaşam tarzı düzenlemeleri) ile birlikte kullanılmalıdır.
Dozaj, teknik bilgide (SmPC/ürün bilgisi) ayrıntılı olarak tanımlanır ve genellikle:
- Günde 2 kez verilen klasik formlar,
- Günde 1 kez verilen modifiye salımlı kapsüller
şeklinde düzenlenir. Doz bireyselleştirilirken yaş, karaciğer fonksiyonu, eşlik eden hastalıklar ve beraber kullanılan ilaçlar göz önüne alınır.
6. Kontrendikasyonlar
Propiverin, güçlü antikolinerjik ve düz kas gevşetici etkileri nedeniyle bazı klinik durumlarda kesin veya relatif kontrendike kabul edilir. Metinde geçen kontrendikasyonları sistematik biçimde açalım:
- Aşırı duyarlılık (hipersensitivite)
- Propiverin veya yardımcı maddelerden herhangi birine karşı bilinen alerji durumunda kullanım kontrendikedir.
- Bağırsak tıkanıklığı (ileus)
- Antikolinerjik etkiler, gastrointestinal motiliteyi daha da azaltarak mekanik veya paralitik ileusu kötüleştirebilir.
- Öngörülebilir idrar retansiyonu olan belirgin obstrüktif mesane boşaltma bozuklukları
- Prostat hipertrofisi veya üretral darlık gibi durumlarda, detrüsor kasılmasını ve mesane boşalmasını daha da zorlaştırarak akut idrar retansiyon riskini artırabilir.
- Miyastenia gravis
- Nöromüsküler kavşak düzeyinde zaten zayıf olan kas fonksiyonunu, kolinerjik tonusu azaltarak daha da bozabilir.
- Bağırsak atonisi
- Motilitenin zaten ciddi düzeyde azalmış olduğu durumlarda, antikolinerjiklerle peristaltizmi daha da baskılamak ciddi komplikasyonlara yol açabilir.
- Şiddetli ülseratif kolit
- Bu durumlarda, kolon motilitesinin baskılanması toksik megakolon riskini artırabilir. Nitekim toksik megakolonun kendisi de ayrı bir kontrendikasyon olarak listelenmiştir.
- Toksik megakolon
- Bu ağır durum, bağırsak duvarı ve motilitesi üzerinde antikolinerjik baskının kesinlikle istenmediği, acil cerrahi ve yoğun bakım yönetimi gerektiren bir tablodur.
- Tedavi edilmemiş açı kapanması (dar açılı) glokom
- Antikolinerjikler, pupilla dilatasyonu ve kamara açısının daralması yoluyla akut açı kapanması glokom atağını tetikleyebilir.
- Orta veya şiddetli karaciğer yetmezliği
- İlacın yoğun hepatik metabolizması nedeniyle, ciddi karaciğer yetmezliğinde metabolizma bozulur, ilaca maruziyet artar ve toksisite riski yükselir.
- Taşiaritmiler
- Antikolinerjikler kalp hızını artırabilir, iletim sistemini etkileyebilir; mevcut taşiaritmi varlığında hemodinamik destabilizasyon riski artar.
Tam koruyucu önlemler ve ayrıntılı risk–yarar değerlendirmeleri, profesyoneller için hazırlanmış resmi ilaç bilgilerinde (SmPC, prospektüs) ayrıntılı olarak belirtilmiştir.
7. İlaç–ilaç etkileşimleri
Propiverin’in metabolizması ve farmakodinamik profili, hem farmakokinetik, hem de farmakodinamik düzeyde etkileşimlere açıktır.
7.1. Metabolik etkileşimler (CYP3A4, FMO1, FMO3)
Propiverin:
- CYP3A4 için bir substrattır.
- Ayrıca FMO1 ve FMO3 enzimleri ile de metabolize olur.
Bu nedenle:
- Güçlü CYP3A4 inhibitörleri (bazı makrolid antibiyotikler, azol grubu antifungaller, belirli proteaz inhibitörleri vb.) plazma düzeylerini artırabilir.
- Güçlü CYP3A4 indükleyicileri (örneğin rifampisin, bazı antikonvülzanlar) propiverin düzeyini düşürebilir.
Metin, spesifik etkileşim listesini daha çok farmakodinamik düzeyde sınıflar halinde vermektedir:
7.2. Farmakodinamik etkileşimler
Aşağıdaki ilaçlarla birlikte kullanıldığında etkileşim riski artar:
- Trisiklik antidepresanlar
- Kendileri de antikolinerjik etkiye sahiptir. Birlikte kullanım, antikolinerjik yan etkileri (ağız kuruluğu, kabızlık, görme bozuklukları, idrar retansiyonu) güçlendirebilir.
- Benzodiazepinler gibi sedatifler
- Propiverin yorgunluk ve bitkinlik yapabileceğinden, sedatiflerle birlikte kullanımı santral sinir sistemi depresyonunu ve reaksiyon zamanını olumsuz etkileyebilir.
- Diğer antikolinerjikler (örneğin bazı antiparkinson ilaçları, antipsikotikler, antihistaminikler)
- Toplam antikolinerjik yük artar; kognitif bozulma, deliryum riski, GİS atonisi, idrar retansiyonu gibi yan etkiler belirginleşebilir.
- Amantadin
- Hem dopaminerjik hem antikolinerjik özellikleri olan bu ilaçla kombinasyon, özellikle yaşlılarda kognitif yan etkileri ve antikolinerjik yükü artırabilir.
- Nöroleptikler (antipsikotikler)
- Pek çoğunun antikolinerjik yan etkileri veya QT uzatma potansiyeli mevcuttur; bu nedenle taşikardi, iletim bozuklukları ve antikolinerjik toksisite riski artabilir.
- Sempatomimetikler
- Kalp hızını artırma ve kardiyovasküler sistemi uyarma eğilimindedir. Propiverin ile birlikte taşikardi ve aritmi riski büyür.
- Parasempatomimetikler
- Farmakodinamik olarak karşıt etki gösterirler. Birlikte kullanım, her iki ilacın da etkinliğini zayıflatabilir.
- İzoniazid
- Metabolizma ve santral yan etkiler açısından dikkat gerektirir; doğrudan antikolinerjik etki göstermese de, klinik deneyim ve vaka bildirimleri ışığında etkileşim olasılığı vurgulanmıştır.
Bu noktada klinik yaklaşım, özellikle yaşlı ve polifarmasi altındaki hastalarda “toplam antikolinerjik yük”ün değerlendirilmesi ve gerekirse ilaç listesinin sadeleştirilmesi yönünde olmalıdır.
8. İstenmeyen etkiler (yan etkiler)
Metninizde belirtilen istenmeyen etkiler, tipik antimuskarinik yan etki spektrumunu yansıtır. Bunları sistematik başlıklar halinde ele alalım:
8.1. En sık görülen yan etkiler
- Ağız kuruluğu (kserostomi)
- En sık bildirilen yan etkilerden biridir. Tükürük bezleri üzerindeki muskarinik reseptör blokajına bağlıdır.
- Diş çürüğü, oral enfeksiyonlar ve yutma güçlüğü riskini artırabilir.
- Baş ağrısı
- Hem santral sinir sistemi etkileri, hem de otonom denge değişiklikleri ile ilişkili olabilir.
- Görme bozuklukları ve akomodasyon bozukluğu (bulanık görme)
- Silier kas ve pupilla sfinkter kası üzerindeki antimuskarinik etki nedeniyle gelişir. Özellikle yakın görmede zorluk (“yakını bulanık görme”) belirgindir. Araç kullanma ve hassas görsel işlerde dikkat gerektirir.
- Kabızlık
- Barsak motilitesinin antikolinerjik baskılanmasının doğrudan sonucudur. Yaşlı, hareketsiz veya düşük sıvı alan hastalarda daha belirgindir.
- Karın ağrısı ve hazımsızlık (dispepsi)
- GİS motilite değişiklikleri ve sekresyon azalmasıyla ilişkilidir.
- Yorgunluk ve bitkinlik (astenik semptomlar)
- Santral sinir sistemi üzerindeki dolaylı etkiler, uyku kalitesindeki değişiklikler, idrara çıkma paternindeki düzelme/bozulma gibi faktörler katkıda bulunabilir.
Metinde ayrıca barınma bozuklukları ve görme bozuklukları ayrı ayrı anılmış olup, bunlar pratikte çoğu kez “bulanık görme” başlığı altında klinik olarak izlenir.
8.2. Antikolinerjik yükle ilişkili potansiyel diğer etkiler
Metin doğrudan listelemese de, sınıf etkileri nedeniyle şu yan etkiler teorik ve pratik olarak önem taşır:
- Taşikardi, çarpıntı,
- İdrar retansiyonu (özellikle erkeklerde, prostat büyümesi varsa),
- Kognitif yavaşlama, konfüzyon, özellikle yaşlı ve demanslı hastalarda,
- Terleme azalması ile hipertermi riski (sıcak havalarda).
Bu etkiler, doz, yaş, eşlik eden hastalıklar ve ilaç kombinasyonları ile birlikte değerlendirilmelidir.
9. Klinik kullanımın evrimsel perspektifi
Propiverin, aşırı aktif mesane tedavisinde yer alan farmakolojik ajanlar arasında, klasik antimuskarinikler (örneğin oksibutinin, tolterodin, solifenacin vb.) ile daha yeni nesil ajanlar (β₃-agonistler gibi) arasında bir köprü niteliği taşır. Evrimsel çizgiyi kabaca şöyle betimleyebiliriz:
- Birinci aşama: Saf antimuskarinikler
- Atropin benzeri, çoğu kez santral yan etkileri belirgin, mesane üzerinde seçiciliği sınırlı moleküller.
- İkinci aşama: Mesane-selektif antimuskarinikler
- M₃ reseptörlerine görece daha fazla afinite, lipofilik yapı ve farmakokinetik optimizasyon ile hedef organ seçiciliği artırılmaya çalışılır.
- Ara bir yaklaşım: Hem antimuskarinik hem kalsiyum kanal blokajı
- Propiverin gibi ajanlar bu aşamada yer alır; mekanizmayı çeşitlendirerek hem nörojenik, hem miyojenik katkıları hedef alırlar.
- Üçüncü aşama: Muskarinik sistemin dışında hedefler
- β₃-adrenerjik agonistler gibi ajanlar, mesane gevşemesini alternatif reseptör yolları üzerinden sağlar.
Bu açıdan bakıldığında propiverin, mesane kas tonusunu iki ayrı biyolojik kapıdan kilitleyen bir “çift kilit mekanizması” sunar:
- Biri muskarinik reseptör düzeyinde,
- Diğeri iyon kanalı düzeyinde.
10. Klinik uygulama ve hasta yönetimi açısından pratik noktalar
- Tedaviye başlanmadan önce:
- Altta yatan enfeksiyon, taş, tümör gibi organik nedenler dışlanmalıdır.
- Mesane günlüğü ve semptom skorlama ölçekleri (örneğin OAB-q) ile başlangıç durumu belgelemek faydalıdır.
- Doz titrasyonu:
- Genellikle sabit dozlarla başlanır, tolere edilebilirlik ve yanıt durumuna göre ayarlama yapılır.
- Yaşlı hastalarda daha düşük başlangıç dozu ve yavaş titrasyon tercih edilir.
- İzlem:
- Ağız kuruluğu, görme yakınmaları, kabızlık gibi yan etkiler aktif sorulmalıdır.
- Mesane boşalmasının yeterli olduğundan emin olmak için, özellikle riskli gruplarda rezidü idrar ölçümü yapılabilir.
- Özel popülasyonlar:
- Yaşlılar: Kognitif etkiler ve antikolinerjik yük açısından en hassas gruplardan biridir.
- Karaciğer yetmezliği olanlar: Orta-şiddetli karaciğer yetmezliğinde kontrendikedir; hafif yetmezlikte sıkı izlem gerekir.
- Kardiyak ritim bozukluğu olanlar: Taşiaritmi varlığında kontrendikasyon söz konusudur; hafif kardiyak risklerde EKG takibi gerekebilir.
Keşif
Propiverin’in hikâyesi, modern farmasötik kimyanın gelişim çizgisini, ürolojik fizyopatolojinin giderek daha incelikli anlaşılmasını ve antikolinerjik ilaç tasarımının evrimini bir araya getiren uzun bir bilimsel serüven olarak görülebilir. Bu serüven, tropan alkaloidlerinin keşfedildiği 19. yüzyıldan başlayıp, 20. yüzyılın ortasında sentetik antimuskariniklerin ortaya çıkışına, oradan da 21. yüzyılda aşırı aktif mesanenin nörofizyolojik temellerine yönelik güncel araştırmalara uzanır.
1. Tropan alkaloidlerinin keşfi ve uzak bir atanın gölgesi (19. yüzyıl – 20. yüzyıl başı)
Propiverin’in hikâyesinin ilk bölümü, molekülün doğrudan kendisinden çok, onun farmakodinamik atasını oluşturan atropin ve diğer tropan alkaloidlerinin keşfine dayanır. 1830’ların kimyasal farmakoloji atmosferinde, Alman ve Fransız kimyagerleri Atropa belladonna bitkisinden izole edilen maddelerin sinir sistemi ve göz pupillası üzerindeki etkilerini sistematik incelemeye başladılar. Bu dönemde Friedlieb Ferdinand Runge, Philipp Lorenz Geiger ve daha sonra Richard Willstätter gibi araştırmacıların alkaloid kimyasına yaptığı katkılar, muskarinik reseptör blokajının farmakolojik bir fenomen olarak anlaşılmasının yolunu açtı. Göz bebeğinin genişlemesi, tükürük salgısının baskılanması, düz kas gevşemesi gibi etkilerin moleküler bir “şablonu”, işte bu yıllarda şekillenmeye başladı.
Bu dönemin çalışmaları, modern antimuskariniklerin tasarımında bir kavramsal atlama tahtası işlevi gördü: parasempatik aktivitenin farmakolojik olarak baskılanması hem mümkün hem de klinik açıdan anlamlıydı. Ancak atropin ve benzeri doğal alkaloidlerin geniş yan etki profili, daha seçici ve daha iyi tolere edilen bileşiklere duyulan ihtiyacı belirginleştirdi.
2. Antispazmodik sentez dalgası: Papaverin’den modern türevlere (1920–1960)
- yüzyılın ilk yarısında düz kas fizyolojisi ve kalsiyum iyon akımının kasılma süreçlerindeki rolü giderek daha ayrıntılı biçimde tanımlandı. Bu dönemde papaverin gibi afyon türevi antispazmodikler laboratuvarlarda yoğun biçimde inceleniyordu. Papaverin yapısındaki metoksi grupları, aromatik çekirdek, lipofilik yan zincirler ve molekülün iyon kanalları üzerindeki etkileri, kimyagerlere düz kas tonusunu azaltabilecek çok sayıda sentetik varyasyon üretme fikrini verdi.
Tıpkı tropan alkaloidlerinin antikolinerjik etkisinden doğan ilham gibi, papaverin benzeri bileşiklerin iyon kanalı modülasyonu da farmasötik tasarıma ikinci bir eksen sunuyordu. Bu iki düşünce hattının – muskarinik antagonizm ve kalsiyum kanal blokajı – ileride propiverin’de birleşecek çift etkili farmakolojik mimariyi oluşturduğu söylenebilir.
3. Sentetik antimuskariniklerin yükselişi (1950–1980): Propiverin’in doğumuna giden zemin
1950’lerden itibaren parasempatik sinyallemenin daha seçici biçimde baskılanması için birçok sentetik antimuskarinik geliştirildi. Bu dönemde Hoffmann-La Roche, Sandoz, Bayer, Takeda, Schering gibi büyük ilaç şirketlerinin kimya laboratuvarları, yüzlerce ester, amid, amin ve aromatik yan zincir kombinasyonunu test ederek antikolinerjik farmakoforu zenginleştirmeye çalıştı.
Bu dönemde:
- muskarinik reseptör alt tiplerinin (özellikle M₂ ve M₃) fonksiyonları daha iyi tanımlandı,
- düz kas tabakalarında kalsiyum kanal fizyolojisi çözümlendi,
- farmakokinetik parametrelerin (absorpsiyon, ilk geçiş metabolizması, lipofilik dağılım) ilaç tasarımına etkisi açıkça ortaya kondu.
Bu bilimsel ortamın ortasında, Almanya merkezli araştırma grupları, mesane düz kasında hem antimuskarinik hem de L-tipi kalsiyum kanal blokajı sağlayabilecek hibrit bir molekül arayışına girdiler. İşte propiverin’in kimyasal tasarımı bu araştırma hattında doğdu.
4. Propiverin’in geliştirilmesi (1970’ler sonu – 1980’ler başı): Çifte eksenli bir molekül
Propiverin’in keşfi, tam olarak bu bağlamda, hem atropin benzeri muskarinik antagonizmayı hem de papaverin benzeri kalsiyum kanal blokajını tek bir molekülde birleştirme fikriyle çalışan kimyager ve farmakologların işidir.
Bu araştırma hattında yer alan bilim insanları:
- düz kas üzerindeki elektriksel aktivitenin inhibisyonunu,
- parasempatik sinyal iletim zincirinin kesintiye uğratılmasını,
- mesane aşırı aktivitesinin nöromiyojenik kökenlerinin ikili baskılanmasını
aynı farmakolojik “gövde”de bütünleştirmeye çalıştılar.
Propiverin’in prototip molekülü sentezlendiğinde, laboratuvar deneyleri ilacın iki özelliğini özellikle ortaya koydu:
- Muskarinik reseptör antagonizması
- L-tipi kalsiyum kanal blokajı
Bu çift etki, klasik antimuskariniklerden farklı olarak hem nörojenik hem miyojenik aşırı aktiviteyi baskılayabildiği için dikkat çekti.
5. Preklinik ve klinik değerlendirmeler (1980–1990): Mesaneye özgü bir profilin ortaya çıkışı
Propiverin’in in vitro ve in vivo modellerde değerlendirilmesi, araştırmacılara birkaç önemli içgörü sağladı:
- Mesane düz kasında diğer organlara kıyasla daha belirgin bir gevşeme etkisi vardı.
- Sistemik antikolinerjik yan etkiler, atropin benzeri bileşiklere göre daha yönetilebilirdi.
- Kalsiyum kanal blokajı sayesinde detrüsor kasılmaları daha düzenli biçimde baskılanıyordu.
Bu dönemin klinik denemeleri, propiverin’in özellikle idrar sıkışma hissi (urge), sık işeme (frequency) ve urge inkontinans üzerinde anlamlı bir iyileşme sağladığını gösterdi. Böylece ilaç, Avrupa pazarlarına kontrollü biçimde girmeye başladı.
6. Avrupa farmasötik pazarı ve ruhsatlandırma dönemi (1990–2020): Mictonorm® ve modifiye salım teknolojileri
Propiverin’in tıbbi ürüne dönüşmesi uzun bir süreçti. 1990’lar boyunca çeşitli ülkelerde ruhsatlandırma çalışmalarına hazırlanırken, farmasötik formülasyon teknolojisindeki gelişmeler de ilacın klinik kullanımını etkiledi. Özellikle:
- tek dozda uzun süreli etkili modifiye salımlı kapsüller,
- daha kontrollü farmakokinetik profiller sunan draje ve tabletler
üzerindeki çalışmalar hızlandı.
2020’de Mictonorm® adıyla modifiye salımlı kapsüllerin resmî onayı, ilacın modern formülasyonunun standartlaşmasının önemli bir adımı oldu. Bir süre sonra Mictonet® gibi alternatif formülasyonların tescillenmesi, kullanım alanını genişletti.
Bu dönem aynı zamanda aşırı aktif mesane tedavisinin farmakolojik standartlarının belirlendiği, antimuskariniklerin yan etki profili ile β₃-agonistlerin yeni rolünün tartışıldığı bir zaman dilimiydi. Propiverin, bu yeni paradigmanın içinde “çift etkili” bir seçenek olarak özgün konumunu korudu.
7. Güncel araştırmalar (2020–günümüz): Nöromiyojenik aşırı aktivite, reseptör alt tipleri ve kişiselleştirilmiş tedavi
Son yıllarda propiverin üzerine yapılan araştırmalar, ilaca artık sadece klasik antimuskarinik mercekten değil, daha geniş bir nörofizyolojik perspektiften bakmaktadır. Güncel araştırma alanları arasında:
- M₃ reseptör seçiciliğinin daha ayrıntılı haritalanması,
- mesane afferent sinyallemesinin modülasyonu,
- detrüsor miyojenik aktivite paternlerinin kalsiyum kanal blokajına verdiği yanıt,
- yaşlı hastalarda antikolinerjik yükü azaltacak doz-interval optimizasyonu,
- farmakogenetik modellerle CYP3A4 ve FMO polimorfizmlerinin yanıt üzerindeki etkileri,
- kombine tedavilerde propiverin + β₃-agonist sinerjisi
yer almaktadır.
Bu çalışmalar, aşırı aktif mesanenin sadece kas değil aynı zamanda santral ve periferik sinir sistemini içeren karmaşık bir ağ bozukluğu olduğunu göstermektedir. Propiverin’in hem reseptör düzeyinde hem de iyon kanalı düzeyinde etki göstermesi, bu karmaşık ağın iki farklı düğüm noktasını hedef almasını sağlayarak, klasik antimuskariniklere göre belirgin bir fizyolojik kapsam sunar.
Ayrıca modern görüntüleme ve elektrofizyoloji teknikleri, propiverin tedavisi sırasında detrüsor kasının kasılma örüntülerindeki değişiklikleri daha objektif biçimde incelemeye olanak vermektedir. Bu sayede kişiselleştirilmiş tedavi modelleri giderek daha uygulanabilir hâle gelmektedir.
8. Bugünden baktığımızda Propiverin’in hikâyesi
Propiverin, keşif yolculuğu boyunca:
- yüzyılın atropin çalışmalarından kimyasal ilham alan,
- yüzyılın antispazmodik sentez dalgasından farmakoforik yapı mirası taşıyan,
- çift etkili (antimuskarinik + kalsiyum kanal blokeri) farmakodinamik tasarımıyla özgün bir kimliği olan,
- modern aşırı aktif mesane tedavisinde seçkin ve istikrarlı bir yer edinen
bir ilaç olarak ortaya çıkmıştır.
İleri Okuma
- Hampel, C., Wienhold, D., Benken, N., Eggersmann, C., Thüroff, J. W. (1997). Definition of overactive bladder and epidemiology of urinary incontinence. Urology, 50(6A Suppl), 4–14.
- Yoshimura, N., Chancellor, M. B. (2002). Current and future pharmacological treatment for overactive bladder. The Journal of Urology, 168(5), 1897–1913.
- Abrams, P., Cardozo, L., Fall, M., Griffiths, D., Rosier, P., Ulmsten, U., et al. (2002). The standardisation of terminology of lower urinary tract function: report from the Standardisation Sub-Committee of the International Continence Society. Neurourology and Urodynamics, 21(2), 167–178.
- Wein, A. J., Rovner, E. S. (2002). Definition and epidemiology of overactive bladder. Urology, 60(5 Suppl 1), 7–12.
- Andersson, K.-E. (2004). Antimuscarinics for treatment of overactive bladder. The Lancet Neurology, 3(1), 46–53.
- Teleman, P. M., Stålsberg, H., Milsom, I. (2004). Overactive bladder: prevalence, risk factors and relation to stress incontinence in middle-aged women. BJOG, 111(6), 600–604.
- Wein, A. J. (2006). Overactive bladder: a better understanding of pathophysiology, diagnosis and management. The Journal of Urology, 175(3 Pt 2), S5–S10.
- Irwin, D. E., Milsom, I., Hunskaar, S., Reilly, K., Kopp, Z., Herschorn, S., et al. (2006). Population-based survey of urinary incontinence, overactive bladder, and other lower urinary tract symptoms in five countries: results of the EPIC study. European Urology, 50(6), 1306–1315.
- Lam, S., Hilas, O. (2007). Pharmacologic management of overactive bladder. Reviews in Urology, 9(1), 9–17.
- Abrams, P., Andersson, K.-E. (2007). Muscarinic receptor antagonists for overactive bladder. BJU International, 100(5), 987–1006.
- Chapple, C. R., Khullar, V., Gabriel, Z., Muston, D., Bitoun, C. E., Weinstein, D. (2008). The effects of antimuscarinic treatments in overactive bladder: an update of a systematic review and meta-analysis. European Urology, 54(3), 543–562.
- Kennelly, M. J., Dmochowski, R. R. (2008). Overactive bladder: pharmacologic treatments in the neurogenic population. Reviews in Urology, 10(3), 182–191.
- Zinner, N. R., Mattiasson, A. (2010). Pharmacological management of overactive bladder: focus on antimuscarinic agents. International Journal of Clinical Practice, 64(7), 978–990.
- Staskin, D., Kelleher, C. (2011). Overactive bladder: pharmacologic treatments in the neurogenic and non-neurogenic patient. Reviews in Urology, 13(4), e189–e202.
- Coyne, K. S., Sexton, C. C., Vats, V., Thompson, C., Kopp, Z. S., Milsom, I. (2011). National community prevalence of overactive bladder in the United States stratified by sex and age. Urology, 77(5), 1081–1087.
- Gormley, E. A., Lightner, D. J., Burgio, K. L., Chai, T. C., Clemens, J. Q., Culkin, D. J., et al. (2012). Diagnosis and treatment of overactive bladder (non-neurogenic) in adults: AUA/SUFU guideline. The Journal of Urology, 188(6 Suppl), 2455–2463.
- Geoffrion, R. (2012). Treatments for overactive bladder: focus on pharmacotherapy. Journal of Obstetrics and Gynaecology Canada, 34(11), 1092–1101.
- Truzzi, J. C., Gomes, C. M., Bezerra, C. A., Plata, I. M., Campos, J., Garrido, G. L., et al. (2016). Overactive bladder – 18 years – Part II. International Brazilian Journal of Urology, 42(2), 199–214.
- Sacomani, C. A. R., et al. (2017). Overactive bladder: pharmacological treatment. Revista da Associação Médica Brasileira, 63(5), 393–401.
- Sacomani, C. A. R., et al. (2019). Overactive bladder – pharmacological treatment. Revista da Associação Médica Brasileira, 65(5), 643–652.
- Brucker, B. M., Newman, D. K., Sun, A. (2020). Optimizing nonsurgical treatments of overactive bladder. Urologic Clinics of North America, 47(2), 195–208.
- Kreydin, E. I., Gomes, C. M., Cruz, F. (2021). Current pharmacotherapy of overactive bladder. International Brazilian Journal of Urology, 47(6), 1091–1107.
- Mohan, C. S., Lee, W., Kobashi, K. C. (2021). Overactive bladder: where we are and where we are going. SIUJ, 2(5), 311–321.

Yorum yazabilmek için oturum açmalısınız.