HCN kanalları (hyperpolarization-activated cyclic nucleotide-gated channel) hiperpolarizasyon ile açılan ve siklik nükleotidler tarafından modifiye edilen katyon kanallarıdır.

Oluşum
HCN kanalları, depolarize edici katyon akışına neden olarak hem kalp hem de beyindeki ritmik aktivitede önemli bir rol oynar. Bu durum kalpte “Eğer”, beyinde ise “Ih” olarak adlandırılır.
Ayrıca HCN kanalları retinanın yanı sıra dilin tada duyarlı hücrelerinde ve spermde de bulunur. Memelilerdeki HCN ailesi dört alt tipten (HCN1-HCN4) oluşur, ancak bunlar beyin ve kalpte farklı şekilde ifade edilir ve organlardaki dağılım modeli de farklılık gösterir.

Kalpteki işlevi
HCN kanalları, özellikle de kalp pili kanalı HCN4, örneğin kalbin sinüs düğümünde, repolarizasyondan hemen sonra katyon akışını sağlar. Bu durum özellikle sodyum için geçerlidir, çünkü hücre içi konsantrasyonunun düşük olması nedeniyle potasyumun aksine kimyasal gradyanı hücrenin içine doğru yönelir. Bu yine yavaş, spontan, diyastolik bir depolarizasyona neden olur ve daha sonra T tipi kalsiyum kanalları tarafından desteklenir.
Hayvan deneylerinde farelerde HCN4 geninin inaktivasyonu, muhtemelen ortaya çıkan anormal kalp pili potansiyeli nedeniyle embriyonun hayatta kalamadığını göstermiştir. Ayrıca, HCN eksikliği olan farelerin kalpleri çok daha yavaş atmaktadır.
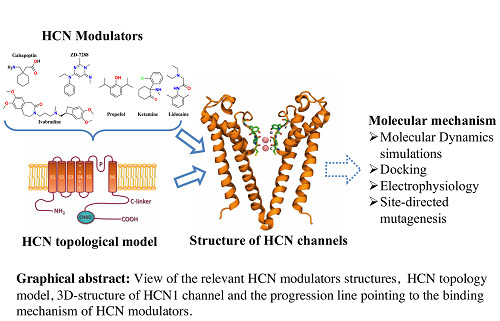
Hiperpolarizasyonla aktive olan Döngüsel Nükleotit kapılı (HCN) Kanallar ve Asit Algılama:
HCN kanalları, asidik uyaranlara yanıt verdikleri dilin tada duyarlı hücrelerinde (HCN1-HCN4) bulunur. Asidik bir uyaranın saptanması üzerine, HCN kanalları açılarak asit sinyalini yükseltir1.
HCN Kanallarının Düzenlenmesi:
Sempatik sinir sistemi, adrenerjik reseptörler aracılığıyla siklik adenozin monofosfat (cAMP) düzeylerini artırarak HCN kanallarını düzenler. cAMP, HCN kanalları için bir ligand görevi görür ve adenilat siklazı uyararak cAMP düzeylerinin artmasına yol açan bir G proteinine bağlı reseptör olan beta-1 reseptörünün aracılık ettiği pozitif bir kronotropik etki gösterir2.
Farmakolojisi:
HCN kanalları yalnızca sinüs ve atriyoventriküler (AV) düğümlerde bulunur ve ivabradin gibi HCN kanal blokerleri aracılığıyla kalp hızının hedeflenen manipülasyonuna olanak tanır. İvabradin, doza bağımlı bir şekilde HCN kanallarını bloke ederek diğer kardiyak fonksiyonları etkilemeden kalp atış hızını seçici olarak azaltır. Retinadaki iyonik akımdaki azalmaya atfedilen ivabradinin yan etkileri arasında sinüs bradikardisi ve fosfenler gibi görme bozuklukları yer alır. İvabradin, kanalın açık durumuna bağlanır ve onu inhibe eder, ancak kapalı durumda ayrışarak inhibisyonu tersine çevirir. Önerilen ivabradin dozları, istirahat ve egzersiz sırasında kalp atış hızının dakikada yaklaşık on atım azalmasına neden olur3.
Tarih
Kanallar ilk olarak 1970’lerin başında keşfedilmiştir. Kanalların başlangıçta hücre ölümünün düzenlenmesinde rol oynadığı düşünülmüştür. Ancak artık HCN kanallarının nöronal uyarılabilirliğin düzenlenmesi, kalp atış hızının kontrolü ve glikoz metabolizmasının düzenlenmesi de dahil olmak üzere çeşitli hücresel süreçlerde rol oynadığı bilinmektedir.
HCN kanalları çeşitli fizyolojik süreçler için önemlidir. Bununla birlikte, hastalık gelişiminde de rol oynayabilirler. Örneğin, HCN kanallarının epilepsi ve kalp aritmilerinin gelişiminde rol oynadığı düşünülmektedir.
HCN kanallarına yönelik araştırmaların geleceği, bu kanalların çeşitli hastalıklardaki rolünü anlamaya odaklanmıştır. Bilim insanları ayrıca HCN kanallarını hedef alabilecek yeni ilaçlar geliştirmek için de çalışmaktadır.
Kaynak:
- Mistrik, P., et al. (2005). HCN channels are expressed differentially in retinal bipolar cells and concentrated at synaptic terminals. European Journal of Neuroscience, 21(10), 2448–2464. DOI: 10.1111/j.1460-9568.2005.04073.x
- DiFrancesco, D. (2013). The role of the funny current in pacemaker activity. Circulation Research, 112(4), 706–720. DOI: 10.1161/CIRCRESAHA.111.255075
- Savelieva, I., & Camm, J. (2008). If inhibition with ivabradine: electrophysiological effects and safety. Drug Safety, 31(2), 95–107. DOI: 10.2165/00002018-200831020-00002