1. Kavramsal Çerçeve ve Giriş
“B semptomları” terimi, özellikle Hodgkin lenfoma (HL) ve Hodgkin dışı lenfomaların (non-Hodgkin lenfoma, NHL) evreleme ve prognostik değerlendirmesinde kullanılan, özgül bir sistemik belirti triadını ifade eder: açıklanamayan ateş, sırılsıklam gece terlemeleri ve anlamlı istemsiz kilo kaybı. Bu semptomların birlikte ele alınması ve “B” harfi ile işaretlenmesi, lenfomanın yalnızca anatomik yayılımını değil, aynı zamanda organizma düzeyindeki sistemik yanıtı yansıtması açısından tarihsel ve klinik bakımdan özel bir yere sahiptir.
- “B semptomları”, ateş >38 °C, sırılsıklam gece terlemeleri ve 6 ay içinde vücut ağırlığının >%10’luk istemsiz kaybını içeren, standardize edilmiş bir sistemik belirti üçlüsüdür.
- Bu kavram, 1971’de geliştirilen Ann Arbor evreleme sistemi ile lenfoma evrelemesine girmiş, “A” ve “B” kategorileriyle klinik pratiğe yerleşmiştir.
- B semptomları, başta Hodgkin ve Hodgkin dışı lenfomalar olmak üzere, KLL ve diğer hematolojik malignitelerde ileri hastalığı, yüksek tümör yükünü ve daha belirgin sistemik inflamasyonu yansıtır.
- Patofizyolojik olarak, proinflamatuvar sitokinlerin hipotalamus, karaciğer, kas ve yağ dokusu üzerindeki etkileriyle ilişkilidir.
- Klinik açıdan, hem evreleme, hem prognoz tahmini, hem de tedavi planlaması ve tedavi yanıtının izlenmesi için temel parametrelerden biridir.
- Evrimsel bakış açısıyla, bağışıklık yanıtına enerji tahsisini artıran adaptif mekanizmaların, malign süreçte kronikleşmiş ve zarar verici bir türevi olarak görülebilir.
2. Terminoloji ve Etimoloji
2.1. “Semptom” kavramı
“Semptom” sözcüğü, Yunanca sýmptōma (σύμπτωμα) kökünden gelir; “birlikte ortaya çıkan”, “tesadüfi olay”, “başına gelen şey” anlamlarına dayanır. Klinik bağlamda semptom, hastanın öznel olarak fark ettiği ve tarif ettiği, hekim tarafından doğrudan ölçülmeyen fenomenleri ifade eder (örn. ağrı, halsizlik, terleme hissi). “B semptomları” kavramı, bu öznel bildirimleri, objektif ölçümlerle (örneğin termometre ile doğrulanan ateş, kaydedilmiş ağırlık kaybı) birleştiren melez bir kategori hâline getirir.
“Konstitüsyonel semptomlar” ya da “sistemik semptomlar” ifadesi, ateş, kilo kaybı, gece terlemesi, iştahsızlık, halsizlik gibi tüm organizmayı ilgilendiren ve altta yatan süreç ne olursa olsun vücudun bütüncül yanıtını yansıtan bulguları tanımlamak için kullanılır. “B semptomları” bu daha geniş konstitüsyonel belirti kümesinin onkolojik bağlamda standartlaştırılmış bir alt kümesi olarak görülebilir.
2.2. “B” harfinin kökeni
Ann Arbor evreleme sistemi, 1971’de Hodgkin lenfomanın klinik evrelemesini standardize etmek amacıyla geliştirilmiştir. Bu sistemde hastalık evresi, esas olarak lenf nodu bölgelerinin sayısı, tutulduğu taraf (diyafram üstü/altı), ekstranodal tutuluma dair bulgular ve sistemik semptomların varlığına göre belirlenir.
- “A” harfi: Tanımlanmış sistemik semptomların yokluğunu
- “B” harfi: Bu semptomların varlığını
gösterir.
“B” harfinin kendisi, alfabetik olarak “A”nın karşıtı ve tamamlayıcısı olması dışında özgül bir etimolojik gerekçeye sahip değildir; yani “B” harfi, belirli bir kelimenin baş harfi (örneğin body ya da B-symptoms gibi) olarak seçilmemiştir. Daha çok, evreleme şemasında semptom varlığını işaretleyecek ikinci bir kategoriye gereksinim duyulması sonucu, alfabetik bir kodlama mantığı ile kullanıma girmiş, zamanla yerleşmiş bir kısaltmadır.
3. Ann Arbor Evreleme Sistemi ve B Semptomlarının Tarihsel Yeri
3.1. Ann Arbor sistemi: Temel yapı
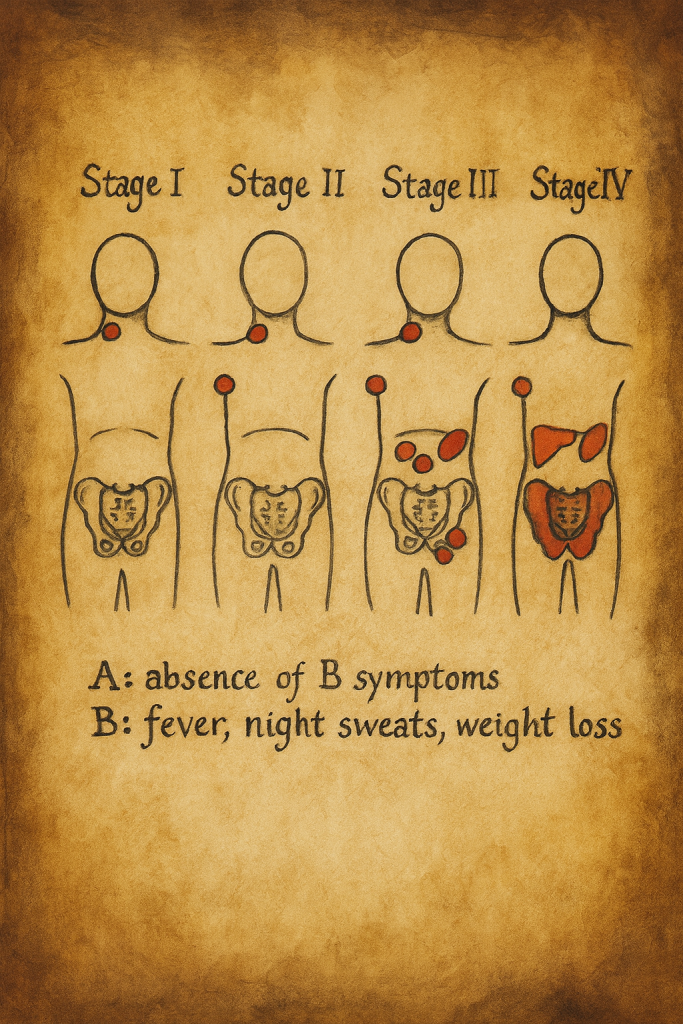
Ann Arbor evreleme sistemi, başlangıçta Hodgkin lenfoma için geliştirilmiş; daha sonra pek çok NHL alt tipine de uyarlanmıştır. Sistem, hastalığın yayılım derecesini şu eksenler üzerinden tanımlar:
- Evre I: Tek bir lenf nodu bölgesinde veya tek bir ekstranodal bölgeyle sınırlı hastalık
- Evre II: Diyaframın aynı tarafında, iki veya daha fazla lenf nodu bölgesinin tutulumu (veya bunlara komşu tek bir ekstranodal tutulum)
- Evre III: Diyaframın her iki tarafında lenf nodu bölgelerinin tutulumu
- Evre IV: Yaygın, diffüz veya dissemine ekstranodal tutulum (örneğin karaciğer, kemik iliği, akciğer, santral sinir sistemi gibi organlarda)
Bu anatomik evreye ek olarak şu modifikasyonlar kullanılır:
- A/B: Sistemik B semptomlarının yokluğu/varlığı
- Bazı şemalarda ek kodlar:
- E (ekstranodal komşuluk tutulum),
- S (dalak tutulumu),
- X (bulky, yani büyük kitleli hastalık) vb.
3.2. A ve B ayrımının rasyoneli
Aynı anatomik evreye sahip iki hastanın prognozunun, sistemik semptomların varlığına göre farklı seyrettiği gözlemi, A/B ayrımının çıkar noktasını oluşturur. Örneğin:
- Evre II lenf nodu tutulumu olup B semptomu olmayan bir hasta: Evre IIA
- Aynı yayılım derecesinde olup B semptomu taşıyan bir hasta: Evre IIB
Bu kodlama, anatomik yayılımın ötesinde, vücudun tümör yüküne ve tümör kaynaklı inflamatuvar yanıta verdiği yanıtın da evreleme şemasına entegre edilmesini amaçlar.
4. B Semptomlarının Standart Tanımı
Klasik tanım üç ana semptomu içerir:
- Açıklanamayan ateş
- Genellikle >38 °C (veya >38,3 °C) olan, persistan ya da tekrarlayan ateş epizodları
- Ateşi açıklayabilecek belirgin enfeksiyon odağı ya da başka bir non-malign nedenin olmaması
- Bazı tanımlarda, “en az üç ardışık gün” süren veya belirli periyotlarla yineleyen ateşten söz edilir.
- Sırılsıklam gece terlemeleri
- Hasta geceleri pijama ve çarşaflarını değiştirmek zorunda kalacak kadar yoğun terleme
- Oda sıcaklığı veya kalın giyinme gibi çevresel faktörlerle açıklanamayan terleme
- Gün içi hafif terlemeler bu kategoriye girmez; vurgu, “drenching” olarak tarif edilen yoğunluğa yapılır.
- İstemsiz ve anlamlı kilo kaybı
- Son 6 ay içinde vücut ağırlığının >%10’unun kaybı
- Diyet, egzersiz veya bilinçli yaşam tarzı değişiklikleriyle açıklanamayan bir kayıp
- Örneğin 70 kg’lık bir bireyde 6 ay içinde 7 kg’dan fazla istemsiz kayıp, B semptomu kriterini karşılar.
Bu üç semptomdan en az birinin, tanımlanmış standartlara uygun biçimde varlığı, hastanın “B” kategorisine yerleştirilmesi için yeterlidir.
5. Patofizyolojik Temeller: Sitokinler, Hipotalamus ve Metabolik Yanıt
B semptomları, tümörün bulunduğu anatomik bölgeyle sınırlı lokal etkilerden çok, sistemik inflamatuvar ve metabolik yanıtların ürünüdür. Bu yanıtın biyolojik altyapısını anlamak için sitokin ağı, hipotalamik düzenleyiciler ve enerji metabolizması birlikteliğine bakmak gerekir.
5.1. Sitokin aracılı inflamatuvar yanıt
Lenfomada tümör hücreleri (örneğin Hodgkin lenfomasında Reed-Sternberg hücreleri) ve tümör mikroçevresindeki immün hücreler (T lenfositler, makrofajlar, stromal hücreler) çok sayıda proinflamatuvar sitokin salgılar:
- Interlökin-1 (IL-1)
- Interlökin-6 (IL-6)
- Tümör nekroz faktörü alfa (TNF-α)
- Interferon-γ (IFN-γ) vb.
Bu sitokinler:
- Hipotalamusta termoregülatuvar merkezlerin set-point’ini yükselterek ateşe yol açar.
- Karaciğerde akut faz yanıtını tetikleyerek CRP, fibrinojen gibi akut faz proteinlerinin artmasına neden olur.
- Kas ve yağ dokusunda katabolizmayı artırarak kilo kaybını ve kas kitlesi kaybını (kaşeksi) tetikler.
- Merkezi sinir sistemi üzerinden uyku-uyanıklık düzenini ve otonom yanıtları etkileyerek gece terlemelerine zemin hazırlayabilir.
5.2. Enerji metabolizması ve kaşeksi
B semptomlarıyla seyreden lenfomalarda sıkça gözlenen kilo kaybı, basitçe “az yemeye” indirgenebilecek bir olgu değildir. Çoğu hastada:
- Bazal metabolik hız artmıştır,
- Lipoliz ve proteoliz sitokinler aracılığıyla hızlanmıştır,
- İştahı düzenleyen leptin, ghrelin ve diğer nöropeptidlerin dengesi bozulmuştur.
Bu durum, evrimsel açıdan bakıldığında, enfeksiyon veya ağır stres koşullarında organizmanın enerji kaynaklarını bağışıklık yanıtına ve doku onarımına tahsis etmesiyle paralellik gösterir; ancak malign süreçlerde bu yanıt kronikleşir ve maladaptif hâle gelir.
6. B Semptomları ve Lenfomalar
6.1. Hodgkin Lenfoma (HL)
Hodgkin lenfoma, tipik olarak:
- Genç erişkinlerde sık görülen,
- Reed-Sternberg hücreleri ve zengin inflamatuvar mikroçevresiyle karakterize,
- Çoğu olguda servikal veya mediastinal lenfadenopatiyle başlayan
bir lenfoma alt grubudur.
B semptomlarının HL’deki özellikleri:
- Özellikle ileri evre (Evre III–IV) ve bazı histolojik alt tiplerde (örn. nodüler sklerozan, mikst sellüler tip) daha sık görülür.
- B semptomları varlığı, hastanın “B” alt grubu içinde sınıflandırılmasına yol açar (örn. Evre IIIB).
- Tarihsel olarak B semptomlarının varlığı, daha kötü prognostik görünüm ve daha agresif tedavi ihtiyacı ile ilişkilendirilmiştir. Güncel tedavi şemalarında risk stratifikasyonu daha çok çoklu parametrelere (yaş, lökosit sayısı, hemoglobin düzeyi, serum albümini, lenfosit sayısı vb.) dayansa da B semptomları hâlen önemli bir klinik belirteçtir.
HL’de sıklıkla eşlik eden diğer klinik özellikler:
- Ağrısız, lastik kıvamında lenfadenopati
- Özellikle banyodan ya da alkol alımından sonra lenf düğümlerinde ağrı
- Pruritus (yaygın kaşıntı)
- Bazen mediastinal kitleye bağlı öksürük, dispne ve göğüs ağrısı
6.2. Hodgkin dışı Lenfomalar (NHL)
NHL, biyolojik davranışı son derece heterojen, B hücreli, T hücreli ve NK hücreli alt tipleri içeren geniş bir lenfoid malignite grubudur. Bu grupta:
- Agresif lenfomalar (örn. diffüz büyük B hücreli lenfoma, periferik T hücreli lenfomalar) B semptomları ile daha sık başvurur.
- İndolent lenfomalar (örn. foliküler lenfoma, küçük lenfositik lenfoma) ise uzun süre sadece lenfadenopati ile seyredebileceği için B semptomları başlangıçta daha nadirdir, ancak hastalık ilerledikçe ortaya çıkabilir.
NHL’de B semptomlarının klinik etkileri:
- Sistemik hastalık yükünü ve inflamatuvar aktiviteyi işaret eder.
- Tedavi planlamasında, özellikle agresif rejimlerin (örn. R-CHOP, daha yoğun protokoller) seçilmesinde dolaylı rol oynar.
- Bazı prognostik indekslerde (ör. Uluslararası Prognostik İndeks, IPI) doğrudan yer almasa da, yüksek evre ve yüksek LDH düzeyi ile kombine olduğunda kötü prognozun bir parçası olarak değerlendirilebilir.
NHL’de eşlik edebilen diğer bulgular:
- Büyümüş periferik lenf nodları
- Hepatosplenomegali
- Ekstranodal tutulum bulguları (ör. gastrointestinal sistemde karın ağrısı, kanama; santral sinir sisteminde nörolojik defisitler)
7. Diğer Hematolojik Maligniteler ve B Semptomlarına Benzer Tablo
7.1. Kronik Lenfositik Lösemi (KLL) ve diğer lösemiler
KLL, genellikle indolent seyirli bir B hücreli neoplazi olup, uzun süre asemptomatik kalabilir. Ancak ilerleyen evrelerde:
- B semptomları (ateş, gece terlemesi, kilo kaybı),
- Belirgin lenfadenopati ve splenomegali,
- Hematopoetik yetersizlik bulguları (anemi, trombositopeni)
ortaya çıkabilir.
KLL’de B semptomlarının klinik önemi:
- Hastalığın daha agresif bir faza geçişini düşündürebilir;
- Kimi olgularda Richter transformasyonu (KLL’nin agresif büyük B hücreli lenfomaya dönüşmesi) için alarm bulgusu olabilir;
- Tedavi başlama endikasyonları arasında, ileri sitopeniler ve hastalığa bağlı komplikasyonlarla birlikte önemli bir yer tutar.
Akut miyeloid lösemi (AML) ve akut lenfoblastik lösemi (ALL) gibi diğer lösemilerde de ateş, kilo kaybı ve terleme sık görülür; ancak bu tablolar, enfeksiyon, hızlı proliferasyon ve kemik iliği yetmezliğine bağlı karmaşık mekanizmaların ürünüdür ve klasik Ann Arbor “B semptomu” kategorisinden çok “konstitüsyonel semptomlar” başlığı altında değerlendirilir.
7.2. Multipl miyelom ve miyeloproliferatif neoplaziler
Multipl miyelomda:
- Kilo kaybı, halsizlik ve zaman zaman ateş, ilerlemiş hastalık ve enfeksiyonlarla ilişkili olarak görülebilir.
- Sitokin ağı (özellikle IL-6), hem kemik yıkımı hem de sistemik semptomatoloji açısından önemli rol oynar.
Miyeloproliferatif neoplazilerde (örn. miyelofibroz, polisitemia vera, esansiyel trombositemi):
- Ateş, gece terlemesi ve kilo kaybı, yüksek sitokin yükü ve hematopoetik disfonksiyonun parçası olarak ortaya çıkabilir.
- Özellikle miyelofibrozda belirgin B benzeri semptomlar söz konusudur; yine de bu tablo klasik lenfoma B semptomu kategorisinden bağımsız, fakat patofizyolojik açıdan akraba kabul edilebilir.
8. Tanısal Değerlendirme: B Semptomlarını Saptamak ve Ayırıcı Tanı
8.1. Ayrıntılı anamnez ve objektif ölçüm
B semptomlarının doğru şekilde değerlendirilmesi için:
- Ateşin ölçülmüş değerleri, süresi, paterninin (sürekli, aralıklı, dalgalı) kaydı
- Kilo değişiminin belgelenmiş olması (önceki tıbbi kayıtlar, düzenli tartım)
- Gece terlemelerinin şiddet, sıklık ve fonksiyonel etkilerinin (örn. uykudan uyandırması, kıyafet/çarşaf değiştirme gereksinimi) ayrıntılı sorgulanması
gereklidir.
Klinik pratikte, “Sıcak bastığı için mi pijamanızı çıkarıyorsunuz, yoksa çarşafları değiştirecek kadar sırılsıklam mı uyanıyorsunuz?” gibi sorular, B semptomları ile daha hafif terleme yakınmalarını ayırt etmeye yardımcı olur.
8.2. B semptomlarını taklit eden durumlar
Bu semptomlar malign hastalıklara özgü değildir ve şu durumlarda da sıkça görülebilir:
- Enfeksiyonlar: Tüberküloz, HIV, endokardit, kronik bakteriyel enfeksiyonlar
- Otoimmün ve romatolojik hastalıklar: Romatoid artrit, vaskülitler, bağ dokusu hastalıkları
- Endokrin bozukluklar: Hipertiroidi, feokromositoma
- Metabolik/diğer nedenler: İleri kalp yetmezliği, kronik böbrek hastalığı, ciddi depresyon, yeme bozuklukları
Bu nedenle, B semptomları saptandığında, hematolojik malignitelerin yanı sıra, bu alternatif nedenlerin de sistematik şekilde dışlanması gerekir.
9. B Semptomlarının Prognostik ve Terapötik Önemi
9.1. Evreleme ve prognoz
Lenfomada B semptomlarının evreleme içindeki rolü, özellikle üç düzeyde önem taşır:
- Risk sınıflaması: Aynı anatomik evre içinde B semptomlarının varlığı, çoğu çalışma ve klinik şemada daha kötü prognoz ile ilişkilidir.
- Tedavi yoğunluğunun belirlenmesi: B semptomlu hastalarda, yüksek tümör yükü ve sistemik inflamasyon varsayımıyla, daha yoğun veya uzatılmış kemoterapi protokolleri seçilebilmektedir.
- Tedavi yanıtının izlenmesi: Başarılı tedaviyle B semptomlarının gerilemesi, hem hastanın yaşam kalitesi hem de tümör yükünün azalması bakımından önemli bir klinik gösterge kabul edilir.
9.2. Görüntüleme ve ileri tanısal işlemler
B semptomlarının varlığı, hastalığın yaygınlığını saptamak için daha kapsamlı incelemeleri tetikleyebilir:
- BT ve PET-BT ile lenf nodu ve ekstranodal tutulumun kapsamlı değerlendirilmesi
- Kemik iliği biyopsisi ile kemik iliği infiltrasyonunun araştırılması
- Gerekirse organ spesifik incelemeler (örn. MRI, endoskopi, biyopsiler)
Bu sayede, B semptomları yalnızca bir sınıflandırma kodu değil, tanısal stratejinin şekillenmesini sağlayan bir klinik işaret hâline gelir.
10. Evrimsel Tıp Perspektifi: Ateş, Terleme ve Kilo Kaybı Neden Bir Arada?
Evrimsel açıdan bakıldığında, ateş, iştahsızlık ve enerji tüketimindeki artış, akut enfeksiyonlarda konak lehine, patojen aleyhine işleyen koruyucu mekanizmalar olarak yorumlanır:
- Ateş, pek çok patojenin replikasyonunu zorlaştırır, immün hücre fonksiyonlarını (örn. fagositoz, antijen sunumu) optimize eder.
- İştahsızlık ve geçici katabolizma, sindirim sisteminden ziyade immün sisteme enerji kaydırılmasını ve zararlı maddelerin alımının kısıtlanmasını sağlayabilir.
- Terleme, hem termoregülasyonun bir parçası hem de otonom sinir sistemi aktivasyonunun dışavurumu olarak ortaya çıkar.
Lenfoma ve diğer kanserlerde bu yanıt, patojenlere değil tümör hücrelerine ve tümör mikroçevresindeki kronik inflamatuvar uyaranlara karşı tetiklenir. Bu durumda:
- Başlangıçta savunma amaçlı olan mekanizma,
- Tümörün tamamen ortadan kaldırılamadığı kronik bir durumda süregenleşir
- Ve sonuçta maladaptif bir hâl alarak hastanın kas kütlesi kaybetmesine, güçsüzleşmesine ve yaşam kalitesinin düşmesine yol açar.
B semptomları böylece, evrimsel açıdan adaptif süreçlerin, onkolojik bağlamda patolojik bir uzantısı olarak da okunabilir.
Keşif
1. İsim Konmadan Önce: 19. Yüzyılda İlk Gözlemler
1.1. Malpighi’den Hodgkin’e uzanan çizgi
Lenfomaya özgü bir tabloyu andıran ilk patolojik tanımlamalardan biri, 17. yüzyılda Marcello Malpighi’ye atfedilir. 1666 tarihli çalışmasında, dalağında nodüler lezyonları olan genç bir kadından söz eder; bu olgu daha sonra geriye dönük olarak Hodgkin benzeri bir tablo olarak yorumlanacaktır.
Yine de modern anlamda “Hodgkin lenfoma”ya giden yol, Thomas Hodgkin ile başlar. 1832’de, ünlü makalesi “On Some Morbid Appearances of the Absorbent Glands and Spleen”’de, Guy’s Hospital’dan yedi olguyu sistematik biçimde tarif eder: boyun, mediasten, dalak ve bazen karaciğerde belirgin büyümeler; eşlik eden halsizlik, bazen uzamış ateş ve belirgin zayıflama. Hodgkin, bugün bizim “B semptomu” dediğimiz triadı isimlendirmez; ama hastaların bir kısmında sistemik kötüleşmenin, yalnızca şişmiş lenf düğümleriyle açıklanamayacağını dikkatle kaydeder.
Bu dönem için ayırt edici olan şudur:
- Lenf düğümlerindeki büyüme herkesin dikkatini çeker.
- Ateş, terleme, zayıflama ise “genel halsizlik” başlığı altında, dağınık biçimde not edilir.
- Yani lokal anatomi çok ciddiye alınırken, sistemik belirtiler henüz ayrı bir kavramsal kategori hâline gelmemiştir.
1.2. Wilks, Reed, Sternberg ve hastalığın kimlik kazanması
- yüzyıl ortalarından itibaren tablo netleşmeye başlar:
- Samuel Wilks (1865 civarı), Hodgkin’in olgularını yeniden gözden geçirir, yeni olgular ekler ve hastalığı “Hodgkin hastalığı” olarak adlandırır.
- 1898’de Carl Sternberg, 1902’de Dorothy Reed lenf nodlarında, bugün kendi adlarını taşıyan büyük, çift çekirdekli Reed–Sternberg hücrelerini tarif eder.
Bu isimlerin çalışmaları, hastalığı ayrı bir neoplazi olarak netleştirir; ama hâlâ kimse “ateş + gece terlemesi + kilo kaybı” için özel bir isim kullanmaz. Bunlar, tıpkı tüberküloz veya kronik enfeksiyonlardaki gibi “yapı bozulması ve zayıflama” olarak görülür.
2. 20. Yüzyıl Ortası: Radyoterapi, Stajing İhtiyacı ve Ann Arbor’a Giden Yol
2.1. Erken evreleme denemeleri
- yüzyılın ilk yarısında radyoterapi güçlendikçe, başka bir soru öne çıkar:
“Hodgkin hastalığının hangi evresine ne kadar ışın verelim?”
Bu soru, anatomik yayılımı standart bir dille tarif etme ihtiyacını doğurur. 1950’lerde:
- Vera Peters ve çağdaşları, alan sınırlı radyoterapi ile erken evre Hodgkin hastalarında kür olabileceğini gösterir.
- Peters, Rosenberg ve diğerleri, lenf nodu bölgelerini tek tek tanımlayan ve “evre I, II, III” gibi kavramları kullanan erken stajing şemalarını geliştirir.
Bu erken şemalarda, hastanın genel durumu ve konstitüsyonel belirtileri elbette kaydedilir; fakat bunlar hâlâ evre koduna gömülmüş değildir. Ateş ve kilo kaybı, prognoz sezgisi verir ama adlandırılmış bir alt sınıf hâlini almaz.
2.2. 1971: Ann Arbor Evreleme Sistemi ve “B” harfinin doğuşu
Kırılma noktası, 1971’dir. Paul P. Carbone başkanlığındaki bir komite – Henry S. Kaplan, Karl Musshoff, David W. Smithers, Maurice Tubiana ile birlikte – klasik makaleleri “Report of the Committee on Hodgkin’s Disease Staging Classification”’ı yayımlar.
Bu rapor, bugün “Ann Arbor Evreleme Sistemi” diye bildiğimiz şemayı resmileştirir:
- Evre I–IV: Lenf nodu bölgelerinin sayısı, diyaframın hangi tarafında oldukları, ekstranodal tutulum (E), dalak tutulumu (S) vb. ile tanımlanır.
- İlk kez, sistemik semptomlar ayrı ve standart bir kategoriye dönüştürülür.
Komite üç temel sistemik belirtiyi şu şekilde kodlar:
- Açıklanamayan ateş:
- 38 °C; bilinen enfeksiyonla açıklanamayan, günler süren ateş epizodları.
- Sırılsıklam gece terlemeleri:
- Hasta pijamasını, çarşafını değiştirmek zorunda kalacak kadar terleme.
- 6 ay içinde vücut ağırlığının >%10’unun istemsiz kaybı.
Bu üçlü, “B semptomları” olarak adlandırılır ve:
- Bu semptomlar yoksa: evre sonuna “A”,
- En az biri varsa: evre sonuna “B”
harfi eklenir (örn. IIA, IIIB).
Komite, B sınıflaması için ilginç bir ayrıntıyı da ekler:
- Sırf pruritus (kaşıntı) olması B sınıfı için yeterli değildir.
- Ateşin “kısa süreli ve açıklanmış bir enfeksiyonla ilişkili” olması da B sınıfına sokulmaz.(Scribd)
“Neden B?” sorusunun cevabı, aslında son derece dünyevîdir:
- A = Asymptomatic (ya da semptomsuz) gibi okunabilecek, “semptom yok” anlamını taşıyan bir etiket.
- Buna karşıt kategoriyi belirtmek için, alfabetik olarak bir sonraki harf olan B seçilir.
- Herhangi bir mitolojik ya da kelime kökenine dayanan özel gerekçe yoktur; amaç, pratik, kısa, evrensel bir kod yaratmaktır.
Bu noktayla birlikte, 19. yüzyıldan beri dağınık biçimde not edilen “ateş – terleme – kilo kaybı” üçlüsü, resmen evrensel bir prognostik sembole dönüşür.
3. 1980–1990’lar: Kemoterapi Çağı, B Semptomlarının Prognostik Güce Dönüşmesi
3.1. MOPP, ABVD ve “agresif hastalık” vurgusu
1970’lerin sonu–1980’lerin başı, sistemik kemoterapinin Hodgkin lenfomada kürü mümkün kıldığı dönemdir. Vincent DeVita ve çalışma arkadaşlarının MOPP rejimi, daha sonra Bonadonna ve ekibinin geliştirdiği ABVD şeması, ileri evre Hodgkin hastalığında bile uzun süreli sağkalımın mümkün olduğunu gösterir.
Bu çalışmalarda giderek netleşen gözlem şudur:
- Aynı anatomik evrede olan hastalarda, B semptomu olanlar,
- Daha yüksek tümör yüküne,
- Daha sık hepatosplenomegali ve kemik iliği tutulumuna,
- Daha yüksek LDH ve inflamatuvar belirteçlere sahiptir.
Bu nedenle, tedavi planları giderek iki eksende şekillenmeye başlar:
- Evre (I–IV): Hastalığın ne kadar yayıldığı.
- A/B durumu: Organizmanın bu tümör yüküne ne kadar “sistemik” yanıt verdiği.
Örneğin, servikal ve mediastinal nodlarla sınırlı iki hasta düşünelim:
- B semptomu olmayan: Evre IIA,
- Aynı yayılımda, ama 39 °C’ye varan açıklanamayan ateş, gece terlemeleri ve belirgin kilo kaybı olan: Evre IIB.
Bu iki hastanın anatomik haritası aynı olsa da, tedavi yaklaşımı ve beklenen prognoz farklıdır; B semptomlu hasta, daha agresif kombine radyoterapi + kemoterapi rejimlerine aday hâle gelir.
3.2. Cotswolds toplantısı ve Ann Arbor’un rafine edilmesi
1989’da T. Andrew Lister başkanlığındaki Cotswolds toplantısı, Ann Arbor sistemini ayrıntılı biçimde revize eder.
Bu toplantıda:
- A/B kodlaması korunur,
- B semptomlarının tanımı netleştirilir,
- “Bulky disease (X)” ve ekstranodal tutulumun detayları (E, S gibi ekler) daha sistematik hâle getirilir.
Böylece B semptomları:
- Sadece klinik pratikte kullanılan bir pratik kısaltma olmaktan çıkıp,
- Uluslararası klinik araştırma tasarımlarının ve
- Prognostik indekslerin ayrılmaz parçası hâline gelir.
4. 2000’lere Doğru: B Semptomları Hodgkin’in Dışına Taşınıyor
4.1. Hodgkin dışı lenfomalar (NHL) ve agresif alt tipler
Zamanla Ann Arbor sistemi, Hodgkin dışı lenfomalara da uyarlanır. Agresif alt tipler – özellikle diffüz büyük B hücreli lenfoma (DLBCL), bazı T hücreli lenfomalar – tanımlandıkça, klinisyenler şu paterni fark eder:
- B semptomları NHL’de de ileri evre ve yüksek proliferasyon ile birlikte görülme eğilimindedir.
- Bununla birlikte, B semptomlarının NHL’deki bağımsız prognostik rolü, Hodgkin’deki kadar net değildir; bazı çalışmalarda, B semptomları daha çok yaygın hastalık ve yüksek histolojik grade ile koreledir, kendi başına bağımsız bir risk faktörü olmayabilir.
Bu dönemde B semptomları:
- NHL evrelemesinde de “A/B” ayrımına yansır,
- Özellikle agresif lenfomalarda, tedavi yoğunluğunu belirlerken yardımcı bir işarete dönüşür,
- Ancak giderek daha karmaşık prognostik skorlar (IPI, FLIPI, MIPI vb.) içinde **tek başına belirleyici olmaktan uzaklaşır.
4.2. KLL ve diğer hematolojik maligniteler
B semptomu triadı, yavaş yavaş:
- Kronik lenfositik lösemi (KLL)
- Miyeloproliferatif neoplaziler
- Multipl miyelom gibi tablolar için de günlük dilde kullanılmaya başlar.
Özellikle KLL’de:
- B semptomlarının ortaya çıkması, çoğu zaman daha indolent bir fazdan agresif dönüşüme (örneğin Richter dönüşümü) işaret eden bir alarm bulgusudur.
Resmi kılavuzların bir kısmı B semptomlarını bu hastalıkların “evre koduna” gömmese de, klinik pratikte:
“Bu hasta artık B semptomu taşıyor; sadece takip etmek yerine tedavi planlamalı mıyız?”
sorusunu tetikleyen kritik bir eşik hâline gelir.
5. Patofizyolojik Derinleşme: Sitokinler, Kaşeksi ve Hipotalamus
5.1. IL-6, IL-10, TNF-α ve B semptomlarının biyokimyasal zemini
1990’lar ve 2000’lerle birlikte, B semptomlarının biyolojisi daha ayrıntılı araştırılmaya başlar. Bir dizi çalışma göstermiştir ki:
- Hodgkin hastalığı ve diğer lenfomalarda serum IL-6 ve IL-10 düzeyleri yükselmiştir.
- Özellikle IL-6 düzeyleri, B semptomlarının varlığıyla korelasyon gösterir; IL-6 ne kadar yüksekse, ateş ve kilo kaybı o kadar belirgindir.
Bu sitokinler:
- Hipotalamusta ısı ayar noktasını yükselterek ateşe,
- Karaciğerde akut faz yanıtını (CRP, fibrinojen artışı),
- Kas ve yağ dokusunda proteoliz ve lipolizi hızlandırarak kilo kaybına,
- Otonom sinir sistemi üzerinden gece terlemelerine katkıda bulunur.
B semptomları, bu açıdan bakıldığında:
- Tümörün lokal varlığından çok,
- Tümör ve konak bağışıklık sistemi arasındaki sitokin fırtınasının klinik yüzüdür.
5.2. Kanser kaşeksisi araştırmaları ile birleşen hat
Paralel bir araştırma hattı, kanser kaşeksisi (anoreksi, kas ve yağ kaybı, artmış enerji harcaması) üzerine yoğunlaşır. Bu literatür, TNF-α, IL-1, IL-6, IL-8, IL-10 ve çeşitli tümör kaynaklı faktörlerin:
- Bazal metabolik hızı artırdığını,
- İştahı azalttığını,
- Kas protein yıkımını ve yağ mobilizasyonunu hızlandırdığını,
- Brown yağ dokusunda termogenezi artırarak ısı üretimini yükselttiğini gösterir.
Lenfomalı hastalarda B semptomlarıyla beraber görülen:
- Hızlı kilo kaybı,
- Kas gücü kaybı,
- Sürekli hafif ateş hâli
bu kaşeksi biyolojisinin somutlaşmış biçimi olarak yorumlanmaya başlanır. Böylece B semptomları, sadece “stajing kodu” değil, sistemik metabolik ve immün bozulmanın bir aynası olarak da ele alınır.
6. 2010’lar: PET-BT, Lugano Sınıflaması ve B Semptomlarının Yeniden Konumlandırılması
6.1. PET-BT’nin evrelemeye girmesi
2000’lerin sonu–2010’larla birlikte 18F-FDG PET/BT, lenfoma evreleme ve yanıt değerlendirmesinde merkezî rol üstlenir. Birçok çalışma, metabolik aktivitenin ve metabolik tümör volümünün (MTV) prognozla güçlü ilişkisini ortaya koyar.
Bu dönüşüm, stajing sistemine de yansır:
- 2014 tarihli Lugano sınıflaması (Cheson ve ark.), Ann Arbor’u modernize eder:
- FDG-tutucu lenfomalar için PET-BT’yi standart evreleme aracı olarak benimser.
- Kemik iliği biyopsisinin gerekliliğini pek çok olguda azaltır.
- A/B kodlamasını esasen Hodgkin lenfoma ile sınırlar; NHL’de A/B vurgusu zayıflar.
Amerikan Kanser Derneği ve diğer kılavuzlar, Hodgkin lenfoma için artık “Lugano temelli, modifiye Ann Arbor” sistemini kullanmakta; evre I–IV, E, X ve A/B kodları hâlâ yerini korumaktadır.
6.2. B semptomları PET çağında ne kadar önemli?
PET-BT çağıyla birlikte yeni bir tartışma doğar:
“Hâlâ üç semptomlu bu kaba klinik triada bu kadar ağırlık vermeli miyiz,
yoksa PET-BT parametreleri (SUV, MTV, TLG vb.) daha mı değerli?”
DLBCL ve diğer agresif lenfomalarda:
- Bazı çalışmalar, B semptomlarının, güncel prognostik modellerde bağımsız yerinin sınırlı olduğunu;
- Buna karşın PET-BT’deki metabolik parametrelerin (örneğin tedavi öncesi MTV, tedavi ortası SUV düşüşü) sağkalımı daha güçlü öngördüğünü gösterir.
Buna rağmen klinik pratikte:
- B semptomları hâlâ anamnezde mutlaka sorulan temel bir bloktur.
- Özellikle sınırda ya da belirsiz PET bulgularında, devam eden ateş–terleme–kilo kaybı, rezidüel aktif hastalık lehine yorumlanabilir.
Lugano sınıflaması da bu ikili dengeyi yansıtır:
- Bir yanda son derece sofistike görüntüleme ve kantitatif parametreler,
- Diğer yanda hâlâ geçerliliğini koruyan, basit ama güçlü üç klinik soru:
“Ateşin var mı?
Geceleri sırılsıklam terliyor musun?
Son 6 ayda istemeden ciddi kilo kaybettin mi?”
7. 2020’ler ve Ötesi: Güncel Araştırma Hatları
7.1. Daha karmaşık prognostik modeller içinde B semptomları
Güncel araştırmalar, B semptomlarını artık:
- Tek başına “iyi/kötü prognoz” belirleyicisi olarak değil,
- Moleküler alt tipler, gen ekspresyon imzaları, PET-BT ölçümleri, serolojik biyobelirteçler ile birlikte işleyen bir ağın parçası olarak ele alıyor.
Örneğin:
- DLBCL’de hücre kökenine (GCB vs non-GCB), MYC/BCL2/BCL6 yeniden düzenlenmelerine,
- Relaps/rezistan hastalarda CAR-T öncesi PET-BT parametrelerine göre geliştirilen modellerde, B semptomları çoğu zaman ikincil ya da tamamlayıcı bir değişken olarak yer alıyor.
7.2. Sitokin imzaları ve hedefe yönelik semptom yönetimi
İnflamatuvar sitokinler üzerine yürüyen yeni çalışmalar, özellikle:
- IL-6 ailesi sitokinleri,
- TNF-a ilişkili kaskadları,
- Tümör kaynaklı proteoliz ve lipoliz indükleyici faktörleri
ayrıntılı biçimde haritalamaya çalışıyor. Amaç, yalnızca tümörü tedavi etmek değil, B semptomlarının kendisini – yani sistemik inflamasyon ve kaşeksiyi – hedef alacak tedavi stratejileri geliştirmek.
Bu yaklaşım, iki düzeyde önem kazanıyor:
- Yaşam kalitesi: Ateş, gece terlemeleri ve hızlı kilo kaybı, hastanın günlük hayatını en çok bozan belirtiler arasında.
- Tedavi toleransı: Kaşektik ve sistemik inflamasyonu yüksek hastalar, agresif kemoterapi veya CAR-T gibi tedavilere biyolojik olarak daha kırılgan.
Bu nedenle gelecekte B semptomları, yalnızca stajing kodunda bir harf değil, immün-metabolik hedefli destek tedavilerin tasarlandığı bir biyobelirteç ekseni hâline gelebilir.
8. Genel Çizginin Toplanışı
Tarihsel çizgiye yukarıdan bakıldığında:
- 19. yüzyılda Hodgkin ve çağdaşları, tanımsız ama dikkat çekici bir sistemik şablon görmüşlerdi: açıklanamayan ateşler, geceleri ıslanan çarşaflar, eriyen bedenler.
- 1971’le birlikte Carbone, Kaplan ve komitesi bu tabloya bir harf verdi: B; ateş, gece terlemesi ve kilo kaybını, evrensel bir klinik kısa adıma dönüştürdü.
- 1980–1990’larda kemoterapinin yükselişiyle B semptomları, “daha agresif, daha yaygın hastalık” eşanlamlısı hâline geldi ve tedavi kararlarına yön verdi.
- 2000’lerden itibaren kavram, Hodgkin dışı lenfomalara, KLL’ye ve diğer hematolojik malignitelere doğru genişledi; eşzamanlı olarak sitokin biyolojisi ve kaşeksi araştırmaları, bu semptomların biyolojik köklerini aydınlattı.
- PET-BT ve Lugano sınıflaması çağında B semptomları, daha sofistike görüntüleme ve moleküler belirteçlerin gölgesinde kalsa da, hâlâ hem klinik değerlendirmede hem de hastanın kendi hastalık anlatısında merkezî bir rol oynamaya devam ediyor.
İleri Okuma
- Carbone, P. P., Kaplan, H. S., Musshoff, K., Smithers, D. W., & Tubiana, M. (1971). Report of the Committee on Hodgkin’s Disease Staging Classification. Cancer Research, 31(11), 1860–1861.
- Lister, T. A., Crowther, D., Sutcliffe, S. B., Glatstein, E., Canellos, G. P., Young, R. C., Rosenberg, S. A., Coltman, C. A., & Tubiana, M. (1989). Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin’s disease: Cotswolds meeting. Journal of Clinical Oncology, 7(11), 1630–1636.
- Tzankov, A., & Dirnhofer, S. (2006). Pathobiology of classical Hodgkin lymphoma. Pathobiology, 73(3), 107–125. doi:10.1159/000095558
- Connors, J. M. (2005). State-of-the-art therapeutics: Hodgkin’s lymphoma. Journal of Clinical Oncology, 23(26), 6400–6408. doi:10.1200/JCO.2005.05.016
- Cheson, B. D., Fisher, R. I., Barrington, S. F., Cavalli, F., Schwartz, L. H., Zucca, E., & Lister, T. A. (2014). Recommendations for initial evaluation, staging, and response assessment of Hodgkin and non-Hodgkin lymphoma: The Lugano classification. Journal of Clinical Oncology, 32(27), 3059–3067. doi:10.1200/JCO.2013.54.8800
- Ansell, S. M. (2015). Hodgkin lymphoma: 2015 update on diagnosis, risk-stratification, and management. American Journal of Hematology, 90(11), 1125–1132. doi:10.1002/ajh.24175
- Connors, J. M. (2015). State-of-the-art therapeutics: Hodgkin’s lymphoma. Journal of Clinical Oncology, 33(27), 2975–2983.
- Armitage, J. O. (2017). The aggressive peripheral T-cell lymphomas: 2017 update on diagnosis, risk stratification, and management. American Journal of Hematology, 92(7), 706–715. doi:10.1002/ajh.24791
- Swerdlow, S. H., Campo, E., Harris, N. L., Jaffe, E. S., Pileri, S. A., Stein, H., Thiele, J., & International Agency for Research on Cancer (eds.). (2017). WHO Classification of Tumours of Haematopoietic and Lymphoid Tissues. Revised 4th ed. Lyon: IARC. ISBN 978-92-832-4494-3
- Alizadeh, A. A., Armand, P., & Shipp, M. A. (2018). Clinical characteristics and treatment of B-cell non-Hodgkin lymphoma. New England Journal of Medicine, 378(15), 1485–1496. doi:10.1056/NEJMra1707850
- Hallek, M., Shanafelt, T. D., & Eichhorst, B. (2018). Chronic lymphocytic leukaemia. The Lancet, 391(10129), 1524–1537. doi:10.1016/S0140-6736(18)30422-7


Yorum yazabilmek için oturum açmalısınız.