1) Kavramın tohumları: şekerin sodyumla dansı
- yüzyılda elma ağacı kabuğundan izole edilen florizin’in deney hayvanlarında belirgin glikozüriye yol açması, “glikozu kana değil idrara yönelten” bir biyolojik kapının varlığını düşündürdü. 1960’ta R. K. Crane bağırsakta sodyum-glikoz kotransportu fikrini ortaya koydu; 1980’lerin sonunda M. Hediger ve E. M. Wright ekolleri SGLT1’i klonlayarak konsepti moleküler düzleme indirdi. 1990’ların başında böbreğin proksimal tübülüne özgü SGLT2 (SLC5A2) tanımlanınca, “şekeri kandan uzaklaştırıp idrara veren” terapötik hedef berraklaştı: SGLT2’yi seçici inhibe etmek.
2) Kimyasal sıçrama: O-glikozidden C-glikozide
Florizin güçlü bir proof-of-concept sağlasa da ağızdan verildiğinde β-glikozidazlarla hızla hidrolize olur ve SGLT1’i de inhibe ederek diyare gibi istenmeyen etkiler doğururdu. 2000’lerde ilaç kimyası, glikoz halkasını C-glikozid bağla stabilize eden, yüksek SGLT2/SGLT1 seçiciliği ve oral biyoyararlanımı olan yeni bir sınıf geliştirdi. Bu dalgada farklı şirketler kendi adaylarını ilerletti; empagliflozin, Boehringer Ingelheim–Eli Lilly ortaklığının seçilmiş molekülü oldu.
3) Preklinik doğrulama: böbreğin “glikoz musluğu”
Kemirgen ve köpek çalışmalarında empagliflozin, SGLT2’yi seçici engelleyerek eşiğe bağımlı glikozüri, kan glikozunda düşüş, osmotic diürez/ hafif natriürez ve vücut ağırlığında azalma üretti; hedef dışı etkilerin minimal olduğu gösterildi. Bu tablo, diyabet tedavisinde insülinden bağımsız bir ekseni klinik denemelere taşımak için yeterliydi.
4) İlk insan adımı: farmakokinetik, güvenlik ve tolere edilebilirlik (2008–2010)
Faz 1 programında tek-çoklu doz çalışmalar, hızlı emilim, ~12 saatlik etkili yarı ömür ve doz-yanıtlı glikozüriyi doğruladı; hipoglisemi riski insülinden bağımsız mekanizma nedeniyle düşüktü. Klinik tolerabilite açısından öne çıkan sinyal, genitoüriner enfeksiyonlarda artış oldu; doz seçimi ve hasta eğitimi bu yan etkiyi yönetmek üzere optimize edildi.
5) Dozu bulmak: glisemik uç noktalarla Faz 2 (2010–2012)
Faz 2 çalışmalarında değişik doz kademeleri, HbA1c, açlık plazma glikozu ve postprandiyal glikoz üzerinde anlamlı iyileşmeler sağladı; vücut ağırlığı ve sistolik kan basıncında da istikrarlı düşüşler izlendi. Kombinasyon kolları (metformin, DPP-4 inhibitörleri, bazal insülin) farmakodinamik tamamlayıcılığı destekledi.
6) Büyük resim: Faz 3 ve “gliseminin ötesi” (2012–2014)
Geniş Faz 3 paketinde empagliflozin, tek başına ve kombinasyonlarda HbA1c düşüşünü, kilo ve kan basıncı avantajını doğruladı. Bu verilerle Ağustos 2014’te FDA, tip 2 diyabet (T2DM) tedavisi için Jardiance adını verdiği empagliflozini onayladı; eş zamanlı olarak Synjardy (metformin kombinasyonu) ve Glyxambi (linagliptin kombinasyonu) gibi formülasyonlar da pazara girdi.
7) Paradigma kırılması: EMPA-REG OUTCOME (2015)
Bernard Zinman, Christoph Wanner ve ekiplerinin yürüttüğü EMPA-REG OUTCOME denemesi, T2DM ve yerleşik KVH olan >7000 hastada sürpriz bir kapı açtı: primer MACE’de anlamlı azalma, KV mortalitede ~%38, kalp yetersizliği nedeniyle hastaneye yatışta ~%35 azalma. Bu, SGLT2 inhibitörlerini “sadece glisemik” olmaktan çıkarıp kardiyometabolik ilaç konumuna taşıdı. Aynı veri kümesinde böbrek uç noktaları da (nefropati ilerlemesinde azalma) umut vericiydi.
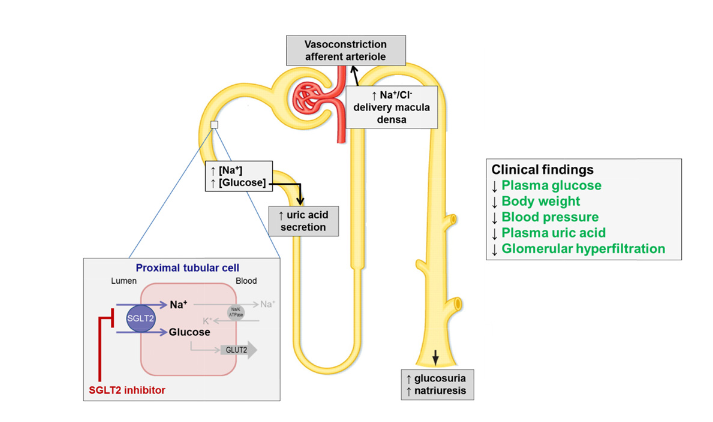
Klinik sinyallerin ardından laboratuvar sahası yeniden ısındı. Hipotezler tübüloglomerüler geribildirim ve proksimal tübül sodyum yükünün azaltılması, osmotic/ natriüretik dekonjesyon, eritropoietin-hematokrit artışı, keton kullanımının artmasıyla kardiyak verimlilik, epikardiyal yağ ve inflamasyonun azalması gibi çok katmanlı açıklamalar etrafında birleşti. Tek bir “büyük mekanizma” yerine birikimli küçük etkilerin toplam faydayı oluşturduğu görüşü güçlendi.
9) Kalp yetersizliği sahnesi: EMPEROR programı ve etiket genişlemeleri (2020–2022)
Milton Packer ve Stefan D. Anker liderliğindeki EMPEROR-Reduced (HFrEF) ve EMPEROR-Preserved (HFpEF) denemeleri, diyabetten bağımsız bir faydayı gösterdi: KV ölüm veya KY hastaneye yatış birleşik sonlanımında anlamlı azalma. Bunun üzerine 2021’den başlayarak düzenleyiciler azaltılmış EF’li KY için, 2022’de ise tüm EF aralığında KY risk azaltımı için etiketleri genişletti.
10) Nefrolojide dönemeç: EMPA-KIDNEY ve ötesi (2019–2023)
Daha geniş eGFR yelpazesi ve albuminüri düzeylerini içeren EMPA-KIDNEY, diyabetli ve diyabetsiz hastalarda böbrek fonksiyon kaybı veya KV ölüm riskinde anlamlı azalma gösterdi. 2023’te birçok düzenleyici otorite kronik böbrek hastalığı için endikasyonu genişletti; empagliflozin artık nefrolojide bir “temel taş” halini aldı.
11) Devam eden sınırlar: 2024–…
Güncel araştırmalar HFpEF alt fenotipleri, ileri evre KBH (düşük eGFR’de doz ve güvenlik), akut kalp yetmezliği/kardiyojenik şok bağlamı, GLP-1RA + SGLT2i kombinasyonlarının uzun dönem kardiyo-renal sonuçları ve post-MI popülasyonları gibi alanlarda sürüyor. Giderek artan veri, kardiyo-renal-metabolik ekseni tek bir patofizyolojik çatı altında birleştiriyor; empagliflozin bu eksende “glisemik ajan”dan sistemik sonuç iyileştiricisine evriliyor.
12) Kaşifler ve yol gösterenler (seçilmiş)
- Temel fizyoloji/molekül keşfi: R. K. Crane (SGLT kavramı); M. Hediger & E. M. Wright (SGLT1 klonlama); 1990’lar SGLT2/SLC5A2 tanımları.
- İlaç keşfi/kimya: Boehringer Ingelheim–Eli Lilly kimya ekipleri (C-glikozid, yüksek seçicilik tasarımı).
- Klinik öncü ekipler: Bernard Zinman ve Christoph Wanner (EMPA-REG OUTCOME); Milton Packer, Stefan D. Anker (EMPEROR programı); William Herrington, Richard Haynes ve ortakları (EMPA-KIDNEY).
- Regülasyon ve çeviri tıbbı: 2014 FDA T2DM onayı; 2016 KV mortalite risk azaltımı eki; 2021–2022 KY; 2023 KBH genişlemesi.



Yorum yazabilmek için oturum açmalısınız.