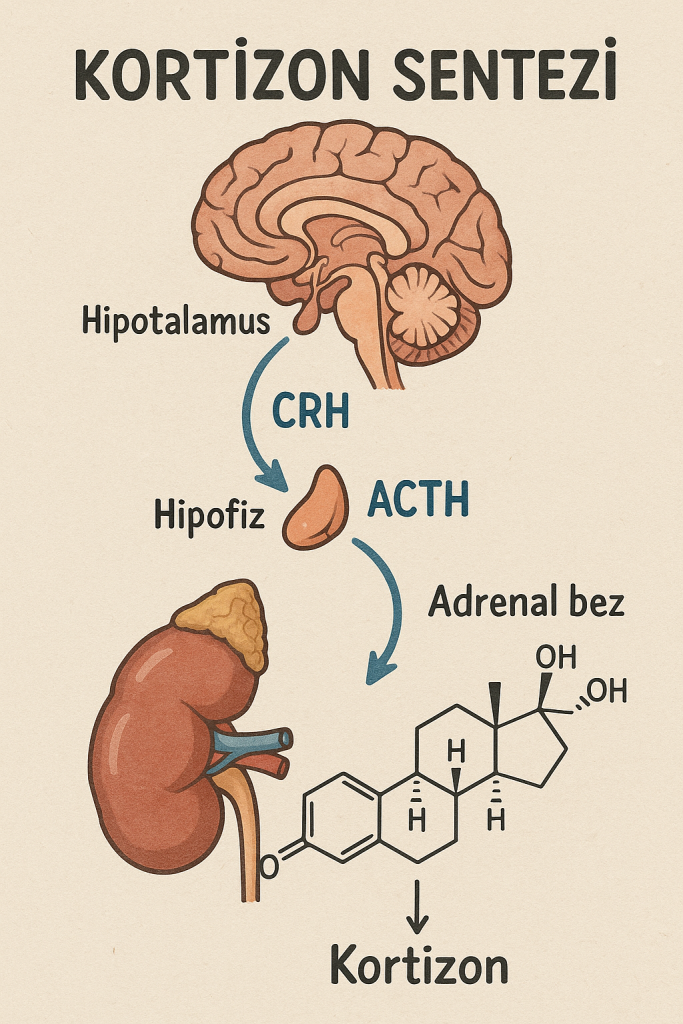
Kortikosteroid terimi, Latince cortex (“kabuk” veya “kabuk katmanı”) sözcüğünden türetilmiş “Cortico-” eki ile “steroid” sözcüğünün birleşiminden oluşur. “Kortikosteroid” adı, bu hormonların adrenal bezin dış katmanı olan kortekste üretilmesine atıf yapar. Steroid ise, dört halka içeren karakteristik bir yapıya sahip bir molekül sınıfını ifade eder. Kısacası, kortikosteroidler, steroid yapısında hormonlardır ve esas olarak böbreküstü bezinin korteks bölgesinde sentezlenir. Vücutta kolesterol temel kaynağı olarak kullanılarak üretilirler; enzimlerle düzenlenen bir dizi biyokimyasal tepkime sonucunda önce prohormonlar, sonra aktif hormonlara dönüştürülürler. Böylece kortikosteroidler, hem doğal olarak salgılanan hormonları (örneğin kortizol, aldosteron) hem de bunların yapay olarak üretilen analoglarını kapsayan bir hormon sınıfını oluşturur.
Adrenal Korteks ve Üretim Yeri: Adrenal bez, böbreklerin hemen üzerinde yer alır ve kabuğu (korteks) ile iç medullası olmak üzere iki bölümden oluşur. Korteks üç katmandan oluşur: dışta zona glomerulosa, ortada zona fasciculata, içte zona reticularis. Zona glomerulosa başlıca mineralokortikoid (esansiyel sodyum-su dengesini düzenleyen hormonlar; örneğin aldosteron) üretirken, zona fasciculata glukokortikoid (strese adaptasyon ve metabolizmaya yönelik hormonlar; örneğin kortizol) üretir. En iç katman zona reticularis ise adrenal androjen benzeri hormonlar (dehidroepiandrosteron gibi) üretir. Böylece adrenal korteks, kortikosteroid sınıfı hormonların kaynağıdır. Bu hormonlar, vücudun stres tepkisini uyarmada, metabolik dengeleri korumada, bağışıklık ve inflamasyon yanıtlarını düzenlemede ve sıvı-elektrolit dengesini sağlamada kritik görevler üstlenir. Bu nedenle kortikosteroidler, steroid bazlı hormonların adrenal kortekste üretilen bir alt kümesi olarak işlev görür.
Kortikosteroidlerin Biyolojik İşlevleri
Kortikosteroidler, çok çeşitli fizyolojik süreçlerde rol oynarlar. Başlıca işlevleri şunlardır:
- Stres Tepkisi ve Metabolik Etkiler: Glukokortikoid sınıfındaki kortikosteroidler (en önemlisi kortizol), karaciğerde glukoz üretimini (glukoneogenez) artırarak kan şekeri seviyesini yükseltir. Ayrıca proteinden amino asitler ayrışmasını, yağ dokusundan yağ asidi serbestleşmesini teşvik ederek vücudun enerji kaynaklarını düzenler. Bu yolla, vücut stres altında (örneğin açlık ya da akut stres durumlarında) yeterli enerji sağlar. Glukokortikoidler aynı zamanda yağın vücudun çeşitli bölgelerine dağılımını etkiler. Örneğin uzun süreli dozlarda yüz ve gövde bölgesinde yağ birikimini (ay yüzü, moon face; sırtta “manda hörgücü” görünümü) artırırken, kol ve bacaklarda yağ kaybına neden olabilir. Kortikosteroidler kan basıncını da düzenler; stres sırasındaki enerji artışının yanı sıra damar duyarlılığını da etkileyerek kan basıncı kontrolüne katkıda bulunurlar.
- Antiinflamatuar ve İmmünsüpresif Etkiler: Kortikosteroidler bağışıklık sisteminin aktivitelerini baskılayarak iltihabi yanıtı azaltırlar. Hücre içi glukokortikoid reseptörlerine bağlanarak DNA’da transkripsiyon değişikliklerine yol açar; bu sayede sitokin (ilacı mediatör) üretimi düşer ve iltihabi hücrelerin (lökositlerin, makrofajların) inflamasyon bölgesine göçü engellenir. Aynı zamanda enflamasyon yaratıcı enzimlerin (örneğin fosfolipaz A2) aktivitesi lipokortin-1 üretimiyle dolaylı olarak azaltılır. Sonuçta kortikosteroidler, astım, alerjik reaksiyonlar, otoimmün hastalıklar (örneğin romatoid artrit, lupus) ve çeşitli inflamatuar koşullarda inflamasyonu ve bağışıklık cevabını baskılayarak semptomları hafifletir.
- Sıvı-Elektrolit Dengesi: Aslında bu görev daha çok aldosteron gibi mineralokortikoid sınıfındaki kortikosteroidlere aittir. Aldosteron, böbrek tübüllerinde sodyum emilimini artırır ve potasyum atılımını yükseltir. Bunun sonucunda su tutulur, kan hacmi ve kan basıncı yükselir. Ancak yüksek dozlarda glukokortikoidlerin kendisinin de benzer etkilere sahip olabileceği bilinmektedir. Özetle kortikosteroidler vücudun su ve elektrolit dengesinde dolaylı olarak rol oynar, böylece kan basıncının ve doku fonksiyonlarının sürdürülmesine yardımcı olur.
- Diğer Etkiler: Kortikosteroidler ayrıca bazı davranış ve ruhsal tepkiler üzerinde de etkili olabilir. Stres hormonları olarak bilinen glukokortikoidler, uyanıklık düzeyini ve duygudurum değişkenliğini etkiler. Bu hormonların ritmik salgılanması, vücudun gün içindeki biyolojik ritmini (sirkadiyen ritm) düzenler.
Sentetik Kortikosteroidlerin Gelişimi ve Kullanım Alanları
Tarihçe: Doğal kortikosteroid hormonların izole edilmesi ve yapılarının belirlenmesi, 20. yüzyılın ortalarında büyük bir tıbbi atılım sağlamıştır. 1940’larda Edward C. Kendall, Philip Hench ve Tadeusz Reichstein tarafından kortizon (hidrokortizon) gibi adrenal korteks hormonları keşfedilmiş ve bu alandaki çalışmalar 1950 Nobel Tıp Ödülü ile onurlandırılmıştır. Erken dönemlerde yüksek maliyetli ve karmaşık sentez yöntemleri kullanılarak doğal kortikosteroidler elde edilmiştir. Örneğin ilk sentetik kortizon üretimi 1940’ların sonunda başlayan uzun işlemlerle yapılmaktaydı.
1950’li ve 1960’lı yıllarda, kortikosteroid hormonlarının yapısı ve işlevleri anlaşıldıkça, onlar üzerinde yapılan kimyasal değişikliklerle daha güçlü ve uzun etkili sentetik türevler geliştirildi. Örneğin prednizon, prednisolon ve deksametazon gibi sentetik glukokortikoidler bu dönemde piyasaya girdi. Bu yeni moleküller doğal hormonlara kıyasla daha yüksek farmakolojik etkinlik ve uzun etki süresi sağladı. Özellikle, prednizon ve prednisolon 1955 yılında piyasaya sürülmüş, kısa sürede iltihap ve bağışıklık sistemi üzerinde güçlü etkiler gösterdiği için klinik uygulamalarda hızla yerini almıştır. Bu gelişmeler, kortikosteroidleri ilaç alanında çok daha esnek bir şekilde kullanılabilir hale getirmiştir.
Tıbbi Kullanım Alanları: Kortikosteroidler bugün en yaygın kullanılan ilaç sınıflarından biridir ve pek çok hastalığın tedavisinde kritik öneme sahiptir. Glukokortikoidlerin kuvvetli antiinflamatuar ve immünsüpresif etkileri, otoimmün hastalıkların (örneğin romatoid artrit, lupus), kronik inflamatuar bağırsak hastalıklarının (Crohn, ülseratif kolit), astım ve kronik obstrüktif akciğer hastalığı (KOAH) gibi solunum sistemi bozukluklarının tedavisinde vazgeçilmezdir. Alerjik reaksiyonlar ve atopik dermatit gibi deri hastalıklarında da etkili olurlar. Ayrıca organ nakli sonrası reddi önlemek ve bazı kanser kemoterapi protokollerinde kullanılırlar. Mineralokortikoid türevi sentetik ilaçlar (örneğin fludrokortizon) ise Addison hastalığı ve primer aldosteronizm gibi sodyum-su dengesini etkileyen durumlarda tercih edilir. 20. yüzyılın ortalarında kortikosteroidlerin keşfi, dönemin en önemli tıbbi ilerlemelerinden biri olarak kabul edilmiştir.
Bununla birlikte, kortikosteroid tedavisinin yaygınlaşmasıyla beraber zaman içinde yan etkileri de gözlemlenmeye başlanmıştır. İlk dönemlerde “mucize ilaç” olarak büyük coşkuyla reçete edilirken, uzun süreli kullanımlarının ciddi komplikasyonlar yaratabildiği anlaşılmıştır. Bu durum yeni antienflamatuar ilaç arayışlarını da tetiklemiş, NSAID (non-steroid antiinflamatuar ilaçlar) geliştirilmesinin nedenlerinden biri olmuştur. Günümüzde hekimler kortikosteroid tedavisinden beklenen fayda ile olası riskleri dikkatlice tartarak, doz ve tedavi süresini mümkün olduğunca sınırlı tutacak stratejiler belirler.
Yaygın Kortikosteroid İlaçları
En sık kullanılan kortikosteroid ilaçlardan bazıları şunlardır:
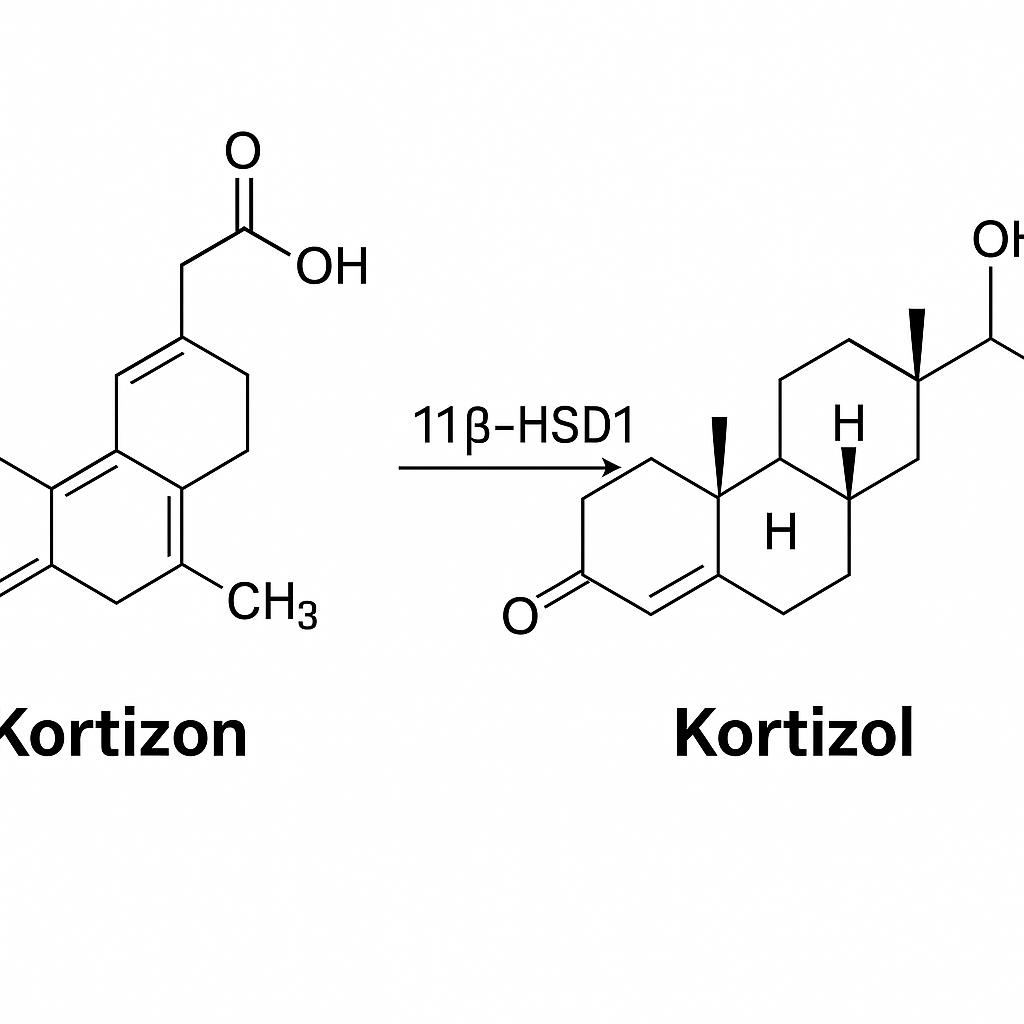
- Kortizon: Aslında vücutta aktif olmayan bir prohormondur; karaciğerde hidrokortizole dönüşür. Güçlü bir antiinflamatuar etkinlik gösterir ve romatizmal hastalıklarda, cilt rahatsızlıklarında (dermatit, egzama) sıklıkla kullanılır.
- Hidrokortizon (Kortizol): Vücudun doğal stres hormonudur. Farmasötik olarak sentetik hidrokortizon, genellikle topikal (cilt) kremler halinde cilt rahatsızlıkları için kullanılır. Ayrıca sistemik adrenal yetmezlik (Addison hastalığı) gibi durumlarda eksik hormona replasman tedavisi olarak alınır.
- Prednizon ve Prednisolon: 1950’lerde geliştirilen sentetik glukokortikoidlerdir. Prednizon vücutta aktif forma (prednisolon) dönüştürülerek etkisini gösterir. Oldukça güçlü antiinflamatuar ve immünsüpresif özelliklere sahiptir. Romatoid artrit, astım, çeşitli alerjik reaksiyonlar ve otoimmün hastalıklarda birinci basamak tedavi olarak kullanılır. Kortizon ve hidrokortizona göre daha kuvvetli etki gösterirler, bu yüzden daha düşük dozlarda tercih edilir.
- Deksametazon ve Betametazon (entegre grup C ajanları): Bunlar günümüzde mevcut olan en güçlü glukokortikoidlerden bazılarıdır. Deksametazon ve betametazon, şiddetli inflamatuar durumlar (örneğin şiddetli astım krizi, bazı kanser kemoterapileri esnasında ödem kontrolü) için kullanılır. Deksametazon, yakın zamanda COVID-19 kaynaklı ağır solunum yetmezliği tedavisinde mortaliteyi azaltıcı etkisiyle de gündeme gelmiştir.
Her bir ilacın etki gücü ve kullanılabilirlik süresi farklıdır; bu nedenle tedavi edici hekimin, tedavi edilecek hastalığın türü ve şiddetine göre uygun ilacı ve dozu seçmesi önemlidir.
Kimyasal Yapıya Göre Sınıflandırma
Kortikosteroidler, kimyasal yapılarına göre gruplandırıldıklarında farklı gruplar içinde incelenir. Örneğin dermatolojide sıkça kullanılan Coopman sınıflandırmasına göre ana başlıca üç grup vardır:
- Grup A – Hidrokortizon Tipi: Bu gruptaki moleküller, hidrokortizon (kortizol) ve yakın türevleri ile karakterizedir. Örnekler arasında hidrokortizon asetat, kortizon asetat, prednizolon, metilprednizolon ve prednizon bulunur. Bu ilaçlar genellikle orta düzeyde antiinflamatuar güçtedir ve geniş yelpazede romatolojik, dermatolojik ve alerjik durumlarda kullanılır.
- Grup B – Asetonidler (Trikomaketonidler): Bu grup, daha güçlü ve genellikle daha uzun etkili glukokortikoidlerden oluşur. Triamcinolone acetonide, fluocinolon acetonide, halcinonide gibi moleküller buraya girer. Dermatoloji uygulamalarında sık görülür ve özellikle güçlü antiinflamasyon gerektiğinde tercih edilir.
- Grup C – Betametazon Tipi: Betametazon, deksametazon ve benzeri güçlü glukokortikoidler bu gruptadır. Etki süresi uzundur ve inflamatuar olayları şiddetle baskılama kabiliyetleri yüksektir. Nadir durumlarda sistemik şiddetli inflamasyon veya pıhtılaşmayı engellemek için (örneğin tümör kaynaklı beyin ödeminde) gibi durumlarda kullanılırlar.
Bu gruplama, özellikle topikal (cilt) kortikosteroidlerde alerjik reaksiyon risklerini değerlendirmede yardımcı olur. Örneğin bir gruptaki bir ilaca karşı alerjisi olan kişinin, aynı gruptaki diğer ilaçlara da tepki verme olasılığı yüksektir. Dolayısıyla kullanım öncesi bu sınıflandırma ve ilacın kimyasal yapısı göz önünde bulundurulur.
Prednizon: Önemli Bir Glukokortikoid
Prednizon, anti-inflamatuar ve immünsüpresif etkinliği nedeniyle tıp dünyasında en çok bilinen kortikosteroidlerden biridir. Romatoid artrit, lupus, inflamatuar bağırsak hastalığı gibi otoimmün ve kronik inflamatuar hastalıklarda tedavi stratejisinin temel taşlarından biridir. Kısa sürede güçlü bir rahatlama sağlayabildiği için akut atak veya alevlenmelerde tercih edilir. Ayrıca ciddi alerjik reaksiyonlarda (örneğin şiddetli astım krizi, anafilaksi) hayati önem taşıyan bir ilaçtır. Prednizon, uygun dozda ve sürede kullanıldığında pek çok hastada semptomların hızla gerilemesini sağlar. Ancak uzun süreli kullanım gerektiren durumlarda veya yüksek doz tedavilerde doktor gözetiminde olmak zorunludur.
Kortikosteroidlerin Yan Etkileri ve Riskleri
Kortikosteroidler son derece etkili ilaçlar olmakla birlikte, bu güç beraberinde çeşitli yan etki risklerini de getirir. Özellikle yüksek dozda veya uzun süreli kullanımda karşılaşılabilecek başlıca yan etkiler şunlardır:
- Bağışıklık Supresyonu ve Enfeksiyon Riski: Kortikosteroidler bağışıklık tepkisini baskıladığı için, uzun süreli kullanımda vücudun enfeksiyonlara karşı savunması zayıflar. Bu durum, orta dereceli enfeksiyonların bile ağırlaşmasına veya fırsatçı enfeksiyonların ortaya çıkmasına neden olabilir. (Örneğin mantar veya viral enfeksiyonlar daha kolay gelişebilir.)
- Elektrolit ve Sıvı Birikimi: Sodyum tutulumu artar, potasyum atılımı yükselir. Bu etki özellikle mineralokortikoid benzeri dozlarda belirgindir. Sonuç olarak vücutta su tutulumu ve kan basıncında yükselme (hipertansiyon) görülebilir. Ödem (vücutta sıvı birikimi) ve kalp-damar sistemi üzerine ek yük oluşması da mümkündür.
- Kan Şekeri ve Metabolik Bozukluklar: Kortikosteroidler karaciğerde glukoz üretimini artırıp insülin etkinliğini azaltarak hiperglisemiye (kan şekeri yüksekliğine) yol açar. Uzun dönem tedaviler diyabet riskini artırabilir veya mevcut diyabeti kötüleştirebilir. Ayrıca karın ve yüz çevresinde yağ birikimi (elma tipi obezite), kas kaybı (protein yıkımı) ve deri altı bağ dokusu zayıflaması sonucu kolay morarma görülebilir.
- Kemik Erimesi (Osteoporoz): Steroidler kemik oluşumunu yavaşlatıp kemik yıkımını artırır. Uzun süreli kullanımda özellikle yaşlılarda omurga ve kalça kemiklerinde kırık riski yükselebilir. Ayrıca çocuklarda büyüme geriliğine neden olabilir.
- Kas Zayıflığı (Steroid Miyopatisi): Kas proteinlerinin yıkımı artar. Bu da özellikle kol ve bacaklardaki kasların zayıflamasına yol açabilir. Kas güçsüzlüğü, günlük aktiviteleri etkileyebilir.
- Göz Problemleri: Kronik kortikosteroid kullanımı katarakt ve glokoma sebep olabilir. Göz içi basıncında artma ve retina problemleri görülebilir.
- Ciltte İncelme ve Yavaş İyileşme: Topikal veya sistemik kullanımda ciltte incelme, çizgilenme (stria), kolay morarma, yara iyileşmesinde gecikme gibi etkiler ortaya çıkabilir.
- Psikolojik ve Sinir Sistemi Etkileri: Uyku düzen bozuklukları, sinirlilik, ajitasyon, mani-benzeri duygudurum değişiklikleri görülebilir. Bazı hastalarda uzun süreli yüksek doz tedavilerde steroid kaynaklı psikotik epizodlar nadiren gelişebilir. “Steroid sevinci” olarak bilinen geçici ruh hali yükselmesi veya tam tersi depresyon hali gözlemlenebilir.
- Hormonel Geribildirim Bozukluğu: Dışarıdan verilen kortikosteroidler, vücudun kendi kortikosteroid üretimini baskılar. Uzun süreli tedavi sonlandırılırken dikkatli olunmazsa adrenal bez fonksiyonu baskılanmış haldeki vücut, yeterli hormon salgılayamayabilir. Bu nedenle tedavi genellikle kademeli (açarak) sonlandırılır. Aniden ilacın kesilmesi hipokortizolemiye (adrenal yetmezlik benzeri duruma) yol açabilir.
- Cushingoid Görünüm: Uzun süreli kullanımda vücut şekli değişiklikleri (yuvarlak ay yüzü, ense bölgesinde kambur yağ birikimi, gövde obezitesi) gelişebilir. Bunlar “Steroid Cushing sendromu” olarak adlandırılan tabloya özgü bulgulardır.
Tüm bu yan etki riski nedeniyle, hekimler kortikosteroid tedavisini mümkün olan en düşük etkili doz ve sürede uygular. Tedavi planlanırken hastanın yaşı, genel sağlık durumu ve ek hastalıkları göz önüne alınır. Gerektiğinde elektrolitler, kan şekeri ve kemik yoğunluğu düzenli olarak izlenir. Bazı durumlarda steroid dozu azaltılırken, aynı anda kemik erimesini önleyici veya kan şekeri düzenleyici ilaç desteği verilebilir. Uygulanacak enflamasyon kontrolü stratejisi, alternatif tedavi seçenekleri (örneğin biyolojik ajanlar veya NSAID’ler) ile desteklenerek ağır yan etkilerin önüne geçilmeye çalışılır.
Keşif
Adrenal bezleri, böbreklerin üstünde bulunan üçgensel organlardır ve hayati hormonlar üretir. 1930 yılında Wilbur W. Swingle ile Joseph J. Pfiffner, sığır adrenal bezlerinden elde ettikleri hormonik özütün Addison hastalığını tedavi edebileceğini gösterdiler. Bu çalışmada Addison krizi geçiren bir hasta, acil gönderilen adrenal özütü aldıktan birkaç gün içinde sağlığına kavuştu. Böylece adrenal korteks hormonlarının eksikliğinin yerine konabileceği ilk kez kanıtlanmış oldu.
Önemli Dönüm Noktaları: Kortikosteroid keşfi, aşağıdaki tarihi adımlarla gelişti:
- 1930: Swingle ve Pfiffner, büyük miktarda sığır adrenal özütü hazırlayarak Addison hastalarında geçici iyileşmeler gösterdiler. Bu, adrenal hormon eksikliğinin tedavisinde bir atılım oldu.
- 1936: Mayo Kliniği’nden Edward C. Kendall, adrenal korteks özünden altı ayrı steroid bileşiği (A–F) ayırdı. Bunlar arasında “E” bileşiği, daha sonra kortizon olarak adlandırıldı. (Ayrıca “F” bileşiği hidrokortizol/kortizol olarak bilinir.)
- 1948: Merck’ten Lewis H. Sarett, 37 aşamalı karmaşık bir sentez yöntemiyle yeterli miktarda sentetik kortizon üretti. Bu sayede laboratuvar ölçeğinde hazırlanan kortizon, klinik denemeler için yeterli hale geldi. Aynı yıl, Dr. Philip Hench ve meslektaşları romatoid artritli “Bayan G” hastasına 100 mg kortizon uyguladı; üç gün içinde belirtiler dramatik şekilde geriledi. Bu sonuç, kısa sürede medyada “adeta bir mucize” olarak yorumlandı.
- 1950: Edward C. Kendall, Tadeus Reichstein ve Philip S. Hench, “adrenal korteks hormonlarıyla ilgili keşif, yapı ve biyolojik etkiler” konusundaki öncü çalışmaları nedeniyle Nobel Fizyoloji veya Tıp Ödülü’ne layık görüldü. Nobel Komitesi, üç ismin adrenal korteks hormonlarına dair buluşlarını özellikle vurgulamıştır.
Nobel Ödülü ve Öncü Araştırmacılar
1950 Nobel Ödülü’yle taçlanan bu çalışmaların kahramanları şunlardır:
- Edward C. Kendall (Mayo Clinic): Adrenal korteksten izole ettiği steroid bileşiklerini saflaştırdı. Altı bileşik (A–F) üzerinde çalıştı ve bileşik E’nin kimyasal yapısını belirleyerek bunu kortizon olarak tanımladı. Kendall’in çalışmaları adrenal hormon kimyasını çözerek modern endokrinolojinin temelini attı.
- Tadeus Reichstein (Zürih): Adrenokortikal steroidlerin yapısını çözümlendirdi ve yapısal düzenlemeler yaparak sentetik yollar geliştirdi. Örneğin Reichstein, desoksikortikosteron gibi ilk adrenal steroidleri sentezleyerek sodyum-tuz dengesi düzenleyici (mineralokortikoid) grubu aydınlattı. Eş zamanlı olarak glukoz metabolizmasını düzenleyen glukokortikoidler üzerine de çalışmalar yaptı.
- Philip S. Hench (Mayo Clinic): Klinik gözlemleri ile kortizonun romatoid artrit gibi iltihabi hastalıklarda üstün etkinliğini gösterdi. Hastalarda sarılık veya gebelik gibi stresi arttıran durumlarda artrit semptomlarının gerilediğini fark etti ve “antirematik madde X” arayışına odaklandı. Sonunda Kendall’in sağladığı sentetik kortizonla yaptığı tedavi deneylerinde, romatoid artritli hastaların semptomlarının hızla kaybolduğunu belgeledi. Bu çalışma, kortizonun artrit tedavisinde devrim yaratmasını sağladı.
Kortizonun Tıptaki İlk Uygulaması
Dr. Philip Hench ve ekibi, kortizonun klinikteki ilk kullanımını 1948’de gerçekleştirdi. Rochester Mayo Kliniği’nde 100 mg kortizon (Bileşik E) uygulanan “Bayan G” adlı 29 yaşındaki romatoid artritli hastada, birkaç gün içinde hemen hemen tüm eklem sertliği ve ağrısı geriledi. Bu dramatik düzelme, tıp dünyasında büyük heyecan yarattı: Hench, Bileşik E içindeki aktif maddeye “kortizon” adını verdi. Hastada tedavi kısa sürede fiziksel iyileşme sağladı ancak tedavi uzadıkça belirgin yan etkiler ortaya çıktı. Yirmi üç gün sonra yüzde belirgin şişlik; kırk gün sonra yüz kıllanmaları (hirsutizm) ve akne görüldü; hasta ilaç dozlarını artırmak zorunda kaldı. Tedavi süresince ruh hali değişiklikleri (depresyon ve sinirlilik) gelişti, buna karşın romatoid artrit semptomlarında ancak yaklaşık %50’lik bir iyileşme sağlanabildi. Bu olgu, kortizonun kısa vadede “mucizevi” faydalarının yanında, uzun vadede ciddi metabolik ve psikiyatrik yan etkilere yol açabileceğini gösterdi.
Klinik Kullanım Alanları
Kortizon ve türevleri, ilk deneylerden sonra pek çok hastalıkta kullanıma girdi. Modern tıpta başlıca kullanım alanları şunlardır:
- Otoimmün ve enflamatuar hastalıklar: Romatoid artrit, lupus ve diğer bağışıklık sistemine bağlı eklem/kas hastalıkları gibi durumlarda kortizon semptomları hızla azaltır.
- Alerjik ve deri rahatsızlıkları: Astım, atopik dermatit (ekzema), ciddi alerjik reaksiyonlar (anafilaksi) gibi iltihabi hastalıklarda solunum ve cilt belirtilerini kontrol altına almak için kullanılır.
- Nörolojik durumlar: Beyin tümörlerine bağlı ödemi azaltarak baş ağrısı, bulantı, nörolojik fonksiyonları iyileştirir. Örneğin deksametazon gibi güçlü glukokortikoidler, beyin tümörü kaynaklı intrakraniyal basıncı düşürür.
- Onkoloji: Kemoterapi veya radyoterapiye bağlı yan etkileri hafifletmek için kullanılır. Kortizon, kanser tedavisi gören hastalarda bulantı-kusmayı, ağızda ülseri ve iştahsızlığı azaltır.
- Organ nakli: Kortikosteroidler, organ reddini önlemek amacıyla immün sistemi baskılayarak verici organın kabulünü kolaylaştırır. (Günümüzde çoğunlukla steroid-sparing protokoller tercih edilse de, yüksek doz kortikosteroidler nakil sonrası immünosupresyonun temel bileşenlerinden biridir.)
Yan Etkiler ve Dikkat Edilmesi Gerekenler
Kısa süreli kullanımlarda etkili olan kortizon, uzun süreli veya yüksek dozda kullanıldığında ciddi yan etkilere neden olur. En belirgin yan etkiler arasında şunlar sayılabilir:
- Cushingoid değişiklikler: Yüzde yuvarlaklaşma (ay yüzü), sırt üstü yağ birikimi, karın çevresinde şişkinlik.
- Dermatolojik etkiler: Akne, ince cilt, kolay morarma ve enfeksiyonlara yatkınlık.
- Endokrin/metabolik etkiler: Kan şekeri yükselmesi, kemik erimesi (osteoporoz), kas zayıflığı.
- Psikiyatrik etkiler: Uykusuzluk, anksiyete, irritabilite veya depresyon gelişebilir.
- Hematolojik etkiler: Uzun süreli kortizon uygulamasında hipokrom mikrositer anemi görülebilir. Yan etki profili, Bayan G vakasında gözlemlenen belirtilerle benzerdi; hasta ciddi ruh hali değişiklikleri ve cilt değişiklikleri yaşarken artrit belirtileri yalnızca kısmen (%50 kadar) gerilemişti. Bu tecrübeler, kronik kortizon tedavisi gerektiren hastalıklarda doz-dönüşüm stratejileri ve ek ilaç kullanımıyla yan etkileri azaltma çabalarına yol açtı.
Gelişen Tedaviler ve Yeni Steroid Moleküller
Kortizonun keşfi sonrasındaki yıllarda, tedavi etkinliğini artırmak ve yan etkileri azaltmak için çok sayıda yeni steroid geliştirildi:
- 1950 – Prednizon ve Prednizolon: Mikrobiyal oksidasyon yöntemiyle Arthur Nobile, kortizonu prednizona ve hidrokortizonu prednizolona dönüştürdü. Yeni ilaçlar kortizona kıyasla çok daha güçlü antiinflamatuar etki sağlarken, yan etkileri görece azaltılmıştı. Bu buluş, astım, ülseratif kolit, kanser kaynaklı ödem ve dermatolojik hastalıklar gibi pek çok ek kullanım alanına yol açtı.
- 1950’lerin sonları: Prednizolonun yanı sıra metilprednizolon ve deksametazon gibi yeni sentetik glukokortikoidler piyasaya girdi. Bu ilaçlar, kortizona göre binlerce kat daha yüksek etki gücüne sahipti ve mineralokortikoid özellikleri minimize edilecek biçimde tasarlandı. Bu sayede tedavi etkinliği artarken, su-tuz tutulumu gibi yan etkiler nispeten azaldı.
- Steroid-sparing stratejiler: Kortizon dozu ihtiyacını azaltmak için fenilbutazon gibi erken dönemde kullanılan steroid-sparing nonsteroid antienflamatuvar ilaçlar geliştirildi. 1970’lerde ise metotreksat ve azathioprin gibi immünsüpresif ilaçlar, romatizmal hastalıklarda kortizon kullanımını önemli ölçüde düşürdü. Bugün modern tedavi protokollerinde bu ilaçlar, kortikosteroidlerle kombine veya doz azaltıcı olarak yer alır.
Kortikosteroidlerin keşfi tıbbın en önemli dönüm noktalarından biridir. Günümüzde kortizon ve türevleri hâlâ milyonlarca hastanın yaşam kalitesini yükseltmekte, bağışıklık sistemi kaynaklı hastalıklarda rahatlama sağlamaktadır. Ancak uzun süreli kullanıma bağlı ciddi yan etkiler bilinmektedir; bu nedenle tedavi doz ve süresi çok dikkatli planlanır. Araştırmalar, daha hedefe yönelik etki gösteren ve yan etkileri minimize eden yeni steroid benzeri moleküller geliştirme yönünde devam etmektedir. Özetle 20. yüzyıl ortasında kortizonla atılan adımlar, modern endokrinoloji ve immünoloji tarihine altın harflerle geçmiştir.
İleri Okuma
- Kendall, E.C. (1936). The isolation of a crystalline compound from the suprarenal gland. The Journal of Biological Chemistry, 114, 613-631.
- Hench, P.S., Kendall, E.C., Slocumb, C.H., & Polley, H.F. (1949). The effect of a hormone of the adrenal cortex (17-hydroxy-11-dehydrocorticosterone: compound E) and of pituitary adrenocorticotropic hormone on rheumatoid arthritis. Proceedings of the Staff Meetings of the Mayo Clinic, 24(8), 181-197.
- Nobel Prize. (1950). The Nobel Prize in Physiology or Medicine 1950. NobelPrize.org. Retrieved from https://www.nobelprize.org/prizes/medicine/1950/summary/
- Schimmer, B.P., & Parker, K.L. (Eds.). (2001). Adrenal Corticosteroids. In Goodman & Gilman’s The Pharmacological Basis of Therapeutics (10th ed.). McGraw-Hill.
- Rhen, T., & Cidlowski, J.A. (2005). Anti-inflammatory action of glucocorticoids—new mechanisms for old drugs. The New England Journal of Medicine, 353(16), 1711-1723.
- Coutinho, A.E., & Chapman, K.E. (2011). The anti-inflammatory and immunosuppressive effects of glucocorticoids, recent developments and mechanistic insights. Molecular and Cellular Endocrinology, 335(1), 2-13.


Yorum yazabilmek için oturum açmalısınız.