Etimoloji ve tarihçe
“Histamin” terimi Yunanca histos (doku) ve “amin” (azotlu organik bileşik) sözcüklerinden türetilmiştir; histaminin 1910’larda doku ekstraktlarından izole edilmesi ve düz kas üzerindeki güçlü etkilerinin tanımlanması, alerjik patofizyolojinin kimyasal aracı kavrayışının temelini attı. H1 reseptörünün kavramsallaştırılması, histaminin H1 ve H2 etkilerinin farmakolojik ayrımına (1950–60’lar), ardından 1980’lerde reseptörün moleküler klonlanmasına uzanır. İlk antihistaminikler (birinci kuşak) 1940’lardan itibaren yaygınlaştı; etkin fakat sedatif ve antikolinerjik yükü yüksek bu moleküllerin yerine 1990’lardan itibaren kan-beyin bariyerini (KBB) daha az geçen, daha seçici ikinci kuşak ajanlar geliştirildi. Terfenadinin QT uzaması ve torsades de pointes riski nedeniyle pazardan çekilmesi, kardiyak güvenlilik paradigmasını şekillendirdi ve feksofenadinin (terfenadinin farmakolojik aktif metaboliti) daha güvenli bir alternatif olarak benimsenmesine zemin hazırladı.
Histamin–H1 ekseni: biyoloji ve evrimsel çerçeve
Histamin; mast hücresi ve bazofillerin granüllerinde depolanan, immün ve nöral dokularda geniş dağılıma sahip biyojenik bir amin olup H1, H2, H3 ve H4 olmak üzere dört G-protein kenetli reseptöre bağlanır. H1 reseptörü Gq/11 üzerinden fosfolipaz C–IP₃/DAG yolunu aktive eder; damar düz kasında vazodilatasyon (endotel kaynaklı NO aracılığıyla), kapiller permeabilite artışı, duyu sinirlerinde prurit ve ağrı, hava yolu düz kasında bronkokonstriksiyon ve mukus sekresyon artışı başlıca sonuçlardır. Evrimsel açıdan histamin sistemi, enfestasyon ve toksinlere hızlı yanıt (kaşıntı, ödem, bronkokonstriksiyon) sağlayan bir “erken uyarı” devresi olarak avantaj sunarken, modern çevrede atopik hastalıklarda mal-adaptif aşırı aktivasyon ile klinik belirtilere yol açar.
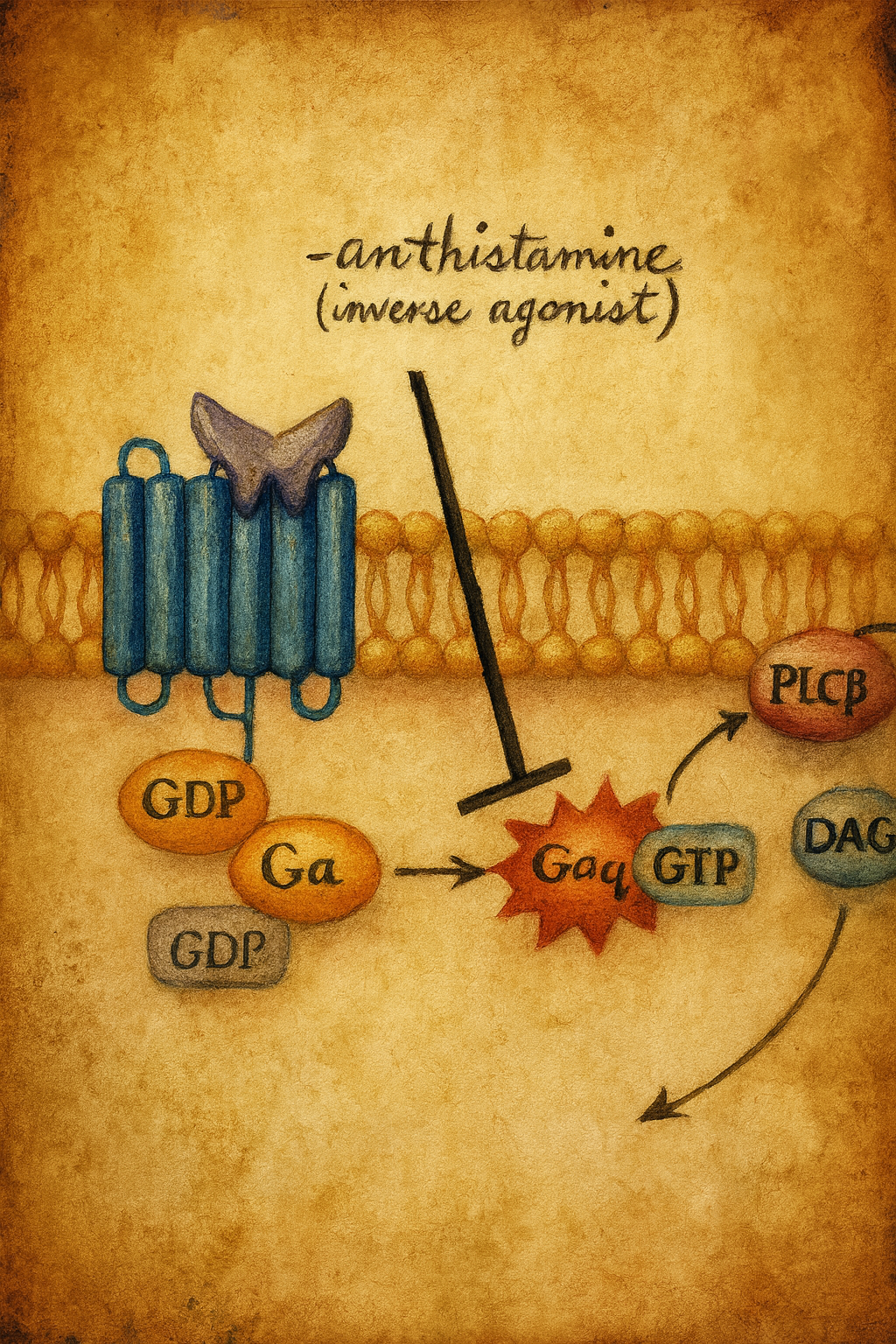
Farmakoloji: etki mekanizması ve farmakodinami
H1 reseptör antagonistlerinin çoğu gerçekte ters agonist gibi davranır: reseptörün bazal (aktif) konformasyonunu stabilize ederek histaminin etkisini kompetitif olarak azaltır. Klinik düzeyde sonuç;
- Vasküler düzey: Vazodilatasyon ve damar geçirgenliği artışının inhibisyonu → ödem, eritem ve rinore azalır.
- Duyu sinirleri: Prurit ve hapşırma reflekslerinde azalma.
- Düz kas: Bronkokonstriksiyon ve gastrointestinal spazm eğiliminin hafiflemesi (antikolinerjik etkisi belirgin olan birinci kuşaklarda ek katkı olabilir).
- Merkezi sinir sistemi: Birinci kuşakta KBB geçişi nedeniyle sedasyon, psikomotor yavaşlama, antiemetik ve hipnotik etki; ikinci kuşakta minimaldir.
Sınıflandırma ve temsilciler
Birinci kuşak (klasik, sedatif)
KBB’yi kolay geçen, lipofilik ve çoğu kuaterner olmayan amin yapısında; antikolinerjik, antiserotonerjik ve antiadrenerjik etkilere kısmen sahip:
- Difenhidramin, doksilamin, klemastin, dimetinden, meklozin.
Klinikte antiemetik (meklozin, difenhidramin), soğuk algınlığı kombinasyonlarında sedatif-antikolinergik destek, kısa süreli hipnotik (doksilamin) olarak da kullanılırlar.
İkinci kuşak (seçici, non-sedatif)
H1 üzerinde daha seçici, P-glikoprotein ve OATP aracılı beyin girişine sınırlı, uzun etkili:
- Setirizin (aktif enantiyomer: levosetirizin)
- Loratadin (aktif metabolit: desloratadin)
- Feksofenadin (terfenadinin aktif metaboliti)
- Ebastin, bilastin
- Azelastin, levokabastin (özellikle intranazal/oftalmik topikal kullanıma elverişli)
- (Tarihsel) Terfenadin: QT uzaması riski nedeniyle klinik pratikten kalkmıştır.
Notlar:
• Loratadin başlıca CYP3A4/2D6 üzerinden desloratadine metabolize olur.
• Setirizin minimal metabolize edilir; böbrekten atılım baskındır.
• Feksofenadin CYP ile sınırlı metabolizmaya uğrar; P-gp ve OATP taşıyıcılarının substratıdır ve meyve suları ile emilimi azalabilir.
• Bilastin emiliminde polyvalan katyonlar ve meyve suları (OATP etkileşimi) önemlidir; genellikle aç karnına önerilir.
• Azelastin ve levokabastin mukozada birikim göstererek lokal formülasyonlarda hızlı ve belirgin semptom kontrolü sağlar.
Farmakokinetik genel ilkeler
- Başlangıç ve pik etki: Oral ikinci kuşakların çoğu 0,5–2 saat içinde etki başlatır; pik etki ~2–4 saat.
- Süre: Genelde ~24 saat; günde tek doz olanağı.
- Dağılım: Birinci kuşak lipofilik ve KBB geçişi belirgin; ikinci kuşak daha polar ve/veya taşıyıcılarca dışlanır.
- Eliminasyon: Böbrek (setirizin/levosetirizin) veya hepatik metabolizma (loratadin/desloratadin, ebastin) ile; feksofenadin safra/feçes ağırlıklı atılır.
- Özel durumlar: Yaşlılık, böbrek/karaciğer yetmezliği, polifarmasi doz ve ilaç seçimini etkiler.
Klinik endikasyonlar ve kullanım formları
- Alerjik rinokonjonktivit ve rinit: Oral ikinci kuşaklar birinci basamak; intranazal antihistaminik (azelastin) hızlı semptom giderir; göz damlaları (ketotifen, levokabastin, azelastin) konjonktival bulguda etkilidir.
- Ürtiker (akut/kronik spontan): İkinci kuşak oral antihistaminikler temel tedavidir; dirençte doz artışı (kılavuz temelli up-dosing) ve ek tedaviler düşünülür.
- Dermatografizm ve diğer fiziksel ürtikerler: Profilaktik kullanım semptomları azaltır.
- Prurit (histamin aracılı): Topikal jel/losyon veya sistemik kullanım (ör. böcek ısırığı sonrası).
- Vestibüler bulantı/seyahat hastalığı: Birinci kuşak (meklozin, dimenhidrinat/difenhidramin) antiemetik ve antivertijinöz etki ile tercih edilebilir.
- Soğuk algınlığı kombinasyonları: Sekresyon azaltıcı ve sedatif katkı için (kanıt gücü değişkendir).
- Kontrast madde uygulamaları ve ilaca bağlı reaksiyon profilaksisi: Seçilmiş protokollerde H1 antagonisti eklenebilir.
- Anafilaksi yönetimi: Adrenalin ve glukokortikoid yerine geçmez; prurit/ürtiker gibi kutanöz belirtilerde yardımcı tedavidir.
Dozlama ve uygulama ilkeleri (özet prensipler)
- Günlük tek doz rejimleri uyumu artırır (setirizin 10 mg, levosetirizin 5 mg, loratadin 10 mg, desloratadin 5 mg, feksofenadin 120–180 mg vb.).
- İntranazal azelastin semptom başlangıcından kısa süre sonra etkili olabilir; kombine intranazal steroid + antihistaminik spreyler (ör. azelastin+flutikazon) nazal konjesyonda üstündür.
- Topikal göz damlaları günde 2–4 kez; kullanım tekniği ve prezervan duyarlılığı önemlidir.
- Bilastin ve feksofenadin için meyve suları ve bazı yiyeceklerle araya zaman koyma önerilir (emilim azalmasını önlemek için).
Yan etki profili
Birinci kuşak
- Sedasyon ve psikomotor yavaşlama: Sürüş/iş güvenliği açısından kritik; paradoksal ajitasyon çocuklarda görülebilir.
- Antikolinerjik etkiler: Ağız kuruluğu, bulanık görme, konstipasyon, idrar retansiyonu; dar açılı glokom ve prostat hipertrofisinde sorun yaratabilir.
- Ortostatik hipotansiyon, kilo artışı (iştah artışı), kognitif yavaşlama (özellikle yaşlılarda).
İkinci kuşak
- Genellikle non-sedatif; ancak bireysel duyarlılık ve yüksek dozlarda sedasyon mümkün (özellikle setirizin).
- Baş ağrısı, ağız kuruluğu, bulantı gibi hafif geçici yakınmalar.
- Kardiyak güvenlilik: Modern ajanlarda QT uzaması riski düşüktür. Terfenadin ve astemizol gibi tarihsel ajanlar ciddi aritmi riski nedeniyle artık kullanılmaz.
İlaç etkileşimleri ve güvenlik
- CNS depresanları ve alkol: Birinci kuşakla sedatif etki additif artar.
- CYP aracılı etkileşimler:
- Loratadin CYP3A4/2D6 substratıdır; güçlü inhibitörlerle plazma düzeyi artabilir.
- Ebastin benzer şekilde CYP3A4 ile metabolize olur.
- Taşıyıcı temelli etkileşimler:
- Feksofenadin ve bilastin OATP/P-gp substratlarıdır; greyfurt, portakal, elma suları emilimi azaltabilir.
- QT uzaması riski:
- Terfenadin/astemizol + güçlü CYP3A4 inhibitörleri (makrolidler, azol antifungaller) → torsades riski (bu nedenle terk edilmişlerdir).
- Antikolinerjik yük: Birinci kuşak + diğer antikolinerjiklerle kümülatif risk (deliryum, konstipasyon, retansiyon).
Kontrendikasyonlar ve dikkat gerektiren durumlar
- Birinci kuşak: Dar açılı glokom, prostat hipertrofisi/retansiyon, ağır astım (sekresyon viskozitesini artırabilir), çocuklarda sedatif etkiler nedeniyle seçici kullanım.
- Gebelik ve emzirme: Loratadin ve setirizin/levosetirizin gebelikte klinik pratikte sık tercih edilen, güvenlilik verisi iyi ajanlardır; topikal formlar sistemik maruziyeti azaltır.
- Yaşlı hastalar: Beers kriterlerine göre birinci kuşak antihistaminikler kaçınılmalıdır; kognitif etkiler ve düşme riski artar.
- Böbrek/karaciğer yetmezliği: Setirizin/levosetirizin için renal doz ayarı; loratadin/desloratadin ve ebastin için hepatik dikkat.
Moleküler çeşitlilik ve yapısal-fonksiyonel korelasyon
H1 antagonistleri etilen-diamin, etanolamin, alkilamin, piperidin ve piperazin iskeletleri gibi farklı kimyasal sınıflara ayrılır. Bu iskeletler lipofiliklik, pKa ve polariteyi belirler; KBB geçirgenliği ve sedasyon eğilimi bu parametrelerle ilişkilidir. İkinci kuşakta polar gruplar ve taşıyıcı etkileşimi (P-gp substratlığı) bilinçli olarak artırılarak periferik seçicilik sağlanmıştır. Enantiyomer çözümlemesi örneği olarak levosetirizin, racemik setirizinin aktif S-enantiyomeridir ve reseptör afinitesi ile klinik potens korelasyonu gösterir.
Uygulama formlarının karşılaştırılması
- Oral: Sistemik semptomlar ve pereniyal alerji kontrolünde temel; 24 saatlik etkiyle uyumu artırır.
- İntranazal antihistaminikler (özgül olarak azelastin): Hızlı başlangıç, nazal konjesyonda monoterapi olarak orta, steroidle kombinasyonda üstün etki.
- Oftalmik damlalar (levokabastin, azelastin, ketotifen): Kaşıntı, sulanma ve hiperemi üzerine güçlü lokal kontrol, sistemik yan etki minimal.
- Topikal dermal jeller: Lokal pruritte yararlı; geniş yüzeylere veya hasarlı deriye uygulamada sistemik emilim ve fotosensitivite riski göz önüne alınmalı.
Klinik stratejiler ve pratik ipuçları
- Zamanlama: Polen maruziyeti öngörüldüğünde profilaktik sabah dozu; akut atafta intranazal azelastinin hızlı etkisinden yararlanma.
- Titrasyon: Kronik ürtikerde kılavuz temelli olarak ikinci kuşak dozunun kademeli artırımı düşünülebilir.
- Kombinasyon: Alerjik rinitte intranazal kortikosteroid temel tedavidir; antihistaminikle kombinasyon ağır semptomlarda faydalı olabilir.
- Yaşam tarzı ve tetikleyici yönetimi: Akar, polen, hayvan epiteli maruziyetini azaltma; göz semptomları için soğuk kompres ve suni gözyaşı destekleri.
Sık yapılan hatalar ve yanlış inanışlar
- “Antihistaminikler anafilaksiyi tedavi eder.” Yanlış. Anafilakside hayat kurtarıcı tedavi adrenalin (IM)’dir; antihistaminikler yalnızca kutanöz semptomlara yardımcıdır.
- “İkinci kuşak hiç sedasyon yapmaz.” Genellikle doğruya yakın olsa da bireysel farklılıklar ve yüksek dozlarda sedasyon görülebilir (özellikle setirizin).
- “Feksofenadin CYP3A4 ile metabolize olur.” Esasen CYP metabolizması minimaldir; başlıca taşıyıcı aracılı farmakokinetikle seyreder ve meyve suları emilimi azaltabilir.
Gelecek yönelimler
- Biyobelirteç temelli kişiselleştirme: Ürtiker fenotipleri ve farmakogenetik profillerle doz/ajan seçimi.
- Multimodal formülasyonlar: Antihistaminik + intranazal steroid sabit kombinasyonları.
- Selektivite ve güvenlilik: H1 reseptörünün allosterik modülasyonu ve dokuya özgü dağılım stratejileri.
- Nörokognitif güvenlik: Yaşlı popülasyonda uzun dönem kognitif sonuçlara dair prospektif verilerin güçlendirilmesi.
Temsilci ilaçlar: kısa katalog
1. kuşak
- Difenhidramin: Sedatif, antiemetik; kısa etkili.
- Doksilamin: Kısa süreli hipnotik; antikolinerjik yük belirgin.
- Klemastin: Sedatif; IV formları bazı acil durum protokollerinde yer almıştır.
- Dimetinden: Oral ve topikal formlar; sedasyon orta.
- Meklozin: Antivertijinöz ve antiemetik; hareket hastalığında yararlı.
2. kuşak
- Setirizin / Levosetirizin: Hızlı başlangıç; böbrekten atılım; pruritte etkili.
- Loratadin / Desloratadin: Hepatik metabolizma; gündüz uyumu iyi.
- Feksofenadin: Kardiyak güvenli; OATP/P-gp substratı; meyve suyu etkileşimi.
- Ebastin: Uzun etkili; CYP3A4 ile metabolizma.
- Bilastin: Aç karnına alım; taşıyıcı etkileşim hassasiyeti.
- Azelastin (intranazal/oftalmik): Hızlı lokal etki; acı tat sık yakınma.
- Levokabastin (oftalmik/intranazal): Yüksek lokal afiniteli, hızlı semptom kontrolü.
- Terfenadin (tarihsel): QT uzaması nedeniyle terk edilmiştir.
Özet ilkeler
- Alerjik rinit/konjonktivitte ikinci kuşak oral ajanlar ilk tercihtir; intranazal/oftalmik antihistaminikler hızlı ve hedefe yönelik semptom kontrolü sağlar.
- Birinci kuşak ajanlar sedatif ve antikolinerjik yükleri nedeniyle seçilmiş durumlar dışında (antiemetik, kısa süreli hipnotik) tercih edilmemelidir; yaşlılarda kaçınılmalıdır.
- İlaç seçiminde komorbidite (glokom, prostat, kognitif duyarlılık), meslekî gereklilikler (araç kullanma) ve ilaç-yiyecek etkileşimleri (meyve suyu, polyvalan katyonlar) dikkate alınmalıdır.
- Anafilakside antihistaminikler yardımcı rol oynar; adrenalinin yerini almaz.
Keşif
İlk sahne 20. yüzyılın başlarında açılır: kimyagerler, dokulardan türeyen bir “otakoid”in peşindedir. 1907’de Windaus ve Vogt, “β-imidazoliletilamin”ı sentezler; birkaç yıl sonra Henry Dale ve P. P. Laidlaw, bu molekülün —artık “histamin”— damarları genişletip düz kasları kasan güçlü bir aracı olduğunu gösterir. Böylece alerjinin kimyasal yüzü görünür hâle gelir; “kaşıntı, kızarıklık, akıntı ve bronş spazmı” artık bir sözcükle anılabilir: histamin. (ScienceDirect)
1930’ların Paris’i, Pasteur Enstitüsü’nün sentetik kimya laboratuvarlarında ikinci perdeyi açar. Daniel Bovet, histaminin etkisini kesebilecek moleküller arar ve 1937’de ilk antihistaminik etkinliği gösterir; böylece klinik farmakolojinin yeni bir çağını başlatır ve 1957’de Nobel’e uzanan hattı çizer. Kısa sürede toksisite ve sedasyon sorunları aşılarak klinik kullanıma elverişli ilk temsilciler ortaya çıkar. (NobelPrize.org)
Savaş sonrası dönemde sahne Amerika’ya döner. Cincinnati’de genç bir kimya profesörü, George Rieveschl, kas gevşeticiler üzerinde çalışırken 1943’te diphenhydramine’i keşfeder; Parke-Davis iş birliğiyle 1946’da ABD’de ilk reçeteli antihistaminik olarak onay alır. Bu “birinci kuşak” dalga, promethazine, mepyramine ve pek çok akranıyla birlikte etkili ama sedatif bir klinik figüre dönüşür: burun akıntısı azalır, ancak sınıfa özgü antikolinerjik yük ve santral sedasyon bedeldir. (Universität Cincinnati)
1966’da farmakoloji, histamini tek bir sahneden iki ayrı perona ayırır: Ash ve Schild, histaminin etkilerinin farklı reseptörlerle (H1 ve H2) aracılanabileceğini kanıtlar. Bu ayrım, bir yandan H1 karşıtlarının alerjideki rolünü netleştirirken, diğer yandan James Black’in H2-blokörleriyle asit sekresyonuna yeni bir tedavi ekseni açmasının temelini atar. Klinik tiyatrodaki rol dağılımı böylece kalıcılaşır: H1 periferde kaşıntı, ödem ve bronkospazm; H2 asit sekresyonu. (PubMed)
Moleküler çağ 1990’larda kapıyı aralar. 1991’de H1 reseptörünün sığır kaynaklı cDNA’sı ekspresyon klonlamasıyla ortaya konur; kısa süre sonra insan H1 geninin intronsuz yapısı tanımlanır. Bu, reseptörün yalnızca “var” olmadığını, aynı zamanda klasik amin reseptörleriyle (GPCR’ler) aynı mimaride davrandığını —Gq/11, PLC-IP₃/DAG ekseni— kesinleştirir. (PNAS)
Ve 2011: perde, atomların dansına zoom yapar. İnsan H1 reseptörü, birinci kuşak bir ligandla (doxepin) kompleks hâlinde kristallenir; bağlanma cebinin hidrofobik doğası ve muhafazakâr Trp^6.48 ile etkileşim, neden ilk kuşakların “geniş hedefli” olduğunu yapısal düzeyde açıklar. 2021’de aktif H1R-Gq kompleksinin cryo-EM yapısı, etkinleşme hareketinin anlık fotoğrafını sunar. Yapısal biyoloji, artık rasyonel tasarımın koordinatlarını verir. (PubMed)
Klinikte aynı yıllar, güvenlik dersleriyle bezelidir. Terfenadin, karaciğerde CYP3A4 ile aktif metaboliti feksofenadine dönüşür; metabolizma engellendiğinde (makrolidler, greyfurt suyu vb.) ebeveyn ilacın kardiyotoksisitesi ortaya çıkar ve QT uzamasıyla torsades de pointes riski belirginleşir. FDA 1996’da feksofenadin’i onaylar; daha güvenli metabolit, kısa süre içinde terfenadinin yerini alır ve orijinal ilaç 1997–98’de piyasadan çekilir. “Seçicilik” ve “güvenlik penceresi” bundan böyle yalnızca akademik terimler değildir. (U.S. Food and Drug Administration)
Aynı dönemde kuramsal bir dönüşüm daha yaşanır: H1 “antagonistleri”nin çoğu aslında ters agonisttir; reseptörün bazal aktivitesini söndürerek inaktif konformasyonu stabilize ederler. Kavram, antihistaminiklerin antiinflamatuvar etkilerini ve doz-yanıt davranışlarını açıklamaya başlar; birinci kuşakların santral etkilerinden kaçınmak için lipofiliklik/polarite ve taşıyıcı etkileşimleri (ör. P-gp) hedeflenir. Klinik pratikte de ikinci kuşak ajanlar —loratadin/desloratadin, setirizin/levosetirizin, feksofenadin, bilastin, ebastin— gündelik yaşamı uyutmadan semptom kontrolünü mümkün kılar. (PMC)
Topikal sahnede, intranazal ve oftalmik formülasyonlar ayrı bir ritim tutar. Azelastin gibi intranazal antihistaminikler hızlı başlangıçlarıyla öne çıkar; kortikosteroidle sabit kombinasyon (azelastin+flutikazon) ise randomize çalışmalarda monoterapilere üstünlük göstererek “çıktı odaklı” bir sinerji sunar. Bu, burun tıkanıklığı dahil çok boyutlu semptom yükünü kısa sürede aşağı çeker. (PubMed)
Rehberler sahneden çekilmez; özellikle ürtikerde ikinci kuşak H1 antagonisti, birinci basamak standarttır. Yetersiz yanıtta dört katına kadar kılavuz temelli doz artırımı ve sonrasında biyolojik ajanlara (omalizumab) geçiş, 2022 güncellemesiyle küresel mutabakata dönüşür. Böylece “güçlü ama uykusuz” bir antihistaminik çağı, algoritmik bir netlikle işler. (UCARE)
Bugün perde, üç eksende ileri hareket eder:
- Yapısal farmakoloji: H1R’nin aktif-inaktif geçişlerine ait yüksek çözünürlüklü haritalar, allosterik bölgelerin ve biaslı sinyal iletiminin ilaç tasarımına taşınmasını mümkün kılar.
- Biyofiziksel ölçümleme: Canlı hücrelerde BRET-tabanlı biyosensörlerle agonist etkinlik, β-arrestin rekruitmanı ve desensitizasyonun ayrıştırılması, “aynı reseptör, farklı cevap” ilkesini nicel hâle getirir.
- Yeniden konumlandırma: H1 antagonistlerinin antiviral ve immünomodülatör potansiyelleri, özellikle solunum yolu enfeksiyonlarında araştırma gündemindedir; hipotez üretimi, mekanistik temellendirme ve klinik sinyaller dikkatle ayrıştırılır. (Nature)
Ve yeni bir sahne daha: eczane raflarında “uyutmayan” tabletler, klinikte algoritmik doz stratejileri, mikroskobun altında atomik cepler. Yüzyıl önceki keskin amin kokusundan, bugün bilgisayar ekranındaki yoğunluk haritalarına uzanan bu hikâyede, H1 reseptör engelleyicilerinin ortak paydası aynı kalır: histaminin taşkın sinyalini, yaşam kalitesini bozmadan kısma sanatı.
İleri Okuma
- Tiligada, E. (2018). Histamine pharmacology: from Sir Henry Dale to the 21st century. British Journal of Pharmacology, 175(1), 1–3. https://pmc.ncbi.nlm.nih.gov/articles/PMC7012941/
- NobelPrize.org (1957). Daniel Bovet – Facts. Nobel Prize in Physiology or Medicine. https://www.nobelprize.org/prizes/medicine/1957/bovet/facts/
- Ash, A. S. F., & Schild, H. O. (1966). Receptors mediating some actions of histamine. British Journal of Pharmacology and Chemotherapy, 27(2), 427–439. https://pubmed.ncbi.nlm.nih.gov/4381779/
- Yamashita, M., Fukui, H., Sugama, K., Horio, Y., Ito, S., Mizuguchi, H., & Wada, H. (1991). Expression cloning of a cDNA encoding the bovine histamine H1 receptor. Proceedings of the National Academy of Sciences USA, 88(24), 11515–11519. https://www.pnas.org/doi/10.1073/pnas.88.24.11515
- Fukui, H., et al. (1994). Molecular cloning of the human histamine H1 receptor gene. Biochemical and Biophysical Research Communications, 201(2), 894–901. https://pubmed.ncbi.nlm.nih.gov/8003029/
- Shimamura, T., et al. (2011). Structure of the human histamine H1 receptor complex with doxepin. Nature, 475(7354), 65–70. https://pubmed.ncbi.nlm.nih.gov/21697825/
- Xia, R., et al. (2021). Cryo-EM structure of the human histamine H1 receptor/Gq complex. Nature Communications, 12, 194. https://www.nature.com/articles/s41467-021-22427-2
- U.S. FDA (2023). Drug Therapeutics & Regulation in the U.S. (Feksorenin onayı ve terfenadinin çekilmesi kronolojisi). https://www.fda.gov/about-fda/fda-history-exhibits/drug-therapeutics-regulation-us
- U.S. Federal Register (1997). Terfenadine ve QT uzaması uyarısı. 62(9), 3060–3065. https://www.govinfo.gov/content/pkg/FR-1997-01-14/pdf/97-714.pdf
- Church, D. S., & Church, M. K. (2011). Pharmacology of antihistamines. World Allergy Organization Journal, 4(Suppl 3), S22–S27. https://pmc.ncbi.nlm.nih.gov/articles/PMC3666185/
- University of Cincinnati (2006). Local Inventor Honored for Developing World’s First Antihistamine (Benadryl). https://www.uc.edu/news/articles/legacy/healthnews/2006/05/local-inventor-honored-for-developing-worlds-first-antihistamine.html
- Hampel, F. C., et al. (2010). Double-blind, placebo-controlled study of azelastine and fluticasone in a single nasal spray device. Annals of Allergy, Asthma & Immunology, 105, 168–173. https://pubmed.ncbi.nlm.nih.gov/20674829/
- U.S. FDA (2012). Dymista (azelastin/flutikazon) onay dosyası. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2012/202236Orig1s000SumR.pdf
- Zuberbier, T., et al. (2022). The international EAACI/GA²LEN/EuroGuiDerm/APAAACI guideline for urticaria. Allergy, 77(3), 734–766. https://onlinelibrary.wiley.com/doi/10.1111/all.15090
- Verweij, E. W. E., et al. (2022). BRET-Based Biosensors to Measure Agonist Efficacies in GPCRs (H1R bağlamı). International Journal of Molecular Sciences, 23(6), 3184. https://www.mdpi.com/1422-0067/23/6/3184
- Qu, C., et al. (2021). Could Histamine H1 Receptor Antagonists Be Used for Treating COVID-19? International Journal of Molecular Sciences, 22(11), 5672. https://www.mdpi.com/1422-0067/22/11/5672