“Transferrin” terimi, proteinin demiri vücutta “transfer etme” işlevinden türetilmiştir. “Trans-” öneki çapraz veya içinden anlamına gelir ve “ferrin”, Latince demir kelimesi olan “ferrum” ile ilgilidir. Dolayısıyla bu isim, proteinin demir taşınmasındaki birincil rolünü etkili bir şekilde tanımlamaktadır.
Transferrin ilk olarak 20. yüzyılın başlarında kan serumu proteinleri üzerine yapılan çalışmalar sırasında tanımlandı. Demir taşınmasındaki rolü daha sonra açıklığa kavuşturuldu ve vücutta demir homeostazisinin korunmasındaki kritik işlevi ortaya çıktı.
Fonksiyonu
Transferrin ağırlıklı olarak kan plazmasında bulunan bir glikoproteindir. Demirin diyetten ve depo alanlarından vücuttaki tüm hücrelere taşınmasında çok önemli bir rol oynar. Demir, DNA sentezi, elektron taşınması ve hemoglobinde oksijen taşınması dahil olmak üzere çeşitli biyolojik süreçler için gereklidir. Ancak serbest demir toksik olabilir ve zararlı serbest radikallerin üretimini katalize edebilir. Transferrin, demirin toksik olmayan bir biçimde güvenli bir şekilde taşınmasını sağlar.
Etki Mekanizması
Diyetteki demir bağırsaklarda emilir ve kan dolaşımına salınarak transferrine bağlanır. Her transferrin molekülü iki demir iyonunu bağlayabilir. Transferrin-demir kompleksi daha sonra kan dolaşımı yoluyla çeşitli hücrelere gider. Hücrelerin yüzeylerinde, transferrin-demir kompleksini tanıyan ve ona bağlanan, transferrin reseptörleri olarak bilinen reseptörler bulunur. Bu bağlanma, demirin kullanıldığı veya depolandığı hücrelere girişini kolaylaştırır.
Düzenleme:
Vücut, demir seviyelerine göre transferrin ve reseptörlerinin miktarını düzenler. Demir seviyeleri düşük olduğunda demir taşınmasını artırmak için daha fazla transferrin üretilir. Tersine, demir seviyeleri yüksek olduğunda vücut, hücreler tarafından demir alımını azaltmak için transferrin reseptörlerinin sayısını azaltır.
Klinik Önemi:
Transferrin seviyeleri vücudun demir durumunun bir göstergesi olabilir. Düşük transferrin seviyeleri yetersiz beslenmeye veya bazı kronik hastalıklara işaret edebilirken, yüksek transferrin seviyeleri demir eksikliği anemisine işaret edebilir. Klinik ortamlarda transferrin doygunluğu (bağlı demirin, transferrinin toplam demir bağlama kapasitesine oranı) demirle ilişkili bozukluklara ilişkin bilgiler sağlayabilir.

Tarihçe
Transferrin ilk olarak 1946 yılında kan plazmasının demir bağlama kapasitesini inceleyen Joseph B. Granick tarafından keşfedildi. Plazmada, demirin dokulara ve dokulardan taşınmasından sorumlu olan bir proteinin bulunduğunu buldu. Bu protein başlangıçta “demir bağlayıcı bileşen” olarak adlandırıldı, ancak daha sonra “demir taşıyıcı” anlamına gelen transferrin olarak yeniden adlandırıldı.
Transferrinin ilk ayrıntılı karakterizasyonu 1958’de Jacques Laurell tarafından yayınlandı. Laurell, transferrinin molekül ağırlığı yaklaşık 80 kDa olan bir glikoprotein olduğunu gösterdi. Ayrıca transferrinin, her biri bir Fe3+ iyonunu bağlayabilen iki demir bağlama bölgesine sahip olduğunu da gösterdi.
1960’lı ve 1970’li yıllarda araştırmacılar transferrinin demir metabolizmasındaki rolünü araştırmaya başladı. Demirin duodenumdan karaciğere, dalağa ve kemik iliğine taşınması için transferrinin gerekli olduğunu buldular. Ayrıca transferrinin, demirin depo alanlarından salınmasında ve demirin gelişmekte olan kırmızı kan hücrelerine iletilmesinde rol oynadığını da buldular.
Son yıllarda araştırmacılar transferrinin doğuştan gelen bağışıklık sistemi ve kanser gibi diğer biyolojik süreçlerdeki rolünü araştırmaya başladılar. Örneğin transferrinin bakterilere bağlanıp onları öldürdüğü gösterilmiştir. Transferrinin kanser hücrelerinin büyümesinde ve gelişmesinde de rol oynadığı gösterilmiştir.
Transferrin araştırmalarının ilk günlerinde bu proteinin işlevi hakkında bazı tartışmalar vardı. Bazı araştırmacılar transferrinin sadece demir için bir depolama proteini olduğuna inanıyordu. Diğerleri transferrinin demirin taşınmasında rol oynadığına inanıyordu. 1960’lı ve 1970’li yıllara kadar araştırmacılar transferrinin demir için bir taşıma proteini olduğunu kesin olarak gösteremediler.
1980’lerde araştırmacılar transferrinin farklı genetik varyantlarının olduğunu keşfettiler. Bu varyantlara transferrin izoformları adı verilir. Var olduğu bilinen 100’den fazla farklı transferrin izoformu vardır. Bu izoformların bazıları diğerlerinden daha yaygındır. En yaygın transferrin izoformu transferrin C olarak adlandırılır.
1990’larda araştırmacılar transferrinin bazı hastalıkların teşhis ve tedavisinde kullanılabileceğini keşfettiler. Örneğin demir eksikliği anemisinde transferrin seviyeleri azalır. Bazı kanser türlerinde transferrin seviyeleri de artmaktadır.
- Transferrin çok stabil bir proteindir. Çok çeşitli pH ve sıcaklık koşullarına dayanabilir.
- Transferrin demirin yanı sıra çinko ve bakır gibi diğer metallere de bağlanabilir.
- Transferrin tüm omurgalıların kan plazmasında bulunur.
- Transferrin, böcekler gibi bazı omurgasızların kan plazmasında bile bulunur.
- Transferrinin antimikrobiyal özelliklere sahip olduğu gösterilmiştir. Bakterileri ve diğer mikroorganizmaları öldürebilir.
Kaynak
- Aisen, P., Enns, C., & Wessling-Resnick, M. (2001). Chemistry and biology of eukaryotic iron metabolism. International Journal of Biochemistry & Cell Biology, 33(10), 940-959.
- Anderson, G. J., & Frazer, D. M. (2017). Current understanding of iron homeostasis. The American Journal of Clinical Nutrition, 106(suppl_6), 1559S-1566S.
- Ganz, T. (2013). Systemic iron homeostasis. Physiological Reviews, 93(4), 1721-1741.



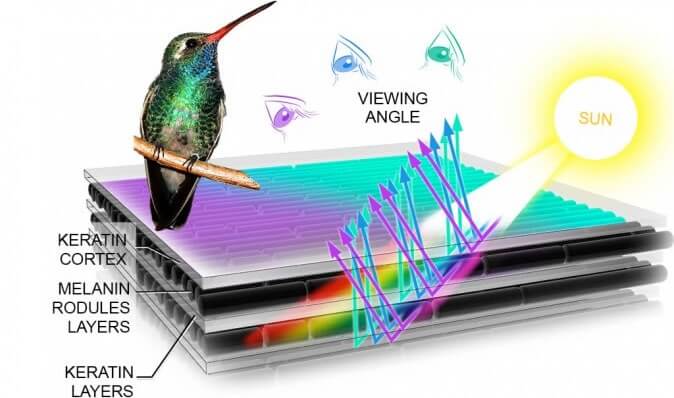

 Öncelikle, ‘memelilerde bu renklere asla rastlanmaz’ demenin doğru olmayacağını belirtmek gerekir. Örneğin köpeksi maymunlar ailesinden bir primat olan mandriller, özellikle genital bölgelerinde ve arkalarında çoğunlukla mavi olmak üzere pembe, mor, açık kırmızı renkli tüyler bulundurmaktadır. Esasında, hayatta kalma, kamuflaj ve eş bulma (veya eş olarak tercih edilme) gibi güdüler dolayısıyla yaygın olan hakim renklerin içinde aynı sebeplerden ötürü bahsi geçen renklerin oluşması, gelişmesi ve kullanılması da anlaşılabilirdir.
Öncelikle, ‘memelilerde bu renklere asla rastlanmaz’ demenin doğru olmayacağını belirtmek gerekir. Örneğin köpeksi maymunlar ailesinden bir primat olan mandriller, özellikle genital bölgelerinde ve arkalarında çoğunlukla mavi olmak üzere pembe, mor, açık kırmızı renkli tüyler bulundurmaktadır. Esasında, hayatta kalma, kamuflaj ve eş bulma (veya eş olarak tercih edilme) gibi güdüler dolayısıyla yaygın olan hakim renklerin içinde aynı sebeplerden ötürü bahsi geçen renklerin oluşması, gelişmesi ve kullanılması da anlaşılabilirdir. Bu örneklerden birisi Amazon Nehri Yunusu veya Boto olarak bilinen pembe yunus türü olabilir. Ancak bu tür gerçekten pembe renkte olmamakla birlikte, yalnızca albinodur. Melanin pigmenti sentezleyen genlerin mutasyona uğramış veya bir biçimde inaktive olmuş olması veya resesif olarak aktarılan bir fenotip olan albinoluk, nispeten transparan bir derisi olan bu türün deri altı kan damarlarında dolaşan kırmızı kan dolayısıyla pembe bir görüntü oluşturmaktadır. Bir memeli olarak kanlarındaki hemoglobin ve bu molekülün de yoğun yüzdesi dolayısıyla 2007’de keşfedilen bu tür sıradışı görüntülerin oluşmasını sağlamaktadır.
Bu örneklerden birisi Amazon Nehri Yunusu veya Boto olarak bilinen pembe yunus türü olabilir. Ancak bu tür gerçekten pembe renkte olmamakla birlikte, yalnızca albinodur. Melanin pigmenti sentezleyen genlerin mutasyona uğramış veya bir biçimde inaktive olmuş olması veya resesif olarak aktarılan bir fenotip olan albinoluk, nispeten transparan bir derisi olan bu türün deri altı kan damarlarında dolaşan kırmızı kan dolayısıyla pembe bir görüntü oluşturmaktadır. Bir memeli olarak kanlarındaki hemoglobin ve bu molekülün de yoğun yüzdesi dolayısıyla 2007’de keşfedilen bu tür sıradışı görüntülerin oluşmasını sağlamaktadır.






Yorum yazabilmek için oturum açmalısınız.