“İnfluenza” sözcüğü, İtalyanca influenza kelimesinden türemiştir ve tarihsel olarak “etki, tesir, nüfuz” anlam alanına dayanır. Orta Çağ ve erken modern dönemde salgın hastalıkların gök cisimlerinin ya da mevsimsel “havaların etkisi” ile ortaya çıktığı fikri yaygın olduğundan, terim başlangıçta hastalığın nedeni olarak varsayılan dışsal etkilenimi ima eder. Zaman içinde kavram, klinik olarak ani başlangıçlı ateş, miyalji, üst ve alt solunum yolu belirtileriyle seyreden, epidemik ve pandemik yayılım gösterebilen viral enfeksiyon tablosunu adlandırmak üzere daralmış ve modern virolojinin gelişmesiyle etkenin Orthomyxoviridae ailesine ait influenza virüsleri olduğu gösterilmiştir.
Orthomyxoviridae adı, Yunanca orthos kökünden gelen “doğru, düzgün” ve myxa kökünden gelen “mukus” kelimelerinin birleşimiyle oluşturulmuştur; bu adlandırma, virüsün başlıca hedef dokusunun solunum mukozası olması ve doğal enfeksiyonların mukozal yüzeylerde başlamasıyla ilişkilidir. Aile içinde insan patolojisi açısından en belirleyici cinslerden biri, farklı kuş ve memeli konaklarda dolaşabilen ve geniş ekolojik havuzdan genetik çeşitlilik devşirebilen Influenzavirus A cinsidir. Klinik ve halk sağlığı bakış açısından “İnfluenza A” ifadesi, hem mevsimsel epidemilerin önemli bir bölümünden sorumlu olan hem de antijenik sıçrama kapasitesi nedeniyle pandemilere yol açabilen virüs grubunu temsil eder.
Tarihsel gelişim: salgın gözlemlerinden moleküler virolojiye
İnfluenza benzeri hastalıklar, tarih boyunca “nezle” ve “katarr” gibi şemsiye terimler altında tanımlanmış; ancak influenza, yüksek bulaşıcılığı ve dalgalar hâlindeki yayılımıyla ayırt edici bir epidemiyolojik örüntü sergilemiştir. Modern influenza tarihi, özellikle 20. yüzyılda ardışık pandemi dalgalarıyla belirginleşir:
- 1918–1919: H1N1 alt tipinin neden olduğu, yüksek mortalite ve olağandışı yaş dağılımıyla öne çıkan pandemi.
- 1957: H2N2 alt tipinin ortaya çıktığı pandemi.
- 1968: H3N2 alt tipinin neden olduğu pandemi.
- 1977: H1N1’in yeniden dolaşıma girmesiyle karakterize, çoğunlukla çocuk ve genç erişkinleri etkileyen dalga.
- 2009: Domuz kökenli genetik bileşenleri olan yeni bir H1N1 varyantının küresel yayılımıyla pandemi.
Bu tarihsel çizgi, influenza A virüslerinin yalnızca nokta mutasyonlarıyla kademeli değişim göstermediğini; aynı zamanda segmentli genom yapıları nedeniyle “parça değişimi” yoluyla büyük antijenik sıçramalar yapabildiğini ortaya koymuştur. Virolojide influenza virüslerinin izolasyonu, hücre kültürü ve embriyolu tavuk yumurtasında çoğaltma teknikleri, serolojik tiplendirme yöntemleri, daha sonra da ters genetik ve yüksek verimli dizileme teknolojilerinin gelişmesi; patogenez, bulaş dinamikleri ve aşı tasarımının bilimsel temellerini şekillendirmiştir.
Evrimsel biyolojik bağlam: segmentli genom, konak ekolojisi ve “One Health” gerçekliği
İnfluenza A virüsleri evrimsel olarak kuşları geniş bir doğal rezervuar olarak kullanır. Özellikle su kuşları ve kıyı kuşları, çok sayıda hemaglutinin ve nöraminidaz kombinasyonunu taşıyabilen virüslerin dolaşımına olanak tanır. Bu ekolojik havuz, virüsün genetik çeşitliliğini sürekli besler. Virüs, kuşlardan memelilere doğrudan sıçrayabildiği gibi, çoğu senaryoda ara konak ya da “karışım kabı” rolü oynayabilen türler üzerinden adaptasyon kazanabilir. Domuzlar, hem kuş hem insan influenza virüslerinin bağlanabildiği sialik asit reseptör tiplerini solunum epitellerinde barındırabildikleri için, farklı kökenli segmentlerin aynı hücrede buluşmasına ve yeniden düzenlenme yoluyla yeni genotiplerin doğmasına uygun bir ekolojik niş sağlar.
Evrimsel perspektiften influenza A’nın başarısı üç ana özellikte yoğunlaşır:
- Hata eğilimli replikasyon: RNA polimeraz kompleksinin düzeltme mekanizması zayıftır; bu, kısa sürede geniş bir mutant spektrumu üretir.
- Segmentli genom: Sekiz ayrı RNA segmenti, ko-enfeksiyon durumunda “genetik karışım” olasılığını artırır.
- Konak ve doku tropizmi üzerinde seçilim: Reseptör bağlanma tercihleri, hücresel giriş verimliliği, interferon yanıtından kaçış ve memelilerde üst solunum yolu replikasyonuna uyum gibi özellikler, tür bariyerini aşmada belirleyicidir.
Bu nedenle influenza A, klasik bir “tek sağlık” örneğidir: insan sağlığı, hayvan sağlığı ve çevresel faktörler birbirine sıkı biçimde bağlıdır. Göç yolları, canlı hayvan ticareti, yoğun üretim çiftçiliği, kentleşme ve küresel mobilite; virüsün çeşitlenmesini ve yayılımını hızlandıran üst düzey belirleyicilerdir.
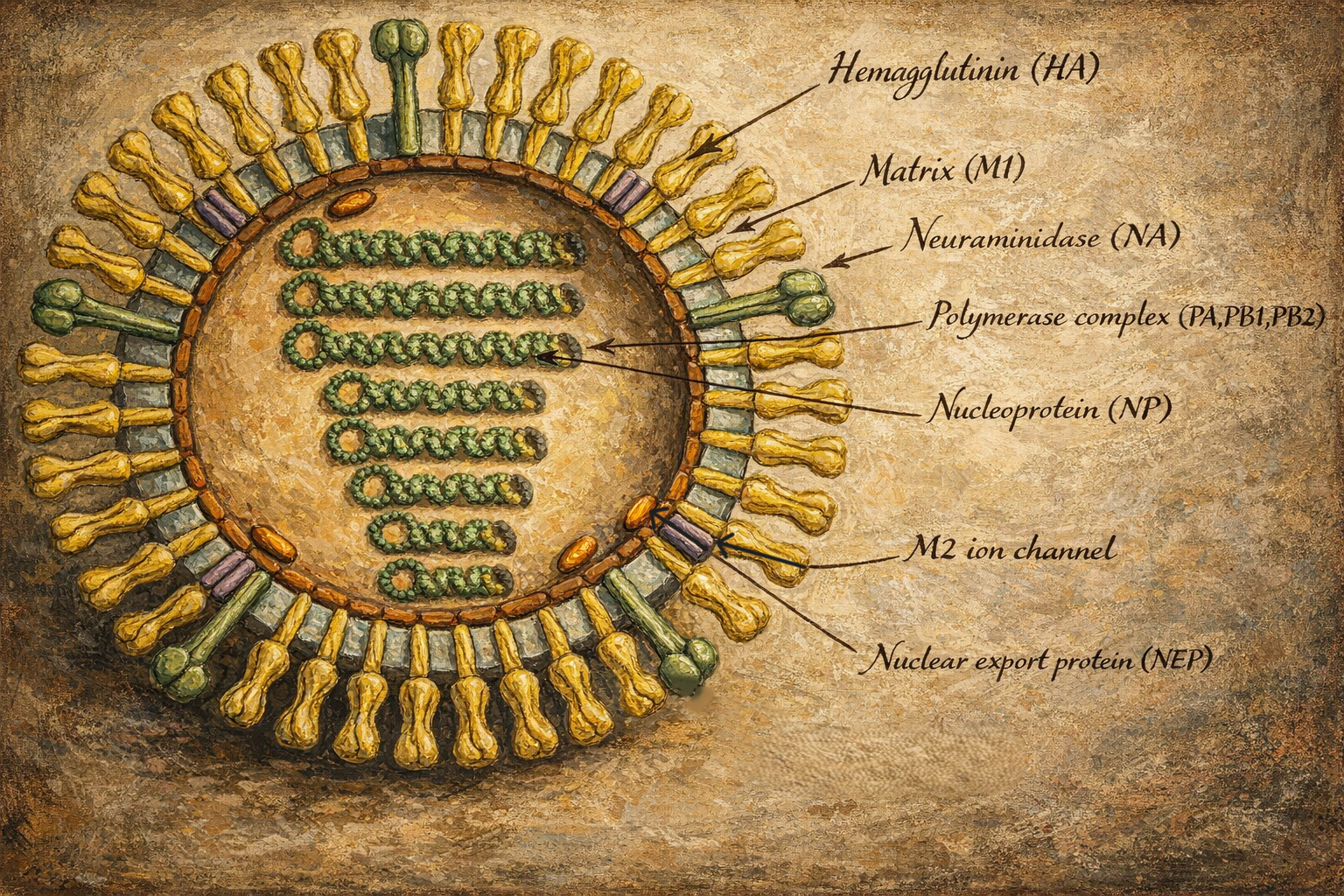
Taksonomi ve yapısal organizasyon
Influenzavirus A cinsi, zarlı ve pleomorfik partiküller oluşturur. Virion yüzeyinde üç temel yapı öne çıkar:
- Hemaglutinin: Konak hücre reseptörlerine bağlanma ve membran füzyonunu başlatma işlevine sahiptir.
- Nöraminidaz: Sialik asit kalıntılarını keserek yeni oluşan virüslerin hücre yüzeyinden ayrılmasına ve mukus bariyerinde ilerlemesine yardım eder.
- M2 iyon kanalı: Uncoating sürecinde endozomal asitleşmeye yanıt vererek virüs iç yapılarının açığa çıkmasını kolaylaştırır.
Zarfın altında matriks proteinleri ve her bir RNA segmentini saran ribonükleoprotein kompleksleri bulunur. Her segment, nükleoprotein ile kaplı negatif polariteli tek iplikçikli RNA’dan oluşur ve virüsün RNA polimeraz alt birimleriyle birlikte işlevsel bir transkripsiyon ve replikasyon ünitesi hâline gelir.
Genomun sekiz segment hâlindeki mimarisi, influenza A’nın genetik esnekliğinin merkezindedir. Segmentler, yüzey antijenleri ve iç proteinlerin kodlanmasına bölüştürülmüştür; bu bölünmüşlük, hem bağışıklıktan kaçış hem de konak adaptasyonu açısından modüler bir evrim alanı yaratır.
Replikasyon döngüsü: çekirdek aşaması olan bir RNA virüsü
İnfluenza A’nın yaşam döngüsü, solunum epiteline yerleşme ve burada hızlı çoğalma üzerine kuruludur. Süreç, çok basamaklı ve yüksek derecede düzenlenmiş bir dizi olayla ilerler:
1. Tutunma: sialik asit reseptörleri ve bağlanma seçiciliği
Hemaglutinin, konak hücre yüzeyindeki glikoprotein ve glikolipitlerin uçlarında bulunan sialik asit kalıntılarını tanır. Sialik asit, özellikle N-asetil nöraminik asit formuyla önem kazanır. Burada kritik ayrım, sialik asidin galaktoza bağlanma biçimidir: kuşlarda daha çok alfa2,3 bağlanma; insan üst solunum yolunda daha çok alfa2,6 bağlanma yaygındır. Bu reseptör topografisi, virüsün doku ve tür tropizmini belirleyen başlıca moleküler eşiklerden biridir.
2. Endositoz ve zarf füzyonu
Reseptör aracılı endositozla virion endozoma alınır. Endozomal pH düştükçe hemaglutinin konformasyon değiştirir ve zarf ile endozom membranı arasında füzyon gelişir. Aynı zamanda M2 iyon kanalı üzerinden virion içi asitleşme artar; bu olay, matriks ile ribonükleoprotein kompleksleri arasındaki bağların çözülmesine yardım eder.
3. Çekirdeğe taşınma: ribonükleoproteinlerin nükleer importu
Serbestleşen ribonükleoprotein kompleksleri, nükleer lokalizasyon sinyalleri aracılığıyla çekirdeğe taşınır. İnfluenza A’nın RNA virüsleri içinde ayırt edici yönlerinden biri, transkripsiyon ve replikasyonun ana aşamalarının çekirdekte gerçekleşmesidir.
4. Transkripsiyon: kap kapma ve viral mRNA sentezi
Virüs, konak hücre mRNA’larının 5 uç kap yapısını kullanarak “kap kapma” stratejisiyle kendi mRNA’larını başlatır. Viral polimeraz, konak transkriptlerinden kısa kaplı primerler üretir ve bunları viral RNA şablonunda uzatarak viral mRNA’ları sentezler. Böylece hem konak translasyon makinesine uyumlu kaplı mRNA’lar oluşur hem de konak gen ifadesi baskılanır.
5. Replikasyon: tam uzunlukta ara formlar ve yeni genom üretimi
Viral genomun çoğaltımı, mRNA üretiminden farklı olarak kap bağımsızdır ve tam uzunlukta tamamlayıcı RNA ara formu üzerinden ilerler. Bu ara form, yeni negatif polariteli segmentlerin sentezine şablon olur. Hata oranı yüksek polimeraz etkinliği, geniş bir mutant bulutu üretir; seçilim, bağışıklık baskısı ve konak içi yayılım avantajlarına göre şekillenir.
6. Protein sentezi ve montaj
Viral mRNA’lar sitoplazmada çevrilir. Yüzey glikoproteinleri endoplazmik retikulum ve Golgi üzerinden işlenir, hücre membranına taşınır. Ribonükleoprotein kompleksleri çekirdekten çıkarılır ve plazma membranında bir araya gelen yapısal proteinlerle buluşur.
7. Tomurcuklanma ve salınma: nöraminidazın rolü
Yeni virionlar hücre membranından tomurcuklanarak ayrılır. Bu aşamada nöraminidazın sialik asitleri kesmesi kritik önemdedir; aksi hâlde virionlar hücre yüzeyine ya da birbirine yapışık kalır. Nöraminidaz, ayrıca mukus içindeki sialilasyon motiflerini kırarak virüsün mukozal bariyeri aşmasına katkıda bulunur.
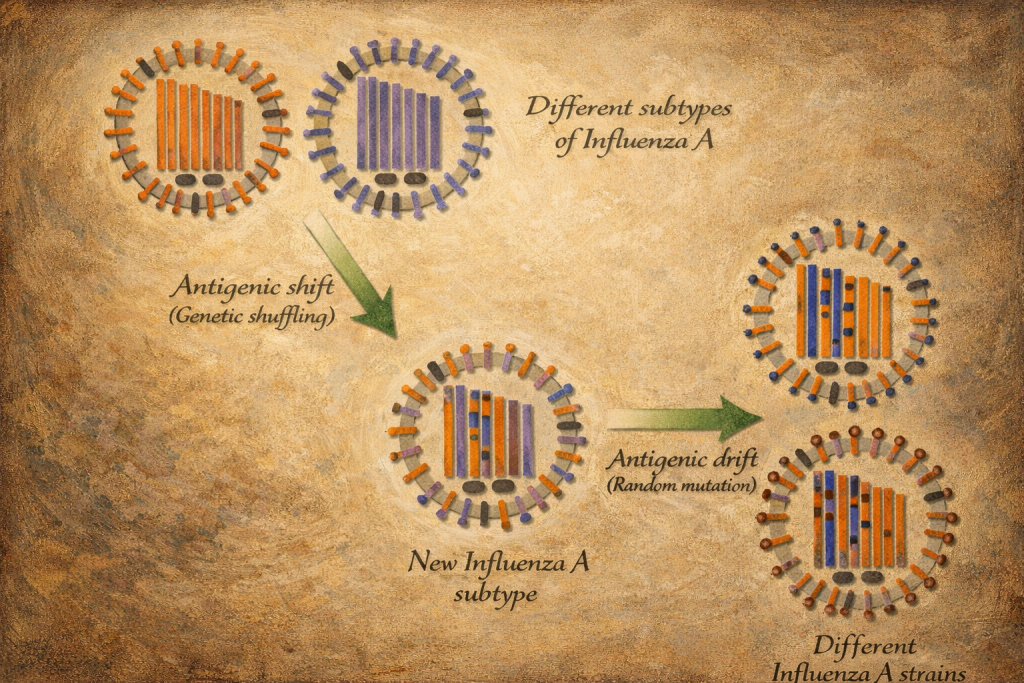
Antijenik değişim: antijenik sürüklenme ve antijenik sıçrama
Antijenik sürüklenme
Antijenik sürüklenme, özellikle hemaglutinin ve nöraminidaz genlerinde biriken nokta mutasyonları sonucu antijenik yüzeyin kademeli olarak değişmesidir. Bu süreç, nüfus bağışıklığının zamanla “uyumsuz” hâle gelmesine, mevsimsel epidemilerin yinelenmesine ve aşı bileşiminin düzenli güncellenmesi gerekliliğine yol açar. İnfluenza A yanında influenza B de sürüklenme sergiler; buna karşın influenza A, ek olarak sıçrama kapasitesi nedeniyle pandemik riskte öne çıkar.
Antijenik sıçrama
Antijenik sıçrama, farklı influenza A virüslerinin aynı hücreyi enfekte etmesiyle segmentlerin yeniden düzenlenmesi sonucu yeni hemaglutinin ve nöraminidaz kombinasyonlarının ortaya çıkmasıdır. Nüfusun bu yeni antijenik yapıya karşı önceden etkili bağışıklığının bulunmaması, hızlı ve geniş çaplı yayılımı mümkün kılar. Pandemilerin biyolojik temeli çoğu kez bu mekanizmadır; ancak pandemik başarının yalnızca yeni antijenle açıklanamayacağı, üst solunum yolunda etkin çoğalma, insandan insana bulaşabilirlik ve uygun aerosolle yayılım gibi ek adaptasyonların da gerekli olduğu bilinmektedir.
Alt tipler, konak spektrumu ve patojenite
İnfluenza A alt tipleri, hemaglutinin ve nöraminidazın antijenik çeşitliliğine göre adlandırılır. İnsan patolojisi açısından tarihsel olarak öne çıkan alt tipler:
- H1N1: 1918–1919 pandemisi ve 2009 pandemisiyle ilişkilidir; günümüzde mevsimsel dolaşımda da yer alır.
- H2N2: 1957 pandemisinin etkenidir; daha sonra dolaşımdan çekilmiştir.
- H3N2: 1968 pandemisinden beri mevsimsel dolaşımda kalmış; özellikle yaşlılarda ağır hastalık yüküyle ilişkilendirilmiştir.
Kuş gribi bağlamında, insan enfeksiyonlarına yol açabilen ve zoonotik risk taşıyan başlıca hemaglutinin alt tipleri arasında H5, H7, H9 öne çıkar; belirli coğrafi ve ekolojik koşullarda diğer alt tipler de memelilere sıçrayabilmektedir. Kuş kökenli virüslerin insanlarda oluşturduğu klinik tablo, hafif üst solunum yolu enfeksiyonundan fulminan pnömoni ve çoklu organ yetmezliğine uzanan geniş bir spektrum gösterebilir. Patojenitenin belirleyicileri arasında hemaglutininin proteazlarla kesilebilirlik özellikleri, replikasyon kinetiği, doğuştan bağışıklık yanıtını baskılayabilme kapasitesi ve alt solunum yoluna tropizm gibi faktörler bulunur.
Patogenez ve klinik spektrum: moleküler olaylardan sendromlara
İnfluenza, tipik olarak solunum epiteline yerleşir ve kısa inkübasyon süresinin ardından ani başlangıçlı sistemik belirtilerle kendini gösterir. Klinik tabloda ateş, baş ağrısı, miyalji, halsizlik ve öksürük belirgindir. Patogenez, yalnızca viral sitopatik etkiyle değil; konak bağışıklık yanıtının oluşturduğu inflamatuvar medyatörlerle de şekillenir. Epitelyal hasar ve mukosiliyer klirensin bozulması, sekonder bakteriyel enfeksiyonlara yatkınlığı artırabilir. Ağır olgularda viral pnömoni, diffüz alveoler hasar ve akut solunum sıkıntısı sendromu gelişebilir.
Risk artışı; ileri yaş, gebelik, kronik kardiyopulmoner hastalıklar, immünsüpresyon, metabolik komorbiditeler ve belirli nörolojik durumlarla ilişkilidir. Influenza A’nın hastalık yükü, yalnızca akut enfeksiyonla sınırlı değildir; kardiyovasküler olay riskinde geçici artış, kronik hastalık alevlenmeleri ve bakım sistemleri üzerinde mevsimsel dalgalanma gibi dolaylı etkiler de önemlidir.
Epidemiyoloji: mevsimsellik, bulaş yolları ve izlem
İnfluenza, özellikle ılıman iklim kuşaklarında belirgin mevsimsellik gösterir; kış aylarında artan kapalı alan teması ve düşük nemin aerosoller üzerindeki etkileri bulaşı kolaylaştırır. Bulaş, damlacık ve aerosol yoluyla; ayrıca kontamine yüzeyler üzerinden dolaylı temasla gerçekleşebilir. Kısa seri aralığı ve presemptomatik dönemde bulaştırıcılık olasılığı, kontrol önlemlerini güçleştirir.
Güncel bilimsel yaklaşım, influenza yükünü azaltmak için klinik müdahalelerin yanında güçlü bir küresel sürveyans ağına dayanır. Sürveyansın temel hedefleri; dolaşımdaki suşların antijenik ve genetik özelliklerini izlemek, antiviral direnç örüntülerini takip etmek, zoonotik sıçrama sinyallerini erken yakalamak ve aşı bileşim önerilerini veriyle beslemektir.
Bağışıklık yanıtı: doğal enfeksiyon ve aşıyla oluşan koruma
İnfluenza enfeksiyonunda doğuştan bağışıklık yanıtı, viral replikasyonu sınırlamada erken dönemde etkindir; tip I interferon yanıtı ve doğal öldürücü hücre aktivitesi önemli rol oynar. Edinsel bağışıklıkta, hemaglutininin özellikle baş bölgesine karşı gelişen nötralizan antikorlar enfeksiyonu önlemede kritik kabul edilir. Nöraminidaza karşı antikorlar ise viral yayılımı ve hastalık şiddetini azaltmada katkı sağlar. Hücresel bağışıklık, özellikle iç proteinlere karşı gelişen T hücresi yanıtları üzerinden, alt tipler arasında kısmi çapraz koruma sağlayabilir; bu durum, ağır hastalığın sınırlandırılmasında önem kazanır.
Antijenik sürüklenme nedeniyle, hem doğal enfeksiyon hem aşıyla oluşan humoral bağışıklık zamanla dolaşımdaki suşlarla uyumsuzlaşabilir. Bu gerçeklik, influenza kontrolünün “tek seferlik bağışıklama” ile çözülememesinin temel nedenlerinden biridir.
İmmünprofilaksi: aktif ve pasif yaklaşımlar
Aktif immün profilaksi: aşılar
İnfluenza aşıları, antijenik sürüklenme nedeniyle düzenli güncellenen biyolojik ürünlerdir. Başlıca platformlar şunlardır:
- İnaktive aşılar: Virüs bütün hâlde inaktive edilerek, parçalanmış ürünler şeklinde ya da belirli yüzey antijenlerini içerecek biçimde hazırlanabilir. Çoğalma yeteneği yoktur.
- Canlı atenüe aşılar: Replikasyon kapasitesi azaltılmış, patojenitesi düşürülmüş suşlar kullanılır; mukozal bağışıklığı uyarma avantajına sahip olabilir. Uygun olmayan bireylerde kullanımı kısıtlıdır.
- Rekombinant ya da hücre kültürü temelli aşılar: Üretim teknolojisine bağlı olarak, yumurta adaptasyonuna bağlı antijenik değişim riskini azaltma ve üretim esnekliği sağlayabilir.
- Adjuvanlı ve yüksek doz formülasyonlar: Özellikle yaşlılarda daha güçlü bağışıklık yanıtı hedeflenebilir.
Aşı bileşiminin belirlenmesi, küresel dolaşım verilerinin antijenik ve genetik analizine dayanır. Uygulama prensibi, grip sezonundan önce bağışıklık yanıtını oluşturacak şekilde yıllık bağışıklamadır. Aşının amacı yalnızca enfeksiyonu önlemek değil; aynı zamanda ağır hastalık, hastane yatışı ve mortaliteyi azaltmaktır.
Pasif immün profilaksi
Pasif immünizasyon, hazır antikor verilmesine dayanır. Klasik yaklaşım immün globulin preparatlarıdır; daha modern stratejilerde monoklonal antikorlar belirli epitoplara hedeflenebilir. Pasif yaklaşımlar, bağışıklık sistemini “eğitmez”; koruma etkisi kısa süreli olup antikorların biyolojik yarılanma ömrüyle sınırlıdır. Belirli yüksek riskli durumlarda, özellikle immün yanıt oluşturma kapasitesi düşük bireylerde teorik avantaj sağlayabilir.
Tedavi
1) Klinik hedef: “influenza tedavisi”nden ne anlıyoruz?
İnfluenza A tedavisinde iki paralel hedef vardır:
- Bireysel klinik fayda: Semptom süresini ve şiddetini azaltmak, komplikasyon (pnömoni, alevlenme, hastane yatışı) riskini düşürmek.
- Halk sağlığı faydası: Viral saçılımı azaltmak, kurum içi yayılımı kırmak, yüksek riskli kişileri korumak.
Antiviraller, virüsün yaşam döngüsünde farklı basamakları hedefler:
- Nöraminidaz inhibitörleri (NAI): Oseltamivir (oral), zanamivir (inhalasyon; bazı ülkelerde IV form), peramivir (IV). Temel etkileri virion salınımını ve yayılımını azaltmaktır. (CDC)
- Kap-bağımlı endonükleaz inhibitörü: Baloksavir (oral tek doz), viral mRNA sentezindeki “cap-snatching” sürecini bloke eder. (CDC)
- M2 iyon kanalı inhibitörleri (adamantanlar): Amantadin/rimantadin tarihsel önemdedir; ancak güncel dolaşan influenza A suşlarında yaygın direnç ve influenza B’ye etkisizlik nedeniyle rutin kullanım dışındadır. (OUP Academic)
2) Klinik karar algoritması (çekirdek akış)
Aşağıdaki akış, pratikte “bir bakışta karar” için tasarlanmıştır.
Adım 0 — Acil triage: ağır/komplike hastalık var mı?
Aşağıdakilerden biri varsa “ağır/komplike” kabul edin ve düşük eşik ile hastane/YOĞUN BAKIM değerlendirin:
- Solunum sıkıntısı, hipoksemi, siyanoz, konfüzyon, hemodinamik instabilite
- Hızla kötüleşen klinik tablo, ciddi dehidratasyon, oral alım bozukluğu
- İnfluenza ile ilişkili komplikasyon şüphesi (pnömoni, miyokardit, ensefalopati, sekonder bakteriyel infeksiyon vb.)
Bu grupta antiviral tedavi test sonucunu beklemeden başlatılır (klinik şüphe yeterlidir). (CDC)
3) “Kim tedavi almalı?” (endikasyon matrisi)
A) Mutlak/çok güçlü endikasyon (test beklemeden)
Aşağıdaki gruplarda semptom başlangıcından kaç saat geçtiğine bakılmaksızın (özellikle hastane yatışı/ağır hastalık varsa) antiviral düşünün:
- Hastaneye yatırılan veya yatırılma eşiğinde olanlar
- Ağır, komplike veya progresif influenza tablosu olanlar
- Yüksek riskli hastalar (komplikasyon riski yüksek)
CDC ve IDSA, bu gruplarda erken tedaviyi temel strateji olarak vurgular; 48 saat penceresi, “en yüksek fayda” penceresidir ama ağır/yüksek risklilerde daha geç başlanması da klinik fayda sağlayabilir. (CDC)
B) Koşullu endikasyon (paylaşımlı karar)
Düşük riskli, komplike olmayan ambulatuvar olguda:
- Semptom başlangıcı ≤48 saat ise antiviral verilebilir (özellikle yoğun salgın döneminde, iş gücü kaybı/komplikasyon kaygısı belirginse).
- Semptom başlangıcı >48 saat ve hasta düşük riskli ise rutin antiviral zorunlu değildir; destek tedavisi + yakın izlem çoğu zaman yeterlidir.
CDC, komplike olmayan olgularda “oseltamivir/zanamivir 5 gün, peramivir tek doz IV, baloksavir tek doz” seçeneklerini standardize eder. (CDC)
4) “Yüksek risk” tanımı (klinikte pratik liste)
Yüksek risk kategorileri ülkeden ülkeye küçük farklılıklar gösterse de klinikte pratik bir çerçeve:
- Gebelik ve postpartum erken dönem
- Yaşlılar (özellikle ≥65)
- Küçük çocuklar (özellikle <2 yaş; rehberlere göre <5 yaş da artmış risk)
- Kronik hastalıklar: KOAH/astım, kardiyovasküler hastalıklar, diabetes mellitus, kronik böbrek/karaciğer hastalığı, nörolojik hastalıklar
- İmmünsüpresyon (hematolojik malignite, transplant, biyolojik ajanlar, yüksek doz steroid)
- Uzun süreli bakım kurumunda yaşama (huzurevi vb.)
Çocuklar ve gebelik gibi özel gruplarda antiviral seçimi ve dozlar ayrıca yapılandırılmalıdır. (CDC)
5) Tanı ve test stratejisi (tedavi kararını kilitlemeden)
Klinik pratik yaklaşım
- Salgın sezonunda tipik influenza semptomları olan hastada tanı klinik konabilir; antiviral endikasyonu varsa test sonucu beklenmez. (CDC)
- Testin en çok değer kattığı durumlar:
- Hastane yatışı/yoğun bakım, pnömoni
- İmmünsüprese hasta
- Kurum salgın yönetimi (kohortlama, izolasyon, profilaksi)
- “İnfluenza mı, başka bir etken mi?” ayrımı tedavi/izolasyon kararını değiştirecekse
6) Antiviral seçimi: “hangi ilaç, hangi hasta?”
Aşağıdaki seçim mantığı, klinik düzeyde en çok iş gören pratik yaklaşımdır.
Birinci tercih omurgası: Oseltamivir (oral)
- En geniş klinik deneyim ve “hastane yatışı/ağır hastalık/gebelik/çocuk” senaryolarında en sık tercih edilen seçenektir.
- Oral/enteral uygulanabilir (NG/OG sonda ile de verilebilir).
- Renal fonksiyon bozukluğunda doz ayarı gerekebilir.
Birçok ulusal rehber, ağır hastalık ve immünsüpresyonda oseltamiviri “çekirdek tedavi” olarak konumlar. (GOV.UK)
Alternatif: Zanamivir (inhalasyon) / IV zanamivir (bazı bölgelerde)
- İnfluenza A ve B’ye etkilidir; ancak inhaler form reaktif hava yolu hastalığı olanlarda (astım/KOAH) bronkospazm riski nedeniyle uygun değildir.
- IV zanamivir bazı bölgelerde pandemi/özel endikasyon çerçevesinde kullanılabilir (ülke ruhsatı ve erişim koşullarına bağlı).
ECDC ve EMA materyalleri, zanamiviri NAI sınıfı içinde konumlandırır ve inhalasyon formuna ilişkin pratik sınırlılıkları vurgular. (ECDC)
Hastane/IV seçenek: Peramivir (tek doz IV; bazı ağır olgularda farklı şemalar)
- Özellikle oral ilaç alamayan, IV tedavi gereken ambulatuvar veya hastane olgularında seçenek olabilir.
- Klinik senaryoya göre tek doz şema öne çıkar.
CDC, komplike olmayan influenza için peramiviri tek doz IV seçenek olarak listeler. (CDC)
Tek doz oral seçenek: Baloksavir
- Tek doz kullanım kolaylığı sağlar; erken dönemde (özellikle ≤48 saat) ambulatuvar olguda pratik olabilir.
- İmmünsüprese hastada direnç gelişimi/viral rebound kaygıları nedeniyle bazı protokoller daha ihtiyatlıdır.
- Gebelik/emzirme ve belirli yaş gruplarında kullanım endikasyonları ülkelere göre değişebilir; yerel ruhsat ve rehberle uyum aranmalıdır.
CDC, baloksaviri komplike olmayan influenza için tek doz seçenek olarak tanımlar; novel/zoonotik influenza A’da ise bazı durumlarda kombinasyon yaklaşımı gündeme gelebilir. (CDC)
Adamantanlar (amantadin/rimantadin): rutin dışı
- Güncel dolaşan influenza A suşlarında direnç çok yaygın olduğundan ve influenza B’ye etkisiz olduğundan rutin tedavide önerilmez. (OUP Academic)
7) Doz ve süre: klinikte “standart şemalar”
Aşağıdaki şemalar komplike olmayan olgu için “standart çekirdek”tir; ağır/immünsüprese olguda süre/uygulama bireyselleştirilebilir.
Erişkin, komplike olmayan influenza
- Oseltamivir: günde 2 kez, 5 gün
- Zanamivir (inhalasyon): günde 2 kez, 5 gün
- Peramivir (IV): tek doz
- Baloksavir (oral): tek doz
Bu “çekirdek rejim” CDC ve IDSA özetlerinde ortak bir omurga olarak yer alır. (CDC)
Ağır hastalık / hastane yatışı / immünsüpresyon
- Çoğu kurumda oseltamivir temel ajan olarak başlanır.
- Tedavi süresi 5 günün ötesine uzatılabilir; karar; klinik yanıt, viral saçılımın sürmesi, komplikasyonlar ve immünsüpresyon derecesine göre verilir.
- Oral alım yoksa enteral tüple oseltamivir veya uygun IV seçenekler düşünülür.
UKHSA (İngiltere) rehberi, ağır ve immünsüprese olgularda oseltamivir lehine kanıt birikimini ve zanamivirin daha çok “oseltamivir uygun değilse/etkisizse” senaryosunda konumlanmasını vurgular. (GOV.UK)
8) Direnç olgusu: neyi, ne zaman düşünmeli?
İnfluenza A’nın evrimsel hızı nedeniyle direnç, “nadir bir istisna” değil; izlenmesi gereken sürekli bir olasılıktır. Direnç klinikte üç düzeyde ele alınır:
(1) Popülasyon düzeyi (sürveyans)
- Dolaşan suşların duyarlılığı mevsimden mevsime değişebilir; ulusal/uluslararası laboratuvar ağları direnç örüntülerini izler.
- Adamantan direnci, yıllardır küresel ölçekte yüksek olduğu için sınıf rutin dışıdır. (OUP Academic)
(2) Hasta düzeyi (şüphe kriterleri)
Aşağıdakiler direnç/tedavi başarısızlığı şüphesi doğurur:
- Özellikle immünsüprese hastada uygun tedaviye rağmen devam eden viral replikasyon (uzamış ateş, kötüleşme, PCR pozitifliğinin sürmesi)
- Oseltamivir/peramivir altında klinik kötüleşme veya viral yük düşüşünün olmaması
- Kurum içinde tedavi/profilaksi alanlarda beklenmedik yeni olgular (bulaş devamı)
Bu durumda örneklerin direnç analizi için referans laboratuvara yönlendirilmesi ve tedavinin ajan/süre açısından yeniden değerlendirilmesi gerekir.
(3) Novel/zoonotik influenza A (H5, H7 vb.) özel durumu
Novel influenza A şüphesinde (kuş/domuz maruziyeti, kümelenme, ağır pnömoni) direnç riski ve hızlı kötüleşme nedeniyle yaklaşım daha agresiftir; CDC, hastanede novel influenza A olgularında kombinasyon antiviral tedavisinin değerlendirilebileceğini belirtir (kurumsal protokol ve uzman konsültasyonu ile). (CDC)
9) Profilaksi algoritması: “temaslıya ne yapalım?”
Profilaksi, iki ana bağlamda düşünülür: (i) bireysel yüksek riskli temaslı, (ii) kurum salgını.
A) Post-eksposizyon profilaksisi (PEP)
Kimler için mantıklı?
- Komplikasyon riski çok yüksek temaslı
- Aşılanmamış, aşılanmış ama henüz 2 haftası dolmamış, immünsüprese veya aşı yanıtı zayıf olması beklenen temaslı
- Kapalı kurumlarda (huzurevi, bakım evi, yatılı birimler) hızla yayılan kümelenme
Zamanlama
- PEP en iyi maruziyetten sonraki 48 saat içinde başlanır.
ECDC, oseltamivirin hem tedavi hem profilaksiste kullanılabileceğini; CDC ise antiviral kullanımının aşıyla ilişkisinde belirli “bekleme pencereleri” olduğunu (baloksavir daha uzun) hatırlatır. (ECDC)
B) Kurum salgını (huzurevi/bakım evi) yönetimi
- Vaka tanımı + hızlı test stratejisi + izolasyon/kohortlama
- Vaka sayısı artıyorsa, riskli sakinlerde ve yakın temaslı personelde toplu profilaksi kurum protokolüne göre gündeme gelebilir.
- Burada hedef yalnız bireysel koruma değil, yayılımı kırmaktır.
10) Klinik izlem: yan etkiler, etkileşimler, pratik noktalar
Nöraminidaz inhibitörleri (özellikle oseltamivir)
- En sık: gastrointestinal yakınmalar (bulantı/kusma), baş ağrısı
- Renal yetmezlikte doz ayarı ve ilaç düzeyi/yan etki izlemi gerekir
- Ciddi nöropsikiyatrik olaylar nadirdir; özellikle çocuk/adolesanlarda davranış değişiklikleri bildirimleri nedeniyle aile bilgilendirmesi yapılabilir (ülke farmakovijilans uyarılarına göre)
Zanamivir (inhalasyon)
- Astım/KOAH’ta bronkospazm riski nedeniyle kaçınma veya çok dikkatli kullanım
- İnhaler tekniği kötü olanlarda etkinlik düşebilir
Baloksavir
- Tek doz avantajı
- Bazı ilaçlarla (özellikle polivalan katyon içeren ürünlerle) birlikte alım emilim sorunları yaratabilir; yerel ürün bilgisi esas alınır
- İmmünsüprese olguda direnç gelişimi/viral rebound olasılığı nedeniyle klinik yakın izlem gerekir
11) Uygulanabilir “tek sayfa” özet algoritma (metin akış şeması)
- İnfluenza şüphesi (sezonda tipik semptomlar ± epidemiolojik temas)
- Ağır/komplike mi?
- Evet → Hastane değerlendirmesi + test (tercihen) + hemen antiviral (genellikle oseltamivir)
- Hayır → 3. adıma geç
- Yüksek risk var mı?
- Evet → Test beklemeden antiviral (tercihen oseltamivir; uygun hastada baloksavir/zanamivir seçenek)
- Hayır → 4. adıma geç
- Semptom başlangıcı ≤48 saat mi?
- Evet → Paylaşımlı karar: antiviral verilebilir (oseltamivir 5 gün / zanamivir 5 gün / peramivir tek doz / baloksavir tek doz)
- Hayır → Genellikle destek tedavisi + yakın izlem (kötüleşirse yeniden değerlendir)
- Özel durumlar
- Gebelik/çocuk/hastane yatışı/immünsüpresyon → oseltamivir lehine eğilim
- Astım/KOAH → inhaler zanamivirden kaçın
- Novel/zoonotik şüphe → uzman konsültasyonu, olası kombinasyon, direnç izlemi
- 48–72 saat içinde yeniden değerlendirme
- Klinik kötüleşme, uzamış ateş, hipoksemi → komplikasyon/sekonder bakteriyel pnömoni açısından yeniden muayene + görüntüleme/lab + tedavi revizyonu
- İmmünsüprese → uzamış saçılım/direnç olasılığı, örnekleme ve referans laboratuvar planı
Keşif
İlk Gözlemler ve Salgınların Tanınması
İnsanlık, solunum yollarını hedef alan ve kitleleri hızlıca hasta eden gizemli bir hastalıkla binlerce yıldır karşı karşıyaydı. Milattan önce 5. yüzyılda hekim Hippokrates, ateş, öksürük ve ağrılarla aniden ortaya çıkan ve hızla yayılan bir hastalığı ayrıntılı şekilde tanımlamıştı; muhtemelen bu, bugün influenza olarak bildiğimiz hastalığın ilk yazılı betimlemelerinden biriydi. Orta Çağ boyunca ve sonrasında tarihçilerin ve hekimlerin kayıtlarında, birkaç yılda bir ortaya çıkıp şehirleri kasıp kavuran grip benzeri salgınlardan bahsediliyordu. 16. yüzyılda büyük pandemiler ardı ardına dünyayı vurdu: 1510’da Asya’dan Avrupa’ya ulaşan ve neredeyse kıtalararası seyreden bir salgın, ardından 1557-1559 yıllarında dünyanın dört bir yanına yayılan bir başka büyük grip dalgası yaşandı. 1580 yılında Avrupa’yı saran şiddetli salgın ise o kadar iyi belgelendi ki dönemin kronikleri, bu hastalığın ani başlangıcını ve yüksek can kayıplarını ayrıntılarıyla aktardı.
Bu erken dönemlerde hastalığa farklı isimler takılmıştı. Fransızlar “la grippe” (kapma, yakalama anlamında) derken, İngilizler bazen “coqueluche” veya sadece “yeni hastalık” diye bahsettiler. İtalyanlar ise gökyüzüne bakarak nedenini yıldızların etkisine yoruyor ve bu salgına “influenza” adını veriyordu (İtalyanca influentia, yani etki kelimesinden). 18. yüzyıla gelindiğinde influenza terimi Avrupa dillerinde yerleşmişti; 1743’te İtalya’da başlayan bir salgın sırasında bu kelime İngiltere’de de kullanıldı ve o dönemden itibaren grip hastalığını tanımlayan uluslararası bir terim haline geldi. Adı ne olursa olsun, hekimler hastalığın hava ve temas yoluyla hızla yayıldığını gözlemliyor, fakat sebebini bir türlü açıklayamıyorlardı. Mikrop teorisi öncesinde birçokları bunun “kirli hava” (miasma) ya da astrolojik etkiler sonucu ortaya çıktığına inanıyordu. Salgınlar arasında hastalık sırra kadem basıyor, ancak birkaç on yılda bir aniden geri dönerek toplulukları kırıp geçiriyordu. Bu tekrar eden kabus, meraklı zihinlerde hastalığın doğasını ve sebebini anlama isteğini sürekli körüklüyordu.
19. Yüzyılda Merak ve Yanlış İzler
1800’lere gelindiğinde tıp bilimi hızla ilerliyor, mikrop teorisi filizlenmeye başlıyordu. Yine de influenza hâlâ bir muamma idi. 1830-1833 yılları arasında dünya çapında bir salgın milyonlarca insanı etkiledi; hemen ardından 1889’da başlayan “Rus Gribi” pandemisi ulaşımın gelişmesiyle hızla küresel bir boyuta ulaştı. Artık bakteriler birçok hastalığın nedeni olarak yeni keşfedilmişti ve bilim insanları grip salgınlarının da bir mikrobik failinin olması gerektiğini düşünüyordu. 19. yüzyıl sonuna doğru, influenza salgınlarından alınan örnekler mikroskop altında incelendi ve araştırmacılar hummalı bir şekilde sorumlu mikroorganizmayı aradı.
Bu arayışta, 1892 yılında Alman bakteriyolog Richard Pfeiffer önemli bir keşif yaptığını düşündü: Grip hastalarından aldığı balgam örneklerinde çok küçük bir basil izolasyonu yapmayı başardı. Bu bakteriye “Bacillus influenzae” (Pfeiffer basili, günümüzde Hemophilus influenzae olarak bilinir) adını vererek onun grip hastalığının etkeni olduğunu ilan etti. Tıp camiası, nihayet grip bilmecesinin çözüldüğüne inanarak bu bulguyu heyecanla karşıladı. O kadar ki, 1890’lardaki grip salgınlarına karşı ilk aşı denemeleri bile Pfeiffer’in basilini ve diğer bazı bakterileri içeren karışımlarla yapıldı. Ancak bilmece aslında çözülmemişti: Pfeiffer’in mikrobu grip hastalarının solunum yollarında sık görülüyordu ama her vakada bulunmuyordu ve sağlıklı insanlarda da rastlanabiliyordu. Yine de, başka bir açıklama olmadığı için yaklaşık kırk yıl boyunca bilim dünyası grip hastalığını bu bakteriye bağladı. Ne var ki 1918 yılında sahneye çıkacak olan büyük bir felaket, bu yerleşik inancı kökten sarsacak ve gerçeğin izinin bambaşka yerde olduğunu gösterecekti.
1918 Pandemisi: Bilinmezin Yüzüyle Karşılaşma
Dünya, 20. yüzyılın başında hem bir dünya savaşıyla hem de modern tarihin en ölümcül grip pandemisiyle karşı karşıya kaldı. 1918-1919 yıllarındaki “İspanyol Gribi”, insanlık tarihinde görülmemiş bir hız ve şiddette yayılarak tahminen 50 milyon kadar can aldı. Salgının ilk dalgası ılımlı seyretmiş olsa da, özellikle 1918 sonbaharında gelen ikinci dalga genç, sağlıklı bireyleri bile günler içinde öldüren ağır zatürre vakurlarına yol açtı. O güne dek grip salgınları can kaybına neden olmuştu ama böylesine yıkıcı bir etki hiç görülmemişti. Doktorlar çaresizlik içinde hastalığın sebebini anlamaya ve hastaları kurtarmaya çalışırken, geleneksel bilgiler de sınanıyordu. Pek çok bilim insanı hâlâ Pfeiffer’in bakterisini suçlasa da, salgın sırasında yapılan incelemelerde bu bakterinin her hastada bulunmadığı fark edildi. Ayrıca bazı kurbanlar, bakteri değil de akciğerlerde virüslerden kaynaklandığı sonradan anlaşılan mavi bir görünümle (oksijen yetersizliğinden) hayatını kaybediyordu. Otopsilerde çeşitli bakteriler izole ediliyor ama tutarlı bir sonuca varılamıyordu.
Bu durum, ileri görüşlü bazı araştırmacıları başka bir ihtimali düşünmeye yöneltti: Acaba grip, “süzülebilir bir virüs”ten mi kaynaklanıyordu? O dönemde virüs kavramı henüz yeni filizlenmişti; 1890’larda bilim insanları bazı hastalıkların, bakterilerden bile daha küçük ve filtrelerden geçen görünmez etkenler -yani virüsler- nedeniyle oluştuğunu keşfetmeye başlamışlardı. 1918 pandemisinin ortasında, Britanya’da İngiliz Tıp Araştırma Konseyi (MRC) sekreteri Sir Walter Fletcher, ordu sağlık birimlerine gripte olası bir virüs rolünün araştırılmasını önerdi. Fransız ve İngiliz ekipler, savaşın son aylarında gripli askerlerden aldıkları örnekleri bakteriyel filtreden geçirip hayvanlara enjekte ederek bir “süzülebilir ajan” arayışına girişti. Nitekim 1918’in sonlarında Fransa’da görevli iki ayrı ekip, gripli hastalardan alınan ve bakterilerden arındırılmış numunelerin hayvanlarda hastalık belirtileri oluşturduğunu bildirerek grip etkeninin bir virüs olabileceğine dair ilk işaretleri verdiler. Ancak bu çalışmalar, bilimsel kanıtları tam oturtamadı ve dönemin olağanüstü koşullarında çok dikkat çekmedi. Virüsler o dönem doğrudan mikroskopla görülemiyordu; varlıkları ancak filtre deneyleri ve hayvanlarla dolaylı olarak anlaşılabiliyordu. Yine de 1918 salgınının yarattığı dehşet, genç bir araştırmacı kuşağının zihninde bu sırrı çözme tutkusunu uyandırmıştı. Grip gizemini çözmek için yeni yöntemler, yeni modeller gerekiyordu ve savaş sonrasında bazı bilim insanları bu amacı gerçekleştirmeye adandı.
Virüsün İzolasyonu: Bir Dönüm Noktası (1930’lar)
1918 felaketinin ardından gelen 1920’li yıllar, dünyada viroloji biliminin yükselişe geçtiği bir dönem oldu. İngiltere’de MRC bünyesinde çalışan veteriner araştırmacı Dr. Patrick Laidlaw, 1922’den itibaren “filtreyi geçen mikroplar” üzerinde bir proje yürütmeye başladı. Önce köpek gençlik hastalığı (distemper) üzerinde çalışarak virüs araştırmaları için deney hayvanları ve yöntemler geliştirdi. Laidlaw ve meslektaşı George Dunkin, köpek distemper virüsünü incelemek için feret adı verilen küçük etçil hayvanları deney modeli olarak başarıyla kullanmış ve 1920’lerin sonuna doğru bu hastalığın aşısını bile geliştirmişlerdi. Elde ettikleri başarılar, onları bir sonraki hedefe yöneltti: Artık akıllarında influenza virüsünü bulmak vardı. Bu amaçla 1933 yılı başlarında Dr. Laidlaw, genç virologlar Wilson Smith ve Christopher Andrewes ile birlikte büyük bir deneye girişti.
Ocak 1933’te Londra’daki Mill Hill araştırma merkezinde bu ekip, grip olan hastaların boğaz ve burun sıvı örneklerini topladı. Bu örnekleri bakteriyel filtrelerden geçirerek farenin, kobayın, maymunun da aralarında bulunduğu çeşitli hayvanlara verdiler ancak hiçbirinde belirgin bir hastalık oluşmadı. Son çare olarak, daha önce distemper çalışmalarında başarılı bir model olan feretlere yöneldiler. Şubat 1933’te, ekipten Wilson Smith, grip hastası meslektaşı Andrewes’dan aldığı filtre edilmiş burun akıntısını iki sağlıklı feretin burnuna damlattı. Birkaç gün içinde feretler hapşırmaya ve hastalanmaya başladı; bu, tarihi bir andı. Feretlerde görülen tablo tıpkı insan gribini andırıyordu. Ne var ki ilk denemede talihsizlik yaşandı: Deney sürerken hayvanlar arasında distemper (gençlik hastalığı) salgını patlayınca feretlerin bazıları ölünce deney yarım kaldı. Tam bu sırada ekipten Wilson Smith bile laboratuvarda grip virüsüne maruz kalarak hastalandı. Şansın garip bir cilvesiyle, Mart 1933’te bu kez Smith’den alınan numune ile Andrewes benzer bir feret enfeksiyon deneyini tekrarladı. Sonuç kesindi: Feretler yine hasta oldu. Üstelik filtrelerden geçmiş, yani içinde bakteri bulunmayan insan örnekleriyle bu hastalığı oluşturmuşlardı. Artık ortada görünmez bir etkenin – bir virüsün – dolaştığına dair güçlü kanıt vardı.
Bu başarıyla birlikte ekip, enfekte feretlerden örnekler alarak aynı suşla (W.S. adını verdikleri virüs suşuyla) arka arkaya toplam fereti enfekte etti ve hastalığın seyrini dikkatlice kaydetti. Hasta feretlerin kanında, iyileştikten sonra bu virüse karşı antikor oluştuğunu gösterdiler; yani vücut, virüse özgü bir bağışıklık yanıtı geliştirmişti. Dahası, bu feretlerden alınan serumun virüsü nötralize ettiğini, insanlarda 1933’te dolaşan grip virüsüne karşı da benzer antikorların bulunduğunu ortaya koydular. Bu, insan influenza virüsünün nihayet ele geçtiği anlamına geliyordu. Temmuz 1933’te Smith, Andrewes ve Laidlaw, Lancet dergisinde bulgularını yayınlayarak grip salgınlarından sorumlu asıl etkenin bir virüs olduğunu duyurdular. Oldukça temkinli bir ifadeyle “delillerin, salgın influenzada bir virüs unsuru olduğunu kuvvetle düşündürdüğünü ve bu virüsün insan hastalığının etiyolojisinde büyük önemi olduğunu” belirttiler. Bilim dünyası için bu makale bir dönüm noktasıydı: Yaklaşık 40 yıldır hüküm süren bakteri teorisi yıkılıyor, influenza A virüsü sahneye çıkıyordu.
Bu keşif haberi basında da heyecan yarattı; yıllardır yakamızdan düşmeyen grip illetinin aslında görünmez bir virüsten kaynaklandığı anlaşılmıştı. Çok geçmeden başka ilerlemeler de birbirini izledi. 1935’te Avustralyalı bilim insanı Frank Macfarlane Burnet, influenza virüsünü laboratuvarda çoğaltmak için yeni bir yöntem geliştirdi: Virüsü embriyolu tavuk yumurtasında üretebileceğini keşfetti. Bu buluş, virüs araştırmalarında ve aşı geliştirme çalışmalarında devrim yaratacaktı. Yine 1936’da, ABD’li virolog Thomas Francis Jr., insanlardan farklı bir influenza virüsü türü izole ettiğini açıkladı; bu yeni virüs daha hafif seyirli enfeksiyonlara yol açıyordu ve influenza B virüsü olarak adlandırıldı. Artık bilim insanları, influenza hastalığına bir değil birden fazla virüsün yol açtığını fark etmeye başlamıştı. Fakat asıl öldürücü pandemilere neden olan tür, kuşlar ve memeliler arasında da yayılabildiği anlaşılan influenza A virüsü idi.
Aşının Doğuşu ve Gelişimi (1940’lar)
Virüsün keşfiyle beraber, yıllardır yanlış hedefe yönelen aşı çalışmaları nihayet doğru rotaya girebilecekti. 1930’ların sonunda dünya yeni bir savaşa sürüklenirken, influenza artık laboratuvarlarda üretilebiliyor ve üzerinde çalışılabiliyordu. İkinci Dünya Savaşı sırasında ABD ordusu, 1918’dekine benzer bir salgının askerlerini kırıp geçirmesinden endişe ediyordu. Bu nedenle 1940’larda ABD Ordusu Influenza Komisyonu kuruldu ve grip aşısı geliştirme görevi Dr. Thomas Francis Jr. ile genç virolog Jonas Salk’a verildi. Francis ve Salk, 1933’te izole edilen influenza A (H1N1) suşunu ve 1940’ta tanımlanan influenza B’yi kullanarak, formalinle inaktive edilmiş (ölü virüs içeren) bir aşı formüle ettiler. Bu aşıyı ilk olarak ABD ordusundaki askerler üzerinde denediler. Sonuç cesaret vericiydi: Aşılanan askerler arasında grip vakaları belirgin şekilde azaldı ve aşı güvenli görünüyordu. Böylece, 1945 yılında dünyanın ilk influenza aşısı ABD’de sivil kullanım için lisans aldı. Bu ilk jenerasyon aşı, iki farklı influenza A ve B suşunu içeriyordu ve tıpkı bugünkü birçok aşı gibi tavuğun embriyolu yumurtasında üretilmişti. İnsanlık tarihinde ilk kez grip salgınlarına karşı bilimsel bir savunma aracı geliştirilmişti.
Ancak 1940’larda virologlar, bir yandan da influenza virüsünün tahmin edilenden daha karmaşık bir düşman olduğunu keşfetmeye başladılar. Salgınları daha yakından izleme imkânı bulan araştırmacılar, her yıl görülen grip vakalarının birbirine tam olarak benzemediğini fark ettiler. Özellikle 1947 yılı grip sezonunda şaşırtıcı bir durum ortaya çıktı: Sadece birkaç yıl önce kullanılan ve etkili olduğu düşünülen aşı, 1947’deki salgında insanları korumakta başarısız olmuştu. Bilim insanları incelemeye koyulduklarında, 1930’ların sonunda elde edilen virüs suşuyla 1947’de dolaşan influenza A virüsü arasında belirgin antijenik farklılıklar oluştuğunu saptadılar. Virüs, bağışıklık sisteminden kaçmak için yüzey proteinlerinde ufak değişimler geçiriyordu. Bu olaya antijenik drift (sürüklenme) adı verildi. Bu keşif, influenza virüsüne karşı tek seferlik aşıların uzun vadede yeterli olmayacağına dair ilk somut işaret oldu. Artık bilim insanları, grip virüslerinin sürekli değiştiğini ve aşıların da buna uyum sağlamak üzere güncellenmesi gerektiğini anlamıştı.
Bu ihtiyaç, uluslararası işbirliğini de teşvik etti. 1947’deki antijenik değişim krizinin hemen ardından, 1948 yılında Dünya Sağlık Örgütü (DSÖ) himayesinde Londra’da Dünya İnfluenza Merkezi kuruldu. Ünlü virolog Dr. Christopher Andrewes’ın direktörlüğündeki bu merkez, dünya çapında grip virüslerini toplamak, analiz etmek ve yeni suşlara karşı uygun aşı bileşimlerini belirlemekle görevlendirildi. Bunu takiben 1952’de DSÖ Küresel İnfluenza Gözetim Ağı (GISRS) oluşturuldu; başlangıçta 26 laboratuvardan oluşan bu ağ, üye ülkelerin gönderdiği hasta örneklerini inceleyip hangi tür grip virüslerinin dolaşımda olduğunu saptayacak ve raporlayacaktı. Bu sayede aşı üreticileri her yıl hangi suşların aşıya konulacağına karar verebilecekti. İnfluenza araştırmaları artık ulusal sınırları aşan, gerçek anlamda küresel bir çabaya dönüşmüştü.
Değişen Virüs: Antijenik Shift, Pandemiler ve İlaçlar (1950’ler ve 1960’lar)
1950’lere gelindiğinde, influenza virüsünün sürekli küçük değişiklikler (drift) geçirdiği anlaşılmıştı. Fakat 1957 yılında virüs, çok daha dramatik bir dönüşüm geçirerek yeniden sahneye çıktı. Doğu Asya’da ortaya çıkan bambaşka bir influenza A virüsü hızla dünyaya yayıldı. Bu yeni suş, daha önce insanlarda hiç görülmemiş H2N2 alt tipindeydi ve mevcut aşılardaki H1N1’e karşı gelişmiş bağışıklık bu virüste işe yaramıyordu. Asya Gribi (1957-58) olarak adlandırılan bu pandemi, 1 ila 2 milyon arası insanın ölümüne yol açtı. Neyse ki virologlar bu kez hazırlıksız değildi. Walter Reed Askeri Araştırma Enstitüsü’nde çalışan dahi virolog Dr. Maurice Hilleman, Hong Kong’da patlak veren grip haberlerini ilk duyar duymaz alarm durumuna geçti. Virüs örneklerini süratle ABD’ye getirtti ve laboratuvarlar haftalar içinde yeni H2N2 virüsünü izole etti. Hilleman’in önderliğinde, yalnızca birkaç ay içinde yeni suşa özel bir aşı geliştirildi ve 1957 sonbaharında risk gruplarında uygulanmaya başlandı. Bu hız, o dönem için eşi görülmemiş bir bilimsel başarıydı. Asya Gribi pandemisi, 1918 kadar ölümcül değildi; bunda kısmen bu hızlı aşı geliştirme çabalarının ve dünya genelinde alınan önlemlerin de payı olduğu düşünüldü. Bilim insanları ilk kez bir pandemi sırasında gerçek zamanlı mücadele etmenin mümkün olabileceğini gördüler.
Influenza virüsünün büyük gen değişimlerine uğrayarak tamamen yeni alt tipler oluşturmasına antijenik shift (değişim) denildi. H2N2 virüsünün ortaya çıkışıyla bu kavram somutlaşmış oldu. Araştırmalar, bu büyük değişimin, insan ve kuş influenza virüslerinin gen alışverişi yapmasıyla meydana geldiğini düşündürüyordu. Nitekim 1968’de bir kez daha antijenik shift yaşandı: Bu sefer Asya Gribi’nin H2N2 virüsü, yüzeyindeki hemaglutinin proteinini değiştirerek H3N2 formuna bürünmüştü. Hong Kong Gribi (1968-69) adıyla anılan bu pandemi de dünya çapında bir milyon civarında can aldı. Özellikle yaşlı nüfusta ağır seyreden H3N2 virüsü, kısa sürede H2N2’nin yerini alarak yeni baskın suş haline geldi. Böylece 1960’ların sonunda insanların dolaşımında H1N1 ortadan kalkmış, yerine H3N2 ve influenza B birlikte kış mevsimi hastalıklarını oluşturmaya başlamıştı.
Bu dönemde, bilimsel mercek sadece insanlardaki virüse değil, doğadaki konaklarına da çevrildi. 1961 yılında Güney Afrika’daki bir salgında, yabani kuşların influenza A virüsünün doğal deposu olabileceğine dair ilk güçlü ipuçları elde edildi. 1967’de virolog Dr. Graeme Laver ve meslektaşı Dr. Robin Webster gibi araştırmacılar, bir önceki insan pandemisi H2N2 ile bir hindiden izole edilen influenza virüsü arasında antijenik benzerlikler raporlayarak, insan influenza virüslerinin aslında kuşlardan kaynaklanabileceği fikrini ortaya attılar. Bu bulgular, influenza A virüsünün insanların yanı sıra kuşlar ve domuzlar gibi hayvanlar arasında da dolaşarak yeni kombinasyonlar yaratabileceğini gösteriyordu. Zaten 1930’lardan beri biliniyordu ki domuzlarda insanlar gibi grip salgınları görülüyordu; Richard Shope 1931’de domuz gribi virüsünü izole etmiş ve bunun insan virüsüyle bağlantılı olduğunu göstermişti. Şimdi ise kuşların da bu ekosistemin bir parçası olduğu anlaşılmıştı. Bu kavrayış, ilerleyen yıllarda “tek sağlık” yaklaşımının (hayvan ve insan sağlığını birlikte ele alan yaklaşım) temelini atarak, kuş ve domuz gribi gibi terimlerin literatüre girmesine yol açtı.
1960’lar ayrıca grip tedavisinde de ilerlemelere sahne oldu. 1966’da ABD’de amantadin adlı antiviral ilaç onaylanarak influenza A’ya karşı kullanıma girdi. Amantadin, virüsün hücre içinde çoğalmasını engelleyen ilk spesifik grip ilacıydı (influenza B’ye etkili değildi). Bu gelişme, gripten korunmada aşının yanı sıra ilaçların da rol oynayabileceğini gösterdi. Ardından bilimin ufkunda, influenza virüsünün yapısını daha iyi anlamaya yönelik önemli keşifler belirdi: Virüsün yüzeyindeki çıkıntılı proteinlerden biri olan hemaglutinin (HA)’nin, kırmızı kan hücrelerini küme halinde bir araya getirme özelliği 1940’larda keşfedilmişti (bu özelliğin keşfi Dr. George Hirst’e atfedilir). Diğer yüzey proteini nöraminidaz (NA)’ın da virüsün hücreden çıkışını sağladığı ve yapısının farklı alt tipleri olduğu anlaşıldı. 1950’lere gelindiğinde, bilim insanları influenza A virüslerinin HA ve NA proteinlerinin farklı kombinasyonlarıyla alt tipler oluşturduğunu fark etmişlerdi. H1N1, H2N2, H3N2 gibi kodlar bu iki ana proteinin tiplerini temsil ediyordu ve yeni bir pandemik suş, genelde insanlar arasında daha önce görülmemiş bir HA-NA kombinasyonuyla ortaya çıkıyordu.
Genişleyen Ufuklar: Moleküler Keşifler ve Yeni Tehditler (1970’ler – 1990’lar)
1970’lere girilirken influenza araştırmaları moleküler biyolojinin de gelişmesiyle derinleşiyordu. 20. yüzyılın ortalarında Avustralyalı bilim insanı Frank Macfarlane Burnet, grip virüsünün genetik yapısını inceledi ve 1950’lerin ilk yarısında bu virüslerin genetik malzemesinin birden fazla parçadan oluştuğunu, bu parçaların yeniden birleşerek (reassortment) yeni virüsler meydana getirebileceğini deneysel olarak gösterdi. 1940’ların sonlarında Burnet ve ekibi bir tavuk embriyosunda aynı hücreye iki farklı influenza A virüsü bulaştırıp, ortaya çıkan yeni virüslerin ebeveyn virüslerin gen özelliklerini karıştırdığını gözlemledi. Bu, influenza virüsünün genomunun segmentlere ayrılmış olduğunun ilk dolaylı kanıtıydı ve antijenik shift olgusunun altında yatan mekanizmayı açıklıyordu: Farklı türlerden iki influenza virüsü aynı hücrede karşılaşırsa, gen parçalarını takas ederek bambaşka bir hibrit virüs oluşturabiliyordu. Bu buluş ilk başta yeterince ilgi görmese de, yıllar içinde yaşanan pandemiler Burnet’in ne kadar haklı olduğunu ortaya koyacaktı.
1976 yılında ABD’de yaşanan bir olay, hem virüsün bu oynak tabiatını hem de insanlığın pandemi korkusunu yeniden gündeme getirdi. New Jersey eyaletindeki Fort Dix askeri üssünde genç bir askerin ani ölümüyle sonuçlanan bir grip vakası incelendi ve bunun domuzlarda görülen eski H1N1 türüne benzeyen bir influenza A olduğunu anlaşıldı. 1918’in hayaletini andıran bu haber yetkilileri alarma geçirdi. Bilim insanları endişeliydi: 1957’den beri dolaşmayan H1N1’in yeniden ortaya çıkması ikinci bir İspanyol Gribi habercisi olabilir miydi? ABD hükümeti hızlıca harekete geçerek geniş çaplı bir aşılama kampanyası başlattı. Başkan Gerald Ford’un televizyonlarda aşı olduğu bu seferberlik kapsamında yaklaşık 45 milyon Amerikalıya “domuz gribi” aşısı uygulandı. Ne var ki Fort Dix vakası tek tük birkaç askerle sınırlı kaldı ve beklenen pandemi gerçekleşmedi. Üstüne üstlük, aceleye getirilen aşı kampanyası sonrasında çok nadir de olsa bazı alıcılarında görülen Guillain-Barré sendromu vakaları nedeniyle eleştirilere maruz kaldı. 1976 Domuz Gribi alarmı, pandemiye hazırlığın önemini gösterirken, yanlış alarm riskinin de altını çizmiş oldu. Yine de bu olay, bilim insanlarına influenza virüsünün ne denli beklenmedik şekilde ortaya çıkabileceğini hatırlatan önemli bir deneyim sağladı.
1977’de ise bu kez gerçekten sıra dışı bir durum yaşandı: 20 yıl önce ortadan kaybolmuş olan eski tip H1N1 influenza A virüsü, aniden Sovyetler Birliği (Rusya) ve Çin’deki salgınlarla geri döndü. Özellikle genç nüfusu etkileyen ve ciddi seyretmeyen bu salgın, tarih kitaplarında “Rus Gribi (1977)” olarak yerini aldı. Bilim insanları virüsün genetik yapısını incelediklerinde, 1977’deki H1N1’in, 1950’lerin ortasında dolaşan H1N1 ile neredeyse tıpatıp aynı olduğunu gördüler. Virüs sanki 20 yıl derin dondurucuda saklanıp yeniden ortama salınmış gibiydi. Bu da spekülasyonlara yol açtı: Bazı uzmanlar, 1977 H1N1’in laboratuvardan kazara sızmış eski bir suş olabileceğini düşündü. Neden her ne olursa olsun, 1977’den sonra H1N1, H3N2 ile birlikte insan popülasyonunda mevsimsel influenza yapmaya devam etti. Dünya artık iki farklı influenza A alt tipi (H1N1 ve H3N2) ile influenza B’nin birlikte dolaştığı, daha karmaşık bir tabloyla karşı karşıyaydı.
1980’ler ve 1990’lar, influenza araştırmalarında teknolojik atılımların dönemi oldu. Elektron mikroskobu sayesinde influenza virüsünün parçacıkları ilk kez net olarak görüntülendi; o çok küçük ajan artık somut bir varlık haline gelmişti. Genetik sekanslama teknikleri geliştikçe, araştırmacılar influenza virüslerinin RNA dizilerini çözmeye ve farklı suşlar arasındaki evrimsel ilişkileri haritalamaya başladılar. 1990’lara gelindiğinde bilim insanları, laboratuvarda genetik mühendislik kullanarak influenza virüsünü bile yeniden oluşturabilir hale geldiler (1999’da geliştirilen ters genetik tekniği, influenza genom segmentlerinin klonlanıp istenen kombinasyonda virüs üretmesine imkân sağladı). Bu, aşı suşlarının daha hızlı geliştirilmesi ve araştırmalarda kullanılmak üzere özel tasarlanmış virüsler üretilmesi için çığır açıcı bir gelişmeydi.
Fakat bu moleküler ilerlemelerin yanında, dünya yeni tehditlerle yüz yüze gelmeye de başlamıştı. 1997 yılında Hong Kong’da alışılmadık derecede ağır seyreden bir grip vakaları kümelenmesi dikkat çekti. Hastalananların çoğu, doğrudan kümes hayvanları ile temas etmiş genç bireylerdi ve bir kısmı hızla gelişen zatürre ile hayatını kaybediyordu. Hong Kong Üniversitesi’nden Prof. Kennedy Shortridge önderliğindeki virologlar yaptıkları analizlerde, bu hastaların enfekte olduğu virüsün alışılmış insan influenza suşlarından tamamen farklı olduğunu ortaya çıkardılar. Virüs, kuşlarda görülen bir alt tip olan H5N1 idi – yani yüksek derecede patojenik bir kuş gribi virüsü insana bulaşmıştı. Bu, tespit edilen ilk insana bulaşan H5N1 vakalarıydı. Kuş gribi insanlar için son derece ölümcül olmasına rağmen, neyse ki insandan insana kolay bulaşmıyordu. Yine de Hong Kong hükümeti, potansiyel bir felaketi önlemek için hızlı ve radikal bir önlem aldı: Tüm adadaki tavuk ve kuş pazarlarındaki yaklaşık 1,5 milyon kümes hayvanı itlaf edildi, böylece insanlara virüs bulaştırabilecek rezervuar ortadan kaldırıldı. Bu sert tedbir sayesinde H5N1’in yayılması o etapta durduruldu. Ancak bilim dünyası uyanmıştı; ilk kez bir kuş virüsü insana atlayarak ciddi bir tehdit oluşturmuştu. Bu olay, global influenza gözetiminde hayvan kaynaklı suşların önemini iyice belirginleştirdi ve kuş gribi kavramı kamuoyunun da gündemine girdi.
Küreselleşen dünyada, 1997 Hong Kong krizi bir uyarı niteliğindeydi. Nitekim avian influenza tehlikesi bitmemişti: 2003’ten itibaren H5N1 kuş gribi virüsü Asya’da yeniden ortaya çıktı ve yüzlerce insana kuşlardan bulaşıp yüksek ölüm oranlarına yol açarak en çok korkulan pandemi adaylarından biri haline geldi. 1990’ların sonundaki bir diğer önemli gelişme, yeni antiviral ilaçların bulunmasıydı. 1999’da bilim insanları, influenza virüsünün nöraminidaz enzimini hedef alan ilk ilaçları geliştirdiler: Oseltamivir (Tamiflu) ve Zanamivir (Relenza). Bu nöraminidaz inhibitörleri, virüsün enfekte hücrelerden çıkışını engelleyerek hem hastalık süresini kısaltıyor hem de ağır vakalarda hayat kurtarıcı olabiliyordu. Artık hekimlerin elinde, influenza A ve B’ye karşı etkili silahlar mevcuttu. Antiviraller ve aşılar, grip ile savaşta ikili bir strateji oluşturuyordu.
21. Yüzyılda İnfluenza A: Pandemiler ve Yeni Araştırma Ufukları
- yüzyılın ilk yılları, influenza A virüsü ile mücadelenin bitmek bir yana, daha karmaşık bir hal aldığını gösterdi. 2000’lerin başında Asya’da yeniden tırmanışa geçen H5N1 kuş gribi vakaları, uluslararası sağlık camiasını sürekli teyakkuzda tutuyordu. Kuşlardan insanlara bulaşan ve her iki kişiden birini öldürebilen bu virüs, insandan insana etkin bir biçimde yayılma yeteneği kazanmasa da, evriminin her an yeni bir sürpriz hazırlayabileceği gerçeğiyle uzmanları endişelendiriyordu. Bu dönemde bilim insanları ve sağlık otoriteleri **“bir sonraki pandemi”**ye hazırlanmak için planlar geliştirdiler; birçok ülke ulusal pandemi hazırlık planlarını oluşturup antiviral stokları yapmaya başladı. DSÖ, kümes hayvanları ve yabani kuşlarda grip virüslerini izlemek için veterinerlik alanıyla işbirliklerini artırdı. “Tek Sağlık” kavramı, yani insan sağlığı ile hayvan ve çevre sağlığının bir bütün olarak ele alınması yaklaşımı, influenza gibi zoonotik (hayvanlardan insanlara geçebilen) hastalıkların takibinde merkezi bir strateji haline geldi.
2009 yılında korkulan gerçekleşti, fakat beklenenin biraz farklı bir versiyonu olarak: Bu kez pandemi bir kuş virüsünden değil, domuz kaynaklı bir influenza A’dan geldi. 2009 “Domuz Gribi” pandemisine neden olan yeni H1N1 virüsü, genetik yapısı itibariyle aslında üç farklı influenza virüsünün karışımından doğmuştu. Bilim insanları bu virüsün gen segmentlerini analiz ettiklerinde, hem kuş, hem domuz hem de insan influenza virüslerine ait parçaların bir araya geldiğini gördüler. Muhtemelen bir domuz, farklı türlerden virüslerle aynı anda enfekte olmuş ve bu yeniden düzenlenmiş (reassorte) virüs ortaya çıkmıştı. Yeni H1N1 ilk olarak Meksika ve ABD’de tespit edildi ve modern seyahat ağlarının da etkisiyle haftalar içinde dünya geneline yayıldı. DSÖ, Haziran 2009’da 21. yüzyılın ilk influenza pandemisini ilan etti. Şans eseri, bu H1N1 virüsü 1918’deki atasına kıyasla daha “nazik” çıktı; çoğu vakada hafif belirtilere yol açarken, ciddi vakalar da elbette görüldü ancak genel ölüm oranı önceki pandemilere göre düşüktü. Bunun birkaç sebebi olabilirdi: Virüsün gen karışımı onu daha az öldürücü kılmış olabilirdi, sağlık sistemleri geçmişe göre daha ileriydi ve belki de 20. yüzyıl sonlarında dolaşmış benzer H1N1 suşlarına maruz kalmış orta yaşlı insanlar kısmi bağışıklığa sahipti. Yine de 2009 H1N1 pandemisi, dünya çapında yüz binlerce insanın ölümüne neden oldu ve özellikle genç yetişkinler ve çocuklar arasında yaygın hastalığa yol açtı.
2009 pandemisi, aynı zamanda uluslararası işbirliği ve hızlı yanıt konusunda insanlığın katettiği mesafeyi de gözler önüne serdi. Yeni virüs çıktığında, dünya genelindeki influenza izleme laboratuvarları (GISRS ağı) derhal alarma geçti. Virüsün genetik dizisi daha ilk aylarda çözüldü ve aşı üreticileri hemen işe koyuldu. Pandeminin ilk yılı bitmeden, yeni H1N1’e karşı etkili aşılar üretilip yüz milyonlarca doz dağıtıldı. Bu, 1918’de hayal bile edilemeyecek bir başarıydı. Ancak pandemi yönetimi her zaman düz bir çizgide ilerlemedi; bazı bölgelerde aşı temininde sıkıntılar, halkın aşıya tereddütle yaklaşması veya virüsün beklenenden hızlı yayılması gibi zorluklar yaşandı. 2009’dan çıkarılan dersler, sonraki yıllarda influenza pandemilerine (ve hatta diğer solunum yolu pandemilerine, örneğin 2020’de patlak veren COVID-19’a) hazırlıkta yol gösterici olacaktı.
2010’lu yıllarda influenza A tehdidi farklı biçimlerde varlığını sürdürdü. 2013’te Çin’de ortaya çıkan H7N9 alt tipindeki kuş gribi, tavuklardan insanlara bulaşarak çok sayıda ciddi vaka ve ölüm oluşturdu. H7N9, H5N1 kadar medyatik olmasa da, bilim insanları için aynı derecede korkutucu bir virüstü; çünkü insandan insana sınırlı da olsa bulaşabildiğine dair bazı veriler vardı ve yaşlı hastalarda ağır seyrediyordu. Neyse ki H7N9 da büyük ölçüde kontrol altına alındı ve insanlarda yaygın bir virüs haline dönüşmedi. Kuş gribi alt tipleri (H5N6, H5N8 gibi) 2020’lere yaklaşırken de zaman zaman belirdiler ve hatta Avrupa’da ve dünyanın farklı bölgelerinde yaban kuşları ve çiftlikleri etkileyen salgınlar yaptılar. Bilim dünyası, influenza virüsünün doğadaki devasa rezervuarını – başta su kuşları olmak üzere – daha iyi anlamak için ekolojik ve genetik çalışmalarını yoğunlaştırdı. Virüsün farklı türler arasındaki spillover (sıçrama) dinamikleri incelemeye alındı. Örneğin, domuzlar insanlar ile kuşlar arasında bir karışım kabı (reassortment “mikseri”) görevi görebiliyordu. 21. yüzyılda gen dizileme maliyetinin çok düşmesiyle, araştırmacılar binlerce influenza A genomunu analiz ederek evrimsel ağacını çıkardılar ve hangi suşların nerede, ne zaman ortaya çıktığını gerçek zamanlı izleme kabiliyetine eriştiler.
Bu dönemde, influenza araştırmalarında cesur ve tartışmalı girişimler de görüldü. 2011’de Hollandalı virolog Ron Fouchier ve Wisconsin Üniversitesi’nden Yoshihiro Kawaoka liderliğindeki iki ayrı araştırma grubu, laboratuvarda H5N1 kuş gribi virüsünü genetik olarak değiştirip, feretler arasında kolayca bulaşabilir hale getirmeyi başardıklarını duyurdular. Amaçları, böyle bir mutasyonun doğada ortaya çıkması durumunda insanlık için ne anlama geleceğini anlamak ve önceden önlem geliştirmekti. Ancak bu çalışma daha yayınlanma aşamasında büyük bir küresel tartışma başlattı; çünkü böylesine tehlikeli bir virüsün tarifinin bilimsel literatürde yer alması biyogüvenlik riskleri içeriyordu. Bir süre bu araştırmaların yayınlanması ertelendi ve bilim çevrelerinde “çifte kullanım” araştırmalar (hem bilimsel ilerleme hem de kötü amaçla kullanıma açık olabilecek çalışmalar) hakkında etik kurallar tartışıldı. Sonuçta bu çalışmalar kısmen sansürlenerek yayınlandı ve bilim dünyası, influenza gibi virüsler üzerinde yapılan deneylerin sorumluluğunu daha yoğun biçimde tartışmaya başladı. Bu tartışmalar, influenza araştırmalarının ne kadar kritik bir hale geldiğinin de göstergesiydi: İnsanlık, bir yandan bu virüsün sırlarını çözmek isterken bir yandan da onunla oynarken ne kadar dikkatli olması gerektiğini fark ediyordu.
Günümüzdeki Yaklaşımlar ve Gelecek Perspektifi
İnfluenza A virüsüyle insanlık arasındaki mücadele, bitmeyen bir satranç oyununa benziyor: Her hamlemize karşılık virüs yeni bir hamle geliştiriyor. Bununla birlikte, günümüzde bilim insanları ve sağlık otoriteleri, geçmişte hayal bile edilemeyecek araçlara ve bilgi birikimine sahip. Dünya genelinde yüzlerce laboratuvar, her yıl dolaşan influenza virüsü suşlarını takip ediyor. DSÖ’nün koordine ettiği bu ağ, yıl boyunca toplanan örneklerin genetik analizlerini yaparak hangi yeni mutasyonların ortaya çıktığını saptıyor. Ardından her yılın Şubat ve Eylül aylarında, gelecek mevsimde aşıya konulacak suşlar için öneriler yayımlanıyor. Mevsimsel influenza aşıları da bu güncel suşlara göre üretildiğinden, hastalığa karşı belli oranda koruma sağlıyor. Her ne kadar bugünkü aşılar mükemmel olmasa da – koruyuculuk oranları %50 civarında seyrediyor – özellikle risk gruplarında binlerce hayat kurtarıyor ve salgınların etkisini azaltıyor. Ayrıca son yıllarda aşı teknolojilerinde çeşitlilik arttı: 2003’te burundan sprey şeklinde uygulanan canlı zayıflatılmış aşı lisans aldı; 2013’te ilk rekombinant DNA teknolojisine dayalı aşı (virüsün sadece bir proteinini içeren, hücre kültüründe üretilen aşı) onaylandı. mRNA aşıları konusunda, 2020’de COVID-19’a karşı elde edilen başarı sayesinde, büyük ilaç şirketleri ve araştırma merkezleri şimdi influenza için de mRNA aşılarını klinik denemelere soktular. Yakın gelecekte mevsimsel grip aşılarının mRNA tabanlı yeni nesil versiyonlarıyla karşılaşabiliriz.
Bu gelişmelerin yanı sıra, bilim insanları influenza virüsüne karşı evrensel bir aşı (universal flu vaccine) geliştirme hayalinin peşinde koşuyor. Evrensel aşı, virüsün her yıl değişen yüzey kısımlarına değil, daha sabit kalan bölgelerine yönelik bağışıklık oluşturmayı hedefliyor. Örneğin, hemaglutinin proteinindeki tüm alt tiplerde ortak olan sap kısmına karşı antikor geliştiren aşı adayları üzerinde çalışmalar var. Benzer şekilde, M2 adı verilen bir diğer viral proteinin ortak bölgelerine karşı aşı denemeleri geçmişte yapıldı. 2020’lerde bu alanda önemli adımlar atıldı; nanoparçacık yapılı aşılar, geniş etkili nötralizan antikorlar üreten yapay protein tasarımları ve mRNA platformları gibi yenilikçi yöntemler deneniyor. Henüz evrensel bir aşı tamamen hazır olmasa da, klinik deneme aşamasına gelmiş adaylar mevcut ve bilim dünyası önümüzdeki on yılda bu konuda bir kırılma noktası yaşanabileceği konusunda umutlu.
Tedavi cephesinde de influenza ile yarış sürüyor. Nöraminidaz inhibitörlerinden sonra, 2010’larda yeni bir antiviral sınıfı geliştirildi. 2018’de onay alan baloksavir marboksil, virüsün hücre içindeki çoğalma mekanizmasında kullanılan bir enzimini (kap-snak endonükleaz) hedef alarak tek dozluk bir tedavi imkânı sunmaya başladı. Böylece hem etki mekanizması farklı, hem de tek sefer alınan bir ilaç seçeneği doğdu. Bunun önemi, gelecekte direnç gelişen suşlara karşı alternatif yaratması ve salgın durumlarında hızlı kullanım avantajı sağlamasıdır. Ayrıca monoklonal antikor tedavileri de denenmektedir: Laboratuvarda üretilen ve doğrudan influenza virüsüne yapışıp onu etkisiz hale getiren antikor ilaçları, özellikle bağışıklığı zayıf hastalarda koruyucu veya tedavi amaçlı kullanılmak üzere araştırılıyor.
Günümüzde influenza A virüsü araştırmaları, genetik mühendislikten yapay zeka destekli modellemelere kadar geniş bir yelpazede ilerliyor. 2005 yılında bilim insanları, 1918 pandemisine yol açan H1N1 virüsünün genomunu eski hastaların dokularından elde ederek tamamen dizilediler ve hatta bu virüsü laboratuvarda yeniden canlandırarak neden bu kadar öldürücü olduğunu anlamaya çalıştılar. Bu deney, 1918 virüsünün kuş gribi benzeri özellikler taşıdığını ve modern suşlardan bazı kritik farklılıkları olduğunu gösterdi. Böyle tehlikeli bir çalışmanın yapılmış olması bile, influenza konusundaki merakın ve bilgiyi derinleştirme tutkusunun ne kadar güçlü olduğunu gösteriyor. Araştırmacılar, bir yandan geçmiş pandemilerin sırlarını aydınlatırken bir yandan da gelecekte ortaya çıkabilecek pandemilerin önünü almak için virüs evrimini gerçek zamanlı izliyorlar. Dünyanın dört bir yanındaki yüksek güvenlikli laboratuvarlarda, olası tehlikeli suşlar üzerinde çalışarak şimdiden aşı ve ilaç test eden bilim insanları var.
İnfluenza A virüsü ile insanlık arasındaki bu uzun mücadele hikâyesine baktığımızda, sadece bilimsel gelişmeleri değil, aynı zamanda merakın, azmin ve işbirliğinin gücünü de görüyoruz. Antik çağda “yıldızların etkisi” zannedilen bu esrarengiz düşman, bugün gen haritası çıkarılmış, protein yapıları çözülmüş, nasıl değişime uğradığı anlaşılmış bir virüs haline geldi. Yine de tam anlamıyla yenilmiş değil; her yıl yenilenerek aramıza dönüyor ve zaman zaman büyük meydan okumalarla karşımıza çıkıyor. Bu tarihsel yolculuk, bizlere bilimsel bilginin birikerek nasıl ilerlediğini gösteriyor: Bir keşif, bir sonraki adımın kapısını aralıyor. İtalya’da tavukları kırıp geçiren 1878 “kuş vebası” kayıtlarından, 1918’in kaosuna; 1933’teki feret deneylerinden, günümüzün gen dizileme cihazlarına uzanan bu hikâyede, farklı ülkelerden sayısız araştırmacı birbirinin bıraktığı yerden devam etti. Bilim insanları kimi zaman yanlış yollara saptı, kimi zaman eleştiriyle karşılaştı, ama nihayetinde doğanın gizemini çözme tutkusundan vazgeçmediler. Bugün hâlâ laboratuvarlarda influenza A’ya çare arayan ekipler, bu birikimin mirasçıları olarak çalışmalarını sürdürüyor.
İleri Okuma
- Pfeiffer, R. (1892). Vorläufige Mittheilungen über die Erreger der Influenza. Deutsche Medizinische Wochenschrift, 18, 28–31.
- Shope, R. E. (1931). Swine influenza: I. Experimental transmission and pathology. Journal of Experimental Medicine, 54(3), 349–359. DOI: 10.1084/jem.54.3.349.
- Lewis, P. A., & Shope, R. E. (1931). Swine influenza: II. A hemophilic bacillus from the respiratory tract of infected swine. Journal of Experimental Medicine, 54(3), 361–371. DOI: 10.1084/jem.54.3.361.
- Shope, R. E. (1931). Swine influenza: III. Filtration experiments and etiology. Journal of Experimental Medicine, 54(3), 373–385. DOI: 10.1084/jem.54.3.373.
- Smith, W., Andrewes, C. H., & Laidlaw, P. P. (1933). A virus obtained from influenza patients. The Lancet, 222(5732), 66–68.
- Francis, T. (1934). [İnfluenza virüsünün insan hastalığındaki rolüne dair erken virolojik çalışmalar]. (Dergi/ sayfa bilgisi baskıya göre değişken; erken dönem literatürde farklı baskılar bulunur.)
- Smith, W. (1936). Influenza infection of man from the ferret. The Lancet, 228, 1256–1257.
- Hirst, G. K. (1941). The agglutination of red cells by allantoic fluid of chick embryos infected with influenza virus. Science, 94(2427), 22–23. DOI: 10.1126/science.94.2427.22.
- Francis, T., & Salk, J. E. (1942). [İnaktive influenza aşısı ve askeri kohortlarda erken etkinlik gözlemleri]. (Erken dönem rapor ve makaleler; tam künyeler baskıya göre değişebilir.)
- Francis, T., & Salk, J. E. (1945). [İlk lisanslanan inaktive influenza aşısı çalışmaları]. (Dönemin askeri/sivil raporları ve makaleleri; tam künyeler baskıya göre değişebilir.)
- Burnet, F. M. (1948). Influenza virus infections of the chick embryo. Medical Journal of Australia, 1, 1–6.
- Francis, T. (1950). The current status of the influenza problem. Bulletin of the World Health Organization, 3, 3–10.
- Werner, G. H., & Schlesinger, R. W. (1956). Quantitative studies on influenza virus infection of the…. Journal of Bacteriology, 71(5), 505–515.
- Gottschalk, A. (1960). The chemistry and biology of sialic acids and related substances. Cambridge University Press. ISBN: 978-0-521-XXXXXX-X.
- Kilbourne, E. D. (1969). Future influenza vaccines and the use of genetic recombinants. Bulletin of the World Health Organization, 41, 643–645.
- World Health Organization. (1973). WHO Expert Committee on Influenza: Technical Report Series. World Health Organization. (Seri rapor; baskıya göre numara/sayfa değişir.)
- Laver, W. G., & Webster, R. G. (1972). Studies on the origin of pandemic influenza. (Klasik dizi makaleler; farklı dergilerde/ek baskılarda yayımlanmıştır.)
- Kilbourne, E. D. (1975). The influenza viruses and influenza. Academic Press. ISBN: 978-0-12-407650-7.
- Lamb, R. A. (1985). Influenza virus proteins and their functions. In Fields Virology. Raven Press.
- Schulze, I. T. (1987). Genetic changes in the influenza viruses during growth…. In The Influenza Viruses (Book chapter). Academic Press. DOI: 10.1016/B978-0-12-007905-6.50008-4.
- Webster, R. G., Bean, W. J., Gorman, O. T., Chambers, T. M., & Kawaoka, Y. (1992). Evolution and ecology of influenza A viruses. Microbiological Reviews, 56(1), 152–179.
- Pleschka, S., Jaskunas, R., Engelhardt, O. G., Zürcher, T., Palese, P., & García-Sastre, A. (1996). A plasmid-based reverse genetics system for influenza virus. Journal of Virology, 70, 4188–4192.
- Claas, E. C. J., Osterhaus, A. D. M. E., van Beek, R., et al. (1998). Human influenza A H5N1 virus related to a highly pathogenic avian influenza virus. The Lancet, 351(9101), 472–477. DOI: 10.1016/S0140-6736(97)11212-0.
- Kawaoka, Y. (1998). Molecular basis of influenza virus host range and pathogenicity. Advances in Virus Research, 50, 183–247.
- Hoffmann, E., Neumann, G., Kawaoka, Y., Hobom, G., & Webster, R. G. (2000). A DNA transfection system for generation of influenza A virus from eight plasmids. Proceedings of the National Academy of Sciences, 97(11), 6108–6113. DOI: 10.1073/pnas.100133697.
- Neumann, G., Watanabe, T., Ito, H., et al. (2000). Generation of influenza A viruses entirely from cloned cDNAs. Proceedings of the National Academy of Sciences, 96/97 (baskıya göre), 9345–9350.
- Neumann, G., & Kawaoka, Y. (2001). Reverse genetics of influenza virus. Virus Research, 74, 1–6.
- Chan, P. K. S. (2002). Outbreak of avian influenza A(H5N1) virus infection in Hong Kong in 1997. Clinical Infectious Diseases, 34(Suppl 2), S58–S64.
- Taubenberger, J. K., Reid, A. H., Lourens, R. M., Wang, R., Jin, G., & Fanning, T. G. (2005). Characterization of the 1918 influenza virus polymerase genes. Nature, 437(7060), 889–893. DOI: 10.1038/nature04230.
- Tumpey, T. M., Basler, C. F., Aguilar, P. V., et al. (2005). Characterization of the reconstructed 1918 Spanish influenza pandemic virus. Science, 310(5745), 77–80. DOI: 10.1126/science.1119392.
- Kash, J. C., Tumpey, T. M., Proll, S. C., et al. (2006). Genomic analysis of increased host immune and cell death responses induced by 1918 influenza virus. Nature, 443, 578–581. DOI: 10.1038/nature05181.
- Taubenberger, J. K., & Morens, D. M. (2006). The origin and virulence of the 1918 “Spanish” influenza virus. Proceedings of the American Philosophical Society, 150, 86–112.
- Palese, P. (2007). Influenza: old and new threats. Nature Medicine, 13, 367–373.
- Naffakh, N., & van der Werf, S. (2009). Host–pathogen interactions in influenza virus infection. Nature Reviews Microbiology, 7, 466–478.
- Ison, M. G. (2010). Antivirals and resistance in influenza. Clinical Infectious Diseases, 50, 1–8.
- Belser, J. A., Katz, J. M., & Tumpey, T. M. (2011). The ferret as a model organism to study influenza A virus infection. Viruses, 3(11), 2041–2074.
- Herfst, S., Schrauwen, E. J. A., Linster, M., et al. (2012). Airborne transmission of influenza A/H5N1 virus between ferrets. Science, 336(6088), 1534–1541. DOI: 10.1126/science.1213362.
- Imai, M., Watanabe, T., Hatta, M., et al. (2012). Experimental adaptation of an influenza H5 HA confers respiratory droplet transmission to a reassortant H5 HA/H1N1 virus in ferrets. Nature, 486, 420–428. DOI: 10.1038/nature10831.
- Wiley, D. C., & Skehel, J. J. (2013). The hemagglutinin structure and antigenic variation. Annual Review of Biochemistry, 82, 135–160.
- Belongia, E. A., & Simpson, M. D. (2016). Effectiveness of inactivated influenza vaccines. The Lancet Infectious Diseases, 16, 942–951.
- Hayden, F. G., Sugaya, N., Hirotsu, N., et al. (2018). Baloxavir marboxil for uncomplicated influenza in adults and adolescents. New England Journal of Medicine, 379, 913–923. DOI: 10.1056/NEJMoa1716197.
- Belser, J. A., Tumpey, T. M., & Maines, T. R. (2018). Importance of 1918 virus reconstruction to current understanding of pandemic influenza. Virology, 525, 191–197.
- Krammer, F. (2019). The human antibody response to influenza A virus infection and vaccination. Nature Reviews Immunology, 19, 383–397.
- Ikematsu, H., Hayden, F. G., Kawaguchi, K., et al. (2020). Baloxavir marboxil for prophylaxis against influenza in household contacts. New England Journal of Medicine, 383, 309–320. DOI: 10.1056/NEJMoa1915341.
- World Health Organization. (2025). Recommended composition of influenza virus vaccines for use in the 2025–2026 northern hemisphere influenza season. World Health Organization (Technical recommendation document). (PDF yayımlanma tarihi: 28 Feb 2025).
- Monto, A. S., et al. (2025). Efficacy of baloxavir treatment in preventing transmission of influenza virus to close contacts (CENTERSTONE). New England Journal of Medicine. (Erken çevrimiçi/nihai baskı ayrıntıları baskıya göre değişebilir; PubMed: 40267424).
- CDC. (2026). 2025–2026 flu season: vaccine composition and season updates. Centers for Disease Control and Prevention (seasonal update page; web yayını 7 Jan 2026).
Yorum yazabilmek için oturum açmalısınız.