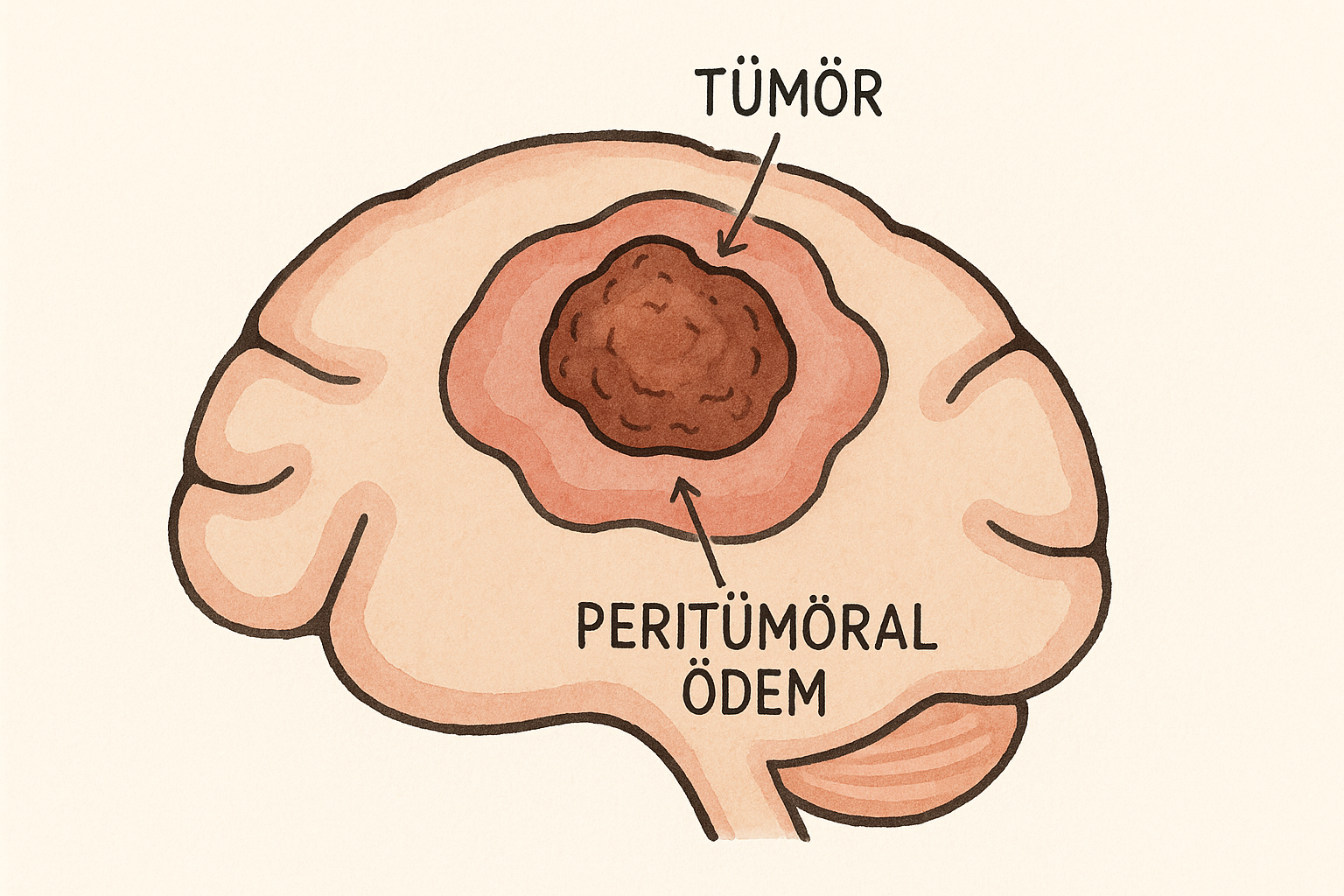
1) Kavramsal Çerçeve
Peritümöral ödem, intrakraniyal tümörlerin (özellikle glioblastom ve belirli menenjiyom alt tiplerinin) çevresindeki parankimde, damar geçirgenliğinin artışı ve bağışıklık hücreleri-glia-endotel etkileşimleri sonucunda biriken sıvıdan doğan, çoğunlukla vazojenik karakterli bir beyin ödemidir. Glioblastomda belirgin neovaskülarizasyon ve VEGF aşırı ekspresyonu, kan-beyin bariyeri (KBB) bütünlüğünü bozarak plazma proteinleri ve suyun ekstrasellüler alana sızmasını kolaylaştırır; bu da T2/FLAIR’de yaygın hiperintens değişiklikler ve klinik olarak baş ağrısı, nöbet, fokal defisit, bilinç değişiklikleri ile intrakraniyal basınç artışına yol açabilir. Menenjiyomlarda ise tümör-beyin ara yüzeyinde araknoid planın bozulması, piyal beslenme, venöz drenaj paternleri, VEGF/anjiyogenez ve stromal/matriks faktörler ödemin ağırlığını belirleyen temel bileşenlerdir.
2) Patofizyoloji: Vazojenik ve Sitotoksik Bileşenler
- Vazojenik ödem: Endotel sıkı bağlantılar (claudin-5, occludin, ZO-1 vb.) ve bazal lamina bütünlüğünün bozulmasıyla albumin-zengin sıvı ekstrasellüler alana geçer. VEGF, anjiopoietinler, MMP’ler ve perisit kaybıyla ilişkili damar olgunlaşma eksikliği KBB sızıntısını derinleştirir.
- Sitotoksik ödem: Enerji yetersizliği ve iyon pompa disfonksiyonu sonucu hücre içi su artışı olur; yüksek dereceli gliomların hipoksik/nekrotik alanlarında odaksal sitotoksik bileşen eşlik edebilir.
- AQP4 (aquaporin-4): Astrosit uç ayaklarında su akışının ana kapısıdır. Deneysel olarak AQP4’ün varlığı vazojenik sıvının uzaklaştırılması için gerekli olabilir; ancak sitotoksik koşullarda su girişini kolaylaştırarak şişmeyi artırabilir. Bu çift yönlü rol, tümör çevresindeki ödemin zamansal-mekânsal seyrini etkiler.
- Mikroçevre ve immün-vasküler eksen: M2-eğilimli mikroglia/makrofajlar, nötrofiller (TAN), mast hücreleri ve T-lenfositler saldıkları proteazlar, reaktif oksijen türleri ve pro-anjiyojenik/permeabilite artırıcı mediatörlerle vazojenik sızıntıyı pekiştirir. Bazı durumlarda nötrofillerin fenotipi (N1 vs N2) antitümöral işlevlere de kayabilir; bu ikili doğa, peritümöral enflamasyonun “yalnızca protümöral” olmadığını gösterir.
3) “Peritümöral Enflamasyon”un Kapsamı
Peritümöral enflamasyon, polimorfonükleer nötrofiller başta olmak üzere myeloid hücrelerin, mikroglianın ve endotel/perisit/astrosit üçgeninin karşılıklı etkileşimleriyle şekillenir. TGF-β ekseni gibi sinyaller nötrofil yönelimi ve fonksiyonunu belirleyerek N2-benzeri proanjiyojenik/propermeabilite fenotiplerini destekleyebilir; TGF-β yolu baskılandığında N1-benzeri antitümöral yanıtlar belirginleşebilir. Bu nedenle enflamasyonun ödem üzerindeki etkisi bağlamsal ve zamansaldır.
4) Tümör Tipine Göre Ayırtılar
- Glioblastom (GBM): Yüksek VEGF, anormal/olgunlaşmamış damar yapısı ve hipoksi-indüklenmiş geçirgenlik artışı ile yaygın vazojenik ödem tipiktir. Ödem, steroid ihtiyacını ve semptom yükünü belirgin etkiler; anti-VEGF/anti-VEGFR tedavileri (örn. bevacizumab, cediranib) ödemi hızla azaltabilir, fakat tümörün biyolojik progresyonunu durdurmadan kontrast tutulumu ve FLAIR sinyalinde “pseudoresponse”a neden olabilir.
- Menenjiyom: Piyal arter beslenmesi, araknoid plan bozukluğu, tümör-beyin kontak yüzeyi, venöz drenaj paternleri ve tümör alt tipi/proliferasyon indeksi (örn. Ki-67) PTÖ (peritümöral ödem) şiddetini öngörebilir. Ödem cerrahi planlamayı, SRS (stereotaktik radyocerrahi) güvenliğini ve postoperatif komplikasyonları doğrudan etkiler.
5) Görüntüleme ile Ayırıcı Özellikler
- MRI temel dizileri:
- T2/FLAIR: Vazojenik ödem yüksek sinyal; sıklıkla kitle etkisiyle birlikte.
- T1-KM: Kontrastlanma damar geçirgenliği ve vasküler yoğunluk hakkında dolaylı ipucu verir; anti-anjiyojenik tedavi sonrası hızlı azalma “pseudoresponse” olabilir.
- DWI/ADC: Sitotoksik bileşende difüzyon kısıtlı (düşük ADC); vazojenik/interstisyel bileşende difüzyon artmış/normal (yüksek/normal ADC).
- Gelişmiş teknikler:
- Dinamik perfüzyon (DSC/DCE), ASL: rCBV/rPH gibi ölçütlerle mikrodamarlanma/anjiyogenez hakkında nicel veri; tedavi yanıtı izleminde değerli.
- Amimoasit PET (MET, FET, FDOPA): Tedavi sonrası nüks vs radyasyon etkisi ayrımında doğruluğu artırır; MRI ile kombine edildiğinde tanısal performans yükselir.
- BTIP/RANO bağlamı: Klinik denemelerde standart beyin tümörü görüntüleme protokolleri ve RANO ölçütleri, özellikle steroid dozu, yeni lezyonlar ve T2/FLAIR alanlarının değerlendirilmesini vurgular; pseudoprogression ve pseudoresponse için uyarı bayrakları içerir.
6) Prognostik Yansımalar
- Glioblastom: Geniş FLAIR alanları ve belirgin ödem yükü, kötüleşmiş performans durumu, artan steroid ihtiyacı ve kısalmış sağkalımla ilişkilendirilebilir; ancak anti-VEGF ile kontrast azalması gerçek biyolojik yanıtı yansıtmayabilir.
- Menenjiyom: Yüksek ödem indeksi, piyal beslenme varlığı ve geniş tümör-beyin ara yüzeyi pre- ve postoperatif morbiditeyi artırabilir; SRS sonrası ödem alevlenmesi için risk öngörüsü sağlar.
7) Tedavi ve Yönetim İlkeleri
- Glukokortikoidler (örn. deksametazon): Vazojenik ödemde hızlı klinik düzelme; ancak hiperglisemi, infeksiyon, miyopati gibi yan etkiler ve uzun süreli kullanımda antitümöral bağışıklığın baskılanması söz konusu.
- Anti-VEGF/anti-VEGFR: Permeabiliteyi ve ödemi hızla azaltır, steroid gereksinimini düşürür; fakat OS artışı sınırlıdır ve pseudoresponse riski yüksektir.
- Osmoterapi (mannitol/hipertoni salin): Akut kafa içi basınç artışında köprü yaklaşımı.
- Cerrahi: Menenjiyomlarda araknoid planın korunması, piyal damar ilişkilerinin dikkatli diseksiyonu ve venöz drenajın korunması postoperatif PTÖ’yi azaltabilir.
- Enflamasyon modülasyonu: Deneysel/erken klinik veriler, nötrofil yönelimi, mikroglia/makrofaj polarizasyonu ve AQP4 hedeflemenin belirli alt gruplarda ödem ve klinik seyrin iyileştirilmesine katkı verebileceğini düşündürür.
8) Tarihçe ve Kronolojik Dönemeçler (Akademik Çerçeve)
1960’lar–1980’ler: Ödem tiplerinin tanımlanması.
Klasik sınıflamada sitotoksik ve vazojenik ödem ayrımı nöropatolojik düzlemde kesinleşti; beyaz cevherin vazojenik ödemde tercihli tutulumu ve serum protein ekstravazasyonu ile su tutulumunun paralelliği vurgulandı. (Klatzo, 1967; Klatzo, 1987)
1990’lar: Menenjiyom-ödem ilişkisi ve anjiyojenik köprü.
Geniş serilerde menenjiyom piyal arter beslenmesi, Edema/Ödem İndeksi ve VEGF ekspresyonu ile PTÖ arasındaki bağ kuvvetlendi; venöz obstrüksiyon çoğu olguda birincil neden olmaktan çok ağırlaştırıcı bir değişken olarak konumlandı. (Ide, 1992; Bitzer ve ark., 1997; Bitzer ve ark., 1998; seçilmiş venöz çalışmalar 1996–2006)
2000’ler başı: Bariyer biyolojisi ve damar olgunlaşması.
KBB sıkı bağlantı proteinleri (claudin-5, occludin, ZO-1 vb.) ayrıntılandı; damar olgunlaşması/perisit ekseninin tümör damarlarında “sızıntılı” fenotipe yol açtığı ve ödemi kolaylaştırdığı kavramsallaştırıldı. (Wolburg & Lippoldt, 2002; Jain, 2003)
2007–2010: Anti-anjiyojenik çağın görüntüleme diline etkisi.
Cediranib (AZD2171) ile damar “normalizasyonu” ve ödemde hızlı gerileme gösterildi; bunu bevacizumab faz II çalışmaları izledi. Aynı dönemde RANO (2010) kriterleri, T2/FLAIR alanları ve steroid dozunu da içerecek şekilde yanıt değerlendirmesini modernize ederek pseudoresponse ve pseudoprogressionı tanımlayıcı çerçeveyi oluşturdu. (Batchelor, 2007; Friedman, 2009; Wen ve ark., 2010)
2010’lar: İmmün-miyeloid eksen ve AQP4’nin çift yönlü rolü.
Nötrofil polarizasyonu (N1/N2) ve myeloid dominant mikroçevrenin gliom biyolojisine etkisi gösterildi; AQP4’ün vazojenik ödem çözünmesindeki olası “drenaj-kolaylaştırıcı” rolü ve sitotoksik ödemdeki ters etkisi deneysel olarak desteklendi. Klinik görüntüleme tarafında BTIP (2015) ve modifiye RANO (2017) yayımlandı; aminoasit PET ile MRI’nın kombinasyonu, nüks-radyasyon etkisi ayrımında doğruluğu artırdı. (Fridlender, 2009; Papadopoulos & Verkman çevresi; Ellingson ve ark., 2015/2017; çoklu PET-MRI derlemeleri)
2020’ler: RANO güncellemeleri, çok-modalite görüntüleme ve immün-damarsal hedefler.
RANO 2.0 ile erişkin gliomlarda birleşik, tedavi-agnostik bir değerlendirme kurgusu pekişti; aminoasit PET + perfüzyon/difüzyon MRI sinerjisi daha netleşti. Nötrofil biyolojisi ve anti-VEGF dışı geçirgenlik hedefleri (perisit-bazal lamina-MMP ekseni, AQP4 izoformları) araştırma odağı olmayı sürdürüyor. (Ellingson ekibi; Galldiks/Overcast/Jabeen ve ark.; güncel nöroimmünoloji derlemeleri)
9) Klinik Pratiğe Yansıyan İlkeler (Özet Akış)
- Ödemin tipi ve sürücüsü belirlenmeli: yaygın vazojenik bileşen (VEGF/anjiyogenez, damar olgunlaşma kusuru) mi, odaksal sitotoksik bileşen mi?
- Görüntüleme standardizasyonu (BTIP) + RANO ile steroid dozu ve T2/FLAIR alanları izlenmeli; anti-anjiyojenik alanında pseudoresponse olasılığı her zaman göz önünde tutulmalı.
- Menenjiyomda ödemi öngören ipuçları: piyal blush, araknoid plan kaybı, geniş kontak yüzeyi, venöz patern, tümör alt tipi/Ki-67. Cerrahi strateji bu parametreleri hesaba katmalı.
- Tedavi: semptomatik vazojenik ödemde steroid; anti-VEGF ile steroid tasarrufu ve ödem kontrolü; osmoterapi akut ICP alevlenmelerinde; deneysel olarak immün-miyeloid ve AQP4 eksenlerini hedefleyen yaklaşımlar seçilmiş senaryolarda umut vadediyor.
Keşif
Peritümöral ödem, beyin tümörlerinin çevresinde görülen anormal sıvı birikimi olarak tarih boyunca cerrahi ve nöropatolojik olgu kayıtlarında fark edilmiştir. 19. yüzyıl sonları ve 20. yüzyıl başlarında cerrahlar ve patologlar beyin tümörlü hastaların beyin dokusunda önemli şişme (edema) ve basınç artışı gözlemlemişlerdir. Harvey Cushing gibi öncü cerrahlar, beyin tümörlerine eşlik eden şişliğin hastanın klinik durumunu kötüleştirdiğini; bu nedenle de basıncı azaltmaya yönelik dekompresif cerrahi yaklaşımlarını kullanmışlardır. 1950’li yıllara gelindiğinde, beyin ödeminin farklı tipleri üzerinde deneysel çalışmalar yoğunlaşmıştır. Özellikle, 1960’larda Igor Klatzo’nun çalışmalarıyla sitotoksik (hücresel) ödem ve vazojenik (damar kaynaklı) ödem ayrımı yapılmıştır. Klatzo’ya göre, sitotoksik ödem hücre içi su birikimini; vazojenik ödem ise kan-beyin bariyerindeki bozukluk sonucu plazma proteinleri içeren sıvı dışarı çıkışını ifade eder. Bu ayırım, beyindeki ödemin patofizyolojisini anlamada dönüm noktası olmuş; tümör kaynaklı ödem büyük ölçüde vazojenik olarak değerlendirilmiştir çünkü tümör damarlarının geçirgenliği artmakta, plazma proteinleri ve su beyin aralığına sızmaktadır.
1960–1970’ler dönemi, beyin ödemi alanında klinik tedavilerin geliştiği bir evre olmuştur. Galicich ve French 1961’de beyin tümörlerine bağlı ödemde yüksek doz deksametazon kullanımını tanımlamışlar; steroidlerin beyin ödemini hızla azaltıcı etkisi bu çalışmayla önem kazanmıştır. Bu yıllarda deneysel çalışmalar da vazojenik ödemin bariyer kaynaklı olduğunu doğrulamış; örneğin hayvan modellerinde deksametazonun kan-beyin bariyerini güçlendirdiği ve ödemi azalttığı gösterilmiştir. Nörovasküler biyoloji alanında aynı dönemde tümör hücreleri tarafından salgılanan faktörlerin ödem oluşturabileceği öne sürülmüştür. 1970–1980’lerde vasküler permeabilite faktörünün (sonraki adıyla VEGF) keşfi, tümör bağlı ödemin kimyasal mediatörlerle ilişkisinin anlaşılmasında kilit rol oynamıştır. 1990’ların başında yayımlanan kapsamlı derlemeler, beyin tümörlerinin kan-beyin bariyerini bozarak su, elektrolit ve protein sızdırdığını ve bu mekanizmaların peritümöral ödemin temelini oluşturduğunu vurgulamıştır.
Görüntüleme alanında en büyük devrim 1970’lerin başında bilgisayarlı tomografinin klinik kullanıma girmesiyle yaşandı. Sir Godfrey Hounsfield ve ekibinin ilk BT taramasıyla, canlı bir hastanın beyninde kistik tümör ve çevresinde hipodens alan tanımlanabildi; bu alan, ödemin radyolojik karşılığıydı. Böylece BT, yalnızca tümör lokalizasyonunu değil, aynı zamanda çevre dokudaki ödemi de gösterebilir hale geldi. 1970’ler boyunca kontrastlı BT, malign tümörlerin kontrast tuttuğunu ve çevresinde ödem bulunduğunu ortaya koydu. Özellikle menenjiyomlarda BT ile peritümöral ödem dağılımı sistematik biçimde incelenmeye başladı. 1980’lerde MRG’nin klinik rutine girişi ile ödem T2 ağırlıklı sekanslarda parlak görünür hale geldi; FLAIR sekansları ile bu alanlar daha da netleşti.
1990’lardan itibaren difüzyon görüntüleme (DWI/ADC), ödemin niteliğini tanımlamada yeni bir kapı açtı: sitotoksik ödem düşük ADC ile, vazojenik ödem ise yüksek ADC ile ayırt edilebildi. Perfüzyon MRG, ödemli alan ile tümör çekirdeğinin kanlanma farklarını gösterdi. MR spektroskopisi, metabolit profilleriyle infiltratif alanları saf ödemden ayırmaya yardımcı oldu. Bu gelişmeler, ödemin yalnızca bir kitle etkisi değil, aynı zamanda biyolojik ve biyokimyasal süreçlerin bir yansıması olarak görülmesini sağladı.
Glioblastomlarda peritümöral ödemin bir kısmı gerçek tümör infiltrasyonu ile iç içe olduğundan, T2/FLAIR hiperintens alan yalnızca sıvı birikimini değil aynı zamanda invaziv tümör hücrelerini de temsil eder. Buna karşın metastazlar ve menenjiyomlar genellikle saf vazojenik ödem ile çevrilidir. Bu fark, cerrahi sınırların planlanmasında ve tedavi stratejisinde kritik önem taşır. Menenjiyomlarda ödemin çok yaygın olabileceği ve bazen tümör hacminden daha büyük kitle etkisi yaratabileceği gözlenmiştir. Bu durum cerrahiyi zorlaştırır ve postoperatif komplikasyon riskini artırır.
Tarih boyunca peritümöral ödem araştırmalarında üç ana paradigma değişimi yaşandı: (1) 1960’larda sitotoksik-vazojenik ödem ayrımının kavramsallaşması, (2) 1960’lardan itibaren steroid tedavisinin klinik kullanıma girmesi, (3) 1970’lerden sonra BT ve MRG ile görüntüleme çağına geçilmesi. 1990’lardan itibaren ise difüzyon, perfüzyon ve spektroskopi gibi ileri teknikler sayesinde ödemin biyolojik doğasına daha yakından bakılabilir hale gelindi.
İleri Okuma
- Galicich J.H., French L.A. (1961). Use of dexamethasone in the treatment of cerebral edema. Journal of Neurosurgery, 19(9):897–903.
- Klatzo I. (1967). Neuropathological aspects of brain edema. Journal of Neuropathology & Experimental Neurology, 26(1):1–14.
- Stevens J.M., Ruiz J.S., Kendall B.E. (1983). Observation on peritumoural oedema in meningioma: Distribution, spread and resolution of vasogenic oedema seen on CT. Neuroradiology, 25(1):71–80.
- Ide M., ve ark. (1992). Peritumoral brain edema associated with meningioma. Surg Neurol / Neurosurgery serileri.
- Criscuolo G.R. (1993). The genesis of peritumoral vasogenic brain edema and tumor cysts: a hypothetical role for tumor-derived vascular permeability factor. Yale Journal of Biology and Medicine, 66(4):277–314.
- Lobato R., ve ark. (1996). Brain oedema in patients with intracranial meningioma: clinicoradiologic and histological correlations. Acta Neurochir (Wien), 138:485–494.
- Bitzer M., Wöckel L., Luft A.R., ve ark. (1997). The importance of pial blood supply to the development of peritumoral brain edema in meningiomas. Journal of Neurosurgery, 87:368–373.
- Wolburg H., Lippoldt A. (2002). Tight junctions of the blood–brain barrier: development, composition and regulation. Vascular Pharmacology, 38(6):323–337.
- Jain R.K. (2003). Molecular regulation of vessel maturation. Nature Medicine, 9(6):685–693.
- Ambrose J.A. (2006). Jamie Ambrose (obituary). BMJ, 332(7547):977.
- Papadopoulos M.C., Verkman A.S. (2007). Aquaporin-4 and brain edema. Biochimica et Biophysica Acta, 1758/1832.
- Batchelor T.T., ve ark. (2007). AZD2171 (cediranib)… normalizes tumor vasculature and alleviates edema in GBM patients. Cancer Cell, 11(1):83–95.
- Gerstner E.R., Batchelor T.T. (2009). VEGF inhibitors in the treatment of cerebral edema in patients with brain cancer. Nature Reviews Neurology, 5.
- Fridlender Z.G., ve ark. (2009). Polarization of tumor-associated neutrophil phenotype by TGF-β (“N1” vs “N2”). Cancer Cell, 16(3):183–194.
- Friedman H.S., ve ark. (2009). Bevacizumab alone or with irinotecan in recurrent GBM (BRAIN). Journal of Clinical Oncology, 27:4733–4740.
- Wen P.Y., ve ark. (2010). Updated Response Assessment Criteria for High-Grade Gliomas (RANO). Journal of Clinical Oncology, 28(11):1963–1972.
- Hou J., ve ark. (2013). Peritumoral brain edema in intracranial meningiomas: VEGF-directed therapy’nin yükselişi (derleme). Neurosurgical Focus, 35(6):E2.
- Nassehi D. (2013). Intracranial meningiomas, VEGF-A pathway, and peritumoral brain oedema. Danish Medical Journal, 60(4):B4626.
- Castillo M. (2014). History and evolution of brain tumor imaging: insights through radiology. Radiology, 273(2 Suppl):S111–S125.
- Ellingson B.M., Wen P.Y., Cloughesy T.F., ve ark. (2015). Consensus recommendations for a standardized Brain Tumor Imaging Protocol (BTIP). Neuro-Oncology, 17(9):1188–1198.
- Ellingson B.M., Wen P.Y., Cloughesy T.F. (2017). Modified criteria for radiographic response assessment in GBM trials (mRANO). Neurotherapeutics, 14(2):307–320.
- Stokum J.A., Gerzanich V., Simard J.M. (2017). Molecular pathophysiology of cerebral edema. Progress in Neurobiology, 152:1–23.
- Jabeen S., ve ark. (2021). Combined amino acid PET-MRI for identifying recurrence in post-treatment gliomas. EJHI, 5.
- Overcast W.B., ve ark. (2021). Advanced imaging techniques for neuro-oncologic tumor response. AJNR/PMC.
- Lee E.J., Ahn K.J., Lee Y.S., Kim D.H. (2021). Differentiation between glioblastoma and solitary metastasis using conventional and diffusion MRI. Investigative Magnetic Resonance Imaging, 25(1):23–30.
- Sanvito F., ve ark. (2023). Standardized brain tumor imaging protocols—güncel bakış ve RANO 2.0 ile ilişki. Frontiers in Radiology, 2023:1267615.
- Sun C., ve ark. (2024). Neutrophils in glioma microenvironment: from immune function to immunotherapy. Frontiers in Immunology, 2024:1393173.