1. Etimolojik Köken ve Kavramsal Genişlik
Latince musivum kelimesi, “Müzlere ait” anlamına gelirken; bu terim kökensel olarak Eski Yunanca moúseios (μουσεῖος) sözcüğünden türetilmiştir. Moúseios, “Müzler tarafından kutsanmış” yahut “sanatla ilgili olan” anlamlarını taşır ve Eski Yunanca Moûsa (Μοῦσα) yani “Müz” (ilham perisi) kelimesine dayanır. Mozaik kelimesinin çağrışımsal anlamı da, birçok küçük parçadan oluşmuş bütünsel bir yapıyı ifade eder. Bu yönüyle kelime, hem sanatsal hem de biyolojik olarak parçalı ama düzenli bir bütünlüğü temsil eder.
2. Genetikte Mozaik Kavramı
Genetik bağlamda “mozaik” (mosaicism), aynı zigottan türemiş hücre popülasyonları arasında genetik farklılıkların bulunması durumudur. Bu, bireyin vücut hücrelerinin (somatik hücrelerin) bir kısmının farklı karyotip ya da genotiplere sahip olması anlamına gelir. Mozaiklik, tek bir döllenmiş yumurtadan köken alan ancak erken embriyonal mitozlar sırasında meydana gelen hatalı bölünmeler sonucu farklı genetik dizilimlere sahip hücre klonlarının oluşmasıyla gelişir.
3. Mozaik Trizomi: Tanım ve Oluşum Süreci
Mozaik trizomi, bir kromozomun üç kopyasının (trizomi) sadece hücrelerin bir alt kümesinde bulunduğu özel bir mozaiklik durumudur. Bu durum, genellikle döllenmeden sonraki ilk birkaç hücre bölünmesi sırasında meydana gelen mitotik nondisjunction (ayrılmama) sonucu oluşur. Mozaik trizomi, klasik trizomilerden farklı olarak, bireyin tüm hücrelerinde değil, yalnızca belirli hücre gruplarında ekstra kromozomun bulunmasıyla karakterizedir.
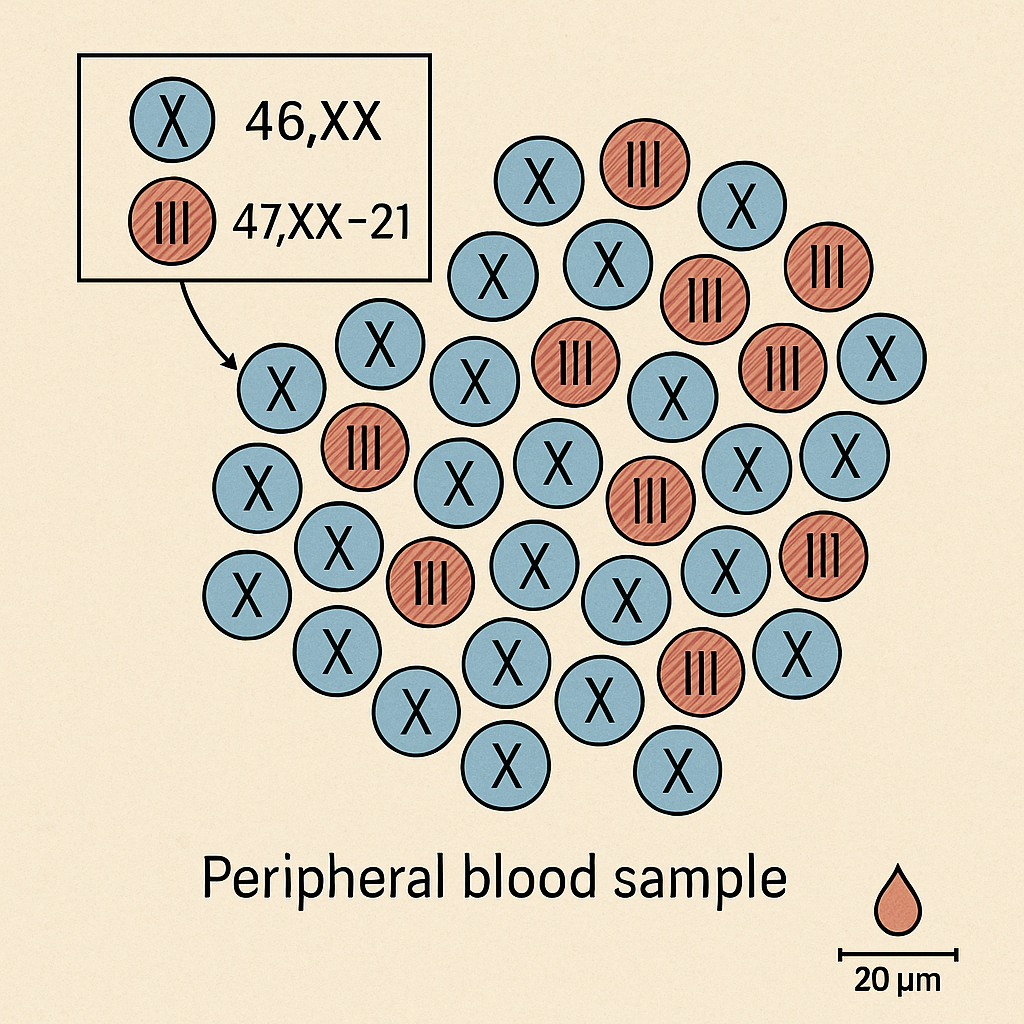
Örneğin, mozaik Down sendromu (mozaik Trizomi 21) vakalarında bireyin bazı hücreleri normal (46 kromozomlu), bazıları ise trizomik (47 kromozomlu, yani fazladan bir 21. kromozom taşıyan) olabilir. Bu durum şu şekilde gösterilebilir:
mos47,XX,+21[34]/46,XX[26]
- 47,XX,+21[34]: 47 kromozomlu, 21. kromozomu üçlemli 34 hücre klonunu temsil eder.
- 46,XX[26]: Normal karyotipe sahip 26 hücre klonunu temsil eder.
Bu örnek, bireyin hücrelerinin yaklaşık %57’sinin trizomik, geri kalanının ise normal olduğunu gösterir.
4. Klinik ve Fenotipik Sonuçlar
Mozaik trizomiye sahip bireylerin fenotipi (gözlemlenebilir özellikleri), trizomik hücrelerin vücutta ne oranda ve hangi dokularda bulunduğuna bağlı olarak büyük değişkenlik gösterir. Örneğin, mozaik Down sendromlu bireylerde bilişsel işlevlerdeki bozulma klasik vakalara kıyasla daha hafif olabilir. Ortalama IQ seviyesi klasik Down sendromunda 50 civarında iken, mozaik formlarda daha yüksek olabilir. Ancak bu durum genelleştirilemez; çünkü trizomik hücrelerin dağılımı (örneğin beyin, kalp, karaciğer gibi hayati organlarda bulunup bulunmadığı) fenotipi doğrudan etkiler.
5. Mozaikliğin Genetik Kaynakları
Mozaik trizomi, tüm trizomik vakaların yaklaşık %1–2’sini oluşturur. Trizomi 21 gibi durumların kaynaklarına bakıldığında:
- %90 oranında anne kökenli nondisjunction: Yumurtanın mayoz I bölünmesindeki ayrılmama hatası sonucu.
- %5 oranında baba kökenli nondisjunction: Spermatogenez esnasında kromozom ayrılmaması.
- %2 oranında Robertsonyen translokasyon: Genellikle 21. kromozom ile bir akrosentrik kromozom (13, 14, 15, 21 veya 22) arasında füzyon olur.
- %2 oranında mozaik vakalar: Mitotik nondisjunction sonucu erken embriyogenez sırasında ortaya çıkar.
6. Mozaiklik Türleri
Mozaiklik, mutasyonun zamanına ve kökenine göre şu şekilde sınıflandırılabilir:
6.1. Somatik Mozaiklik
- Mutasyon döllenmeden sonra mitotik hücre bölünmeleri sırasında ortaya çıkar.
- Bu mutasyon yalnızca belirli somatik dokuları etkiler.
- Kan örneği ile yapılan testlerde bu mutasyonlar tespit edilemeyebilir.
- Fenotipik etkiler genellikle organlara özgüdür.
6.2. Gonadal (Eşey Hücre) Mozaiklik
- Mutasyon eşey hücrelerinin (oosit veya spermatosit) gelişimi sırasında ortaya çıkar.
- Kişi kendisi fenotipik olarak sağlıklı olabilir, ancak mutasyonlu gametler taşıdığı için hastalıklı çocuklara sahip olabilir.
- Mutasyon ne kadar erken meydana gelirse, o kadar çok gamet etkilenir.
- Bu mutasyonlar genetik testlerle (özellikle sperm ya da oosit analizleri ile) ya da dolaylı olarak nesiller arası geçişlerle tespit edilebilir.
Keşif
1. 1950’ler: Kromozomların Sayılabilir Hale Gelmesi
1956 yılına kadar insan kromozomlarının gerçek sayısı dahi bilinmiyordu. Uzun süre boyunca insanlarda 48 kromozom bulunduğu varsayılmıştı. Ancak İsveçli genetikçi Joe Hin Tjio ve Albert Levan, gelişmiş hücre kültürü ve mikroskop teknikleri kullanarak insan hücrelerinde 46 kromozom olduğunu gösterdiler (Tjio & Levan, 1956). Bu teknik atılım, kromozomal hastalıkların incelenmesinde çığır açtı.
2. 1959: Down Sendromu’nun Kromozomal Temelinin Keşfi
O güne dek klinik olarak tanımlanan Down sendromu (mongolizm olarak da adlandırılmıştı), ilk kez 1959 yılında Fransız hekim Jérôme Lejeune ve ekibi tarafından kromozomal düzeyde açıklanabildi. Lejeune, bu bireylerde 21. kromozomun üç kopya halinde (trizomi) bulunduğunu gösterdi (Lejeune et al., 1959). Bu, insan tarihinde bir hastalığın doğrudan kromozom düzeyinde tanımlandığı ilk andı.
3. 1961: “Tüm Hücreler Aynı Değil” Diyen İlk Karyotip
İlk trizomi vakalarında hücrelerin hepsi 47 kromozom taşıyordu. Ancak İngiltere’de çalışan pediatrist ve genetikçi C. E. Ford, 1961 yılında farklı bir vaka raporladı:
Bu çocuğun bazı hücrelerinde 47, bazı hücrelerinde ise normal 46 kromozom vardı. Bu çarpıcı bulgu, klasik trizomi kavramının ötesine geçilmesi gerektiğini gösterdi. Ford, bu durumu tanımlarken ilk kez “mozaik trizomi” ifadesini kullandı. Bu, aynı zigottan gelişen ancak mitotik bölünmeler sırasında farklılaşan hücre soylarının varlığını işaret ediyordu.
4. 1970’ler–1980’ler: Mozaikliğin Klinik Fenotipe Etkilerinin Fark Edilişi
1970’li ve 1980’li yıllarda, klasik Down sendromu vakalarına göre daha hafif seyirli vakalar görülmeye başlandı. Bu bireylerde kas tonusu, yüz hatları ve zihinsel gelişim daha normalken, genetik analizlerde 21. kromozomun mozaik olarak fazladan bulunduğu fark edildi.
Araştırmacılar, mozaik oranı ile fenotip arasında doğrudan bir korelasyon olmadığını ama dolaylı etkilerin bulunduğunu gözlemlemeye başladı. “Ne kadar trizomik hücre, o kadar belirgin klinik tablo” şeklindeki düşünce sorgulanmaya başlandı.
5. 1990’lar: Moleküler Sitogenetik Çağı
Klasik Giemsa bantlama tekniklerinin yerini FISH (Fluorescence In Situ Hybridization) aldı. Artık aynı bireyde yüzlerce hücre kısa sürede sayısal ve yapısal olarak analiz edilebiliyordu. Bu teknoloji sayesinde, daha önce tespit edilemeyen düşük düzeyde mozaik vakalar görünür hale geldi.
Özellikle prenatal tanı alanında, amniyosentezden elde edilen hücrelerde mozaik tespiti birçok etik ve klinik tartışmayı beraberinde getirdi: Mozaik bir bulgu ne anlama geliyordu? Her zaman hastalıkla mı sonuçlanacaktı?
6. 2000’ler ve Sonrası: Genom Düzeyinde Mozaikliğe Yolculuk
2000’li yıllardan itibaren array-CGH ve daha sonra Next Generation Sequencing (NGS) gibi yüksek çözünürlüklü tekniklerin devreye girmesiyle birlikte, artık mozaiklik sadece kromozomal düzeyde değil, genomik varyasyonlar ve hatta tek nükleotid düzeyinde (SNV) bile saptanabilir hale geldi.
Böylece mozaiklik, yalnızca Down sendromu gibi sendromlarla sınırlı kalmayıp; kanser, nörogelişimsel bozukluklar, nörodejeneratif hastalıklar, hatta otizm spektrum bozuklukları gibi çok geniş bir yelpazede incelenmeye başlandı.
7. Bugün: Tanıdan Etik Sorgulamaya
Bugün mozaik trizomi tanısı koymak yalnızca bir genetik test sonucu vermekten ibaret değildir. Hücrelerin hangi dokuda mozaik olduğu, mozaik oranı, mozaik sınırı, hangi kromozomun etkilendiği ve hatta hücresel düzeyde klonal evrim gibi kavramlar tanının yorumlanmasında hayati öneme sahiptir.
Mozaik trizomi, artık yalnızca bir tanı kategorisi değil; aynı zamanda organizmanın genetik bütünlüğüne, gelişimsel kaderine ve hastalığa yatkınlığına dair biyolojik ve felsefi sorulara açılan bir kapıdır.
İleri Okuma
- Tjio, J. H., & Levan, A. (1956). The chromosome number of man. Hereditas, 42(1-2), 1–6.
- Lejeune, J., Gautier, M., & Turpin, R. (1959). Études des chromosomes somatiques de neuf enfants mongoliens. C.R. Hebd. Séances Acad. Sci., 248, 1721–1722.
- Ford, C. E., et al. (1961). The chromosomes in a patient showing both mongolism and the normal phenotype. Lancet, 1(7174), 709–710.
- Warburton, D. (1983). Mosaicism in human fetal tissues. Human Genetics, 64(1), 1–6.
- Biesecker, L.G., (2002). The implications of somatic mosaicism in humans. Nature Reviews Genetics, 3(10), 748–758.
- Hall, J.G., (2003). Somatic mosaicism: observations related to clinical genetics. American Journal of Medical Genetics Part A, 116A(4), 331–339.
- Youssoufian, H., & Pyeritz, R.E., (2002). Mechanisms and consequences of somatic mosaicism in humans. Nature Reviews Genetics, 3(10), 748–758.
- Conlin, L.K., et al. (2010). Mechanisms of mosaicism, chimerism and uniparental disomy identified by single nucleotide polymorphism array analysis. Human Molecular Genetics, 19(R2), R126–R136.
- Grati, F.R., et al. (2015). Chromosomal mosaicism in human preimplantation embryos: a systematic review and meta-analysis. Human Reproduction Update, 21(4), 370–379.