



Tıp terimleri sözlüğü
Bütün canlıların yapısında yer alan kimyasal maddeleri ve canlının yaşamı boyunca sürüp giden kimyasal süreçleri inceleyen bilim dalıdır.





Kuramsal fizikçiler, kim olduğumuzu belirleyenin sadece DNA’mıza kodlanmış enformasyondan ibaret olmadığını doğruladı. DNA’nın kendi üzerine katlanma biçiminin de hangi genlerin bedenlerimizde ifadesinin (ekspresyonunun) olacağı üzerinde etki yaptığı ortaya kondu.
Bu biyologların yıllardan beri bildiği bir şeydi1. Hatta DNA’nın katlanmasından sorumlu olan proteinlerin bir kısmını belirlemeyi de başarmışlardı2. Şimdi ise bir grup fizikçi, simülasyonlar kullanarak bu gizli bilginin evrimimizi nasıl kontrol ettiğini ilk kez olarak gösterdi.
Bu gelişme pek çok bilimcinin kulağına yeni bir haber olarak gelmeyebilir ama konuya aşina olmayanlar için ikinci düzey DNA enformasyonu hakkında kısa bir özet geçelim. Muhtemelen lise yıllarında, Watson ile Crick’in 1953’te kimliğimizi belirleyen DNA kodunun G, A, S ve T harflerinin bir dizisinden oluştuğunu keşfettiklerini öğrenmişsinizdir. Guanin, adenin, sitozin ve timini simgeleyen bu harflerin sıralaması, hücrelerimizde hangiproteinlerin üretileceğini belirler. Yani eğer gözleriniz kahverengiyse, bunun nedeni DNA’nızda irisinizin içinde koyu renk pigment üretecek bir proteini kodlayan belli bir harf dizisi olmasıdır.
Ama öykü bu kadarla kalmıyor. Çünkü bedeninizdeki tüm hücreler tıpatıp aynı DNA kodu ile işe başlıyor olmasına rağmen, her organ başka bir işleve sahip oluyor. Örneğin mide hücrelerinizin kahverengi göz proteini üretmesi gerekmez, ama sindirim enzimleri yapmaları lazımdır. Peki bu nasıl oluyor?
80’li yıllardan beri bilimciler bu süreci kontrol edenin, DNA’nın hücrelerimiz içindeki katlanış biçimi olduğunu biliyor3. Çevresel etkenlerin de bu süreçte payı olabiliyor. Mesela stresin epigenetik yoluyla bazı genleri açık veya kapalı konuma getirebildiği biliniyor. Fakat asıl kontrol mekanizması DNA katlanmasının mekaniğinden kaynaklanıyor. Bedenimizdeki herbir hücre yaklaşık 2 metre uzunluğunda DNA taşıdığında, sığabilmek için DNA’nın nükleozom adı verilen bir öbek biçiminde sıkıca paketlenmesi gerekiyor.
İşte DNA’nın bu paketlenişi, hücre tarafından hangi genlerin okunacağını yönetiyor. Paketin içinde kalan genler proteinler tarafından ifade edilmiyor; sadece dışta kalanların ekspresyonu gerçekleşiyor. Bu durum, aynı DNA’yı taşıyan hücrelerin nasıl olup da farklı işlevleri olabildiğini açıklıyor.
Son yıllarda biyologlar DNA’nın katlanış yöntemini belirleyen mekanik yönergeleri ortaya çıkarmaya başladı. Gelelim kuramsal fizikçilerin bu konuyla ne ilgisi olduğuna… Hollanda’da bulunan Leiden Üniversitesi’nden bir ekip, bir adım geriye gidip sürece genom ölçeğinden bakarak, bu mekanik yönergelerin de aslında DNA içinde kodlanmış durumda olduğunu bilgisayar simülasyonları ile doğruladı.
Helmut Schiessel liderliğindeki fizikçiler, ekmek mayasının ve fisyon mayasının genomlarını simüle etti ve sonra onlara tüm mekanik yönergeleri içeren rastgele ikinci düzey DNA bilgisi atadı. Bu yönergelerin DNA’nın nasıl katlanacağını etkilediğini ve hangi proteinlerin ifade edileceğini belirlediklerini gördüler. Böylece DNA mekaniğinin de DNA’nın içinde gizli olduğu ve evrimsel açıdan kodun kendisi kadar önemli olduğu anlaşılmış oldu. Bunun anlamı, DNA mutasyonlarının canlıyı etkilemesinin birden fazla yolu olduğu demek oluyor. DNA’daki harfler değiştirilerek de farklılık yaratılabilir, DNA’nın katlanışını belirleyen mekanik yönergeler değiştirilerek de farklılık yaratılabilir.
Sonuçları PLOS One dergisinde yayımlanan bu çalışma, biyologların zaten bildiği birşeyi doğrulamış oldu. Fakat işin heyecan verici yanı, bilgisayar simülasyonlarının devreye girmesiyle birlikte DNA’yı biçimlendiren mekanik yönergelerin kontrolünde bilimcilere yeni olasılıklar doğmuş olması. Belki bir gün istenmeyen genlerin ifadelerinden korunmak için DNA’nın katlanma biçimini değiştirebiliriz.
Kaynaklar:
İlgili Makale: Behrouz Eslami-Mossallam, Raoul D. Schram, Marco Tompitak, John van Noort, Helmut Schiessel Multiplexing Genetic and Nucleosome Positioning Codes: A Computational Approach PLOS ONE Published: June 7, 2016http://dx.doi.org/10.1371/journal.pone.0156905
Notlar:
[1] Eran Segal, Yvonne Fondufe-Mittendorf, Lingyi Chen, AnnChristine Thåström, Yair Field, Irene K. Moore, Ji-Ping Z. Wang and Jonathan Widom A genomic code for nucleosome positioning Nature 442, 772-778 (17 August 2006) | doi:10.1038/nature04979; Received 16 March 2006; Accepted 14 June 2006; Published online 19 July 2006
[2] https://en.m.wikipedia.org/wiki/Trithorax-group_proteins
[3] http://www.nature.com/milestones/geneexpression/milestones/articles/milegene16.html
 Yeni bulunan bakteri E.coli’yi sadece 30 saniyede öldürebiliyor. Gün geçtikçe antibiyotik direncin artmasıyla süper bakterilerden kaynaklı endişe büyüyor. Bu nedenle antibiyotiklere direnç kazanan güçlenmesi nedeniyle , başa gelebilecek en kötü senaryoyu engellemek için daha fazla araştırma yaparak yeni ilaçların geliştirilmesi gerekiyor. Neyse ki, Singapur’dan bilim insanlarının katkılarıyla geçtiğimi yıllarda umut vadeden gelişimler yaşanıyor. Yeni geliştirilen madde sadece mikropları çabucak öldürmekle kalmıyor, aynı zamanda antibiyotik dirençli bakteri üremesini engelliyor.
Yeni bulunan bakteri E.coli’yi sadece 30 saniyede öldürebiliyor. Gün geçtikçe antibiyotik direncin artmasıyla süper bakterilerden kaynaklı endişe büyüyor. Bu nedenle antibiyotiklere direnç kazanan güçlenmesi nedeniyle , başa gelebilecek en kötü senaryoyu engellemek için daha fazla araştırma yaparak yeni ilaçların geliştirilmesi gerekiyor. Neyse ki, Singapur’dan bilim insanlarının katkılarıyla geçtiğimi yıllarda umut vadeden gelişimler yaşanıyor. Yeni geliştirilen madde sadece mikropları çabucak öldürmekle kalmıyor, aynı zamanda antibiyotik dirençli bakteri üremesini engelliyor.
İmidazolyum oligomerleri olarak adlandırılan madde, Singapur Fen Teknoloji ve Araştırma Ajansı’nın bir kolu olan Biyomühendislik ve Nanoteknoloji Enstitüsü’nden bilim insanları tarafından geliştirildi.
Zincirimsi moleküler yapısı sayesinde mikropları hızla öldürmüyor , onları sepetlemekte de oldukça etkili. İmidazolyum oligomerleri bakterinin hücre membranını engelleyerek , yeni antibiyotik dirençli suşların türemesini engelliyor. Diğer antibiyotik mikropları öldürebilse de , onları temizlemeyi ihmal ediyor.
Staphylococcus aureus, Pseudomonas aeruginosa ve Candida albicans gibi antibiyotik dirençli bakterilerin % 99,9’unu 2 dakikanın altında öldürebiliyor.
“Eşsiz maddemiz bakteriyi hızla öldürebilir ve antibiyotik dirençli bakteri gelişimini inhibe edebilir. Bilgisayar destekli kimya çalışmalarının desteklediği zincir benzeri bileşik hücre membranına saldırıyor. Ayrıca bu maddenin kullanımı güvenli çünkü, pozitif yük taşıdığından, kırmızı kan hücrelerine hasar vermeden daha fazla negatif yüklü bakteriyi hedefliyor,” diyor IBN Grup Lideri Dr Yugen Zhang. Ekibin geliştirdiği bu madde sabun ve diş macunu gibi hijyen ürünlerinde kullanılan triklosan antibiyotik direnci geliştirdiğinden,onun yerine kullanılabilir.
Ekibin geliştirdiği bu beyaz tozumsu madde, suda çözünerek evlerin ve hastanelerin sterilizasyonundan kullanılan alkollü spreylerde kullanılabilir.
Bu yeni madde sayesinde antibiyotik dirençli bakterilerin yayılması engellenebilir.
Ekibin araştırması Small dergisinde yayınlandı. Sağlıklı E.coli İmidazolyum oligomerine maruz kalan bakterileri zarları parçalanıyor.
Kaynak:

Akşamdan kalmalığın bir tedavisi olmasa da, aşağıdaki çareler semptomları hafifletmeye yardımcı olabilir:
Tarihsel Kayıtlar:
1930’lar-1940’lar:
1950’ler-1970’ler:
1980’ler:
1998:
2000-2010:
Uyku ve Sirkadiyen Faktörler:
Nörotransmitter Düzensizliği:
Kapsamlı Modeller:
Biyokimyasal Belirteçler:
Önleme ve Tedavideki Gelişmeler:
Kişiselleştirilmiş Tıp:









Almanya’nın Münih kentinde bulunan Ludwig Maximilian Üniversitesi’nden bir grup kimyacı, adenin ve guaninpürinlerinin kolayca ve makul bir verimle nasıl sentezlenebileceğini göstererek, RNA‘nın Dünya üzerinde canlılığın yeşermesini sağlamış olabileceğine ilişkin yeni kanıtlar sundu. Science dergisinde yayımlanan makalelerinde ekip, RNA’nın kendini kopyalayan ilk molekül olduğuna ve nihayetinde gezegenimizdeki tüm canlıların ortaya çıkışına yolaçtığına işaret eden kanıtları arama süreçlerini anlatıp, elde ettikleri bulguları açıklıyorlar.
Uzun yıllardan bu yana çok sayıda bilimci, gezegenimizdeki yaşamın bir dizi olay sonucu oluşan RNA moleküllerisayesinde başladığı düşüncesine katılıyordu. RNA bu konuda güçlü bir adaydı, çünkü hem bilgi depolayabiliyor hem de katalizör görevi görüyordu. Kuramı desteklemek için araştırmacılar Dünya’nın erken dönemlerindeki koşullara dayanarak, RNA’nın hangi koşullar altında belirebileceğini göstermeye çalıştı. RNA’nın dört temel yapıtaşından ikisi olan urasil ile sitozinin nasıl ortaya çıkabileceğinin gösterilmesi nispeten kolay oldu. Ancak diğer ikisi olan adenin ile guaninin oluşumu konusunda sorunlar vardı. Yapılan bu son çalışmada, yaşamın başladığı düşünülen zamanın koşulları göz önüne alınarak, adenin ve guaninin oluşabileceği bir senaryo betimleniyor.
Araştırmacılar ilk olarak daha önce yapılmış olan bir çalışmayı geliştirmekle işe başlamış. Söz konusu çalışmada,formamidopirimidin adlı molekülün belli koşullar altında pürinleri oluşturacak tepkimelere girebildiği ortaya konmuştu. Ekip, bir amine (bol miktardaki karbon, azot ve hidrejenden kolayca oluşabilir) asit eklemenin, pürin oluşturacak bir tepkimenin gerçekleşmesini sağlayabileceğini keşfetti. Ayrıca oluşan pürin kolayca formik asit ile bağ yapabiliyor, ki yakın zamanda yapılan araştırmalar formik asitin kuyruklu yıldızlarda bolca bulunduğunu gösterdi.
Bu da şu anlama geliyor: Bir kuyruklu yıldız gezegende doğru yere düşerse, taşıdığı formik asit varolan pürinlerle karşılaşabilir. Böyle bir olay sonucu oluşan tepkimeler, şekerlerle bağların gelişmesine ve dolayısıyla adenin ile guanin de dahil olmak üzere, büyük miktarda pürinin oluşmasına yol açabilir. Bu şekilde, RNA moleküllerinin oluşumu için gereken tüm bileşenler hazır hale gelebilir ve canlı organizmaların gelişeceği ortam kurulabilir.
Kaynak:
İlgili Makale: S. Becker et al. A high-yielding, strictly regioselective prebiotic purine nucleoside formation pathway, Science (2016). DOI: 10.1126/science.aad2808

Bikarbonat (kabartma tozu); maden suyunun (soda) köpürmesine, hamurun kabarmasına, kokunun absorbe edilmesine sebep olur ve diş temizliği de dahil olmak üzere çeşitli şeylerin temizliğinde kullanılabilir. Vücutta ise, bikarbonat; sindirime yardımcı olur, pH’ın tamponlanmasında önemli role sahiptir ve fiziksel gayret sırasında üretilen laktik asiti nötrleştirir. Vücudumuzdaki bikarbonatın çoğu bütün hücrelerde atık olarak üretilenkarbondioksitten kaynaklanır. Bunun yanı sıra, tükettiğimiz karbonatlı içecekler ve bazı karbonat içeren besinler de bikarbonat kaynağıdır.
Journal of Biological Chemistry ‘de yayınlanan Harvard University ve Salus University’nin yaptığı ortak çalışmada, araştırmacılar, bikarbonatın; ışığı saptayan koni ve çubuk fotoreseptörleri tarafından oluşturulan görsel sinyalleri düzenlememizi nasıl değiştirdiğini tanımladılar.
Koni ve çubuk fotoreseptörleri bünyesindeki cGMP isimli küçük çözülebilir bir molekül; foton alımını fotoreseptörün elektrik aktivitesine bağlıyor. Işıkta, cGMP bozulmuş haldedir ve iyon kanalları kapalıdır. Pozitif yüklü sodyum iyonlarının çubuk ve konilere girişi durur ve zar, daha negatif ya da hiperpolarize hale gelir. Bikarbonat ise; direkt olarak cGMP sentezinden sorumlu guanilat sikraz enzimini uyarır.
Harvard University ‘den makale yazarlarından Clint Makino:
“Işığın etkisinin tersine çevrilmesiyle, bikarbonat; foton tepki büyüklüğünü sınırlandırır ve toparlanmasını hızlandırır. Sonuç olarak da; ışığa duyarlılık biraz azalır ancak hareket eden objeleri takip edebilme yetisi gelişir. Asıl şaşırtıcı olan ise; –elbette ki doğrulamak için daha fazla araştırmaya ihtiyaç var ancak– görüş, metabolik düzeyde değişebilir. Bazı retinal hastalıklarda, genetik bozukluk; konilerde ve/veya çubuklardaki cGMP ‘nin ölümcül düzeyde anormal seviyelere yükselmesine sebep oluyor. Bir kez kaybedildiğinde de koni ve çubuklar yenilenemez, bu yüzden de geri dönüşü olmayan körlük trajik son olur” diyor.
İlerleyen zamanlarda, bilimciler; gözdeki bikarbonat seviyesini kontrol ederek göz hastalıklarının gelişimini yavaşlatma ya da tamamen engelleyebilme olanaklarını araştırmayı planlıyorlar.
Makale Referansı: Bicarbonate Modulates Photoreceptor Guanylate Cyclase (ROS-GC) Catalytic Activity, J. Biol. Chem. published March 12, 2015 as DOI: 10.1074/jbc.M115.650408
Kaynak:

Çağımızın hastağı obezitenin insan sağlığı üzerindeki olumsuz etkileri artık birçok insan tarafından biliniyor. Obezite ile savaşmanın belki de en kolay yöntemi egzersiz yapmak olsa da, hali hazırda obezite sorunu olan bireylerin egzersiz yapabilmeleri de oldukça zor. Ayrıca büyük şehirlerdeki yaşam tarzı egzersiz yapmak için gerekli zamanı bulmamızı neredeyse imkansız hale getirirken, beslenme alışkanlıklarımızı da hızlı tüketilen gıdalara yönlendiriyor. Bu sebeple bilim insanları obezite ile savaşta ilaç tedavisinin üzerinde de duruyorlar. Fakat geliştirilen ilaçların çoğu obeziteyi tedavi edeceğini öne sürerken birçok olumsuz yan etkisiyle de vücudun farklı bölümlerine zarar veriyor.
MIT’den bilim insanlarının da yer aldığı bir araştırma grubunun geliştirdiği nanoparçacıklar, anti-obezite ilaçlarını doğrudan yağ hücrelerine iletebiliyor. Bu yöntemle tedavi edilen fareler, 25 gün içerisinde vücut ağırlıklarının %10’unu hiçbir olumsuz yan etki olmadan kaybettiler.
Geliştirilen bu ilaç, yağ depolama hücreleri tarafından yapılan beyaz yağ dokunun, yağ yakan hücreler olan kahverengi yağ dokusuna dönüştürülmesi ile çalışıyor. Bu ilaç ayrıca yağ dokunun içerisinde yeni kan damarları gelişimini de uyarıyor ve nanoparçacıkların beyaz yağ dokuyu hedefleyip kahverengi yağ dokuya çevirmesini olumlu yönde destekliyor.
Aslında bu ilaçlar yeni değiller. Fakat araştırma takımının geliştirdiği yeni yöntem sayesinde bu ilaçlar yağ dokularına oldukça hatasız iletilerek, istenmeyen yan etkiler engellenebiliyor. Yani nanoteknoloji sayesinde kullanılan ilaç yalnızca istenilen etkiyi ortaya çıkartıyor.
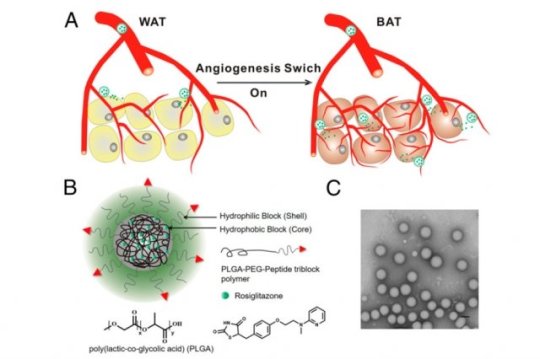
Bu araştırmada görev alan bilim insanları, anjiyogenez olarak bilinen yeni kan damarları gelişiminin yağ dokuyu dönüştürerek kilo kaybına yardımcı olduğunun bulgularına daha önce ulaşmışlardı. Fakat anjiyogenezi destekleyen ilaçların, vücudun geri kalanı için zararlı etkileri vardı.
Bu sorunun üstesinden gelebilmek için bilim insanları, geçtiğimiz yıllarda kanser ve diğer hastalıkların tedavisi için geliştirilen nanoparçacık ilaç iletim stratejisini kullandılar. Nanoparçacıklar sayesinde yalnızca istenilen bölge hedeflenerek etkili dozda ilaçlar yalnızca istenilen bölgeye iletilebiliyor ve vücudun diğer bölgelerindeki ilaç birikimi minimuma indiriliyor.
Araştırmacıların geliştirdiği ve birçok medikal aygıt ve ilaç iletim parçacığında kullanılan polimer olan PLGA’ya bağlı nanoparçacıklar, hidrofobik çekirdekleri içerisinde ilaçları taşıyorlar. Bu çekirdekler içerisinde iki farklı ilaç bulunuyor. Bu ilaçlardan birisi diyabetin tedavisi için onaylanmış fakat yan etkilerinden dolayı yaygın bir şekilde kullanılamayan rosiglitazone. Diğeri ise bir tip insan hormonu olan prostaglandin’in analoğu. Bu iki ilaç, anjiyogenezi ve yağ doku dönüşümünü tetikleyen PPAR adındaki hücresel reseptörü aktif hale getiriyorlar.
Nanoparçacıkların dış kabuğu ise başka bir polimer olan PEG’den oluşuyor. PEG sayesinde parçacıklar istenilen hedefe ulaşmak için gerekli moleküllere yapışıyorlar. Hedeflenen bu moleküller kan damarlarının duvarlarındaki proteinlere bağlanıyorlar.
Araştırmayı yürüten bilim insanları, geliştirdikleri parçacıkları obez fareler üzerinde test ettiler. Bulgulara göre; fareler yaklaşık olarak vücut ağırlıklarının %10’unu kaybederlerken kolesterol ve trigliseridlerin seviyelerinde azalma gözlemlendi. Ayrıca farelerin insülin duyarlılığı da arttı. Fakat farelere 25 gün boyunca her gün bu yöntemle ilaç verilmesine rağmen, herhangi bir yan etki gözlemlenmedi.
Normalde bu tarz ilaçların, iletimindeki zorluklar sebebiyle damara enjekte edilmesi gerekiyor. Fakat bilim insanlarının geliştirdikleri parçacıklar sindirim sisteminden kan akışına dahil olabiliyor. Yani bu ilaçlar hap şeklinde de alınabilecekler.
Kaynak: Bilimfili
İlgili Makale: Yuan Xue, Xiaoyang Xu, Xue-Qing Zhang, Omid C. Farokhzad, and Robert Langer. Preventing diet-induced obesity in mice by adipose tissue transformation and angiogenesis using targeted nanoparticles.PNAS, May 2016 DOI: 10.1073/pnas.1603840113

Avustralya Monash Üniversitesi araştırmacıları, bitkilerin ısınan hava ile birlikte çiçek açmaya başlamalarını sağlayan mekanizmayı çözmeyi başardı. Ulaştıkları sonuçları Nature Plants dergisinde yayımladıkları makale ile açıklayan ekip, bu keşfin bitkilerin fizyolojik tepkilerinin kontrol edilmesi ve küresel ısınma nedeniyle yükselen sıcaklıkların etkisinin düzenlenmesi konusunda yararlı olabileceğini belirtiyor.
Sureshkumar Balasubramanian liderliğindeki araştırmacılar, Arabidopsis çiçekli bitkisi üzerinde genetik, moleküler ve bilgisayar hesaplamalarından yararlandıkları biyoloji deneyleri gerçekleştirdi. Balasubramanian, iki temel hücresel sürecin birlikte işleyerek, normalde bitkinin çiçeklenmesini engelleyen bir proteinin miktarını azalttıklarını ifade ediyor. Böylece bitki, artan sıcaklıkla beraber çiçek üretmeye başlıyor.
“Bu son derece heyecan verici, çünkü bu genetik mekanizmaların birlikte nasıl işlediklerini anladıkça, bitkilerin farklı sıcaklıklarda çiçeklenmesini sağlayabileceğimiz teknolojiyi geliştirebiliriz. Bu mekanizmalar tüm organizmalarda var. Dolayısıyla edindiğimiz bu bilgiyi, tarımsal bitkiler için kullanabiliriz,” diye açıklıyor Balasubramanian.
Aslında Balasubramanian, sıcaklığa bağlı çiçeklenmenin genetik temelini keşfedeli on yıl oluyor. Ancak mekanizmanın keşfi, bilgisayarlı hesaplama yöntemlerinin mümkün olmasıyla beraber yeni yapılabildi.
Balasubramanian’ın laboratuvarında çalışan ve makalenin baş yazarı olan doktora sonrası araştırmacısı Sridevi Sureshkumar şöyle değerlendiriyor: “Çevresel değişimler karşısında başka genleri de kontrol edebilen benzer mekanizmaları araştırmak çok iginç olacak.”

Kaynak:
İlgili Makale: Sridevi Sureshkumar, Craig Dent, Andrei Seleznev, Celine Tasset & Sureshkumar Balasubramanian Nonsense-mediated mRNA decay modulates FLM-dependent thermosensory flowering response in Arabidopsis, Nature Plants, nature.com/articles/doi:10.1038/nplants.2016.55

Araştırmacılar yıllardır iki anormal proteinin, tau ve amiloid betanın; beyinde nasıl biriktiğini ve sonucunda Azheimer hastalığına sebebiyet verecek olan hasarı nasıl oluşturduğunu araştırmaya devam ediyor. Özellikle hangisinin demansın (unutkanlık) itici kuvveti olduğu incelenirken bu sorunun cevabı yeni bir araştırma ile biraz daha netlik kazandı.
Douglas Mental Health University Institute’te Dr. Pedro Rosa-Neto önderliğindeki bir araştırma ekibi tarafından gerçekleştirilen ve Molecular Psychiatry dergisinde yayımlanan araştırmada, ilk kez bu iki proteinin arasındaki etkileşimin, bilişsel bir hasarı bulunmayan bireylerin beyinlerinde hasara yol açtığına dair kanıtlar elde edildi.
Dr. Rosa-Neto’nun açıklamasına göre; bu iki protein de birbirinin toksik etkilerinin artmasına sebebiyet veriyor. Bunun sonucunda da Alzheimer hastalığının da göstergesi olan beyindeki fonksiyon kayıplarına yol açıyor. Buradaki keşif de, tek bir proteindeki anormalliğin hastalığın ilerlemesine sebep olduğunu belirten daha önceki teorilerin bir anlamda sallanmasına sebep oldu diyebiliriz.
Yeni terapötik stratejilere doğru
Araştırmadaki yeni bulguların,bilim insanlarını yeni ve farklı tedavi veya hastalığı geciktirme stratejilerini geliştirmeye iteceğini söylemek çok da yanlış olmayacaktır.
Araştırmanın baş yazarı Dr. Tharick A. Pascoal’un konu ile ilgili açıklaması şöyle: “Şimdiye kadar, terapötik klinik araştırmalar tek bir patolojik süreci hedef alıyordu. Sonuçlarımız, Alzheimer hastalığını önleyecek veya durduracak yeni terapötik stratejiler için bir yol açıyor. Örnek olarak, amiloid ve tau proteinlerinin birikmesine karşı eş-zamanlı olarak kombinasyon terapiler denenmelidir.”
Araştırma ekibi, bilişsel olarak hasar görmemiş 120 (ortalama yaş 75 ve cinsiyet dağılımı eşit) bireyin performanslarını iki yıl süre ile ölçtü ve analiz etti. PET Scan tekniği ile serebrospinal sıvıdan yapılan analiz ile amiloid ve tau proteini seviyelerini ölçen araştırmacılar, Alzheimer hastalığı ile ilgili olan beyin hasarlarına karşı risk altında olan bireyleri de başarı ile tespit etti.
World Health Organization (WHO- Dünya Sağlık Örgütü) raporuna göre 2015 yılında Alzheimer hastalığı Dünya genelinde 30 milyon kişiyi etkiledi.
Kaynak :
Yorum yazabilmek için oturum açmalısınız.