Tiroid hormonlarının keşfi, modern endokrinolojinin doğuşuna paralel ilerleyen, kimi zaman sezgiyle, kimi zaman kuramsal atılımlarla, kimi zaman da teknolojinin gelişmesine bağlanan uzun bir bilim tarihidir. Bu tarih yalnızca levotiroksin ya da liotironin gibi bugünkü farmasötik ürünlerin kökenini anlatmaz; aynı zamanda insan fizyolojisinin en kritik “metabolik orkestralarından biri”nin adım adım nasıl çözüldüğünü gözler önüne serer.
1. 17. ve 18. yüzyıl: “Boğazda gizemli bir bez”
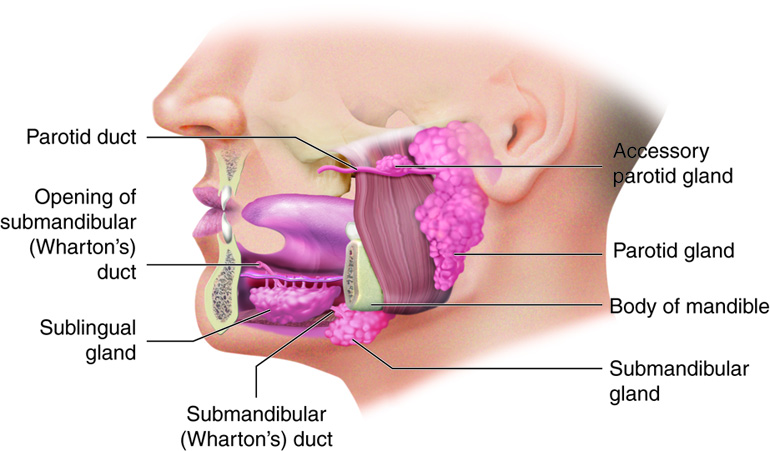
Tiroid bezinin anatomik varlığı antik hekimler tarafından fark edilmiş olsa da, bu organın işlevi yüzyıllar boyunca belirsizdi. 17. yüzyılda Thomas Wharton, boyundaki bu “kalkan biçimli” yapıya thyroid gland adını verirken, ona hafifçe mukus üretme gibi masum bir görev atfetmişti. Bez, fonksiyonundan çok şekliyle tanımlanan bir yapıdır; içindeki moleküllerin kimliği ise tamamen bilinmezdir.
18. yüzyıla gelindiğinde klinik gözlemler, tiroidle bazı hastalıklar arasında bağlantılar olduğunu ima etmeye başlamıştı. Özellikle guatr olgularında bölgesel iyot yetersizliği seziliyordu; fakat hormon kavramı henüz icat edilmediğinden, “kimyasal haberci” fikri kimsenin aklına gelmiyordu.
2. 19. yüzyıl: Hormon kavramının doğuşu ve ilk büyük kırılmalar
2.1. Klinik sendromların tanımlanması
1850’lerden itibaren cerrah William Gull ve daha sonra William Ord, bugün hipotiroidizme özgü kabul edilen ağır, yavaşlamış, ödemli klinik tabloyu ayrıntılı biçimde tanımladı. Bu tabloya myxoedema adını verdiler. Aynı dönemde Paul Brissaud ve Emil Theodor Kocher, tiroid cerrahisinden sonra gelişen ağır nörolojik bozuklukları belgeleyerek tiroidin yaşamsal bir organ olduğu görüşünün yerleşmesine katkıda bulundular.
2.2. “Organ tedavisi” fikri ve mucizevi genç kadın hastası
1880’lerde George Murray ve Victor Horsley gibi klinisyenler, koyun tiroidinden hazırladıkları ekstraktları hipotiroidi hastalarına enjekte ettiklerinde dramatik iyileşmeler gözlemlediler. Tiroid bezinin yaşam için gerekli bir “iç salgı” ürettiği artık açıktı. Bu, modern hormon tedavisinin ilk sistematik örneklerinden biriydi.
3. 20. yüzyılın başı: Molekülün kimliğinin ortaya çıkışı
3.1. İyotun rolünün aydınlanması
Eugen Baumann, tiroid dokusunda yüksek miktarda iyot bulunduğunu göstererek ilk gerçek kimyasal ipucunu sundu. Bu bulgu, organik iyot bileşiklerinin tiroid fonksiyonuyla bağlantılı olabileceğini düşündürdü.
3.2. Tiroksinin izolasyonu
1910’larda Edward Calvin Kendall, tiroid bezinden kristalize ettiği molekülü izole etti ve bu maddeye thyroxine adını verdi. Molekülün yapısının tam anlaşılması ise zaman aldı, ancak Kendall’ın çalışmaları tiroid hormonlarının biyokimyasına giden kapıyı açtı.
3.3. Yapısal çözümleme ve sentetik başarı
1920’lerde Charles Harrington ve George Barger, tiroksinin kimyasal yapısını tam olarak çözdüler. Bir süre sonra, aynı araştırma hattı T4’ün laboratuvarda tamamen sentetik olarak üretilmesini mümkün kıldı. Böylece bugünkü levotiroksin formülasyonlarının temeli atılmış oldu.
4. 1950’ler: T3’ün ortaya çıkışı ve “gerçek aktif hormon” krizinin çözülmesi
1952, tiroid araştırmaları için dönüm noktasıdır. Jack Gross ve Rosalind Pitt-Rivers ile bağımsız olarak Jean Roche ve ekibi, tiroid hormonlarının yalnızca tiroksinden ibaret olmadığını, daha etkin bir hormon olan triiyodotironin (T3) bulunduğunu gösterdiler. Üstelik serumda düşük düzeylerde bulunmasına rağmen biyolojik etkileri tiroksinden daha güçlüydü. Bu bulgu şu soruyu gündeme getirdi: Tiroid gerçekte hangisini salgılıyor, vücut hangisini kullanıyor?
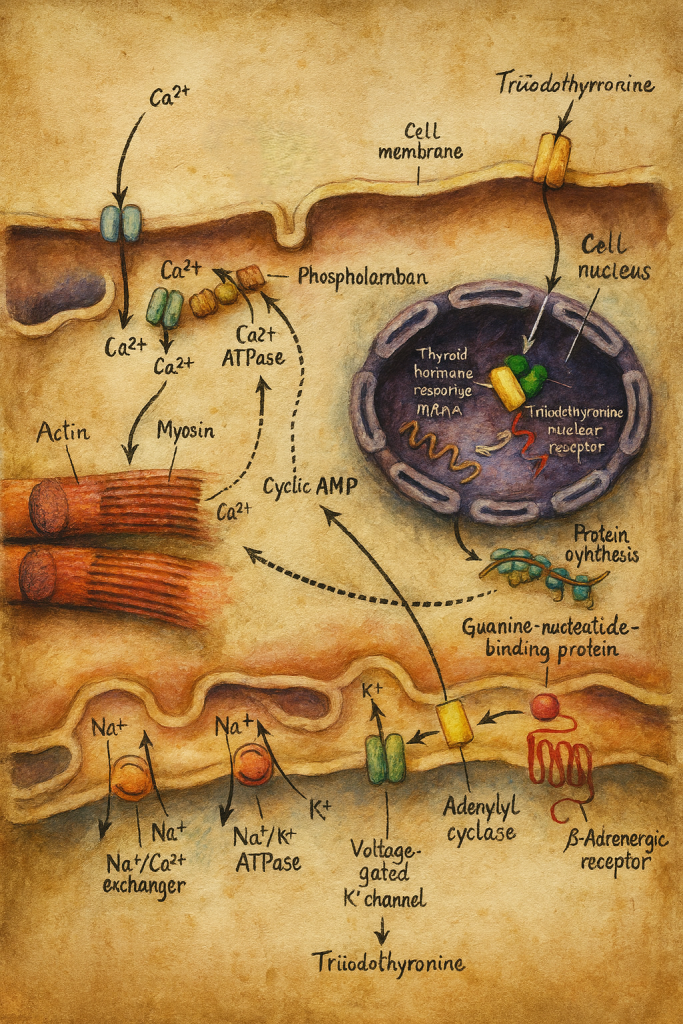
Cevap, kısa süre sonra deiyodinaz enzimlerinin keşfiyle netleşti: T4, aslında bir ön hormon; vücudun gerçek aktif molekülü ise dokularda T4’ten dönüştürülen T3 idi. Bu, tiroid fizyolojisi anlayışını kökten değiştirdi.
5. 1960–1980 arası: Reseptörlerin bulunması, farmasötik standartlaşma ve tedavi stratejileri
Bu dönemde:
- Tiroid hormon reseptörleri ilk kez hücresel düzeyde tanımlandı.
- Nükleer reseptör süper ailesinin bir üyesi oldukları anlaşıldı.
- Tiroid hormonunun gen ekspresyonunu düzenlediği gösterildi.
- T4 ve T3 preparatlarının saflığı, biyoyararlanımı ve doz standardizasyonu uluslararası düzeyde yeniden düzenlendi.
Klinik pratikte, 1970’lerden itibaren levotiroksin monoterapisi, kararlı serum düzeyleri ve daha tahmin edilebilir farmakokinetiği nedeniyle birinci seçenek haline geldi. Kombinasyon tedavileri ise belirli alt gruplara saklandı.
6. 1990’lar ve erken 2000’ler: Genetik çağın açılması
Tiroid hormonlarının etkilerinin yalnızca metabolik hızla sınırlı olmadığı anlaşıldıkça araştırma ölçeği genişledi. Bu dönemde:
- Tiroid hormon taşıyıcıları (ör. MCT8) tanımlandı.
- Deiyodinaz enzimlerinin genetik varyantları ve dokuya özgü rolleri incelendi.
- Tiroid hormon direnci sendromlarının moleküler temeli aydınlatıldı.
- Doğum öncesi beyin gelişiminde T3/T4 dengesinin belirleyici rolü ortaya kondu.
Bu keşifler, tiroid hormonlarını yalnızca metabolik bir düzenleyici değil, nörogelişimsel bir anahtar olarak konumlandırdı.
7. Günümüz araştırmaları: Moleküler terapiler, taşıyıcı hedefleme ve nörobilim
Bugün tiroid hormonları alanında üç büyük araştırma ekseni öne çıkmaktadır:
7.1. Dokuya özgü hormon modülasyonu
Araştırmacılar, her dokunun T3 düzeyini kendi içinde kontrol etmek için farklı deiyodinaz profilleri kullandığını biliyor. Bu nedenle:
- D1, D2 ve D3 enzimlerine yönelik seçici inhibitörler/agonistler,
- Dokulara özgü T3 agonistleri,
- Kardiyovasküler yan etki oluşturmadan metabolizmayı etkileyen T3-analogları üzerinde çalışmalar sürmektedir.
Bu yaklaşım, gelecekte “kalbe dokunmadan yağ dokusuna etki eden” tiroid hormonlarının mümkün olabileceğini düşündürmektedir.
7.2. MCT8 eksikliği ve TRIAC terapisi
Allan–Herndon–Dudley sendromu gibi taşıyıcı protein bozukluklarında klasik T4/T3 tedavileri etkisizdir. TRIAC gibi hücre içine alternatif yollarla geçen analoglar bu alanda çığır açmış, Avrupa’da özel endikasyonla onaylanmıştır.
7.3. Nörobilim ve tiroid hormonları
Güncel nörofizyolojik araştırmalar, T3’ün sinaptik plastisite, miyelinizasyon, glia hücre metabolizması ve hatta erişkin beyinde nörogenez gibi süreçlerde şaşırtıcı derecede aktif olduğunu göstermektedir. Bu nedenle tiroid hormonları depresyon, bilişsel bozukluklar, yaşlanma biyolojisi ve beyin enerji metabolizması araştırmalarında giderek daha önemli bir odak haline gelmektedir.
8. Keşif tarihinin bugüne bıraktığı miras
Tiroid hormonlarının anlaşılması, tıpta bir dizi yeniliği beraberinde getirdi: İç salgı kavramının yerleşmesi, hormon düzenleyici aksların tanımlanması, farmakolojik sentez tekniklerinin gelişmesi, nükleer reseptör biyolojisinin bir disiplin haline gelmesi ve metabolizma biliminin bugünkü şeklini alması.









Yorum yazabilmek için oturum açmalısınız.