Ticari isimler: Strodival
- Quabain, kalp üzerinde pozitif inotropik etkiye sahip bir kardiyak glikozittir, daha doğrusu bir kardenolittir.

Tıp terimleri sözlüğü

Ticari isimler: Strodival

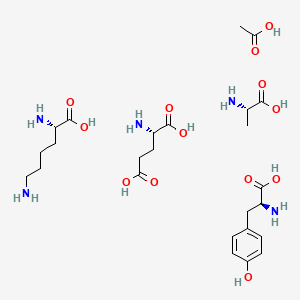
Glatiramer asetat, enjeksiyon için bir çözelti (Copaxone®) olarak ticari olarak mevcuttur. 2004 yılından beri onaylanmıştır. Jenerikler 2015 yılında tescil edildi.

Multipl skleroz tedavisi için.
Uzman bilgilerine göre dozajlanır. Enjeksiyonluk çözelti, günde bir kez önceden doldurulmuş bir şırınga ile deri altından verilir. Enjeksiyon bölgesi günlük olarak değiştirilmelidir.
İhtiyati tedbirlerin tamamı ürün bilgi sayfasında bulunabilir.
Plazma proteinlerine güçlü bir şekilde bağlanan aktif bileşenlerle ilaç etkileşimleri mümkündür.
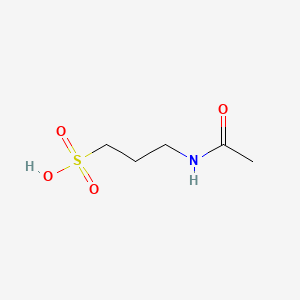
Acamprosat, enterik film kaplı tabletler (Campral®) şeklinde ticari olarak mevcuttur. Aktif bileşen, 1995’ten beri onaylanmıştır.
/campral_lg-569fe68b3df78cafda9efecd.jpg)
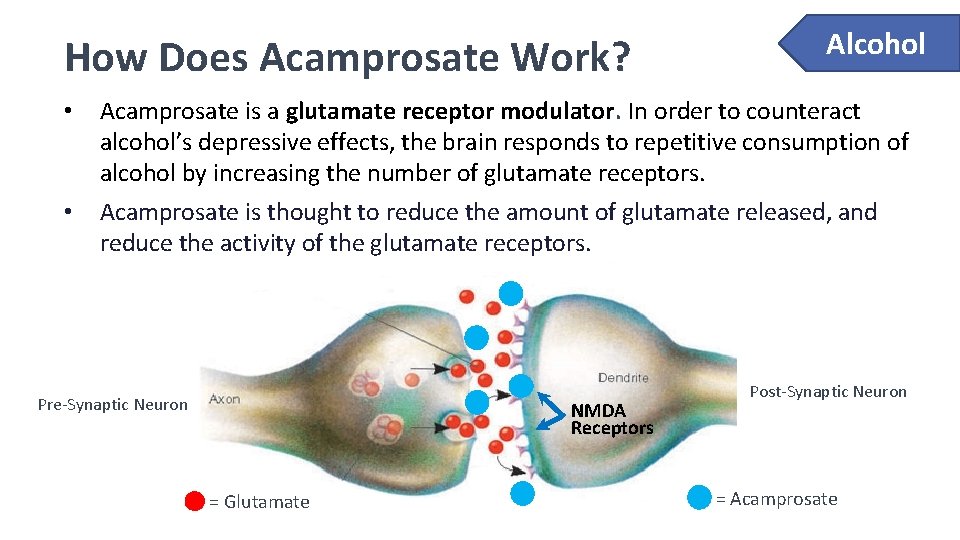
Acamprosat, alkol bağımlılığı için yoksunluk tedavisi sonrası yoksunluğu sürdürmek için kullanılır.
İhtiyati tedbirlerin tamamı tıbbi ürün bilgi sayfasında bulunabilir.
Akamprosat, neredeyse hiç metabolize olmadığı ve değişmeden atıldığı için düşük bir etkileşim potansiyeline sahiptir. CYP450 metabolizmaya dahil değildir. Diltiazem ve naltrekson ile ilaç etkileşimleri bildirilmiştir.
En yaygın olası yan etkiler arasında ishal, karın ağrısı, mide bulantısı, kusma, gaz, kızarıklık, kaşıntı, libido azalması ve iktidarsızlık bulunur.
Alman biyoteknoloji şirketi BioNTech ve Pfizer’den BNT162b2, mRNA aşıları ve Covid-19 aşılarının (Comirnaty®, dondurulmuş süspansiyon) ilk temsilcisi olarak 19 Aralık 2020’de onaylandı. Aşı, 2020 yılında 44.000’den fazla katılımcıyla büyük bir faz III çalışmasında araştırıldı. İsviçre, aşının düzenli bir onay sürecinde onaylandığı ilk ülkeydi.
Aşı, uzun süreli saklama için -60 ° C ile -80 ° C arasında dondurularak saklanır.
-15 ° C ile -25 ° C arasında (donmuş) iki haftaya kadar taşınabilir ve saklanabilir.
Çözüldükten sonra seyreltilmemiş preparat buzdolabında 2 ila 8 ° C’de 5 gün saklanabilir. Kullanmadan önce steril % 0.9 sodyum klorür çözeltisi ile seyreltilmesi gerekir. İlaç bir süspansiyon şeklindedir.
BNT162b2, nükleosit ile modifiye edilmiş bir mRNA aşısıdır (modRNA). Bunlar, SARS-CoV-2’nin başak proteininin oluşumu için mRNA’yı (haberci RNA) içeren lipit nanopartikülleridir.
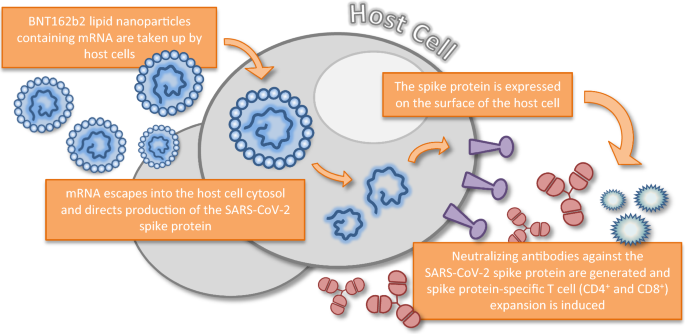
Uygulamadan sonra, vücudun kendi hücreleri mRNA’yı koronavirüsün başak proteinine (S) çevirir. Bu, bir bağışıklık tepkisine neden olur ve enfeksiyona karşı koruma sağlayan antikorların oluşumunu tetikler. Etkinlik ve güvenlik, geniş bir klinik çalışmada doğrulanmıştır (yukarıya bakınız

Covid-19‘un önlenmesi için.
Uzman bilgilerine göre dozajlanır. İlaç, kas içi enjeksiyon (0.3 ml) olarak verilir. En az 21 gün (3 hafta) ara ile iki aşı gereklidir.dozaj
Aşırı duyarlılık
Hamilelik sırasında kullanım için yeterli veri henüz mevcut değildir.
Çalışmanın en önemli dışlama kriterleri hasta öyküsündeki Covid-19, immünsüpresanlar ve immün yetmezliği içeriyordu. Bağışıklık sistemi baskılanmış kişilerde bağışıklık tepkisi azalabilir.
İhtiyati tedbirlerin tamamı tıbbi ürün bilgi sayfasında bulunabilir.
Diğer aşıların birlikte uygulanmasına ilişkin veri bulunmamaktadır.
En yaygın olası yan etkiler şunları içerir:
Klinik çalışmalarda alerjik reaksiyonlar ve anafilaksi gözlenmiştir. Aşılama programları sırasında tolerans daha fazla araştırılacaktır.
Ticari isimler: Androfin®
“Finasteride” kelimesi “fina-” ve “testosteron” kelimelerinin birleşiminden oluşmaktadır. “Fina-” kısmının kökeni bilinmemektedir, ancak “yüzgeç” veya “yüzgeç benzeri yapı” anlamına gelen “fin” kelimesiyle ilişkili olduğu düşünülmektedir. Kelimenin “testosteron” kısmı ise Yunanca’da “testis” anlamına gelen “testis” kelimesinden gelmektedir.
Finasteride ticari olarak film kaplı tabletler şeklinde mevcuttur (prostat: Proscar®, jenerik, 5 mg; saç dökülmesi: Propecia®, jenerikler, 1 mg). 1993’ten beri onaylanmıştır. Propecia®, beş yıl sonra, 1998’de piyasaya sürüldü.
Finasterid iki durumu tedavi etmek için kullanılan bir ilaçtır: prostat büyümesi olarak da bilinen iyi huylu prostat hiperplazisi (BPH) ve daha yaygın olarak erkek tipi kellik olarak bilinen androgenetik alopesi.
BPH: Finasterid, testosteronu dihidrotestosterona (DHT) dönüştüren 5-alfa redüktaz enzimini inhibe ederek çalışır. DHT prostat büyümesine katkıda bulunur. Finasterid, DHT seviyelerini düşürerek prostatın boyutunu azaltmaya ve idrar yapma zorluğu gibi BPH semptomlarını hafifletmeye yardımcı olabilir.
Erkek tipi kellik: Finasteridin DHT üzerindeki etkisi, DHT’nin erkek tipi kellikte önemli bir faktör olduğuna inanıldığından, saç dökülmesinin tedavisinde de yararlı olmasını sağlar. Saç dökülmesi için finasterid alan erkekler genellikle saç dökülmesinin yavaşladığını görür ve bazıları yeni saç büyümesi görebilir.
Finasterid bir 5α-redüktaz inhibitörüdür. 5α-redüktaz, testosteronu dihidrotestosterona (DHT) dönüştüren bir enzimdir. DHT, yüz ve vücut kıllarının büyümesi gibi erkek ikincil cinsiyet özelliklerinin gelişmesinden sorumlu olan daha güçlü bir testosteron formudur. DHT’nin ayrıca iyi huylu prostat hiperplazisi (BPH) ve erkek tipi saç dökülmesinin gelişiminde de rol oynadığı düşünülmektedir.
Finasterid, 5α-redüktazın etkisini bloke ederek çalışır. Bu, testosteronun DHT’ye dönüşmesini önler, bu da BPH ve erkek tipi saç dökülmesinin ilerlemesini yavaşlatmaya yardımcı olabilir.
Esas olarak iyi huylu prostat hiperplazisi (BPH) ve erkek tipi saç dökülmesinin tedavisinde kullanılan bir ilaç olan finasteridin farmakokinetiği, vücuttaki androjen metabolizması üzerindeki spesifik etkisi nedeniyle oldukça ilgi çeken bir alandır. Finasteridin farmakokinetiğini anlamak için vücudun ilacı nasıl emdiğini, dağıttığını, metabolize ettiğini ve salgıladığını keşfetmek önemlidir.
Finasterid oral uygulamadan sonra iyi emilir ve biyoyararlanımı yaklaşık %80’dir. Doruk plazma konsantrasyonuna (Cmaks) uygulamadan bir ila iki saat sonra ulaşılır. Emilim hızı ve miktarı yiyeceklerden önemli ölçüde etkilenmez, dolayısıyla finasterid yemeklerle birlikte veya yemeksiz alınabilir.
Finasterid emildikten sonra nispeten düşük bir dağılım hacmine sahiptir, bu da dokulara sınırlı dağılıma işaret eder. Plazmada yüksek oranda (yaklaşık %90) proteinlere, özellikle albümin ve alfa-1 asit glikoproteine bağlanır. Bağlanma diğer ilaçlar tarafından kolayca değiştirilemez; bu da plazma proteinlerinin yer değiştirmesi nedeniyle ilaç-ilaç etkileşimi riskinin daha düşük olduğu anlamına gelir.
Finasterid, karaciğerde sitokrom P450 3A4 enzim sistemi aracılığıyla, hiçbiri önemli androjen bloke edici aktiviteye sahip olmayan çeşitli metabolitlere geniş ölçüde metabolize edilir. Finasteridin metabolizmasının böbrek yetmezliğinden önemli ölçüde etkilendiği görülmemektedir. Bununla birlikte, karaciğer yetmezliğinin finasterid metabolizmasını etkileyip etkilemediği bilinmemektedir, ancak klerensteki azalmaya bağlı olarak ilaca maruziyet artabilir.
Finasteridin eliminasyonu bifaziktir; hızlı bir başlangıç klerensi ve ardından daha yavaş bir faz gelir. İlacın terminal yarı ömrü 18-60 yaş arası erkeklerde yaklaşık beş ila altı saat ve 70 yaş üstü erkeklerde yaklaşık sekiz saattir; bu da yaşlılarda klerensin biraz azaldığını gösterir. Finasterid ve metabolitleri hem safra hem de idrar yoluyla atılır; ana ilacın idrarla atılımı dozun küçük bir kısmını oluşturur.
Farmakokinetik profili göz önüne alındığında, finasterid tipik olarak günde bir kez dozlanır. Dozlamadan yaklaşık üç gün sonra serumda kararlı durum konsantrasyonuna ulaşır ve farmakokinetiği dozla orantılı değildir; serum konsantrasyonundaki artış, doz artışına göre doğrusal değildir. Bu, farklı hasta popülasyonlarında dozlamayla ilgili hususları etkileyebilir.
Finasteridin etki mekanizması nedeniyle serum prostat spesifik antijen (PSA) düzeylerinde azalmaya neden olduğunu da belirtmekte fayda var. Finasterid alan hastalarda prostat taraması için PSA düzeyleri yorumlanırken, ilacı almayan erkeklerdeki normal aralıklarla karşılaştırmak için değerler iki katına çıkarılmalıdır.
Finasterid tarafından 5-alfa-redüktaz enziminin inhibisyonu, testosteronun, genetik olarak duyarlı bireylerde prostatın genişlemesinden ve saç dökülmesinden sorumlu androjen olan dihidrotestosterona (DHT) dönüşümünü azaltır. Bu farmakolojik etki, finasteridin sırasıyla prostat hacmini önemli ölçüde azaltabildiği ve saçın yeniden büyümesini uyarabildiği BPH ve erkek tipi kellikteki kullanımının temelini oluşturur.
Finasterid tipik olarak iyi tolere edilir, ancak libido azalması, erektil disfonksiyon ve ejakülasyon bozukluğu, meme hassasiyeti, göğüs büyümesi ve döküntü gibi cinsel yan etkiler de dahil olmak üzere yan etkileri olabilir. Finasterid hormon seviyelerini etkilediğinden, erkek fetüsün genital organlarında anormalliklere neden olabileceğinden, özellikle hamile olan veya hamile kalabilecek kadınlar tarafından kullanılmamalıdır.
Finasterid, MK-906 kod adı altında Merck tarafından geliştirilmiştir. Kimyager Gary Rasmusson ve biyolog Jerry Brooks liderliğindeki bir ekip, moleküler tasarım, test ve yeniden tasarımın yinelemeli bir sürecini kullanarak geçiş durumu inhibitörlerine dayalı potansiyel 5α-redüktaz inhibitörleri geliştirdi. 1992 yılında finasterid (5 mg) BPH tedavisi için ABD Gıda ve İlaç Dairesi (FDA) tarafından onaylandı ve Merck tarafından Proscar markası altında pazarlandı. Rasmusson ve Brooks, finasterid üzerindeki çalışmaları nedeniyle 1993 yılında IPO’nun “Yılın Mucidi” ödülüne layık görüldü.
1997 yılında Merck, erkek tipi saç dökülmesinin tedavisi için daha düşük bir finasterid dozunu (1 mg) Propecia markası altında pazarlamak için FDA onayı aldı. Propecia, erkek tipi saç dökülmesinin tedavisi için FDA onaylı tek ilaçtır.
Rocuronium bromide’in isimlendirilmesi, kökenlerini tarihsel olarak steroid bazlı, depolarizan olmayan nöromüsküler blokaj ajanları için kullanılan sistematik isimlendirme kalıplarına kadar götürür. Kesin kurumsal veya tescilli etkiler her zaman resmi olarak belgelenmemiş olsa da (ilaç şirketleri genellikle dahili isimlendirme stratejilerine sahip olduğundan), birkaç tanınabilir dilsel ve kimyasal kural “rocuronium” teriminin temelini oluşturur.
“-curonium” Eki
Önceki Bileşiklerin Etkileri
“Ro-” Öneki
Bromür Tuz Formu
Resmi İsimlendirmeye Entegrasyon
Depolarizan olmayan bir nöromüsküler blokaj ajanı olan rokuronyum bromür, endotrakeal entübasyonu kolaylaştırmak ve cerrahi prosedürler ve mekanik ventilasyon sırasında kas gevşemesini sağlamak için sıklıkla kullanılır. Amerika Birleşik Devletleri’nde klinik kullanım için ilk onayını 1994 yılında aldı ve çeşitli jenerik formülasyonlar arasında Esmeron® ticari adı altında ticari olarak mevcuttur. Rokuronyum bromür, nöromüsküler blokerlerin aminosteroid sınıfına aittir ve yapısal olarak steroid çekirdeğindeki amino ikamesi ile karakterize edilir.

Rokuronyum bromür, yaklaşık 609,7 g/mol’lük bir moleküler ağırlığa sahip C₃₂H₅₃BrN₂O₄ moleküler formülüne sahiptir. Saf haliyle, suda kolayca çözünen, neredeyse beyaz ila soluk sarı, hafif higroskopik bir toz olarak görünür. Yapısal çekirdeği, klinik uygulamada gözlemlenen karakteristik nöromüsküler blokaj özelliklerini veren bir amino grubunun varlığıyla modifiye edilmiş bir steroiddir.
Rokuronyum bromür birincil etkisini nöromüsküler kavşaktaki nikotinik asetilkolin reseptörlerini rekabetçi bir şekilde antagonize ederek, böylece asetilkolin kaynaklı depolarizasyonu inhibe ederek ve iskelet kası felcine yol açarak uygular. Bu mekanizma, rokuronyumun sınıfındaki eski nöromüsküler blokerlere kıyasla nispeten hızlı bir etki başlangıcına sahip olması nedeniyle, hızlı sıralı entübasyon gerektiren klinik ortamlarda avantajlı kabul edilir. İlacın etki süresi, doza, hastanın durumuna ve eş zamanlı ilaçlara bağlı olarak genellikle yaklaşık 30 ila 60 dakika arasında değişebilir.
Rokuronyum bromürün uygulanması genellikle intravenöz enjeksiyon veya sürekli infüzyon yoluyla gerçekleştirilir ve anestezistlerin nöromüsküler blokaj etkisini belirli prosedürel ve hasta gereksinimlerine göre ayarlamasına olanak tanır. Etiket dışı kullanımlar da belgelenmiştir, özellikle tıbbi yardımlı ötanazi bağlamında, ancak bu tür uygulamalar yargı yetkisine göre değişen yasal ve etik hususlara tabidir.
Yaygın yan etkiler arasında lokalize enjeksiyon yeri reaksiyonları, hayati belirtilerdeki dalgalanmalar (örneğin kalp hızı veya kan basıncı) ve ilacın temizlenmesi veya metabolizması bozulursa uzun süreli nöromüsküler blokaj potansiyeli bulunur. Ayrıca, anafilaksi gibi aşırı duyarlılık reaksiyonları bildirilmiştir, ancak bunlar nispeten nadirdir. Rokuronyum bromür, belirli diğer intravenöz ajanlarla karıştırıldığında farmakolojik uyumsuzluklar gösterebilir; bu nedenle, infüzyon hatlarının ve seyreltme protokollerinin dikkatli bir şekilde değerlendirilmesi önerilir.
Kimyasal olarak propofol, yapısını iki izopropil grubu olan bir fenol olarak tanımlayan 2,6-diizopropilfenoldür.
Propofol, hızlı başlangıçlı ve kısa süreli yaygın olarak kullanılan bir intravenöz anesteziktir.

Onaylanmış Endikasyonlar:
Etiket Dışı Kullanım:
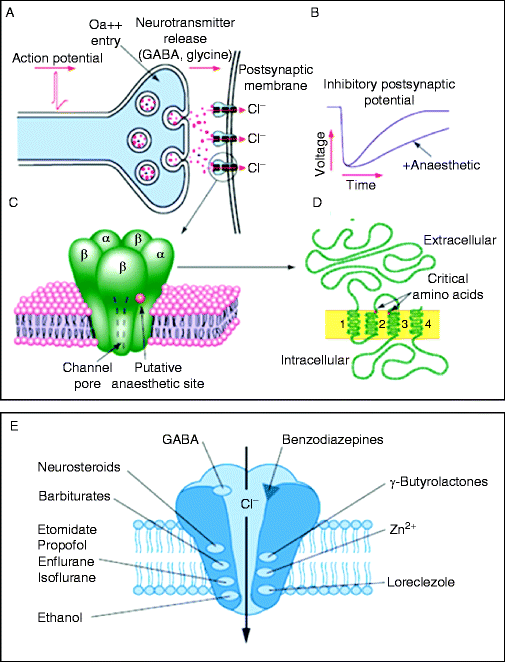
Propofol klinik ortamlarda çok değerlidir ancak yanlış kullanıldığında önemli riskler oluşturur. Güvenli kullanımı, kılavuzlara uyulmasına ve kötüye kullanım potansiyelinin farkında olunmasına bağlıdır.
1840’lar-1850’ler: Anestezinin Gelişimi
1930’lar: İntravenöz Ajanların Keşfi
Fenilefrin, burun damlası, burun spreyi, burun jeli, göz damlası, oral toz şeklinde, bir enjeksiyon preparatı olarak ve tek veya kombinasyon preparatı olarak kapsüller halinde mevcuttur (örn. Neo-Citran®, Triofan® Rinitis Kapsüller, Vibrocil®) . 1968’den beri onaylanmıştır. Rhinopront® ticaret dışıdır.


Dinoproston, doğal prostaglandin E₂ (PGE₂) ile özdeş bir endojen lipit mediyatördür ve obstetrikte servikal olgunlaştırma ve doğum eylemini başlatma amacıyla kullanılan uterotonik ajanlar sınıfında yer alır. Klinik uygulamada vajinal insert (ör. Propess®), vajinal tablet (ör. Prostin E2®) biçimlerinde yaygın olarak bulunur; bazı ülkelerde ayrıca vajinal jel ve vajinal fitil/pessar formları mevcuttur. Düzenleyici onay geçmişi 1980’lerin ortasına uzanır ve pek çok ülkede 1986’dan beri obstetrik kullanım için ruhsatlıdır.
Formülasyonlar arasında uygulama tekniği ve farmasötik teknoloji farklılıkları vardır:
Tüm formlar yalnızca sağlık kuruluşunda, obstetrik izlem ve acil müdahale olanakları mevcutken uygulanmalıdır.
Dinoprostonun klinik etkisi, hem servikal dokuda olgunlaşma hem de miyometriyumda kasılma aktivitesi üzerinden iki eksende anlaşılır:
Bu çift yönlü etki, Bishop skoru düşük olan olgularda servikal olgunlaşma ile doğum indüksiyonunun başarı şansını yükseltir; aynı zamanda aşırı uyarılma olasılığı nedeniyle yakın fetal-maternal izlem gerektirir.
Vajinal yolla uygulanan dinoproston lokal yüksek doku maruziyeti ve düşük sistemik düzeyler hedefler. Sistemik dolaşıma geçen fraksiyon, karaciğer ve akciğerlerde hızlı enzimatik yıkıma uğrar; dolaşımdaki yarı ömrü dakikalar mertebesindedir. Kontrollü salım insert yapıları, belirli bir hızda sürekli salınım sağlayarak öngörülebilir farmakodinamik profil ve gerektiğinde derhal çıkarılabilme avantajı sunar. İlacın soğuk zincirde saklanması (genellikle buzdolabı ısısı) birçok hazırlayıcı için standart lojistiktir.
Kesin kontrendikasyonlar (örnekler):
Dikkat gerektiren durumlar:
Fetal/uterin ilişkili:
Maternal:
Yönetim ilkeleri:
Dinoproston preparatları çoğunlukla soğuk zincirde muhafaza edilir ve tek hasta/tek kullanım prensibiyle uygulanır. Uygulama yalnızca doğum eylemini izleyebilen ve acil sezaryen dâhil müdahale kapasitesi olan merkezlerde yapılmalıdır. Uygulama öncesi bilgilendirilmiş onam, indüksiyon endikasyonunun belgelenmesi ve alternatiflerin (mekanik dilatasyon, oksitosin stratejileri vb.) tartışılması iyi klinik uygulamanın parçasıdır.
Dinoproston seçimi; gebelik yaşı, servikal durum, obstetrik öykü (özellikle önceki uterin cerrahi), anne-fetüs risk profili ve kurumsal protokollerle belirlenir. Alternatifler arasında mekanik yöntemler (balon kateter), diğer prostaglandinler (ör. misoprostol; ülkeye ve merkeze göre değişen protokoller) ve oksitosin yer alır. Klinik ekip, her seçenek için fayda–risk dengesini ve izlem gereksinimlerini göz önünde bulundurur.
Vajinaya yerleştirilen küçük bir insertin arkasında, neredeyse bir asra yayılan bir bilim ve keşif öyküsü yatar. Bu öykünün kahramanları yalnızca doğumhanedeki hekimler değil; aynı zamanda sıçan uterus şeritlerini titreten ilk damlaları gözleyen fizyologlar, kloroform kokulu odalarda viskoz özleri ayıran biyokimyacılar, karbon zincirlerini inatla birleştiren sentetik kimyagerler, hücre zarındaki taşıyıcıları yakalayan moleküler biyologlar ve klinik protokol satırları arasına güvenlik sınırlarını işleyen ebeler ve hemşirelerdir.
1930’da İsviçre–ABD hattında çalışan iki araştırmacı, Siegfried Kurzrok ve Charles Lieb, insan semeninin izole uterus preparatlarında güçlü kasılmalar tetiklediğini gösterdiklerinde, henüz “prostaglandin” kelimesi yoktu. Yakında İsveçli Ulf von Euler, bu biyolojik etkinin ardındaki yağ türevli mediyatörleri semenden ayırıp karakterize etmeye girişti ve 1930’ların ortasında bu maddelere “prostat bezi”ne atfen prostaglandin adını verdi. İsim yanıltıcıydı; çünkü ileride anlaşılacaktı ki bu bileşikler yalnız prostattan değil, çok sayıda dokudan salınıyordu. Yine de ad, bilimin sözlüğüne kazındı ve “görünmez ama güçlü yerel hormonlar” fikri bir çekirdek gibi yerleşti.
Savaş sonrası kimyanın altın çağında, İsveç’te Sune Bergström ve öğrencisi Bengt Samuelsson, yağ asidi kökenli bu mediyatörlerin yapı ve alt sınıflarını adım adım çözdüler. E-serisi ve F-serisi ayrımı, 5 üyeli siklopentan halkasındaki fonksiyonel grupların konumuna dayandırıldı; Prostaglandin E₂ (PGE₂) ise —klinikte “dinoproston” adıyla bildiğimiz molekül— iki çifte bağa sahip, C-9’da keton grubu taşıyan özgül bir kimyasal portre kazandı. Aynı yıllarda İngiltere’de John Vane, bu sınıfın enzimatık üretiminde kilit olan siklooksijenaz (COX) yolunu ve nonsteroid antiinflamatuvarların bu yolu nasıl bastırdığını deneysel olarak sergileyerek, prostaglandin biyolojisini fizyopatolojiyle köprüledi. Bu üç ismin çabaları 1982’de Nobel’le onurlandırıldığında, PGE₂/dinoproston artık “adı, soyadı ve adresi belli” bir mediyatördü.
Doğal kaynaklardan miligram ölçeklerde ayırmak, farmasötik bir gelecek için yeterli değildi. Organik sentezde E. J. Corey ve çağdaşları, prostaglandinlerin ilk toplam sentez rotalarını kurarak endüstriyel ölçekte erişimi mümkün kıldılar. Böylece “biyolojik öz”den “tekrarlanabilir molekül”e geçildi. Obstetrik klinikler, deneysel fizyolojinin işaret ettiği uterotonik ve servikal olgunlaştırıcı etkiyi dikkatli protokollerle sınamaya başladılar. Vajinaya yerel uygulama fikri, servikste zengin reseptör ekspresyonu ve ekstrasellüler matriks üzerinde güçlü “yumuşatma” etkisi nedeniyle hızla benimsendi. İlk dalga formülasyonlar vajinal jel ve vajinal tablet/pessar biçiminde sahneye çıktı; “Prostin E2®” gibi ticari adlar, doğum salonlarının standart sözlüğüne girdi.
Dinoprostonun etkisi yalnızca “uterusu kasar” ifadesine sığmıyordu. Servikste kolajen liflerinin çapraz bağlarını gevşeten ve hyaluronan içeriğini artıran bir yeniden yapılanma başlattığı; MMP-2/MMP-9 gibi matriks metalloproteinazların düzenlenmesine aracılık ettiği anlaşıldı. Miyometriyumda EP1/EP3 ağırlıklı reseptörler üzerinden Ca²⁺ sinyallemesini yükseltirken, EP2/EP4 aracılı gevşeme yolakları dokuya ve gebelik evresine göre farklı dengeler kuruyordu. Upstream’de, membran fosfolipitlerinden türeyen arşidonik asit COX-1/COX-2 ile PGH₂’ye, oradan PGE sentaz izoenzimleriyle PGE₂’ye dönüştürülüyordu. Downstream’de ise hücre zarı boyunca akı, SLCO2A1 (PGT) taşıyıcısı ve MRP4 (ABCC4) gibi dışa akım pompalarıyla incelikli bir farmakokinetik–farmakodinamik örgü örüyordu. Bu moleküler harita, hem etkinlikle güvenliği dengeleyen klinik kararların hem de yeni formülasyonların pusulası hâline geldi.
Klinik pratikte en kritik mesele, hiperstimülasyon riskini azaltırken olgunlaşmayı güvenle başarmaktı. Burada dönüm noktası, kontrollü salım ve “geri alınabilirlik” fikrinin tek bir formda birleştiği vajinal insert tasarımı oldu. Lif benzeri polimer matriks içinde yerleşik dinoproston, saatlere yayılan öngörülebilir bir salım profili sunuyor; fetal distres ya da taşisistol saptandığında insertin ipinden çekilerek derhal çıkarılması mümkün oluyordu. Avrupa’da Propess®, ABD’de eşdeğeri olan Cervidil® gibi adlarla tanınan bu teknoloji, doğum indüksiyonu lojistiğini yeniden biçimlendirdi. Geleneksel Prostin E2® tablet/fitil ve jel formülasyonları ise, kurumların deneyimi ve hasta özelliklerine göre önemini korudu. Pek çok ülkede dinoproston obstetrik endikasyonlarla 1980’lerin ortasından itibaren ruhsatlıydı; yerel kılavuzlar ve kurum içi protokoller, oksitosin ile ardışık kullanımda “wash-out” aralığını, izlem sıklığını ve acil müdahale eşiklerini ayrıntılandırdı.
Dinoproston, özellikle Bishop skoru düşük olgularda servikal olgunlaşmayı hızlandırarak vajinal doğum şansını artırdı. Çoklu gebelik, önceki uterin skar, büyüme geriliği, sınırda plasental rezerv gibi zorlu durumlarda ise karar verme, yalnız etkinlik değil güvenlik marjı üzerinden yürüdü. İzlemde CTG standartlaştı; hiperstimülasyon eşiği (ör. 10 dakikada ≥5 kasılma) ve hipertonisite tanımları, sahada ortak bir dil yarattı. Maternal yan etkiler —ateş, bulantı, baş ağrısı, vajinal sıcaklık hissi— çoğunlukla yönetilebilir kalırken, nadir ama ciddi olayların önlenmesi erken fark et–erken kes stratejisiyle mümkün oldu.
Güncel araştırma cephesi, keşfi yeniden laboratuvar tezgâhına ve bilgisayar ekranına taşıyor:
Bu hikâyede “keşif” bir defaya mahsus bir iş değildir; her kuşak öncekinin haritasına yeni bir katman ekler. Siegfried Kurzrok ve Charles Lieb, organ banyosundaki ilk dalgayı görerek kapıyı araladılar. Ulf von Euler, ismi verdi ve biyolojik etkiyi kimyanın konusu hâline getirdi. Sune Bergström ve Bengt Samuelsson, E-serisini teşhis edip yolakları çizdiler; John Vane, bu yolakları klinik farmakolojiye bağladı. E. J. Corey ve dönemin sentetik kimyagerleri, molekülü laboratuvarda yeniden kurup endüstriyel üretimin eşiğini açtılar. Obstetrik klinisyenler ve ebeler, bu molekülü doğumhanenin rutinine, önce jel ve tablet/pessar, sonra kontrollü salımlı insert halinde yerleştirdiler. Üretici ekipler —Prostin E2®’nin arkasındaki endüstriyel miras, Propess®/Cervidil®’in kontrollü salım teknolojisi— formülasyonu güvenlik kültürüyle birleştirdiler. Moleküler biyologlar taşıyıcıları, doku mühendisleri organoidleri, veri bilimciler CTG’nin ince desenlerini keşfederek hikâyeyi bugünlere taşıdılar.
Bugün dinoproston; doğumu başlatmanın “tek ilacı” değil, çok disiplinli bir kararın farmakolojik ayağıdır. Servikal biyolojinin fizyolojik inflamasyon penceresini nazikçe aralayan, eşik aşıldığında ise geri çekilebilen bir araçtır. Keşif, artık yalnız bir molekülün bulunması değil; doğru hastada, doğru zamanda, doğru doz ve doğru formülasyonla güvenli bir deneyimin birlikte tasarlanmasıdır.
“Metilksantin” terimi iki bileşenden türetilmiştir:
Metilksantinler, ksantinlerin metilasyonu yoluyla oluşan bir grup bileşiktir. Bu kimyasal bileşikler, bir veya daha fazla metil grubu eklenmiş ksantin türevleridir. Metilksantinlerin iyi bilinen bazı örnekleri arasında kafein, teofilin ve teobromin bulunmaktadır.
Metilksantinler, purin halkasında metil grupları bulunan bir ksantin türevleri sınıfıdır ve astım gibi solunum yolu rahatsızlıklarında bronkodilatör ve anti-inflamatuar etkileri için öncelikli olarak kullanılır. Kimyasal yapıları ve farmakolojik mekanizmaları birden fazla yolu içerir, ancak bazı yönleri hala araştırılmaktadır.
Metilksantinler, ksantin çekirdek yapısının nitrojen pozisyonlarındaki (N1, N3, N7) hidrojen atomlarının metil gruplarıyla değiştirilmesiyle oluşur. Başlıca örnekler şunlardır:
| Bileşik | R₁ | R₂ | R₃ | Metil Pozisyonları |
|---|---|---|---|---|
| Kafein | CH₃ | CH₃ | CH₃ | 1,3,7-trimetilksantin |
| Teofilin | CH₃ | CH₃ | H | 1,3-dimetilksantin |
| Teobromin | H | CH₃ | CH₃ | 3,7-dimetilksantin |
| Paraksantin | CH₃ | H | CH₃ | 1,7-dimetilksantin |
Teofilin-etilendiamin kompleksi olan aminofilin, teofilinin klinik kullanım için çözünürlüğünü artırır[1][5]. Bu ikameler çözünürlüğü ve farmakolojik aktiviteyi etkiler; örneğin, teofilinin kafeine kıyasla daha düşük çözünürlüğü terapötik dozajını etkiler.
Farmakolojik Etkiler
Etki Mekanizmaları
Klinik Hususlar
Terapideki Güncel Rolü
Büyük ölçüde inhale β-agonistler/kortikosteroidler tarafından ikame edilmiş olsa da, metilksantinler özellikle şiddetli veya dirençli astımda yardımcı seçenekler olmaya devam etmektedir. Araştırmalar, anti-inflamatuar potansiyellerini ve yeni hedeflerini keşfetmeye devam etmektedir.
Antik Kullanım (Tarih Öncesi Dönemler – Erken Uygarlıklar)
1819 – Kafeinin İzolasyonu
1821 – Kafeinin Saflaştırılması ve İsimlendirilmesi
1827 – Teobrominin Keşfi
1841 – Teofilinin İzolasyonu
1860’lar-1880’ler – Kimyasal Yapının Aydınlatılması
19. Yüzyılın Sonları – Farmakolojik Çalışmalar
20. Yüzyıl – Ticari ve Tıbbi Uygulamalar
Modern Dönem (20. Yüzyıl Sonu – 21. Yüzyıl Başı)
Yorum yazabilmek için oturum açmalısınız.