ἀντι– (anti-) + βιωτικός (biōtikós) (<—βίος (bíos, “life”) + -τικός (-tikós)) + -us (Nötr formda)
- Antibiyotikler, mikroorganizmaların metabolizması üzerinde engelleyici bir etkiye sahip olan ve böylece üremelerini veya hayatta kalmalarını engelleyen maddelerdir.
- Bakterilerin gelişimini engellemek ve öldürmek amacıyla kullanılan aktif maddelerdir.
- Kural olarak, AB olarak kısaltılan antibiyotikler, bakteriyel bulaşıcı hastalıkların lokal veya sistemik tedavisi için ilaçlar olarak tanımlanır.
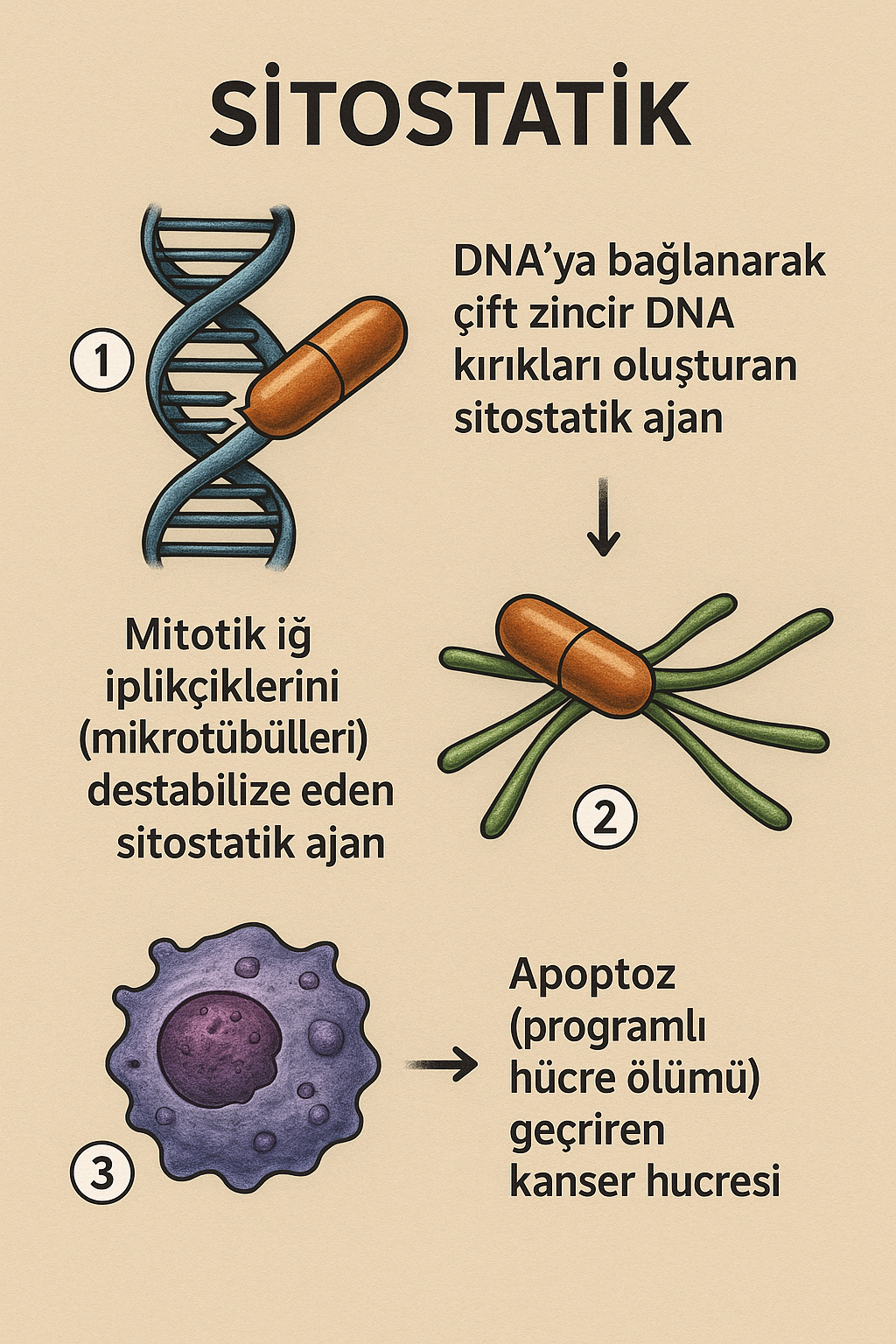
- Bazı madde sınıfları ayrıca immünosupresanlar veya sitostatikler olarak da kullanılır.
- Tedavi için ve daha nadiren bakteriyel bulaşıcı hastalıkların önlenmesi için verilirler.
- Etkileri, patojene özgü moleküler yapılarla seçici etkileşime dayanır.
- Antibiyotikler genellikle oral, parenteral veya lokal olarak uygulanır.
- Yaygın olası yan etkiler hazımsızlık, alerjik reaksiyonlar, mantar enfeksiyonları, deri döküntüleri ve baş ağrısı ve baş dönmesi gibi merkezi sinir bozukluklarıdır.
- Bakteriler antibiyotiklere karşı direnç geliştirebilir ve bu da onları etkisiz hale getirir.

Antibiyotik’ terimi, ilk ortaya çıkışından bu yana anlamında çok sayıda değişiklik gördü. Başlangıçta sadece mikroorganizmaların kendileri tarafından sentezlenen düşük moleküler ağırlıklı maddeler için kullanıldı.
Zahner (1965), biyolojide antibiyotikleri, diğer organizmalara (veya onların hücrelerine) karşı seçici bir toksisiteye sahip olan biyojenik kökenli maddeler olarak tanımlar. Bu tanıma göre, daha yüksek organizmalardan gelen diğer bazı toksinler de antibiyotik olarak kabul edilmelidir (örneğin, risin, kolşisin).
Daha dar bir anlamda, antibiyotikler yalnızca prokaryotlara karşı belirli bir etkiye sahip olan maddeleri içerir. Arkeler, bu alandan hiçbir patojen bilinmediğinden ve ayrıca bakterilere yapısal ve fizyolojik farklılıklar gösterdiğinden hariç tutulur. Diğer mikroorganizmalarla enfeksiyonlar için, kavramsal olarak sınırlandırılmış aktif madde grupları da vardır: virüsler için antiviraller, mantarlar için antimikotikler, protozoa için antiprotozoikler ve solucanlar için antelmintikler. Antibiyotiklerle birlikte antienfektifler grubuna girerler. Bununla birlikte, bu aktif bileşen grupları arasında bir miktar örtüşme vardır.
Daha geniş anlamda, ‘antibiyotik’ terimi, yüksek veya düşük moleküler ağırlıklı, doğal veya sentetik kökenli olup olmadığına bakılmaksızın, herhangi bir formdaki mikroorganizmalara (bakteri, mantar ve protozoa) karşı etkili olan tüm maddeler için kullanılır. Anti-enfektif adı, bu anlam için yeni bir toplu terim olarak tanıtıldı, ancak bu çok yaygın değil.

Antibiyotikler, bakterileri öldürerek ya da büyümelerini engelleyerek bakteriyel enfeksiyonları tedavi etmek için kullanılan bir ilaç sınıfıdır. Penisilinin 1928 yılında keşfedilmesinden bu yana, her biri belirli bakteri türlerini ve bakteriyel süreçleri hedef alan birçok farklı antibiyotik sınıfı geliştirilmiştir. Aşağıda bazı ana antibiyotik sınıflarına ve bunların gelişimlerine kısa bir genel bakış yer almaktadır:
- Penisilinler: Penicillium mantarından türetilen bu beta-laktam antibiyotik grubu ilk keşfedilen antibiyotiklerdir. Penisilin G ve V günümüzde hala kullanılmaktadır, ancak bakteriyel direnç nedeniyle etkinlikleri azalmıştır. Dirençle mücadele etmek ve aktivite spektrumunu genişletmek için daha sonra amoksisilin ve ampisilin gibi yarı sentetik penisilinler geliştirilmiştir.
- Sefalosporinler: Bir başka beta-laktam antibiyotik sınıfı olan sefalosporinler 1940’larda keşfedilmiştir. Penisilinlere benzer bir etki mekanizmasına sahiptirler ancak bakteriyel enzimlere karşı daha dirençlidirler. Sefalosporinler nesillere ayrılır ve her nesil daha geniş bir aktivite spektrumuna ve bakteriyel enzimlere karşı daha fazla dirence sahiptir. Örnekler arasında sefaleksin (birinci nesil), sefuroksim (ikinci nesil), seftriakson (üçüncü nesil) ve sefepim (dördüncü nesil) bulunmaktadır.
- Karbapenemler: Bunlar şiddetli veya yüksek riskli bakteriyel enfeksiyonları tedavi etmek için kullanılan geniş spektrumlu beta-laktam antibiyotiklerdir. Diğer beta-laktam antibiyotikleri parçalayan bakteriyel enzimlere karşı oldukça dirençlidirler. Örnekler arasında imipenem, meropenem ve ertapenem bulunur.
- Makrolidler: 1950’lerde keşfedilen makrolidler, bakteriyel protein sentezini inhibe eden bir antibiyotik sınıfıdır. Genellikle penisilin alerjisi olan hastalar için penisiline alternatif olarak kullanılırlar. Örnekler arasında eritromisin, klaritromisin ve azitromisin bulunur.
- Tetrasiklinler: 1940’larda keşfedilen bu antibiyotik grubu da bakteriyel protein sentezini inhibe eder. Geniş bir aktivite spektrumuna sahiptirler ancak bakteriyel direnç ve yan etkilerle sınırlıdırlar. Örnekler arasında tetrasiklin, doksisiklin ve minosiklin bulunur.
- Aminoglikozidler: 1940’larda keşfedilen bu antibiyotikler bakteriyel protein sentezini hedef alır ve özellikle aerobik Gram-negatif bakterilere karşı etkilidir. Şiddetli enfeksiyonları tedavi etmek için genellikle diğer antibiyotiklerle birlikte kullanılırlar. Örnekler arasında gentamisin, amikasin ve tobramisin bulunur.
- Florokinolonlar: 1980’lerde ortaya çıkan bu sentetik antibiyotik sınıfı, bakteriyel DNA sentezini inhibe eder. Geniş bir aktivite spektrumuna sahiptirler ve genellikle idrar yolu enfeksiyonlarını, solunum yolu enfeksiyonlarını ve gastrointestinal enfeksiyonları tedavi etmek için kullanılırlar. Örnekler arasında siprofloksasin, levofloksasin ve moksifloksasin bulunmaktadır.
- Glikopeptitler: 1950’lerde keşfedilen glikopeptidler bakteri hücre duvarı sentezini inhibe eder ve özellikle MRSA gibi ilaca dirençli suşların neden olduğu Gram-pozitif bakteriyel enfeksiyonları tedavi etmek için kullanılır. Vankomisin en iyi bilinen glikopeptid antibiyotiktir.
- Oksazolidinonlar: 2000’li yıllarda piyasaya sürülen bu yeni sentetik antibiyotik sınıfı, bakteriyel protein sentezini inhibe eder ve ilaca dirençli suşlar da dahil olmak üzere Gram-pozitif bakterilere karşı etkilidir. Linezolid, klinik kullanım için onaylanan ilk oksazolidinon antibiyotiktir.
- Polimiksinler: 1940’larda keşfedilen bu antibiyotik sınıfı, bakteriyel hücre zarlarını hedef alır ve Gram-negatif bakterilere karşı etkilidir. Polimiksin B ve kolistin polimiksin antibiyotik örnekleridir.
- Sülfonamidler: 1930’larda keşfedilen sülfonamidler ilk sentetik antibiyotiklerdir. Büyümeleri için gerekli olan folik asidin bakteriyel sentezini inhibe ederek çalışırlar. Sülfonamidler genellikle idrar yolu enfeksiyonlarını ve diğer bakteriyel enfeksiyonları tedavi etmek için trimetoprim gibi diğer antibiyotiklerle birlikte kullanılır.
- Linkozamidler: 1960’larda keşfedilen bu antibiyotik sınıfı, bakteriyel protein sentezini inhibe eder ve Gram-pozitif bakterilere karşı etkilidir. Klindamisin yaygın olarak kullanılan bir linkozamid antibiyotiktir.
- Streptograminler: Streptograminler, bakteriyel ribozoma bağlanarak bakteriyel protein sentezini inhibe eden bir antibiyotik sınıfıdır. Gram-pozitif bakterilere karşı etkilidirler ve genellikle ilaca dirençli suşların neden olduğu enfeksiyonları tedavi etmek için kullanılırlar. Kinupristin/dalfopristin streptogramin kombinasyonu antibiyotiklere bir örnektir.
- Nitroimidazoller: 1950’lerde keşfedilen bu antibiyotik sınıfı, öncelikle anaerobik bakteriyel enfeksiyonları ve protozoal enfeksiyonları tedavi etmek için kullanılır. Bakteriyel DNA’ya zarar vererek hücre ölümüne yol açarak çalışırlar. Metronidazol yaygın olarak kullanılan bir nitroimidazol antibiyotiktir.
- Monobaktamlar: Monobaktamlar, benzersiz bir monosiklik yapıya sahip olan bir beta-laktam antibiyotik sınıfıdır. Aerobik Gram-negatif bakterilere karşı etkilidirler ve genellikle penisilin alerjisi olan hastalarda enfeksiyonları tedavi etmek için kullanılırlar. Aztreonam piyasada bulunan tek monobaktam antibiyotiktir.
- Ketolidler: Ketolidler, makrolidlerden türetilen daha yeni bir antibiyotik sınıfıdır. Gelişmiş bir aktivite spektrumuna sahiptirler ve makrolidlere dirençli bakterilere karşı etkilidirler. Telitromisin, klinik kullanım için onaylanan ilk ketolid antibiyotiktir.
Yıllar içinde antibiyotik geliştirme çalışmaları, mevcut antibiyotiklerin etkinliğini, aktivite spektrumunu ve güvenliğini artırmanın yanı sıra giderek büyüyen antibiyotik direnci sorunuyla mücadele etmek için yeni antibiyotik sınıfları keşfetmeye odaklanmıştır. Antibiyotik geliştirme alanında devam eden araştırmalar, bakteriyel enfeksiyonlar için etkili tedavilerin sürekli kullanılabilirliğini sağlamak için çok önemlidir.