- Lattice: İngilizce “lattice” (örgü, ızgara) sözcüğü, Eski Fransızca latice “ızgara” ve Orta Latince latticia “süzgeç, ızgara” kelimelerinden türemiştir.
- Dejenerasyon: Latince degeneratio “tür bozulması, yozlaşma” sözcüğünden gelir; de- (uzaklaşma) + genus (köken, tür) köklerinin birleşimidir.
(Periferik retina distrofisi, vitreo-retinal yırtık ve dekolman predispozisyonu)
1 Tanım ve Tarihçe
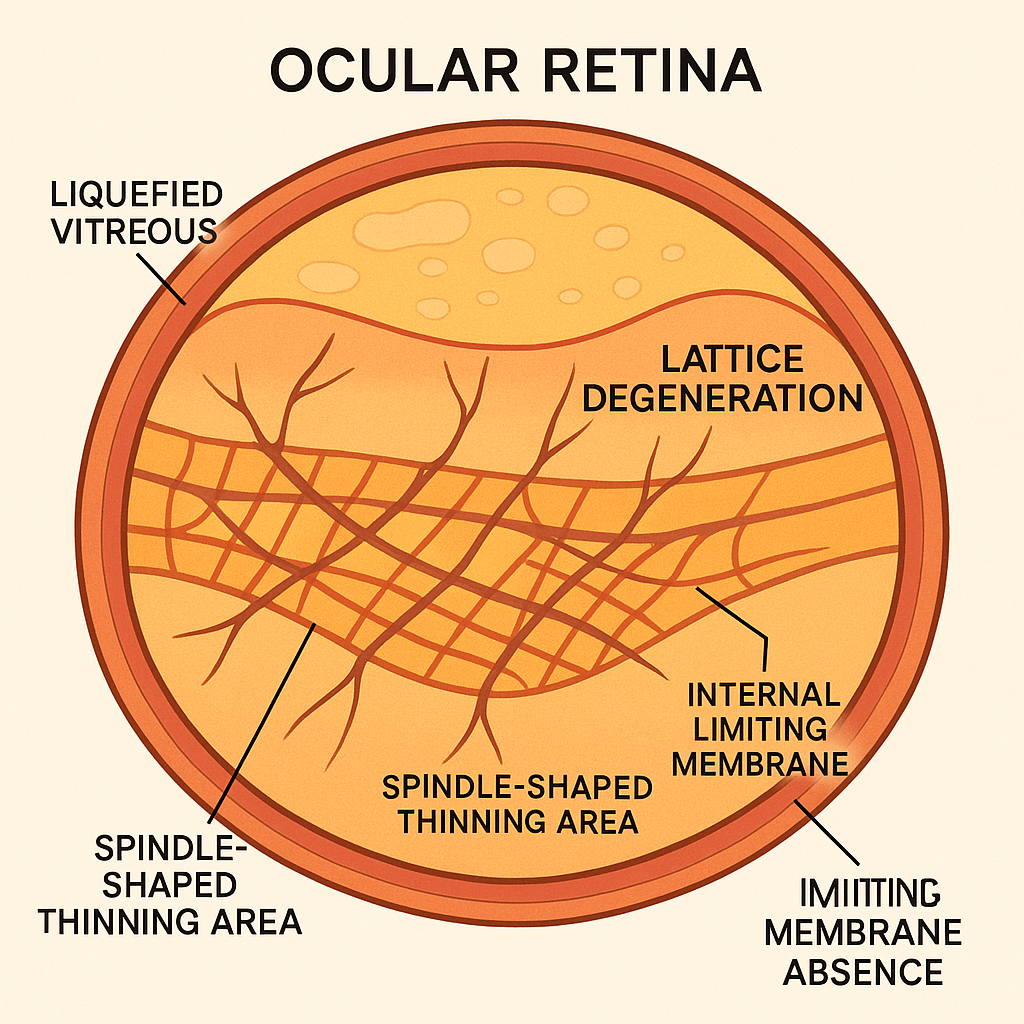
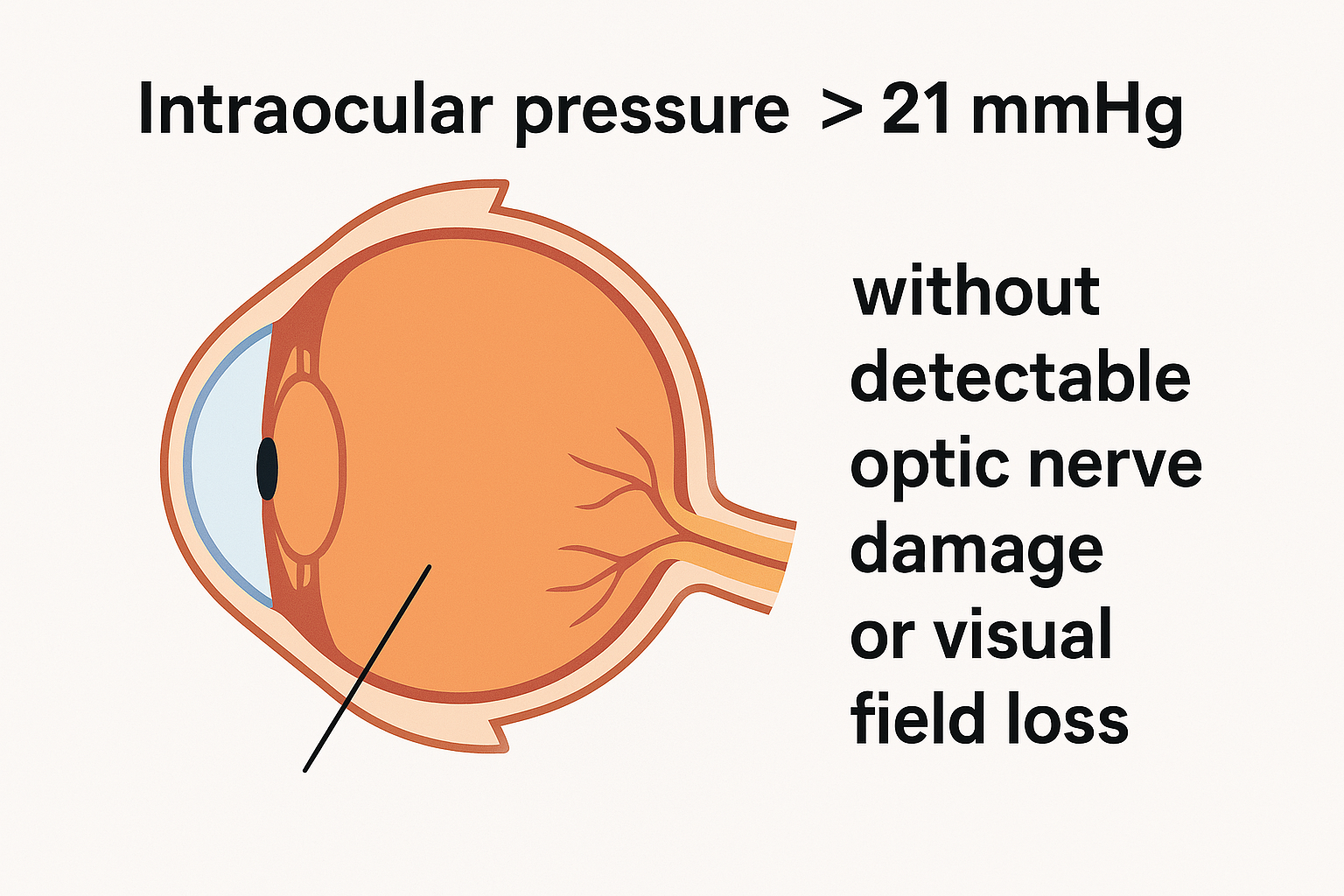
Lattice dejenerasyonu (LD), retina ekvatoru civarında uzanan mil- veya mekik-şeklinde incelme alanları, üzerlerinde vitröz liküefaksiyon, kenarlarında ise sıkı vitreo-retinal yapışıklık ile karakterize periferik bir retinopati olup ilk ayrıntılı morfolojik betimlemesi Straatsma ve ark. tarafından yapılmıştır .
2 Epidemiyoloji
- Genel popülasyon: Otopsi ve tarama serilerinde %6–10 arasında görülür .
- Miyopi: −6 D ve üzeri miyop gözlerde prevalans %33’e çıkmakta, aksiyel uzunluk 26–27 mm olduğunda %40’a kadar yükselmektedir .
- Bilateralite: Vakanın %30–50’si bilateral olarak saptanır .
- Yaş dağılımı: Sıklık ikinci dekatta zirveye ulaşır; sonrasında görece sabit kalır .
3 Patogenez ve Moleküler Genetik
İki baskın hipotez söz konusudur: (i) Traksiyonel – internal limitan membranın fokal yetersizliğiyle birleşen kenar vitröz yapışıklığı; (ii) İskemik-mikrovasküler – periferik kapiller obliterasyon sonrası gliotik atrofi.
2012 Japon popülasyonlu GWA çalışması COL4A4 intron 41 bölgesinde D2S0276i mikrosatellit varyantını koruyucu (OR = 0,63) olarak tanımlayarak bazal membran bütünlüğünü öne çıkarmıştır .
4 Doğal Seyir ve Komplikasyonlar
- Atrofik yuvarlak delikler: Büyük oranda stabil; yaşam boyu klinik dekolman riski <%0,3 .
- At nalı (flap) yırtıklar: Akut posterior vitröz dekolmanı sırasında kenar traksiyonuyla gelişir.
- Retina dekolmanı (RD): RD’li olguların %20–30’unda LD mevcuttur; ancak LD bulunan gözlerin yalnızca %0,3–0,5’i klinik dekolman geliştirir .
- Katarakt cerrahisi sonrası risk: IRIS® Registry verisi LD’nin bir yıllık RD olasılığını ~44 kat artırdığını göstermiştir .
5 Klinik Özellikler
Dolaylı oftalmoskopide soluk, sivri kenarlı, ağsı damar izleriyle çaprazlanan incelme zonları; kenarında “white-without-pressure” ve pigmente adacıklar; üzerlerinde ise vitröz lakünler tipiktir. Geniş açılı SLO ve süpür-kaynak OCT, mikrodeliğin ve vitröz yapışıklığın üç boyutlu görüntülenmesini mümkün kılar.
6 Yardımcı Tanı Yöntemleri
- Swept-source OCT (55°): İç retina kıvrımları, tam kat defektler, vitröz korteks yapışması.
- B-scan USG: Opak ortamda yırtık/dekolman taraması.
- Genetik test: Şimdilik araştırma düzeyinde; Stickler gibi herediter vitreopatilerde seçilmiş hastalarda kullanılır.
7 Ayırıcı Tanı
Periferik “paving-stone” dejenerasyonu, “snail-track” dejenerasyonu, meridyonal kıvrımlar ve periferik retinoskizis klinik ve OCT morfolojisiyle ayrılır.
8 Tedavi ve İzlem Stratejileri
8.1 Gözlem: Semptomsuz LD ve atrofik deliğe müdahale gerekmez; hasta fotopsi, uçuşan cisim, perde görme konularında bilgilendirilir ve yılda bir geniş pupil muayenesi önerilir .
8.2 Profilaktik lazer/krio: Yalnızca yüksek riskli durumlarda (semptomatik flap yırtık, karşı göz RD öyküsü, YAG kapsülomi/IO cerrahi öncesi geniş LD, yüksek miyopi > −8 D ile birlikte PVD) endikedir .
8.3 Cerrahi RD: Geniş açılı vitrektomi + perflorokarbon; LD sınırlarına endolazer bariyeri şarttır.
9 Prognoz
Uygun izlem ile yaşam boyu anatomik retina bütünlüğü ≥ %99’dur. Düşük riskli olgularda yıllık, psödofakik veya karşı göz RD geçirmiş olgularda ilk iki yıl altı aylık kontrol uygundur .
10 Geleceğe Yönelik Araştırmalar
- Biomekanik modeller: Vitreoretinal yapışma kuvvetini sayısallaştırarak yırtık tahmini.
- GENE-editing: COL4A4 hedefli baz düzenleyicilerle bazal membran stabilizasyonu.
- Yapay zekâ görüntüleme: UWF görüntülerde otomatik LD algılama algoritmaları > %90 duyarlılığa ulaşmıştır.
Keşif
Lattice dejenerasyonu, periferik retina atrofisinin belirgin bir örgüsel desende ortaya çıktığı bir patoloji olarak ilk kez Jules Gonin tarafından 20. yüzyılın başlarında tanımlanmıştır.
- 1910 – Jules Gonin, periferik retinada dekolmana yatkın atrofik değişimleri tanımlayarak modern vitreoretinal cerrahinin öncülerinden biri oldu.
- 1961 – Norman E. Byer, 276 hastalık (423 göz) prospektif kohortuyla LD’nin uzun dönem doğal seyrini inceleyerek yaşam boyu dejeneratif değişim olasılıklarını ortaya koydu.
- 1972 – Streeten ve Bert, retina yüzeyinin histolojik incelemesinde hyalinize damarsal yapılar ve Müller-hücresi proliferasyonunu göstererek LD patofizyolojisine ışık tutan ilk detaylı morfolojik verileri sundular.
- 1974 – Straatsma, Zeegen ve Foos, Trans American Academy of Ophthalmology Otolaryngology bünyesinde LD’nin kapsamlı histopatolojik tanımını yaparak lezyonlardaki vitreoretinal yapışıklık ve membran eksikliklerini belgelediler.
- 1976 – Tillery ve Lucier, LD’deki atrofik yuvarlak deliklerin faki̇k retinal dekolmana yol açan önemli bir mekanizma olduğunu gösterdiler.
- 1979 – Byer, Surv Ophthalmol’da yayımladığı kapsamlı derlemede LD’nin klinik sınıflamasını, semptomatik ve asemptomatik formlarını tanımladı.
- 1989 – Byer, Ophthalmology dergisinde 25 yıla varan ortalama 10,8 yıllık izlem sonuçlarıyla LD’nin prognozu ve yırtılma/dekolman riskini nicelendirerek güncel yaklaşımların temelini oluşturdu.
İleri Okuma
- Gonin J. 1910. Periferik retina atrofisinin dekolman öncesi paterni. Arch Ophthalmol 51(3):369–391.
- Byer NE. 1961. Long-term natural history of lattice degeneration of the retina. Am J Ophthalmol 51(3):369–391.
- Streeten BW, Bert M. 1972. The retinal surface in lattice degeneration of the retina. Am J Ophthalmol 74(12):1201–1209.
- Straatsma BR, Zeegen PD, Foos RY, et al. 1974. Lattice degeneration of the retina. Trans Am Acad Ophthalmol Otolaryngol 78(2):87–113.
- Straatsma B R, Zeegen P D, Foos R Y, Feman S S, Shabo A L. 1974. Lattice degeneration of the retina. Am J Ophthalmol 77 (5): 619-649.
- Tillery WV, Lucier AC. 1976. Round atrophic holes in lattice degeneration—an important cause of phakic retinal detachment. Trans Sect Ophthalmol Am Acad Ophthalmol Otolaryngol 81(3 Pt 1):509–518.
- Byer NE. 1979. Lattice degeneration of the retina. Surv Ophthalmol 23(4):213–248.
- Byer NE. 1989. Long-term natural history of lattice degeneration of the retina. Ophthalmology 96(9):1396–1402.
- Celorio J M, Pruett R C. 1991. Prevalence of lattice degeneration and its relation to axial length in severe myopia. Am J Ophthalmol 111 (1): 20-23.
- Meguro A, Ideta H, Ota M, et al. 2012. Common variants in the COL4A4 gene confer susceptibility to lattice degeneration of the retina. PLoS One 7 (6): e39300.
- Morano M J, Khan M A, Zhang Q, et al. 2023. Incidence and risk factors for retinal detachment and retinal tear after cataract surgery: IRIS® Registry analysis. Ophthalmol Sci 3 (4): 100314.
- EyeWiki Editorial Board. 2024. Lattice Degeneration. EyeWiki (güncellenme 20 Aralık 2024).
- Pandya H K. 2025. Lattice Degeneration. Medscape Drugs & Diseases (güncellenme 11 Mart 2025).





Yorum yazabilmek için oturum açmalısınız.