- Pankreas’daki Langerhans adacıklarında salgılanan hormondur. İsmi Latincede ‘adacığa ait olan’ demektir. (Bkz; İnsül–in)
- Latince insula “ada” → 1922 (önceden insuline, 1914)
- İnsülinler, tip 1 veya tip 2 diyabetlerin tedavisi için uygulanan, kan şekerini düşürücü özelliklere sahip aktif bileşenlerdir.
- Domuz ve sığırların pankreasından elde edilir ve insülin şırıngaları ile vücuda verilir. Günümüzde neredeyse tamamen biyoteknolojik olarak üretilmekte ve özel enjeksiyon cihazları (kalemler) veya insülin pompaları ile deri altına enjekte edilmektedir. Bazıları, insan pankreası tarafından üretilen doğal insülin maddesine (insan insülini) karşılık gelir.
- İnsülin analogları yapı ve farmakokinetik özellikler bakımından doğal insülinden farklılık gösterir. En yaygın olası yan etkiler arasında hipoglisemi ve enjeksiyon bölgesi reaksiyonları bulunur.

- İnsülinler, öncelikle berrak enjeksiyon çözeltileri ve bulanık enjeksiyon süspansiyonları (şişeler, kalemler için kartuşlar, önceden doldurulmuş kalemler) şeklinde mevcuttur. İnhalasyon ürünleri de bazı ülkelerde mevcuttur. Ancak bunlar bir istisnadır.
- İnsülinler buzdolabında 2 ila 8 ° C’de saklanır (Soğuk bir yerde saklayın). Hiçbir koşulda dondurulmamalıdırlar. Açıldıktan sonra genellikle oda sıcaklığında belli bir süre, genellikle bir ay saklanabilirler. Güneşe maruz bırakılmamalı ve arabada tutulmamalıdır.
- İnsülinler 1920’lerde tanıtıldı. İlk önce hayvanların pankreasından (domuz insülini, sığır insülini) çıkarıldılar. Günümüzde ağırlıklı olarak biyoteknolojik yöntemler kullanılarak yapılmaktadır. Rekombinant insülin 1980’lerden beri mevcuttur. Bazı insülinlerin biyobenzerleri artık mevcuttur.
İçindekiler
Biyokimya
Yapı
- İnsülin, insanlarda pankreasta bulunan beta hücreleri tarafından yapılan küçük bir proteindir. Polipeptit, toplam 51 amino asit içeren iki zincirden oluşur. A zinciri 21 ve B zinciri 30 amino asitten oluşur. İnsülin, zincirleri birbirine bağlayan iki disülfür köprüsüne ve A zinciri içindeki bir disülfür zincirine sahiptir.
- İnsan insülinine ek olarak, yapısı doğal hormondan biraz farklı olan sözde insülin analogları da piyasada bulunmaktadır. Örneğin, tek tek amino asitler çıkarılır veya başkaları ile değiştirilir. Bu, farmakokinetik özelliklerde bir değişikliğe yol açar.

Biyosentez
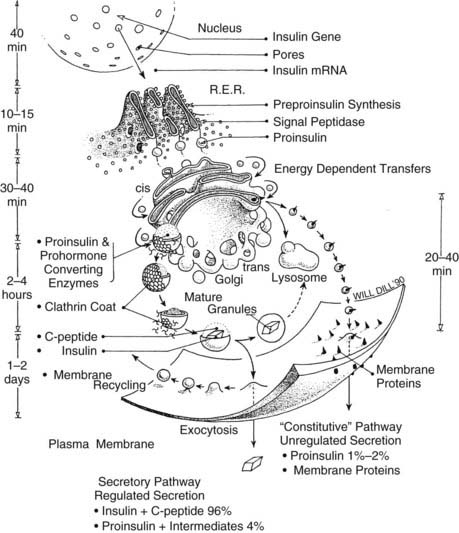
- İnsülin, pankreastaki Langerhans adacıklarının beta hücrelerinde sentezlenir. İnsülin sentezi için genetik bilgi, 11. kromozomun kısa kolundaki yalnızca bir gen lokusu tarafından kodlanır. Gen, yaklaşık 300 nükleotidden oluşur ve iki intron ve üç ekson içerir.
- Genden kopyalanan mRNA, ilk önce kaba endoplazmik retikulumun (RER) ribozomlarında 110 amino asitlik bir peptid olan inaktif bir preproinsüline çevrilir. Başlangıçta B zincirinin 30 amino asidini takip eden bir sinyal dizisinden (lider), ardından bir C peptidinden (bağlayıcı peptid) ve son olarak 21 amino asitlik A zincirinden oluşur:
- Sinyal dizisi – B zinciri – C peptidi – Bir zincir
- Sinyal dizisi, preproinsülinin endoplazmik retikulumun içine taşınmasını sağlar. Peptit hormonunun daha fazla ‘olgunlaşmasının’ gerçekleştiği yer burasıdır:
- sinyal dizisini bölerek ve üç disülfür köprüsü oluşturarak proinsülin (84 amino asit) oluşturulur.
- Daha fazla olgunlaşma sırasında, C zinciri spesifik peptidazlar tarafından ayrılır. İnsülin molekülü daha sonra bir çinko iyonu ile bir heksamer olarak stabilize edilir ve beta hücresinin hücre zarındaki veziküllerde depolanır.

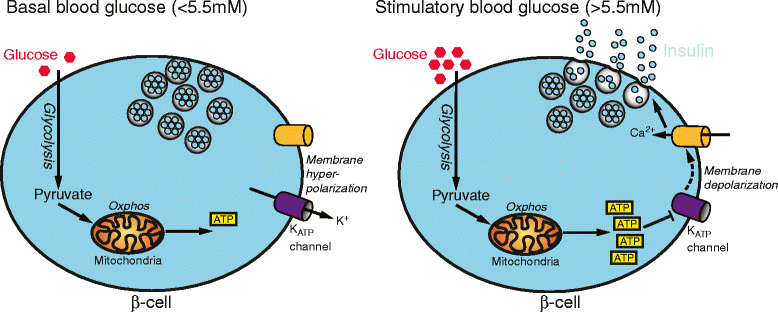
İnsulinin salınımı ekzositoz aracılığıyla gerçekleşir. Salınım için en önemli fizyolojik uyarıcı kan glikoz değeridir. Kan glikoz derişimin artmasıyla salınım oranı sürekli artar. Bu mekanizma aynı zamanda glikoz sensörü olarak da ifade edilir.
Kolşisin, vinka alkaloidleri hücredeki mikrotübüllere etkilerinden dolayı insülin sentezini engeller.
Uluslararası alanda kabul edilmiş bir insülin birimi (1 IE) yaklaşık 40 mcg.
Bir yetişkinin günlük insülin ihtiyacı yaklaşık 40 IE = 1.8 mg.

11. kromozomun kısa kolunda insülin geni bulunur. Bu genden oluşan primer transkript 2 intron içerir;
- Translasyon ürünü insülin öncülüdür. (Sinyal peptidi içerir)
- Endoplazmatik retikulumda sinyal peptidi parçalanır ve insülin öncülü açığa çıkar.
- Golgi aparat aracılığıyla A ve B zincirleri oksidasyona uğrayarak, disülfid köprüleri oluşur. Bu sayede iki zincir birbirine kenetlenir.
- C peptidlerinin proteolitik parçalanması ile İnsülin oluşur.
- Ardından salgılama granüllerinde çinko ile kompleks oluşturarak saklanır.
Etkiler
- İnsülinlerin kan şekerini düşürücü ve antidiyabetik özellikleri vardır. Kan şekerinin dokulara (örneğin kaslar, yağ dokusu) emilimini teşvik ederler. Etkiler, insülin reseptörlerine bağlanmaya dayanmaktadır
- İnsülin analogları, etki başlangıcı (10 ila 60 dakika), etki süresi (3 ila 36 saat), maksimum etki (zirve) ve kan şekerini düşürme derecesi açısından insan insülininden farklılık gösterir:
- Yemek insülinleri (prandial insülinler, bolus insülinler) hızlı bir etki başlangıcına ve kısa bir etki süresine sahiptir. Yemeklerden önce verilir.
- Bazal insülinlerin etki süresi uzundur ve günde bir kez enjekte edilir.
- Karma insülinler, kısa etkili ve uzun etkili insülinlerin sabit bir kombinasyonunu içerir. Genellikle sabah ve akşam enjekte edilirler.
- İzofan insülinleri (= NPH insülinleri) protamin ile kompleks haline gelir ve daha geç bir etki başlangıcına ve sıradan insüline göre daha uzun bir etki süresine sahiptir. Gecikme insülinlerine aittirler. Ayrıca karışık insülinlerde de bulunurlar.


| Karbonhidrat döngüsü | Yağ döngüsü | Protein döngüsü |
| Glikoliz uyarımı | yağ sentezinin artışı | genel anabol |
| Pentoz fosfat yollarının uyarımı | Yağ yıkımı (lipoliz) engellenmesi | |
| glikojen sentezi uyarımı | ||
| Glukoneogenez engellenmesi |
Fizyolojik etkileri
Salgı düzenlenmesi
- Salgı, B hücre zarının depolarizasyonu tarafından tetiklenir.
- Bu, potansiyele bağlı bir Ca2 kanalının açılmasına yol açar.
- Ca girişi, ekzotitoz yoluyla insülin salınımına neden olur.
- Depolarizasyonun tetiklenmesi, ATP tarafından düzenlenen bir potasyum kanalı tarafından gerçekleştirilir.
- ATP düşük ise açık, ATP yüksek ise kapalı
- ATP/ADP’nin oranı düzenleyici faktördür.
- B hücresindeki ATP/ADP bölümü, glukokinaz ve glukoz taşıyıcısı (GLUT2) çok yüksek Km’ye sahip olduğundan ve bu nedenle glukoz fosforilasyonu ve glikoliz de kan glukoz düzeyine bağlı olduğundan kan glukoz düzeyine bağlıdır.
- Salgı modülatörleri şunlardır:
- Monosakaritler, amino asitler, yağ asitleri.
- 2-deoksi-glukoz, mannoheptuloz (metabolize edilmemiş) deneysel inhibitörlerdir
- Adrenalini, noradrenajini inhibe eder (a2 etkisi)
- B-adrenerjik reseptörlerin uyarılması sekresyonu artırır (CAMP yoluyla)
- Gastrik inhibitör peptit ( GIP) salgılamayı arttırır (
- Glukagon benzeri Peptid-1 (GLP-1) salgıyı arttırır
- Sülfonilüreler oral antidiyabetikler – potasyum kanalı İnsülin reseptörünün bir parçası olan bir reseptöre bağlanır.

İnsülin reseptörü
İnsülin reseptörü bir reseptör ailesine aittir.Şunlardan oluşur;
- İnsülin reseptörü
- Insülin benzeri büyüme faktörü (1GF)-1 reseptörü
- İnsülin reseptörü ile ilişkili reseptörden (IRR)
İnsutin yüksek afinite ile bağlanır. Yani, reseptör-insülin kompleksinin ayrışma sabiti çok düşüktür, yaklaşık 10^-10
- Kd=-10^-10 mol/ldelta —> G0=-60 kJ/mol (2 ATP’nin bölünmesine karşılık gelir – termodinamik yön)
- Kd=-10^-10mol/I —> ayrışması 10^10′ kat daha yavaş (9 (kinetik açı)
Sonuç: insülin-reseptör kompleksi aktif mekanizmalar tarafından inaktif edilmelidir.

- İnsülin reseptörleri tetramerlerdir ve 2 alfa ve 2 beta alt birimlerinden oluşur.
- Alfa alt birimi insülini bağlarken, Beta alt birimi sinyali hücreye iletir.
- Beta alt birimi sitoplazmik tarafta tirozin kinaz aktivitesine sahiptir (serbest alfa ile inhibe edilir).
- İnsülinin alfa alt birimine bağlanması bu nedenle fosforilasyon ve daha fazla artan kinaz aktivitesi ile Beta alt biriminin aktivasyonuna yol açar.
- Beta alt biriminin kendisi de tirozinler üzerinde üç bölgede fosforile edilir:
- lükstamembran fosforilasyonu içselleştirmeye yol açar.
- Tritirozin bölgesi işlev için kesinlikle gereklidir
- Karboksi terminali
Ayrıca, fosforilasyon serin ve treonin kalıntılarında da meydana gelir, bu da tirozin kinaz aktivitesinin azalmasına neden olur.
- Beta alt biriminin ve duyarsızlaşmaya neden olur.
- Reseptörün otofosforilasyonu, spesifik bir proteinin, insülin reseptör substratı 1 (IRS-1) olarak adlandırılan Beta alt birimine bağlanmasına neden olur. IRS’nin kendisi de tirozinler üzerinde fosforile edilir ve ayrıca proteinleri SH2- Etki Alanları (src-homoloji) ile bağlar,
- fosfatidil-inositol-3-kinaz
- GRB-2 – MAP kinaz
- SH2 alanlı diğer proteinler Thsulin, x-utremhet’e bağlanır.

İnsülinin ani etkisi, kan şekeri seviyesinde kas ve yağ dokusunda artan glikoz emilimi yoluyla bir azalmadır. Bundan insülin tarafından düzenlenen glikoz taşıyıcı 4 (GLUT 4) sorumludur. İnsülin uyarısı, taşıyıcı proteinleri submembranöz vezikül havuzlarından hücre yüzeyine hareket ettirerek, glukoz için membran geçirgenliğinde ciddi bir artışa neden olur.
Glikoz taşıyıcılarının izoformlarının işlevleri
| Glut 1 | Fetal doku, eritrositler, endotel, Km = 20 mM | Bazal doygunluk, Beyin kan bariyeri |
| Glut 2 | Hepatositler, Pankreas B hücreleri, böbrek epiteli, bağırsak epiteli Km= 40 mM | Transepitel transport, Glucostat Mechanismus |
| Glut 3 | Merkezi sinir sistemi başta olmak üzere birçok doku, Km = 10 mM | Bazal glukoz doygunluk |
| Glut 4 | İskelet kası, yağ | Dokudaki insüline bağlı glukoz miktarı |
| Glut 5 | bağırsak, spermatosit | Fruktoz transport |
| Glut 7 | karaciğer | Glukogenezde glukoz transportu |

Endikasyon
- Tip 1 diyabet veya tip 2 diyabet tedavisi için.
Uzman bilgilerine göre. Enjekte edilecek miktar kişiye özel belirlenir. Çeşitli faktörlere bağlıdır (örn. Vücut ağırlığı, fiziksel aktivite, öğün türü, hastalıklar, stres). Kan şekeri seviyesi günlük olarak kontrol edilmelidir.
Yetersiz oral biyoyararlanım nedeniyle, insülinler genellikle deri altından, örn. Karın, uyluk veya kalça bölgesinde, hasta tarafından intravenöz olarak enjekte edilmemelidir. Delinme bölgesi ve enjeksiyon iğnesi her enjeksiyonda değiştirilmeli ve masaj yapılmamalıdır.
Uygulama süresi, aktif bileşene ve dozaj formuna bağlıdır.
İnsülin kalemleri, insülin pompaları ve daha az sıklıkla şişelerden alınan insülin şırıngaları ile uygulanırlar. İnsülin ayrıca solunabilir.
Etkin maddenin subkutan olarak vücuta verilmesinden sonra İnsülin heksamer kompleks oluşturur. Kana karışabilmesi için etkin, monomer formuna çözülmesi gerekir. Bu faz için iğne-yemek arası için gerek süre normal insülinde 30 dakikadır. Aşırı kısa sürede etkili analoglar için bu süreye ihtiyaç yoktur. Çünkü kolayca ve hızlıca çözülebilir. Bu sebeplerden ötürü klinikte en çok tercih edilen prandiyal insülin tipidir.
Etkin maddeler
| Tip | Dışarıdan görünüşü | pH | Eklemeler | Tesir Başlama-Maksimuma ulaştığı süre- Toplam etki süresi |
| Kısa ve hızlı etkili insülin analogları (yemek zamanı insülinleri, prandial insülinler, bolus insülinler): +İnsülin aspart (NovoRapid®) +İnsülin lispro (Humalog®) +İnsülin glulisin (Apidra®) | berrak | nötr | yok | 15 dk – 1 s -2,5 s |
| kısa süre etkili + normal insülin | berrak | nötr | yok | |
| orta süre etkili + NPH (İzofan) | bulanık | nötr | Fosfat tamponda protamin | |
| Uzun süre etkili insülin analogları (bazal insülinler) +İnsülin detemir (Levemir®) +İnsülin glarjin (Lantus®, biyobenzerler) +İnsülin glarjin U300 +İnsülin degludec (Tresiba®) | berrak berrak berrak berrak | nötr asit asit nötr | yok yok; Ph yüzünden karışabilir değil yok | 1.2 s – 8 s -20 s 4-6 s – x -24 s x – x -24-36 s 1-2 s – 24 s ->42 s |
Etkinin maksimum olduğu süre veya toplam etki süresi büyük değişkenlik gösterebilir. Hastadan hastaya değişebileceği gibi, NPH insülinde aynı bireyde günden günde %30 varan değişim gözlemlenebilir. Uzun süre etkili analoglarda bu değişkenlik belirgin olarak diğerlerinden daha azdır.
Gecikmesli insülinin emilim geciktirme etkisi için bir bazik protein (protamin)den istifade edilmektedir. Bu madde ile yavaş yavaş çözünen komplekslerin oluşumu sağlanır. İnsülin glargin (Lantus) katkı maddeleri olmaksızın istikrarlı bir heksamer oluşturmaktadır. İnsülin glarjinin konsantrasyonu (Lantus® U300 , 100 U / ml yerine 300 U / ml, Toujeo “) değiştirilmesi ile depo tatbik ile eşit bir dağılım ve uzun süre etkili insülin elde edilebilir.
İşleyişi oldukça farklı insülin detemir (Levemir) ve insülin degludec (Tresiba “); B zincirinin 29. amino asitinde bir yağlı asit zinciri olan deri altından vücuda girmesine rağmen, kan içinde serum albümine bağlanarak, burada etkiyi geciktirir. İnsülin dozu dozlama cihazları (insülin kalem) ile gerçekleştirilir ve uluslararası birime (İngilizce; IU) dayanmaktadır.
- 1 IU, pankreastan bir ekmek birimindeki şeker miktarı i.in (1 ekmek birimi = 12 g karbonhidrat = ekmek ince dilim) salgılanan insülin miktarına eşit olduğu kabul edilir.
- Ortalama günlük insülin ihtiyacı tip 1 diyabet için yaklaşık 0.7 IU / kg
| Madde | t 1/ ( h ) | Etki süresi ( h ) | Eliminasyon | Dozaj ( mg ) |
| Sülfonilürelerin | ||||
| Gllbendarid | 9 | 24 | böbrek | Günde x 0.5-15 |
| Gliklorid | 10 | 24 | karaciğer / böbrek | Günde x 30-120 |
| Glimepirid | 5-8 | 24 | karaciğer / böbrek | Günde x 1-6 |
| Gliquidone | 8 | 24 | karaciğer | Günde x 15-120 |
| Glinid | ||||
| Repaglinid | 1 | çok kısa | karaciğer | 3 Günde x 0,5-2 |
Hedef, B hücresinin ATP’ye duyarlı potasyum kanalının SUR1 alt birimidir. Bu neden olur. İnsülin salınımında artış dolaşımdaki glukagonda azalma İnsülin sekretagogları ayrıca öglisemik kan şekerini düşürür (dikkat: hipoglisemi), ancak hiperglisemide daha etkilidir. İnsülin salınımının etkisinde bir azalma olmasına rağmen (SUR1’in geri dönüşümlü aşağı regülasyonu), kan şekerini düşürücü etki düşük kalarak, normal insülin seviyelerini daha uzun süre koruma insülin direnci azalır (muhtemelen azalmış glukoz toksisitesinden dolayı).

Dayanıklı hazır insülin kombinasyonu (Rekombinant insan insülini)
Sadece nadiren kullanılan insan karışık insülin (örn. Huminsulin®): NPH insülin ve normal insülin kombinasyonu
• karışık insülin analoglarının kombinasyonu: insülin lispro ve insülin NPH ;. Aspart ve NPH insülin (lisproprotamin-kompleksli insülin lispro ve sürekli etkin bileşenler olarak aspart ile)
Karışmayan insülinler
• (ultra) kısa etkili insülin ve glarjin (pH = uyumlu) ajanlar
- Hayvansal kökenli insülinler:
- Domuz insülini (Insulin Hypurin Porcine®, ticaret haricinde)
- Sığır insülini (satılmamaktadır)
- İzofan insülin
- Solunabilir insülin (Afrezza®)

Kontrendikasyon
- İnsülinler aşırı duyarlılık, hipoglisemi ve insülinoma durumlarında kontrendikedir.
- Karaciğer ve böbrek yetmezliği (ikincisi Gliquidon için geçerli değildir)
- Gebelik (İnsülin sekretagogları)
İhtiyati tedbirler ve etkileşimlerle ilgili eksiksiz bilgiler ürün bilgi sayfasında bulunabilir. Çok sayıda ilacın kan şekeri üzerinde etkisi vardır.
Yan etkileri
En yaygın olası yan etkiler arasında hipoglisemi ve kızarıklık, ağrı, kaşıntı, şişme, iltihaplanma ve lipodistrofi gibi enjeksiyon bölgesi reaksiyonları bulunur.
- İnsülin salgılatıcıların en sık görülen yan etkisi hipoglisemi ataklarıdır, ancak preparatlar arasında farklılıklar vardır.
- Glibenklamid ile tedavi altında yüksek risk ve glimepirid ve gliklazid ile tedavi altında daha düşük risk vardır.
- Sebep: Düşük plazma glukozu ile bile, glibenklamid insülin salınımını arttırır ve glukagon salınımını baskılar, glimepirid bu etkiye sahip değildir.
- Ayrıca sülfonilüreler kilo alımına neden olabilir.
- Nadiren:
- Döküntü.
- Alkol intoleransı
- Lökopeni
- Hepatopati
- Glibenklamid ile tedavi altında yüksek risk ve glimepirid ve gliklazid ile tedavi altında daha düşük risk vardır.

İnsülin tedavisinin yan etkileri
- Hipoglisemi
- İntravenöz uygulamada: serum potasyumunda düşüş
- Enjeksiyon bölgesinde reaksiyonlar: çok nadiren – alerjik inflamasyon nadiren – distrofik etkilerden kaçınmak için lipoatrofi, lipohipertrofi, enjeksiyon bölgesi düzenli olarak değiştirilmelidir.
Dikkat: Enjeksiyon bölgesinin değiştirilmesi, emilim kinetiklerinde dalgalanmalara yol açabilir (emilim oranı: karın derisi > popo (gluteal) > uyluk). Ayrıca, deri altı yağ dokusundan emilim, kutanöz dolaşımı etkileyerek değiştirilebilir; Örneğin. Sıcak banyo, egzersiz, masaj ile daha hızlı emilim gerçekleşir.
Tedavi formları
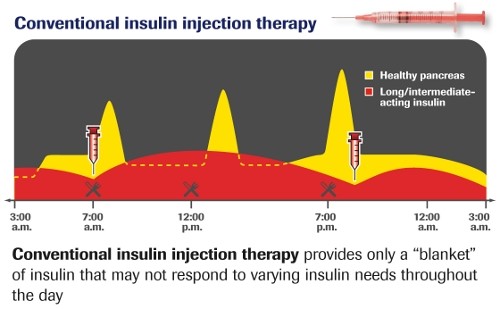
Geleneksel insülin tedavisi
Gıda alımı (yemek), insülin dozunun ve insülin uygulamasının katı şekilde düzenlenmesi. Tip 2 diyabeti olan hastalarda endikedir;
- Günde 2-3 kez karışık insülin,% 30, % 50 ya da % 70 ile ultra kısa sürede etkil insülin ile %70 , % 50 veya % 30 orta ayardaki insülinler
- Belirlenen dozun 2/3 ü sabah ve 1/3’ü akşam olarak ayarlanır.
- Uygun diyet belirlenerek, kesinlikle uygulanması tavsiye edilir.
- Kan şekeri ölçümü günde 1-2 kez (akşam geç saatlerde, aç karnına)
- Düzeltme sadece semptomatik hipoglisemide uygulanır (örn; 1/8 litre meyve suyu ekmek birimine tekabül eder)
- Örnek: karışık insülin (% 30 ultra kısa etkili insülin analog, % 70 NPH insülini) 20-0-10 IU s.c. Diyabet diyeti 12 IU (3-1-3-1-3-1)
Geleneksel Yoğunlaştırılmış insülin tedavisi
Gıda alımı ve insülin dozajının biraz daha esnek uygulanması, ama yine de katı bir plan olarak özellikleri
- Ayrı olarak gecikmeli analogun uygulanması (2 x gün NPH insülini ayrı uygulanması. ya da günde 1-2 defa uzun etkili analog) ve her gün çok kısa etkili analog (günde 3x)
- -.. katı, büyük ölçüde düzeltme tablosu diyet (BE) tarafından dikte düzeltme imkanı
- Günde 3-4 kez kan glukoz ölçümü (Akşam geç saaatlerde, yemekten önce, emin olunmayan durumlarda)
- Geleneksel insülin tedavisine kıyasla bireysel ayarlama imkanı HbA1c düzeyleri yaklaşık %1-1.5 iyileştirmek
- Örnek
- NPH insülin 8-0-0-8 IU
- Ultra kısa etkili insülin 6-6-4 IU
- Düzeltme: Kan şekeri> 250 mg / dl + 2 IU, Kan şekeri> 300 mg / dl + 4 IU ultra kısa etkili insülin
- Diyabet diyeti 12 IU (3-1-3-1-3-1)
- NPH insülin 8-0-0-8 IE ultra kısa etkili
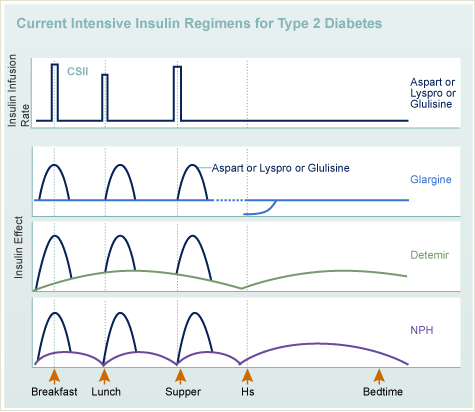
Temel bolus tedavi (fonksiyonel insülin terapisi)
- İnsülin ve gıda alımının esnek kullanımı. Ağırlıklı olarak tip 1 diyabet için endikedir.
- Bazal ve prandiyal insülin gereksinimleri ayrı ikamesi,
- Prandiyal insülin hesaplanmasıiçin algoritma ve kan şekerinin düzenlenmesi için bireysel ikincil ayarlama
- Gıda alımı için katı kurallar olmadan (normal diyet) ve esnek bir yaşam mümkün
- Kan şekeri ölçümü günde x 4-6

- Yoğun bakım (hastanede) bilgilendirmek gerekli
- Hastalar ayrıca istisnai durumlarda (örn. hastalık) insülin dozajını kendileri uyarlamayı öğrenmeliler
- Örnek (diabetes melitus tip 1, 20 yaş):
- Bazal insülin: NPH insülin 8-0-8-0 IE
- sabah piki: 2 birim Ultra -kısa etkili insülin (şafak fenomeninin neden olduğu sabah hiperglisemisi için)
- Prandial insülin: ekmek birimi başına 1 IU Ultra kısa etkili analog
- Bazal insülin: NPH insülin 8-0-8-0 IE
- Kan şekeri için düzeltme değerleri:
- 1 IU ultra kısa etkili kan şekerini 40 mg/di düşürür
- 1 ekmek birimi (EK; 12 gr karbonhidrat) kan şekerini 40 mg/gün kadar yükseltir
- Gıda alımı 3-6 öğüne yayılan yaklaşık 24 EK ile düzeltilmelidir.
- Dikkat: Verilen tüm değerler kişiden kişiye büyük farklılıklar gösterebilir ve bu nedenle sadece örnek olarak anlaşılmalıdır. .
Tarih
- 1869’da, pankreasın yapısını mikroskop altında incelerken, Berlin’de bir tıp öğrencisi olan Paul Langerhans, pankreasın büyük bir kısmına dağılmış, önceden fark edilmemiş bazı doku kümelerini tespit etti. Daha sonra Langerhans adacıkları olarak bilinen ‘küçük hücre yığınlarının’ işlevi başlangıçta bilinmiyordu, ancak Édouard Laguesse daha sonra bunların sindirimde düzenleyici bir rol oynayan sekresyonlar üretebileceklerini öne sürdü. Paul Langerhans’ın oğlu Archibald da bu düzenleyici rolü anlamaya yardımcı oldu.


1889’da doktor Oskar Minkowski, Joseph von Mering ile birlikte, sindirimdeki varsayılan rolünü test etmek için sağlıklı bir köpekten pankreası çıkardı. İdrarı test ederken şeker buldular ve ilk kez pankreas ile diyabet arasında bir ilişki kurdular. 1901’de Amerikalı doktor ve bilim adamı Eugene Lindsay Opie, pankreasın rolünü Langerhans adacıklarına izole ettiğinde bir başka büyük adım attı: ‘Diabetes mellitus, pankreasın bir lezyonunun sonucu, pankreasın tahrip olmasından kaynaklandığında Langerhans adaları ve yalnızca bu bedenler kısmen veya tamamen yok edildiğinde ortaya çıkar ‘.

Önümüzdeki yirmi yıl boyunca araştırmacılar, adacıkların salgılarını izole etmek için birkaç girişimde bulundu. 1906’da George Ludwig Zuelzer, köpekleri pankreas özü ile tedavi etmede kısmi bir başarı elde etti, ancak işine devam edemedi. 1911 ve 1912 arasında E.L. Chicago Üniversitesi’nden Scott, sulu pankreas özleri denedi ve ‘glikozüride hafif bir azalma’ olduğunu fark etti, ancak yöneticisini işinin değeri konusunda ikna edemedi. Israel Kleiner, 1915’te Rockefeller Üniversitesi’nde benzer etkiler gösterdi, ancak I.Dünya Savaşı işini yarıda kesti ve işine geri dönmedi.
1916’da Nicolae Paulescu, diyabetik bir köpeğe enjekte edildiğinde kan şekeri seviyeleri üzerinde normalleştirici bir etkiye sahip olan sulu bir pankreas özü geliştirdi. Birinci Dünya Savaşı nedeniyle deneylerine ara vermek zorunda kaldı ve 1921’de Bükreş’te yaptığı çalışmalar ve şeker hastası bir köpek üzerinde yaptığı testler hakkında dört makale yazdı. O yıl daha sonra, ‘Gıda Asimilasyonunda Pankreasın Rolü Üzerine Araştırma’ yayınladı.

‘İnsülin’ adı, 1916’da Edward Albert Sharpey-Schafer tarafından glikoz metabolizmasını kontrol eden Langerhans’ın (adacık veya ada için Latin insula) pankreas adacıkları tarafından üretilen varsayımsal bir molekül için icat edildi. Sharpey-Schafer’in haberi olmadan, Jean de Meyer 1909’da aynı molekül için çok benzer ‘insülin’ kelimesini ortaya atmıştı.

1922’de Frederick Banting ve Charles Best, Toronto Üniversitesi’nde John Macleod’un yönetiminde insülini keşfettiler. James Collip’in yardımıyla insülin saflaştırıldı ve diyabetin başarılı tedavisi için kullanılabilir hale getirildi. Banting ve Macleod, çalışmaları için 1923’te Nobel Ödülü kazandı.

1953’te kısmi asit hidrolizi ve enzimatik hidrolizin bir kombinasyonu, Sanger ve Avusturyalı biyokimyacı Hans Tuppy’nin insülinin fenilalanin zincirindeki tam amino asit dizisini belirlemesine izin verdi. Benzer şekilde, Sanger ve Avustralyalı biyokimyacı E.O.P. Thompson, glisin zincirinin dizisini belirledi.

Dorothy Crowfoot Hodgkin, İnsülin üzerinde çalışmayı hiç bırakmadı. Ekibi nihayet 1969’da yüksek hızlı bilgisayarlara eriştiklerinde ve bu karmaşık molekülü deşifre etmek için gerekli matematiksel programları geliştirdikten sonra onu kırdılar. Daha sonra hayatındaki en heyecan verici iki anın, bir fotoğraf geliştirdiği ve bir insülin kristalindeki ilk zayıf noktaları gördüğü 1935 akşamı ve bunların yapıyı gerçekten çözebileceklerini anladığı 1969 Temmuz Cumartesi öğleden sonra olduğunu söyledi.
