İçindekiler
1) Terimin etimolojik kökeni ve adlandırma mantığı
“Karbamazepin” adı, molekülün kimyasal kimliğini yansıtan parçalardan türetilmiş bir jenerik addır. “Karbam-” öneki, yapıda bulunan karboksamid (carboxamide) fonksiyonel grubuna işaret eder; bu grup, molekülün hem fizikokimyasal özelliklerini hem de metabolik kaderini etkiler. “-azepin” ise yedi üyeli azot içeren heterosiklik halka sistemi olan azepin çekirdeğine gönderme yapar. Karbamazepin, daha geniş bir yapısal aile olarak “dibenzazepin” türevleri içinde değerlendirilir; burada iki benzen halkasının bir azepin halkasına kaynaşmış olması trisiklik (üç halkalı) mimariyi belirler. Bu adlandırma, molekülün farmakolojik sınıfından çok, kimyasal iskeletini merkeze alır; bu da klinikteki çoklu endikasyonlarının tek bir “etiket” altında toplanmasından ziyade, hedef dokulardaki iyon kanal fizyolojisiyle ilişkili geniş etki spektrumunu açıklamaya daha elverişlidir.
2) Tarihsel gelişim: keşiften modern klinik konumlanışa
Karbamazepin, 1950’li yıllarda kimyasal araştırmaların hızlandığı bir dönemde sentezlenmiş; 1960’ların başında epilepsi ve trigeminal nevralji başta olmak üzere nörolojik endikasyonlarda klinik kullanıma girmiştir. Erken klinik deneyimler, özellikle fokal başlangıçlı nöbetlerde tekrarlayan nöronal deşarjları baskılayabilen bir profil ortaya koymuş; zamanla trigeminal nevraljide belirgin analjezik-etki benzeri bir yanıtın gözlenmesi, ilacın yalnızca “antiepileptik” değil, aynı zamanda “nöral hiperexcitabiliteyi modüle eden” bir ajan olduğunu düşündürmüştür. 1963 yılı, karbamazepinin Avrupa’da antiepileptik olarak klinik pratiğe yerleştiği tarihsel dönüm noktalarından biri olarak anılır; sonraki yıllarda bipolar bozuklukta duygu durum dengeleyici olarak, daha sınırlı ve dikkatli çerçevelerde ise alkol yoksunluk sendromu gibi durumlarda kullanım alanı kazanmıştır.
Tarihsel süreçte karbamazepinin klinik değerini artıran iki temel kavrayış gelişmiştir:
- Etkinliğin, “tek bir reseptör” yerine nöronal membran elektrofizyolojisi düzeyinde stabilizasyonla ilişkili olması.
- Farmakokinetiğinin sabit olmaması; özellikle karaciğer enzim indüksiyonu ve “otoindüksiyon” olgusuyla zaman içinde değişmesi.
3) Evrimsel biyoloji bağlamı: neden sodyum kanalı hedefi bu kadar “merkezi”dir?
Karbamazepinin klinik etkisini anlamanın en verimli yollarından biri, hedeflediği sistemin evrimsel muhafazakârlığını hatırlamaktır. Voltaj kapılı sodyum kanalları (Nav kanalları), hayvanlar âleminde sinir sistemiyle birlikte evrimleşmiş; hızlı elektriksel iletimin biyofiziksel altyapısını oluşturmuştur. Aksiyon potansiyelinin yükselen fazı, bu kanalların milisaniyeler içinde açılıp inaktivasyona girmesiyle şekillenir. Bu mekanizma, farklı türlerde ve farklı sinir devrelerinde korunmuş bir tasarımdır: hızlı yanıt, tekrarlayan ateşleme kapasitesi ve sinaptik ağlara dalga yayılımı.
Bu evrimsel muhafazakârlık, patofizyoloji açısından bir “bedel” doğurur: Aynı kanallar, belirli genetik yatkınlıklar, yapısal beyin lezyonları, ağ ağlarının yeniden yapılanması, metabolik stres ya da ilaç yoksunluğu gibi durumlarda hiperuyarılabilirliğe zemin hazırlayabilir. Epileptik nöbet, trigeminal nevralji paroksizmleri veya manik ajitasyonla ilişkili bazı devre disfonksiyonları, farklı düzlemlerde olsa da “tekrarlayan, eşik altı kolaylaşmış deşarjlar” ortak paydasında buluşabilir. Karbamazepin gibi sodyum kanalı modülatörleri, evrimsel olarak çok temel bir elektriksel “anahtarı” hedeflediği için, farklı klinik tablolar arasında köprü kurabilecek bir biyofiziksel etki alanına sahiptir.
Evrimsel biyoloji açısından ikinci önemli başlık, karaciğerin ksenobiyotik savunma sistemleridir. CYP enzimleri ve nükleer reseptörler aracılığıyla (özellikle ksenobiyotik duyarlı transkripsiyonel yollar), organizma dış bileşiklere maruz kaldığında metabolik kapasitesini artırma eğilimi gösterir. Karbamazepinin güçlü enzim indüksiyonu, bu biyolojik savunma mimarisinin klinik yansıması olarak görülebilir: organizma ilacı “yabancı” olarak algılar ve metabolik klirensi zaman içinde artırır. Bu, tedavi yönetiminde doz titrasyonunu ve etkileşim izlemini zorunlu kılar.
4) Kimyasal yapı ve fizikokimyasal özellikler
Karbamazepin (C₁₅H₁₂N₂O; molekül ağırlığı yaklaşık 236,3 g/mol), beyaz kristal yapıda, suda çok az çözünen bir bileşiktir. Trisiklik dibenzazepin çekirdeği, lipofilik özellikleri güçlendirirken; karboksamid grubu hem metabolik dönüşümler hem de protein bağlanması gibi parametreleri etkiler. Düşük suda çözünürlük, özellikle yüksek doz alımlarda emilimin uzamasına ve gastrointestinal sistemde gecikmiş pik konsantrasyonlara zemin hazırlayabilir; klinik toksikoloji açısından bu özellik ayrıca önem taşır.
Karbamazepinin klinik açıdan kritik bir yönü, aktif metabolit üretmesidir: karbamazepin-10,11-epoksit. Bu epoksit metabolit antikonvülzan aktiviteye katkıda bulunur; aynı zamanda nörolojik yan etkilerin bir kısmına da paydaş olabilir.
5) Etki mekanizması: membran stabilizasyonundan ağ düzeyi sonuçlara
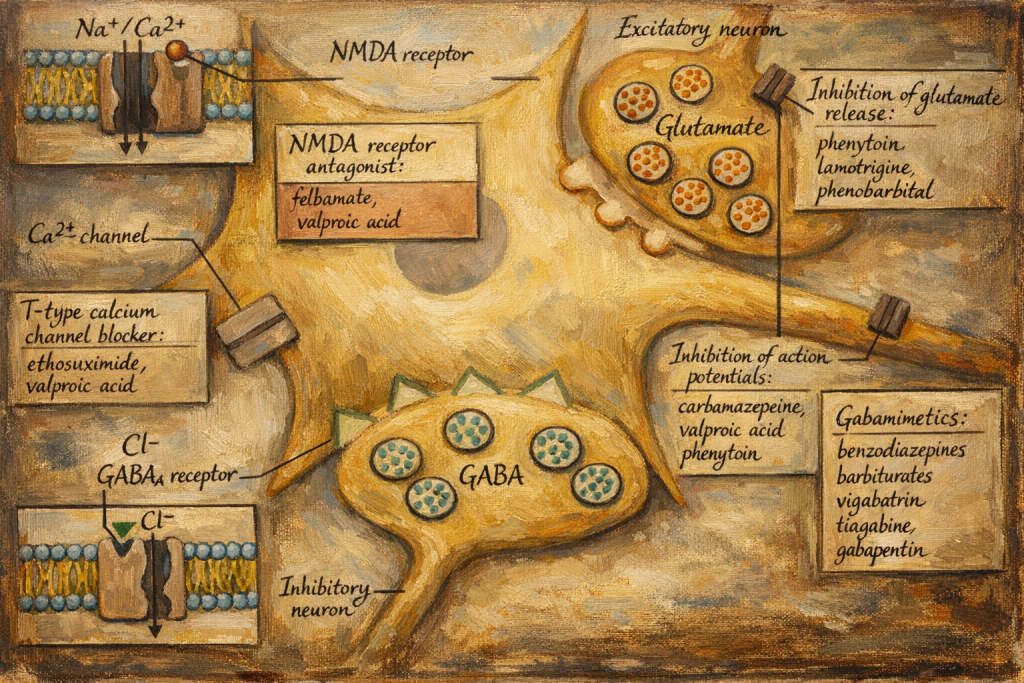
Karbamazepinin temel farmakodinamik etkisi, voltaj kapılı sodyum kanallarının kullanım-bağımlı (use-dependent) modülasyonudur. Hiperaktif nöronlarda kanallar daha sık açılıp inaktive olduğu için, karbamazepin özellikle yüksek frekanslı deşarjları baskılamaya eğilim gösterir. Klinik olarak bunun anlamı şudur:
- Aşırı uyarılmış nöronal membranların stabilizasyonu
- Tekrarlayan deşarjların kesilmesi
- Eksitatör sinaptik yayılımın ağ içinde azalması
Bu etki tek başına “nöbeti durdurma” şeklinde kaba bir sonuç üretmez; daha çok patolojik devrelerin ateşleme eşiğini yükseltir, paroksismal senkronizasyonu zorlaştırır ve zaman içinde epileptojenik ağların sürdürülebilirliğini azaltır. Trigeminal nevralji gibi nöropatik ağrılarda, periferik ve santral duyusal iletim yollarındaki ektopik deşarjların ve “kısa devre” tipi patolojik iletimin zayıflatılmasıyla paroksismal ağrı atakları azalabilir.
6) Farmakokinetik: emilim, dağılım, metabolizma, eliminasyon ve otoindüksiyon
Emilim: Karbamazepin ağızdan alındığında genellikle yavaş ve kısmen değişken emilir. Düşük çözünürlük ve gastrointestinal motilite üzerindeki etkiler, pik zamanını uzatabilir. Uzun salınımlı formlar, plazma dalgalanmasını azaltmayı ve tolerabiliteyi iyileştirmeyi hedefler.
Dağılım: Plazma proteinlerine anlamlı düzeyde bağlanır; bu durum, serbest fraksiyonun klinik etki ve toksisiteyle ilişkisinde önemlidir. Dağılım hacmi orta düzeydedir ve santral sinir sistemine geçiş, lipofilik iskelet tarafından kolaylaştırılır.
Metabolizma: Metabolizmanın merkezi ekseni CYP3A4 üzerinden oksidasyondur. Bu yolla karbamazepin-10,11-epoksit oluşur. Epoksit metabolit daha sonra epoksit hidrolaz ve konjugasyon yollarıyla inaktive edilerek atılır. Epoksit metabolitin birikimi, bazı ilaçlarla birlikte kullanımda klinik olarak belirginleşebilir.
Otoindüksiyon: Karbamazepin, kendi metabolizmasını hızlandıran bir ilaçtır. Tedavinin ilk haftaları içinde klirens artar; yarı ömür zamanla kısalabilir. Bu dinamik, başlangıçta düşük dozla başlayıp kademeli artırma stratejisinin yalnızca tolerabilite için değil, farmakokinetik dengeye ulaşmak için de zorunlu olduğunun biyolojik temelidir.
Eliminasyon: Metabolitler ağırlıklı olarak renal ve safra yoluyla uzaklaştırılır; bu nedenle karaciğer fonksiyonu, ilaç maruziyetini belirleyen temel faktördür.
7) Farmasötik formlar ve preparatlar
Karbamazepin, klinikte süspansiyon ve şurup gibi sıvı formlar; standart tabletler; uzun salınımlı tabletler şeklinde bulunur. Sıvı formlar doz titrasyonunu kolaylaştırabilir; uzun salınımlı formlar ise pik-trough dalgalanmasını azaltarak sedasyon, baş dönmesi ve ataksi gibi dozla ilişkili nörolojik yan etkilerin yönetimine katkı sağlayabilir.
8) Endikasyonlar ve klinik kullanımın rasyoneli
Epilepsi: Özellikle fokal başlangıçlı nöbetlerde ve sekonder jeneralizasyon gösterebilen tabloların bir kısmında etkilidir. Ağ düzeyinde hiperexcitabiliteyi baskılama kapasitesi bu kullanımın temelini oluşturur.
Nöropatik ağrı ve nevraljiler: Trigeminal nevralji, klasik endikasyon alanlarından biridir. Paroksismal ağrı ataklarının frekans ve şiddetinde azalma, ektopik deşarjların ve patolojik iletimin baskılanmasıyla ilişkilendirilir.
Bipolar bozukluk ve akut mani: Duygu durum dengeleyici etkisi, tek bir biyokimyasal hedefe indirgenmeyecek kadar çok katmanlıdır; klinikte daha çok belirli hasta alt gruplarında veya alternatiflerin uygun olmadığı durumlarda değerlendirilir.
Alkol yoksunluk sendromu: Bazı protokollerde semptom kontrolüne katkı amacıyla kullanılabilir; yine de sedasyon, etkileşim ve nörolojik yan etki profili nedeniyle dikkatli hasta seçimi gerekir.
Etiket dışı kullanım alanları, yerel kılavuzlar ve uzman değerlendirmesiyle şekillenir; özellikle komorbiditeler, eş zamanlı ilaçlar ve genetik riskler bu kararı belirgin biçimde etkiler.
9) Dozlama ilkeleri: düşükten başla, yavaş artır; kademeli kes
Karbamazepin tedavisinde iki temel ilke klinik pratiği belirler:
- Başlangıç dozu düşük tutulur ve yavaş titrasyon yapılır. Bunun nedeni erken dönemde sedasyon, baş dönmesi, ataksi gibi dozla ilişkili merkezi yan etkiler ve aynı zamanda otoindüksiyon nedeniyle zamanla değişen farmakokinetik maruziyettir.
- İlacın kesilmesi kademeli olmalıdır. Ani kesilme, epilepside nöbet eşiğini düşürebilir; ayrıca uzun süreli kullanımda nöronal ve metabolik adaptasyonlar nedeniyle yoksunluk benzeri klinik dalgalanmalar görülebilir.
Doz hedefleri endikasyona, yaşa, eşlik eden hastalıklara, preparata ve birlikte kullanılan ilaçlara göre değişir; bu nedenle pratikte titrasyon, klinik yanıt ve tolerabilite üzerinden bireyselleştirilir.
10) İlaç etkileşimleri: CYP3A4 substratı ve güçlü indükleyici olmanın klinik sonuçları
Karbamazepin, hem CYP3A4’ün substratı hem de güçlü bir CYP3A4 indükleyicisidir. Bu ikili özellik, etkileşim riskini olağanüstü yükseltir ve klinik yönetimde sistematik bir yaklaşım gerektirir.
Karbamazepinin düzeyini artırabilen etkenler: CYP3A4’ü inhibe eden ilaçlar, karbamazepin maruziyetini yükselterek baş dönmesi, diplopi, ataksi, uyku hali gibi nörotoksisite bulgularını artırabilir. Ayrıca bazı ilaçlar epoksit metabolitin yıkımını etkileyerek aktif metabolit birikimine yol açabilir.
Karbamazepinin diğer ilaçların düzeyini azaltabilmesi: CYP3A4 indüksiyonu, çok sayıda ilacın klirensini artırarak etkinliğini azaltabilir. Klinik açıdan bu, antikoagülanlar, bazı antidepresanlar/antipsikotikler, immünsupresanlar, bazı antiinfektifler ve hormonal kontraseptifler gibi geniş bir yelpazede terapötik başarısızlık riski anlamına gelebilir.
Otoindüksiyonun etkileşimleri karmaşıklaştırması: Tedavinin ilk haftalarında metabolizma hızının artması, aynı dozda plazma düzeylerinin düşmesine neden olabilir; bu da erken klinik yanıta bakarak acele doz artırma ile geç dönemde toksisite arasında dalgalı bir risk profili yaratır.
11) Kontrendikasyonlar ve temel uyarılar
Karbamazepin kullanımında klasik kontrendikasyonlar arasında şunlar öne çıkar:
- Karbamazepine aşırı duyarlılık
- Atriyoventriküler blok gibi belirgin iletim bozuklukları
- Kemik iliği depresyonu öyküsü veya belirgin hematolojik bozukluklar
- Hepatik porfiri gibi bazı porfiri tipleri
- MAO inhibitörleri ile birlikte kullanım
Bu başlıklar, yalnızca “kullanma” kararını değil, bazen yakın izlemle “kullanılabilir mi” kararını da belirler; çünkü riskin büyüklüğü hastaya göre değişebilir.
12) Güvenlilik profili: yaygın yan etkilerden nadir ama kritik tablolarına
Sık görülen ve dozla ilişkili yan etkiler:
- Bulantı, kusma
- Baş dönmesi, ataksi ve diğer koordinasyon bozuklukları
- Uyku hali, yorgunluk, sersemlik
- Görsel bulanıklık, diplopi gibi nöro-oftalmolojik yakınmalar
Bu grup yan etkiler çoğu zaman titrasyon hızının yavaşlatılması, dozun bölünmesi veya uzun salınımlı forma geçiş gibi stratejilerle yönetilebilir.
Dermatolojik reaksiyonlar:
- Makülopapüler döküntüler, ürtiker ve kaşıntı gibi daha hafif tablolar görülebilir.
- Stevens–Johnson sendromu ve toksik epidermal nekroliz gibi ağır kutanöz advers reaksiyonlar nadirdir ancak yaşamı tehdit edicidir. Bu risk, belirli HLA alelleriyle güçlü biçimde ilişkilidir; özellikle HLA-B*15:02 taşıyıcılığı belirli popülasyonlarda belirgin risk artışıyla bağlantılıdır ve bazı düzenleyici otoriteler bu bağlamda genetik tarama yaklaşımını vurgular. (PMC)
Hematolojik etkiler:
- Lökopeni, klinikte izlenen önemli bir laboratuvar bulgusudur. Çoğu olgu hafif ve geçici olabilir; ancak ciddi hematolojik bozukluklar açısından klinik uyanıklık gerekir.
Hepatik etkiler:
- Karaciğer enzimlerinde artış sık gözlenebilir. Enzim indüksiyonu ile hepatoselüler stresin ayrımı her zaman kolay değildir; klinik semptomlar, kolestatik bulgular ve zaman içindeki seyir birlikte değerlendirilir.
Sodyum düşüklüğü ve SIADH eğilimi:
- Klinik pratikte özellikle yaşlılarda veya eş zamanlı diüretik kullananlarda hiponatremi görülebilir; nörolojik semptomlar bazen ilaca atfedilen sedasyonla karışabilir.
13) İzlem ve klinik yönetim: riskleri öngörme, erken yakalama, doz optimizasyonu
Karbamazepin tedavisi, “başla ve sürdür” tipi basit bir yaklaşımı nadiren tolere eder; daha çok yapılandırılmış izlem gerektirir. Klinik uygulamada izlem genellikle şu eksenlerde kurulur:
- Klinik yanıtın sistematik değerlendirilmesi: nöbet sıklığı, ağrı atakları, duygu durum dalgalanmaları
- Nörolojik tolerabilite: ataksi, diplopi, sedasyon
- Laboratuvar izlemi: tam kan sayımı ve karaciğer fonksiyon testleri, uygun hastalarda serum sodyumu
- Etkileşim kontrolü: yeni ilaç eklenmesi veya kesilmesi durumunda yeniden değerlendirme
- Uygun hastalarda farmakogenetik risk değerlendirmesi: özellikle ağır kutanöz reaksiyon riski açısından belirli etnik kökenlerde HLA temelli tarama stratejileri
14) Özel popülasyonlar: yaşam döngüsü boyunca karbamazepin
Çocuklar: Metabolizma hızı ve epoksit metabolit oranları farklılaşabilir; titrasyon ve hedef dozlar daha dikkatli bireyselleştirilir.
Yaşlılar: Sedasyon, ataksi, düşme riski ve hiponatremi eğilimi daha belirgin olabilir; polifarmasi etkileşim riskini büyütür.
Gebelik ve emzirme: Antiepileptik tedavi, anne ve fetüs risklerinin dengelenmesini gerektirir. Karbamazepin, teratojenite ve neonatal etkiler bağlamında risk–yarar değerlendirmesiyle ele alınır; folat desteği, doğum öncesi izlem ve alternatif seçeneklerin uygunluğu klinik kararı şekillendirir.
Karaciğer hastalığı: Metabolizma merkezi karaciğer olduğundan, maruziyet artışı ve toksisite riski yükselir; doz azaltımı, daha sık izlem ve mümkünse alternatifler gündeme gelebilir.
Keşif
1950’ler: Arayış Dönemi ve İlk Kıvılcımlar
1950’li yıllar, sinir sistemi hastalıklarına çare olacak yeni ilaçların arandığı heyecan verici bir dönemdi. Epilepsi tedavisinde o döneme dek bromür tuzları, fenobarbital (1912’de keşfedilen bir barbitürat) ve 1930’larda bulunan fenitoin gibi birkaç temel ilaç kullanılıyordu. Psikiyatri alanında ise 1952’de ilk antipsikotik olan klorpromazinin başarısı, ilaç endüstrisinde büyük bir merak dalgası yaratmıştı. İşte bu bilimsel atmosfer içinde, İsviçre’nin Basel kentindeki J.R. Geigy firmasının laboratuvarlarında genç kimyager Walter Schindler yeni bir trisiklik bileşik üzerinde çalışmaya başladı. Amaç, imipramin gibi antidepresan ya da klorpromazin benzeri antipsikotik etkili bir molekül geliştirmekti. Schindler 1953 yılında, iminostilben sınıfından bir bileşik sentezlemeyi başardı. Bu bileşiğe daha sonra karbamazepin adı verilecekti. İlk etapta deney tüplerinde ve hayvan modellerinde yapılan testler, Schindler’in sentezlediği bu maddenin beklenenden farklı bir profil sergilediğini gösterdi. Klasik bir yatıştırıcı psikiyatrik ilaç gibi davranmıyordu; buna karşılık elektrikle tetiklenen nöbetleri kedilerde engelleyebildiği ve bazı ağrı modellerinde etkili olabildiği görüldü. Bu sıradışı bulgu, karbamazepinin kaderini belirleyen ilk kıvılcım oldu. Schindler ve meslektaşları, keşfettikleri bu molekülün antiepileptik ve ağrı giderici potansiyelini fark ederek araştırma yönünü değiştirdiler. 1954’te Schindler ve çalışma arkadaşı Franz Häfliger, iminodibenzil türevleri üzerine yaptıkları çalışmayı bilim dünyasına sunarak karbamazepinin kimyasal yapısını tanımladı. Henüz ortada ilacın klinik kullanımı yoktu, fakat laboratuvardaki bu buluş, ileride pek çok hastanın yaşamını değiştirecek bir inovasyonun habercisiydi.
1960’lar: Laboratuvardan Kliniğe – İlk Başarılar
1960’lara gelindiğinde karbamazepin, araştırmacılar arasında kod adı G-32883 olarak anılıyordu ve dikkat çekmeye başlamıştı. Geigy firması 1960 yılında bu bileşik için patent başvurusunda bulundu; bu, ilacın ticarileşme yolculuğunun ilk adımıydı. İlacın potansiyeli, laboratuvar çalışmalarından klinik gözlemlere taşınmak üzereydi. Nöroloji ve ağrı uzmanları, özellikle tedavisi zor bir yüz ağrısı hastalığı olan trigeminal nevralji üzerinde karbamazepini denemeye karar verdiler. O dönemde trigeminal nevralji (eski adıyla tic douloureux) hastaları, yüzlerinde şimşek çakar gibi hissettiren dayanılmaz ağrılara maruz kalıyor ve eldeki tedaviler yetersiz kalıyordu.
Nisan 1962’de bu alanda önemli bir dönüm noktası yaşandı: Hollandalı bir hekim olan Dr. H. B. Bomm (Sjaak Blom olarak da bilinir), The Lancet dergisinde yayımladığı kısa bir makalede, G-32883 numaralı deneysel ilacın trigeminal nevralji ağrısını dindirdiğini duyurdu. Bu çalışma, sadece iki hastanın tedavi sonuçlarını raporluyordu ancak etkiler o kadar çarpıcıydı ki tıp camiasında büyük heyecan uyandırdı. Yeni ilaç, ağızdan verildikten kısa süre sonra yıllardır süren dayanılmaz ağrıları adeta “fişini çekiyor” gibiydi. Bilim insanları için bu sonuç, karbamazepinin laboratuvardan çıkıp gerçek hastaların hayatına dokunduğu ilk başarı olarak tarihe geçti.
Trigeminal nevraljideki bu başarının hemen ardından, karbamazepinin asıl hedeflerinden biri haline gelen epilepsi alanında da adımlar hızlandı. 1963 ve 1964 yıllarında Avrupalı nörologlar ilacı epilepsi hastalarında denemeye başladılar. Bu erken klinik araştırmalar, karbamazepinin epileptik nöbetleri azaltmada güçlü bir etkisi olduğunu gösterdi. Özellikle odak (parsiyel) ve jeneralize tonik-klonik nöbetleri kontrol altına alabildiği anlaşıldı. Bunun üzerine İsviçre, İngiltere ve diğer bazı ülkelerde sağlık otoriteleri hızla harekete geçti. 1963 yılında İsviçre, karbamazepini Tegretol marka ismiyle epilepsi tedavisinde kullanım için onayladı. 1965’te Birleşik Krallık, ilacı antikonvülsan (nöbet önleyici) olarak resmen piyasaya sundu. Tegretol, kısa sürede birçok ülkede epilepsi doktorlarının reçetelerinde yerini almaya başladı. İlacın çifte başarısı – hem epilepsi nöbetlerini kontrol etmesi hem de trigeminal nevralji gibi dirençli bir ağrıyı dindirmesi – onu 1960’lar boyunca nöroloji pratiğinin parlayan yeni yıldızı haline getirdi.
Ne var ki, Atlantik’in öte yakasında, Amerika Birleşik Devletleri’nde süreç biraz daha temkinli ilerledi. Karbamazepin Avrupa’da yaygınlaşırken, ABD’de ilaç düzenleyici kurumları yeni ilaçlara karşı artık daha sıkı güvenlik ve etkililik kriterleri uygulamaya başlamıştı. 1962’deki talidomid faciasının ardından ABD Gıda ve İlaç Dairesi (FDA), ilaç onay süreçlerini sıkılaştırmış ve güçlü klinik kanıtlar talep eder olmuştu. Karbamazepin, 1968 yılında ABD’de trigeminal nevralji tedavisi için sınırlı bir endikasyonda onay almış olsa da, geniş çaplı antiepileptik olarak onaylanması daha uzun sürdü. Bunun en büyük nedeni, ilacın ender de olsa görülen yan etkileri konusundaki endişelerdi. Özellikle birkaç vakada rapor edilen ciddi kan hastalıkları (örneğin aplastik anemi) FDA’yı temkinli olmaya itti. İlaçla ilgili daha kapsamlı klinik veriler biriktikçe, sonunda 1974 yılında FDA karbamazepini epilepsi tedavisi için onayladı. Böylece karbamazepin, ABD’de onaylanırken klinik etkinliğinin kanıtlanmasına dayanan yeni nesil ilaç düzenlemelerinin de ilk örneklerinden biri oldu.
1970’ler: Yeni Ufuklar – Psikiyatriyle Kesişen Yollar
1970’lere gelindiğinde karbamazepin dünya genelinde epilepsi ve trigeminal nevralji tedavilerinin önemli bir parçası haline gelmişti. Ancak ilacın hikâyesi burada durmadı; tam tersine, beklenmedik bir şekilde psikiyatri alanına uzanarak yeni bir ufuk açtı. Bu dönemde Japonya’da yaşananlar, karbamazepinin çok yönlü etkilerine dair en çarpıcı keşiflerden birini ortaya koydu.
Japonya’da o yıllarda bipolar bozuklukta kullanılan temel tedavi olan lityum, düzenleyici engeller nedeniyle piyasada bulunmuyordu. Psikiyatristler, özellikle şiddetli manik ataklar geçiren hastalara yardımcı olabilecek alternatifler arayışındaydı. 1971 yılında Japon psikiyatristler Dr. Yukio Takezaki ve Dr. Yutaka Hanaoka, alışılmadık bir yaklaşım deneyerek, epilepsi tedavisinden aşina oldukları karbamazepini manik hastalara vermeye başladılar. Bu hastalar daha önce antipsikotik ilaçlarla yatıştırılamayacak kadar ajite ve taşkın durumdaydı. Sonuç, beklenmedik biçimde olumluydu: Karbamazepin, birkaç gün içinde mani belirtilerini yatıştırmayı başardı. Hastaların düşünce uçuşmaları ve taşkın davranışları gerilerken, çevrelerine karşı daha duyarlı ve kontrollü hale geldiler. Takezaki ve Hanaoka’nın bu öncü uygulaması, Japonya’da klinik çevrelerde büyük ilgi uyandırdı.
Aynı yıl, Dr. Tadao Okuma adında bir başka Japon psikiyatrist, benzer bir keşfi onlardan bağımsız olarak yaptı. Okuma da lityum yerine çaresiz kaldığı manik hastalarda karbamazepini denemiş ve kayda değer iyileşmeler görmüştü. İlginç olan, bu doktorların her ikisinin de aslında epilepsi konusunda deneyimli oluşlarıydı; yani karbamazepinin nörolojik etkilerini ve saldırganlık azaltıcı potansiyelini biliyorlardı. Bu bilgi birikimini, çaresiz durumdaki bipolar hastalara yaratıcı bir şekilde uyguladılar. Böylece karbamazepin, ilk kez bir duygu durum düzenleyici olarak keşfedilmiş oldu.
1970’lerin geri kalanında Japon araştırmacılar bu bulguyu sistematik olarak incelemeye devam ettiler. Bir dizi vaka serisi ve küçük ölçekli klinik çalışma, karbamazepinin bipolar bozuklukta özellikle manik atakları kontrol altına alabildiğini gösteriyordu. İlacın anti-agresif ve sakinleştirici etkileri, o güne dek sadece antipsikotiklerle veya elektroşok tedavisiyle yönetilebilen bazı vakalarda önemli faydalar sağladı. Bu gelişmeler, Doğu’dan Batı’ya yayılırken Avrupa ve Amerika’daki psikiyatristlerin de dikkatini çekmeye başladı. 1978 yılına gelindiğinde ABD’de de bazı öncü psikiyatristler, lityuma yanıt vermeyen veya hızlı döngülü bipolar bozukluğu olan hastalarda karbamazepini denemeye başladılar. Uluslararası konferanslarda Japonya’daki deneyimler aktarılıyor, yayınlar çoğalıyor ve bilimsel merak büyüyordu. Böylece 1970’ler, karbamazepinin bir antiepileptik olmaktan çıkıp “mood stabilizer” (duygu durum dengeleyici) olarak ikinci bir kariyere adım attığı dönem oldu. Bu, ilacın keşif öyküsünde belki de en beklenmedik ve ilham verici bölümlerden biriydi: Başlangıçta bir psikiyatrik ilaç geliştirmek isteyen Schindler’in molekülü, yıllar sonra bambaşka bir psikiyatrik ihtiyaca cevap vererek adeta tam bir döngü çizmişti.
1980’ler: Mekanizmanın Aydınlanması ve Küresel Yaygınlık
1980’lere girerken karbamazepin artık olgunlaşmış ve dünyanın dört bir yanında hekimlerin güvendiği bir ilaç haline gelmişti. Epilepsi tedavisinde, özellikle fokal (parsiyel) ve jeneralize tonik-klonik nöbetlerin kontrolünde altın standartlardan biri olarak kabul ediliyordu. Trigeminal nevralji denince, ilk ve en etkili ilaç olarak karbamazepin akla gelir olmuştu. Bipolar bozuklukta da, lityuma dirençli vakalarda yararlı olabileceği giderek daha fazla hekim tarafından benimseniyordu. Dünya Sağlık Örgütü de bu ilacın önemini teslim etti ve karbamazepini temel sağlık sistemlerinde bulunması gereken Temel İlaçlar Listesi’ne ekleyerek onun vazgeçilmezliğini vurguladı.
Bu dönemde bilim insanları, karbamazepinin sinir sistemi üzerindeki etkilerinin altında yatan mekanizmaları daha derinlemesine anlamaya yöneldiler. 1980’lerin araştırmaları, ilacın hücresel düzeyde sodyum kanallarını hedef aldığını ortaya koydu. Nörobiyologlar, karbamazepinin nöronlarda aşırı elektriksel boşalımları engelleyen bir “dengeleyici” gibi çalıştığını gösterdiler. Normalde bir sinir hücresi ateşlendikten sonra sodyum kanalları aracılığıyla hızlı bir elektrik sinyali üretir; epileptik beyinlerde bu süreç kontrolden çıkarak sürekli ateşleme döngülerine yol açar. Karbamazepin ise sodyum kanallarını inaktif konumda sabitleyerek, nöronun tekrar tekrar ateşlenmesini zorlaştırıyordu. Bunun sonucu olarak aşırı senkronize deşarjlar engelleniyor ve nöbet eşiği yükseliyordu. Ayrıca bazı çalışmalar, ilacın yüksek frekanslı deşarjları seçici olarak baskıladığını, normal sinir iletimini ise büyük ölçüde koruduğunu gösterdi. Bu, ilacın neden epileptik beyin dalgalarını yatıştırırken hastaları fazla uyutmadan günlük işlevlerini sürdürebilmelerine imkân verdiğini açıklamaya yardımcı oldu.
Karbamazepinin mekanizmasıyla ilgili araştırmalar sadece iyon kanallarıyla sınırlı değildi. 1980’ler boyunca yapılan çeşitli deneysel çalışmalar, bu molekülün aynı zamanda beyindeki GABA sistemi ve glutamat reseptörleri gibi diğer nörotransmitter yolları üzerinde de dolaylı etkilerinin olabileceğini öne sürdü. Örneğin, karbamazepinin uyarıcı glutamat sinyallerini zayıflatabileceği veya inhibitör GABA sinyallerini güçlendirebileceği tartışıldı. Her ne kadar tüm bu etki mekanizmaları tam olarak çözümlenmemiş olsa da, 1980’lere gelindiğinde bilim dünyası karbamazepinin “çok araçlı” bir nöromodülatör olduğunu kabul etmişti. Bu sayede hem epilepsi nöbetlerini hem de duygudurum dalgalanmalarını kontrol edebilmesi daha anlaşılır hale geldi.
Bu on yıl aynı zamanda ilacın güvenlik profilinin yakından izlendiği bir dönem oldu. Karbamazepin kullanan geniş hasta popülasyonlarında biriken veriler, ilacın yaygın yan etkilerinin (sersemlik, uyuklama, hafif denge bozukluğu gibi) genelde yönetilebilir olduğunu gösterdi. Ancak seyrek de olsa ciddi deri döküntüleri (örneğin Steven-Johnson sendromu) ve kan hücresi bozuklukları gelişebildiği tespit edildi. Bu nedenle hekimler, özellikle uzun süreli tedavilerde düzenli kan sayımı takibi ve hastaları olası deri reaksiyonları konusunda uyarma gibi önlemler almaya başladılar. Tüm bu çabalara rağmen karbamazepin, risk-fayda dengesi açısından bakıldığında halen birçok hastalık için en etkili çözümlerden biriydi ve dünya genelinde milyonlarca insanın yaşam kalitesini yükseltiyordu.
1990’lar: İlacın Evrimi – Yeni Türevler ve Gelişmeler
1990’lı yıllar, karbamazepinin başarısından ilham alınarak geliştirilen yeni moleküllerin ve formülasyonların sahneye çıktığı dönem oldu. Kimyagerler, karbamazepin molekülünü temel alarak onun olumlu etkilerini koruyup olumsuz yönlerini azaltabilecek türevler tasarlamaya giriştiler. Bu arayışın bir sonucu olarak oksarbazepin adlı ilaç ortaya çıktı. Oksarbazepin, karbamazepinin yapısal bir analoğuydu; küçük bir kimyasal değişiklik (karbamoil grubun keton türevine çevrilmesi) ile elde edilmişti. Laboratuvar testleri, oksarbazepinin aktif bir metabolitinin (eslikarbazepin) karbamazepine benzer antiepileptik etki sağladığını, ancak karaciğerde enzim indüksiyonunun ve etkileşimlerinin daha az olduğunu gösterdi. 1990 yılında Avrupa’da oksarbazepin çocukluk çağı epilepsilerinde kullanım için onay aldı ve böylece karbamazepin ailesinin ilk “ikinci kuşak” üyesi klinik hayata atılmış oldu. Hastalar ve doktorlar, oksarbazepinin karbamazepine kıyasla daha iyi tolere edilebildiğini, bazı yan etkilerinin (örneğin ilaç etkileşimleri ve nadir kan sorunları) nispeten daha az görüldüğünü deneyimlemeye başladılar. Bu yeni ilaç, 2000 yılında ABD’de de onaylanarak küresel ölçekte kullanıma girdi. Her ne kadar oksarbazepin karbamazepinin yerini tamamen almasa da, özellikle bazı hastalarda iyi bir alternatif olarak epilepsi tedavi cephaneliğine katıldı.
1990’larda bir diğer önemli gelişme, kontrollü salım formülasyonlarının ortaya çıkışıydı. Karbamazepin, farmakokinetik özellikleri gereği günde birkaç doz alımı gerektiren bir ilaçtı ve düzensiz emilim gösterebiliyordu. Bu sorunu aşmak için ilaç firmaları yavaş salınan tabletler geliştirdiler. “Tegretol CR” veya “Carbatrol” gibi uzatılmış salım preparatları sayesinde, hastaların kanındaki ilaç düzeyleri daha dengeli tutulabiliyor, böylece ani zirve düzeylere bağlı yan etkiler azalırken nöbet kontrolü kesintisiz sağlanıyordu. Bu yenilik, özellikle uzun süreli tedavi gören epilepsi hastalarının yaşamını kolaylaştırdı. Ayrıca 1990’ların sonunda, intravenöz karbamazepin formülasyonu üzerine çalışmalar başladı; ilacı ağızdan alamayan veya status epileptikus gibi acil durumdaki hastalara damar yolundan karbamazepin verilebilmesi hedeflendi. Her ne kadar intravenöz form klinik pratikte yaygınlaşması için biraz daha zaman gerekse de, bu araştırmalar karbamazepinin kullanım alanlarını genişletme çabasının bir parçasıydı.
Karbamazepinin 90’lardaki evrimi sadece yeni ilaçlarla sınırlı kalmadı, aynı zamanda ilacın psikiyatrik alandaki konumunun pekişmesini de içerdi. Yapılan daha büyük ölçekli çalışmalar ve klinik deneyimler, karbamazepinin bipolar bozuklukta özellikle hızlı döngülü (rapid cycling) seyrin kontrolünde ve klasik tedavilere yanıt vermeyen olgularda değerli bir seçenek olduğunu doğruladı. Psikiyatri kılavuzları, karbamazepini yavaş yavaş ikinci basamak bir duygu durum düzenleyici olarak listelerine eklediler. Nihayet, bu eğilim resmî bir onayla taçlandı: 2002 yılında ABD FDA, karbamazepinin özel bir kontrollü salım formu olan Equetro’yu akut mani tedavisi için onayladı. Bu, ilacın yaklaşık otuz yıl önce Japonya’da başlayan psikiyatri serüveninin bir nevi resmî kabulü anlamına geliyordu. Artık karbamazepin, dünya genelinde hem nöroloji hem psikiyatri alanlarında kendine sağlam bir yer edinmiş, çok yönlü bir ilaç konumundaydı.
2000’lerden Günümüze: Çağdaş Yaklaşımlar ve Süregelen Araştırmalar
- yüzyıla girerken karbamazepin, “eski fakat eskimeyen” bir ilaç olarak tıp dünyasında varlığını sürdürüyor. Günümüzde de epilepsi için temel tedavilerden biri olmayı, trigeminal nevraljinin birincil ilacı ünvanını ve bipolar bozuklukta önemli bir seçenek olma özelliğini koruyor. Ancak bilimsel merak durmak bilmiyor ve karbamazepin hakkında yeni sorular sormaya, yeni çözümler aramaya devam ediyor. Son yirmi yılda, ilacın hem daha güvenli kullanımı hem de yeni kullanım alanları konusunda dikkat çekici gelişmeler yaşandı.
Öncelikle, karbamazepinin ciddi deri reaksiyonlarıyla ilişkisi, farmakogenetik alanında bir araştırma konusu haline geldi. 2004 yılında Asya’da yapılan çığır açıcı bir genetik çalışma, karbamazepine bağlı Stevens-Johnson sendromu gibi hayatı tehdit edici cilt reaksiyonlarının belirli bir genetik yapıyla ilişkili olduğunu ortaya koydu. Tayvanlı bilim insanları, HLA-B*1502 adı verilen bir doku antijeni geninin belirli varyantını taşıyan bireylerin, karbamazepin aldıklarında bu ağır deri reaksiyonlarını geliştirmeye son derece yatkın olduklarını keşfettiler. Bu keşif, tıp tarihinde kişiye özel tedavi yaklaşımlarının güzel bir örneği haline geldi. Çünkü hemen ardından bazı ülkelerde, özellikle Güneydoğu Asya kökenli hastalarda karbamazepin tedavisine başlamadan önce HLA-B*1502 gen testinin yapılması rutin hale getirildi. FDA da 2007 yılında karbamazepin kutu prospektüsüne bir farmakogenetik uyarı ekleyerek, Asya kökenli hastalarda ilaca başlamadan önce genetik tarama yapılmasını önerdi. Bu sayede, genetik risk taşıyan bireylerde alternatif tedavilere yönelerek hayatı tehdit eden yan etkiler büyük ölçüde önlenebiliyor. Karbamazepin, keşfinden on yıllar sonra bile, bu tür gen-ilaç etkileşimlerine dair araştırmalarla bilim insanlarına yeni şeyler öğretmeye devam ediyor.
Bir diğer yenilikçi yaklaşım, karbamazepinin etkisini mekânsal ve zamansal olarak daha kontrollü hale getirme çabalarından geldi. Son yıllarda fotofarmakoloji adı verilen öncü bir araştırma alanı doğdu. Bu alandaki bilim insanları, ilaç moleküllerine ışıkla etkinleşip etkisizleşebilen özel anahtarlar ekleyerek, ilacın vücuttaki etkisini “ışık düğmesiyle” açıp kapatabilmeyi amaçlıyorlar. 2020’li yılların başlarında Avrupa’da bir araştırma grubu, karbamazepinin kimyasal yapısını modifiye ederek ışığa duyarlı bir türev geliştirmeyi başardı. Bu deneysel bileşik, fare modellerinde deri altına verilip ilgili sinir bölgesine ışık tutulduğunda aktif hale gelerek ağrı sinyallerini bloke edebiliyordu. Işık kaldırıldığında ise etkisi duruyordu. Bu sayede, karbamazepinin tüm vücutta yan etki yapması yerine sadece istenen bölgede ve istenen süreyle etkili olması sağlandı. Henüz bu teknoloji klinik uygulamaya geçmiş olmasa da, bilimsel hayal gücünün karbamazepini bile nasıl yeni bir çağa taşımaya çalıştığının büyüleyici bir örneğini sunuyor.
Karbamazepinin keşif yolculuğu, aynı zamanda yeni endikasyonlar ve farklı disiplinlerde de devam ediyor. Farmakoloji araştırmacıları, bu eski ilacın beklenmedik bazı biyolojik etkilerini keşfederek farklı hastalıklarda işe yarayıp yaramayacağını sorguluyorlar. Örneğin, hücre kültürü ve hayvan modellerinde karbamazepinin hücre içi atık temizleme sistemi olan otofojiyi artırabildiği gösterildi; bu da bazı nörodejeneratif hastalıklarda veya metabolik bozukluklarda faydalı olup olamayacağının araştırılmasına yol açtı. Onkoloji alanında yapılan erken dönem çalışmalarda, karbamazepinin belirli kanser hücrelerinin sinyal yollarını etkileyerek çoğalmalarını yavaşlatabileceği yönünde ipuçları elde edildi. Nadir genetik hastalıklarda ise, bozulmuş iyon kanal faaliyetlerini modüle ederek semptomları hafifletmede rol oynayabileceği öne sürülüyor. Bu çalışmalar henüz başlangıç aşamasında olsa da, karbamazepinin “yeniden konumlandırılması” (yeniden kullanımı) fikri bilim insanlarının ilgisini çekmiş durumda. Belki gelecekte, bu kadim ilacın adını bambaşka tedavi protokollerinde de duyabiliriz.
Günümüzde karbamazepin klinik pratiğin köklü bir demirbaşı olmuştur. Bir yandan daha yeni antiepileptik ilaçlar (örneğin levetirasetam, lamotrijin, vb.) piyasaya çıkmış ve bazı ülkelerde ilk tercih haline gelmiş olsa da, özellikle kaynakların kısıtlı olduğu bölgelerde karbamazepin hâlâ epilepsi tedavisinin bel kemiğini oluşturmaktadır. Trigeminal nevralji tedavisinde de, lazer cerrahisi veya diğer invaziv yöntemler gelişmiş olmasına rağmen, ilk basamak tedavi olarak karbamazepin verilmesi dünya çapında standart uygulamadır. Psikiyatride, güncel kılavuzlar karbamazepini genellikle ikinci sırada önerseler de, ilacın özellikle atakları hızlı döngüsel seyreden veya diğer tedavilere dirençli bipolar hastalarda yararlı olabileceği bilinmektedir. Üstelik bugün karbamazepin, kontrollü salım kapsülleri, şurup formları ve hatta kısa süreli intravenöz infüzyon preparatı gibi çeşitli şekillerde hastaların ihtiyaçlarına uygun olarak sunulmaktadır.
İleri Okuma
- Schindler, W. (1953). Über Derivate des Iminodibenzyls. Helvetica Chimica Acta, 36, 1925–1932.
- Schindler, W., Häfliger, F. (1954). Neue Iminostilben-Derivate mit zentralnervöser Wirkung. Helvetica Chimica Acta, 37, 472–483.
- Häfliger, F., Schindler, W. (1964). Synthese und pharmakologische Eigenschaften neuer Iminostilben-Derivate. Arzneimittel-Forschung, 14, 117–123.
- Blom, S. (1962). Trigeminal neuralgia: its treatment with a new anticonvulsant drug (G-32883). The Lancet, 279(7234), 839–840.
- Blom, S., Schain, R. J. (1963). Further observations on the analgesic effect of carbamazepine in trigeminal neuralgia. Neurology, 13(10), 876–879.
- Hardenberg, J., Schmidt, D. (1966). Clinical experience with carbamazepine in epilepsy. Epilepsia, 7(2), 113–121.
- Dalby, M. A. (1966). The effect of carbamazepine on different types of epilepsy. Epilepsia, 7(4), 291–297.
- Takezaki, Y., Hanaoka, Y. (1971). The use of carbamazepine (Tegretol) in the control of manic-depressive psychosis and other manic, depressive states. Seishin Igaku, 13, 173–183.
- Okuma, T., Kishimoto, A., Inoue, K., Matsumoto, H. (1973). Anti-manic and prophylactic effects of carbamazepine in manic-depressive psychosis. Psychiatry and Clinical Neurosciences, 27(3), 283–297.
- Post, R. M., Uhde, T. W., Ballenger, J. C. (1982). Carbamazepine in the treatment of affective illness: a review. Archives of General Psychiatry, 39(8), 895–902.
- Macdonald, R. L., Kelly, K. M. (1983). Antiepileptic drug mechanisms of action. Epilepsia, 24(Suppl 1), S1–S22.
- Ragsdale, D. S., Avoli, M. (1998). Sodium channels as molecular targets for antiepileptic drugs. Brain Research Reviews, 26(1), 16–28.
- Tomson, T., Tybring, G., Bertilsson, L. (1990). Carbamazepine-10,11-epoxide in epilepsy: a pilot study. Archives of Neurology, 47(8), 888–892.
- Pisani, F., Oteri, G., Russo, M. F., Di Perri, R., Caruso, G., Richens, A. (1990). Interaction of carbamazepine-10,11-epoxide, an active metabolite of carbamazepine, with valproate. Epilepsia, 31(3), 339–343.
- Bertilsson, L. (1978). Clinical pharmacokinetics of carbamazepine. Clinical Pharmacokinetics, 3(2), 128–143.
- Levy, R. H., Kerr, B. M. (1990). Autoinduction of carbamazepine metabolism. Epilepsia, 31(Suppl 3), S17–S22.
- Spina, E., Pisani, F., Perucca, E. (1996). Clinically significant pharmacokinetic drug interactions with carbamazepine. Clinical Pharmacokinetics, 31(3), 198–214.
- Chen, P., Lin, J. J., Lu, C. S., Ong, C. T., Hsieh, P. F., Yang, C. C., Tai, C. T., Wu, S. L., Lu, C. H., Hsu, Y. C., Yu, H. Y., Ro, L. S., Liao, W. P., Chen, W. H., Chen, R. S., Lin, Y. Y., Shih, T. T., Hsieh, Y. J., Wu, Y. R., Chang, C. C., Hwang, J. J., Chen, Y. J., Lin, M. W., Chen, H. C., Wu, S. H., Chang, Y. T., Chen, C. H., Tsai, J. J. (2011). Carbamazepine-induced toxic effects and HLA-B*1502 screening in Taiwan. New England Journal of Medicine, 364(12), 1126–1133.
- Ferrell, P. B., McLeod, H. L. (2008). Carbamazepine, HLA-B*1502 and risk of Stevens–Johnson syndrome and toxic epidermal necrolysis: US FDA recommendations. Pharmacogenomics, 9(10), 1543–1546.
- Tolou-Ghamari, Z., Zare, M., Habibabadi, J. M., Najafi, M. R. (2013). A quick review of carbamazepine pharmacokinetics in epilepsy from 1953 to 2012. Journal of Research in Medical Sciences, 18(Suppl 1), S81–S85.
- Fricke-Galindo, I., LLerena, A., Jung-Cook, H., López-López, M. (2018). Pharmacogenetics of adverse reactions to antiepileptic drugs. Neurología, 33(3), 165–176.
- U.S. Food and Drug Administration. (2022). Carbamazepine label: warnings and precautions including HLA-B*1502. FDA Approved Drug Products Labeling.

Yorum yazabilmek için oturum açmalısınız.