İçindekiler
1. Tarihçe ve Etimoloji
1.1. “Serotonin” ve “depresyon” sözcüklerinin kökeni
Serotonin terimi, 1940’lı yıllarda vasküler tonusu arttıran bir serum bileşeninin tanımlanmasına dayanır: serum + tonus → serotonin. Daha sonra bu maddenin 5-hidroksitriptamin (5-HT) olduğu anlaşılmış, santral sinir sisteminde nörotransmitter olarak da görev yaptığı gösterilmiştir.
Depresyon sözcüğü Latince deprimere (aşağı bastırmak, bastırıp indirmek) fiilinden gelir; psikiyatrik anlamda “duygu durumunun kalıcı biçimde çökmesi” anlamını kazanması 19. yüzyıl sonu–20. yüzyıl başı psikiyatri literatürüyle birlikte olmuştur. Bu etimolojik çerçeve, klinik kavramla uyumludur: SSRI’lar, “aşağı bastırılmış” olan duygu durumunu nörobiyolojik arka planda kısmen “yukarı çekmeyi” hedefler.
1.2. İlk SSRI’ların geliştirilmesi
Monoamin hipotezi, 1950’lerden itibaren reserpin, trisiklik antidepresanlar (TCA’lar) ve monoamin oksidaz inhibitörleri (MAOI’ler) üzerine yapılan gözlemlerle şekillendi. Bu hipotez, depresyonu başlıca serotonin, noradrenalin ve kısmen dopamin düzeylerindeki azalma ile ilişkilendiriyordu.
Zimelidin, 1970’lerin sonlarında geliştirilen ve piyasaya giren ilk SSRI’dır. 1. nesil antihistaminiklerden türetilen bu molekül, rasyonel ilaç tasarımı bağlamında serotonin taşıyıcısına (SERT) selektif bağlanacak şekilde tasarlanmıştı. Ancak Guillain–Barré benzeri nörolojik yan etkiler nedeniyle kısa süre içinde piyasadan çekildi.
Bunu takiben fluoksetin (Prozac®), sitalopram, sertralin, paroksetin, fluvoksamin ve daha sonra escitalopram gibi ajanlar klinik kullanıma girdi. Günümüzde SSRI’lar, hem psikiyatri pratiğinin hem de bir bütün olarak tıbbın en sık reçete edilen ilaç gruplarından biridir.
2. Evrimsel ve Nörobiyolojik Arka Plan
2.1. Serotonin sisteminin evrimsel sürekliliği
Serotonin, yalnızca insan beynine özgü bir molekül değildir. Çeşitli omurgasızlardan memelilere kadar çok geniş bir yelpazede bulunan, evrimsel olarak son derece korunmuş bir monoamindir. Gastrointestinal sistemde motilite ve sekresyon, vasküler tonus, trombosit fonksiyonu, beslenme davranışı, agresyon, sosyal hiyerarşi ve üreme davranışları gibi pek çok temel işlevde rol oynar.
Bu evrimsel süreklilik, serotonin sistemini farmakolojik müdahaleye açık hâle getirirken, aynı zamanda SSRI’ların çok geniş bir yan etki profilinin olmasının da temelini oluşturur: Tek bir nörotransmitter sistemi hedeflemek, hem beyin hem beden düzeyinde geniş bir “fizyolojik alanı” etkilemek anlamına gelir.
2.2. Serotonerjik yollar ve reseptör alt tipleri
Santral sinir sisteminde başlıca serotonerjik çekirdekler raphe çekirdekleridir. Bu nöronların projeksiyonları korteks, limbik sistem, hipotalamus, beyin sapı ve omurilik dâhil çok geniş bir alana yayılır.
Serotonin reseptörleri, fonksiyonel ve farmakolojik açıdan çok sayıda alt tipe ayrılır (5-HT₁A, 5-HT₁B, 5-HT₂A, 5-HT₂C, 5-HT₃, 5-HT₄, 5-HT₇ vb.). SSRI’lar doğrudan bu reseptörleri hedeflemez; esas etkileri serotonin taşıyıcısının (SERT) inhibisyonu yoluyla sinaptik serotonin miktarını arttırmaktır. Ancak kronik SSRI kullanımı, bu reseptör alt tiplerinde desensitizasyon, densite değişikliği ve sinyal yolaklarının yeniden düzenlenmesi ile sonuçlanır. Özellikle 5-HT₁A otoreseptörlerinin desensitizasyonu, antidepresan etkinin gecikmesinde ve kalıcılığında önemli kabul edilir.
3. Etki Mekanizması (Farmakodinami)
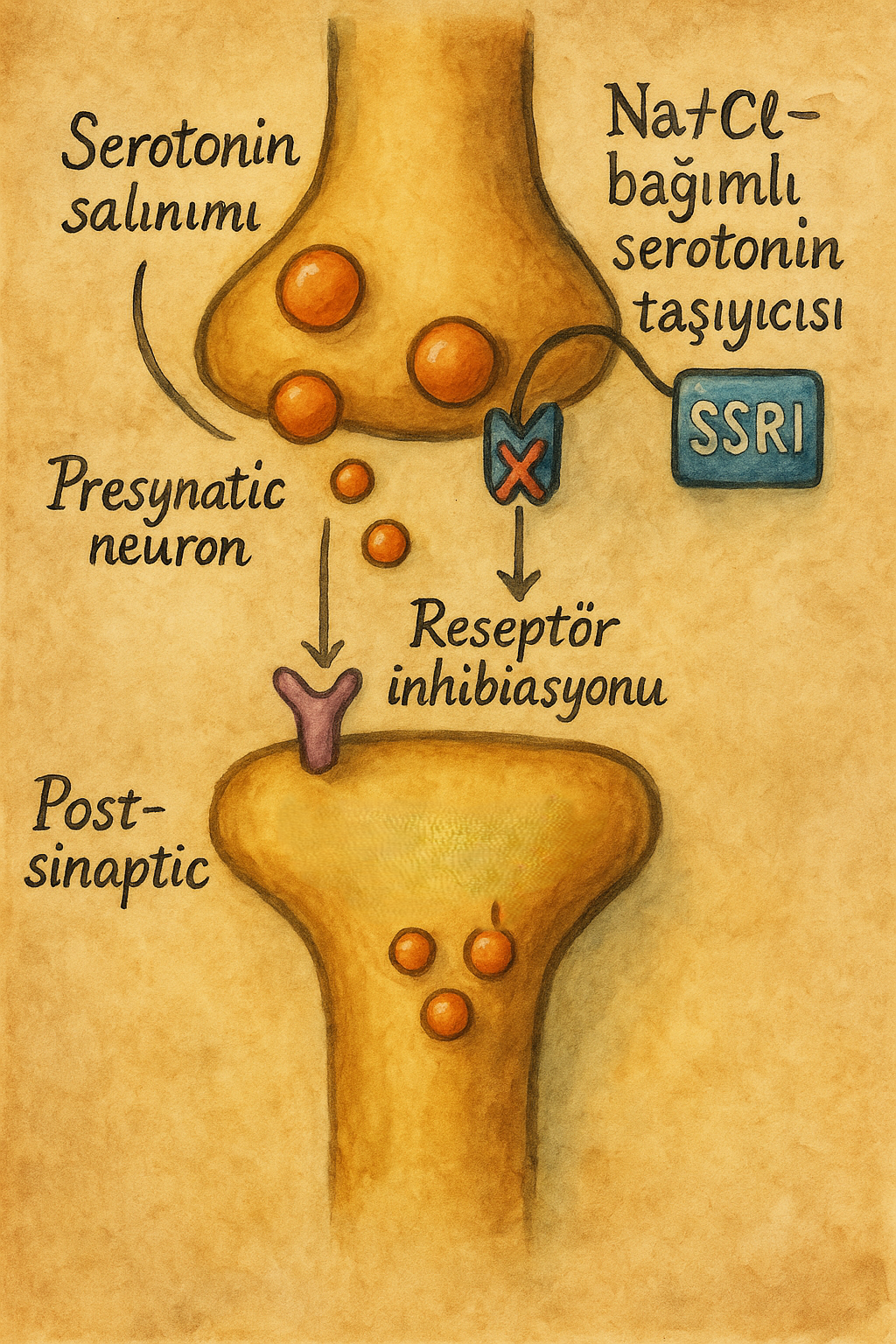
3.1. SERT inhibisyonu ve akut etkiler
SSRI’lar, presinaptik nöron membranında yer alan serotonin taşıyıcısına (SERT) yüksek afiniteli ve görece selektif olarak bağlanır. Bu bağlanma, serotoninin presinaptik hücreye geri alınmasını inhibe eder ve şu sonuçları doğurur:
- Sinaptik aralıkta serotonin konsantrasyonunun artması
- Postsinaptik serotonin reseptörlerinin daha yoğun uyarılması
- Kısa vadede anksiyete ve ajitasyonu geçici olarak artırabilen bir “uyarıcı” etkiler spektrumu
- Uzun vadede (haftalar içinde) reseptör düzeyinde adaptasyon ve duygu durumunda düzelme
Bu mekanizma, monoamin hipotezinin klinik karşılığıdır; ancak güncel anlayış, SSRI’ların asıl antidepresan etkisinin yalnızca “daha çok serotonin” değil, sinaptik plastisite, nörotrofik faktörler (özellikle BDNF), sinaptogenez ve beyin ağlarının yeniden düzenlenmesi üzerinden gerçekleştiğini vurgular.
3.2. Kronik kullanımda nöroadaptasyon
SSRI tedavisinin klinik etkisinin tipik olarak 2–4 hafta, bazen 6–8 hafta sonra belirginleşmesi, nöroadaptif süreçlerin gerekliliğini gösterir. Bu süreçler arasında:
- Somatodendritik 5-HT₁A otoreseptörlerinin desensitizasyonu (raphe çekirdeklerinde “frenin kalkması”)
- Kortikal ve limbik 5-HT reseptörlerinde downregülasyon veya fonksiyonel yeniden ayarlama
- Hipokampusta nörogenez artışı ve BDNF ekspresyonunda artış
- Duygu durum düzenleyici ağlarda (prefrontal korteks–amigdala–hipokampus devreleri) fonksiyonel bağlantı değişiklikleri
SSRI’ların antidepresan etkisi, bu geniş nörobiyolojik yeniden organizasyon sürecinin klinik yansıması olarak düşünülür.
4. Farmakokinetik Özellikler
4.1. Emilim, dağılım ve biyoyararlanım
Çoğu SSRI oral yoldan iyi emilir. Biyoyararlanım genellikle orta-yüksek düzeydedir ve gıdalar emilimi belirgin ölçüde bozmaz. Lipofilik yapıları sayesinde hem kan–beyin bariyerini hem de plasenta bariyerini geçebilir, anne sütüne de belirli oranlarda geçerler.
Plazma proteinlerine bağlanma oranları ilaca göre değişir; örneğin sertralin ve paroksetin belirgin protein bağlanmasına sahiptir. Bu durum, yüksek protein bağlanmalı diğer ilaçlarla etkileşim potansiyelini artırabilir.
4.2. Metabolizma, yarı ömür ve eliminasyon
SSRI’ların önemli bir kısmı hepatik CYP450 enzimleriyle metabolize edilir:
- Fluoksetin: Başlıca CYP2D6 üzerinden metabolize olur; uzun yarı ömrü (1–4 gün) ve aktif metaboliti norfluoksetinin daha da uzun yarı ömrü (7–15 gün) nedeniyle vücuttan tam temizlenmesi haftalar alabilir.
- Sertralin: CYP2D6 ve CYP3A4 başta olmak üzere birden fazla CYP izoenzimi üzerinden metabolize edilir.
- Paroksetin: Güçlü CYP2D6 inhibitörüdür, kendi metabolizmasını da doyurup non-lineer kinetik gösterebilir.
- Fluvoksamin: Belirgin CYP1A2 inhibitörüdür.
- Sitalopram / Escitalopram: CYP2C19, CYP2D6 ve CYP3A4 üzerinden metabolize edilir; QT uzaması riski nedeniyle özellikle yüksek dozlarda dikkat gerektirir.
Eliminasyon çoğunlukla böbrek ve bir ölçüde safra yoluyla metabolitler hâlinde gerçekleşir. Yarı ömürler arası farklılıklar, dozlama sıklığı ve kesilme sendromu riskini etkiler.
5. Klinik Endikasyonlar
SSRI’lar, depresyonun ötesinde geniş bir psikiyatrik ve kısmen nörolojik endikasyon yelpazesinde kullanılır:
- Majör depresif bozukluk (MDB)
- Anksiyete bozuklukları
- Yaygın anksiyete bozukluğu
- Panik bozukluk
- Sosyal anksiyete bozukluğu (sosyal fobi)
- Obsesif-kompulsif bozukluk (OKB)
- Travma sonrası stres bozukluğu (TSSB)
- Bulimia nervosa (özellikle fluoksetin)
- Premenstrüel disforik bozukluk (bazı SSRI’lar, sürekli veya yalnız luteal fazda)
- Erken boşalma (özellikle dapoksetin, kısa etkili SSRI türevi)
- Bazı kronik ağrı sendromları ve somatik semptom bozukluklarında ek / off-label kullanım
Endikasyonlara yaklaşım, ülkeye ve kılavuzlara göre değişebilmekle birlikte, SSRI’lar majör depresyon ve anksiyete spektrumu bozukluklarında ilk basamak farmakoterapi seçenekleri arasında yer alır.
6. Dozaj ve Kullanım İlkeleri
6.1. Başlangıç ve titrasyon
- Çoğu SSRI günde tek doz kullanıma uygundur; uzun yarı ömürleri bu imkânı sağlar.
- Yan etki riskini azaltmak için genellikle düşük dozla başlanır ve klinik yanıta göre 1–2 haftalık aralıklarla titrasyon yapılır.
- Anksiyete bozukluklarında, özellikle panik bozuklukta çok düşük başlangıç dozları tercih edilir; çünkü tedavinin ilk günlerinde artmış anksiyete ve ajitasyon görülebilir.
6.2. Tedavi süresi ve idame
- Majör depresif epizodda ilk yanıt çoğu zaman 2–4 hafta içinde başlar; tam remisyon için 6–12 hafta gerekebilir.
- İlk epizod sonrasında, nüks riskini azaltmak için en az 6–12 ay idame tedavisi önerilir. Çoklu epizod veya yüksek nüks riski durumunda tedavi süresi yıllara uzayabilir.
- Tedavi kesilirken kademeli doz azaltımı tercih edilir; kesilme sendromu riski yüksek olan kısa yarı ömürlü ajanlarda (paroksetin gibi) bu özellikle önemlidir.
7. Kontrendikasyonlar ve Dikkat Gerektiren Durumlar
7.1. Mutlak veya görece kontrendikasyonlar
- MAOI’lerle eşzamanlı kullanım: Klasik (irreversibl) MAOI’lerle SSRI arasında mutlaka “ilaçsız aralık” bırakılmalıdır; aksi hâlde hayatı tehdit eden serotonin sendromu riski doğar.
- Linezolid, metilen mavisi gibi MAO inhibisyonu yapan ajanlarla eş zamanlı kullanımda da ciddi serotonerjik risk vardır.
- Ağır QT uzaması, konjenital uzun QT sendromu, daha önce torsades de pointes öyküsü olan olgularda özellikle sitalopram/escitalopram kullanımı sınırlandırılmalıdır.
- Bipolar bozukluk tanısı alan hastalarda, yalnız başına SSRI kullanımı manik kaymaya yol açabilir; bu nedenle duygudurum dengeleyici ile kombine edilmeden monoterapi olarak verilmesi sakıncalı kabul edilir.
7.2. Özel risk grupları
- Yaşlı hastalar: SIADH/hiponatremi, düşme, ilaç etkileşimi ve kanama riskleri daha yüksektir; düşük doz ve yakın biyokimyasal izlem gerekir.
- Karaciğer yetmezliği: Metabolizma bozulacağından doz ayarlaması ve ilaca göre seçim dikkatle yapılmalıdır.
- Gebelik ve laktasyon: Bazı ajanlar görece daha iyi güvenlik profiline sahiptir; ancak her durumda risk–yarar analizi bireysel yapılmalıdır.
8. İlaç Etkileşimleri
8.1. CYP450 üzerinden etkileşimler
- Fluoksetin ve paroksetin, güçlü CYP2D6 inhibitörleridir; bu durum, aynı enzim üzerinden metabolize edilen beta blokerler, antipsikotikler, antiaritmikler ve bazı analjeziklerin (ör. kodein, tramadol) plazma düzeylerini etkileyebilir.
- Fluvoksamin, belirgin CYP1A2 (ve kısmen CYP2C19) inhibitörüdür; teofilin, klozapin gibi ilaçlarla birlikte dikkat gerektirir.
- Sertralin, sitalopram, escitalopram görece daha zayıf CYP inhibitörleridir, bu nedenle polifarmasili hastalarda tercih sebebi olabilir.
8.2. Serotonerjik ilaçlarla kombinasyon
- Diğer serotonerjik ajanlar (SNRI’lar, triptanlar, tramadol, litiyum, linezolid, bazı opioidler, St. John’s wort vb.) ile birlikte kullanım, serotonin sendromu riskini arttırır.
- Birden fazla antidepresan sınıfı (örneğin SSRI + TCA) kombine edilirken hem serotonerjik hem de kardiyak yan etkiler göz önünde bulundurulmalıdır.
8.3. Kanama riski ve antikoagülanlarla etkileşim
Serotonin, trombositlerde agregasyonu kolaylaştıran bir mediyatördür. SSRI’lar trombosit SERT’ini de inhibe ederek trombosit serotonin içeriğini azaltır, bu da:
- Tek başına hafif derecede kanama risk artışı
- NSAID, aspirin, antikoagülanlar (warfarin, DOAC’lar), trombosit agregasyon inhibitörleri ile birlikte kullanımda klinik olarak anlamlı gastrointestinal kanama risk artışı
ile sonuçlanabilir. Özellikle yaşlı ve komorbid hastalarda bu etkileşim klinik açıdan önemlidir.
9. Yan Etkiler
SSRI’ların yan etki profili, ilaçlar arasında kısmi farklılıklar gösterse de, bazı tipik özellikler pek çok ajan için ortaktır.
9.1. Sık görülen erken yan etkiler
- Gastrointestinal: Bulantı, kusma, ishal veya kabızlık, iştah değişiklikleri
- Santral sinir sistemi: Baş ağrısı, baş dönmesi, uykuya dalma güçlüğü veya sedasyon, huzursuzluk, anksiyete artışı
- Diğer: Terleme artışı, ağız kuruluğu (bazı ajanlarda), titreme
Bu yan etkilerin önemli bir kısmı, tedavinin ilk haftalarında ortaya çıkar ve çoğu olguda birkaç hafta içinde spontan olarak hafifler.
9.2. Cinsel işlev bozuklukları
SSRI’larla ilişkili cinsel işlev bozuklukları en sık ve klinik olarak en belirgin kalıcı yan etkilerdendir:
- Libido azalması
- Ereksiyon ve ejakülasyon bozuklukları
- Anorgazmi veya orgazm eşiğinde belirgin yükselme
- Kadınlarda genital duyum azalması
Bu etkiler genellikle doz bağımlıdır ve uzun süreli kullanımda devam edebilir. Bazı hastalarda tedavi kesildikten sonra da cinsel semptomların sürebildiği bildirilmiştir (post-SSRI cinsel işlev bozukluğu). Klinisyen–hasta iletişiminde sıkça gözden kaçabilen ama yaşam kalitesi açısından çok önemli bir konudur.
9.3. Kilo ve metabolik etkiler
- Bazı SSRI’lar (örneğin paroksetin), uzun vadede kilo artışı ile ilişkilendirilmiştir.
- Fluoksetin gibi bazı ajanlar kısa dönemde iştah azalması ve hafif kilo kaybına yol açabilir; ancak uzun dönem verilerde net ve kalıcı bir kilo kaybı etkisi gösterilememiştir.
- Metabolik sendrom parametreleri üzerindeki etkiler, antipsikotiklere kıyasla daha hafif olsa da, kronik tedavide izlem gerektirir.
9.4. QT uzaması ve kardiyak etkiler
Özellikle sitalopram ve escitalopram, doz bağımlı QT aralığı uzaması ile ilişkilendirilmiştir. Yüksek doz, yaşlılık, elektrolit dengesizlikleri (hipokalemi, hipomagnezemi), eşzamanlı QT uzatan ilaçlar (ör. bazı antiaritmikler, antipsikotikler, makrolid antibiyotikler) varlığında torsades de pointes riski artar. Bu nedenle risk gruplarında EKG izlemi önerilir.
9.5. SIADH ve hiponatremi
SSRI’lar özellikle yaşlılarda uygunsuz ADH salınımı sendromu (SIADH) yoluyla hiponatremiye neden olabilir. Klinik tabloda halsizlik, baş dönmesi, konfüzyon, nöbetler görülebilir. Başlangıç ve doz artışlarından sonra serum sodyum düzeylerinin izlenmesi riskli gruplarda önemlidir.
9.6. Kemik metabolizması ve osteoporoz
Serotonin, hem osteoblast hem osteoklast fonksiyonları üzerinde etkili olup, kemik döngüsüne katılır. Uzun süreli SSRI kullanımı, bazı çalışmalarda:
- Azalmış kemik mineral yoğunluğu
- Artmış kırık riski
ile ilişkilendirilmiştir. Özellikle postmenopozal kadınlar ve osteoporoz riski yüksek yaşlı erkeklerde bu etki pratik açıdan önem taşır.
10. Uzun Süreli Kullanımın Sonuçları
10.1. Nüks ve relaps üzerine etkiler
Uygun doz ve sürede kullanılan SSRI’lar, depresyon ve anksiyete bozukluklarında nüks riskini anlamlı ölçüde azaltır. Bununla birlikte, kronik kullanım:
- Farmakolojik tolerans ve kısmi yanıt
- Bazı olgularda kronik yan etki yükü (özellikle cinsel disfonksiyon, kilo değişimleri)
- İlaç kesilmesini zorlaştıran bağımlılık benzeri psikolojik bağlanma
gibi klinik zorluklar da yaratabilir.
10.2. Kanama riskinde artış
Daha önce değinildiği gibi trombosit fonksiyonu üzerinden etkiler, kronik kullanımla birlikte GİS kanaması ve diğer kanama komplikasyonları riskini artırabilir. Özellikle eşzamanlı antikoagülan veya antiagregan tedavi alan ve daha önce ülser/kanama öyküsü bulunan hastalarda dikkat gerekir.
10.3. Bilişsel etkiler
SSRI’lar genel olarak sedatif etkileri daha düşük ajanlar olmakla birlikte, bazı hastalarda:
- Dikkat azalması
- Mental yavaşlama
- Motivasyon ve “duygusal düzleşme” hissi
bildirilmiştir. Bu etkiler subjektif olup her hastada gözlenmez; ancak doz ayarlaması ve ilaç seçimi açısından önemlidir.
11. Serotonin Sendromu ve Kesilme (Discontinuation) Sendromu
11.1. Serotonin sendromu
Serotonin sendromu, serotonerjik aktivitenin aşırı artışı sonucunda ortaya çıkan, potansiyel olarak hayatı tehdit eden bir tablodur. Klinik triadı:
- Mental durum değişiklikleri: Ajitasyon, konfüzyon, deliryum
- Otonom hiperaktivite: Hipertermi, taşikardi, hipertansiyon, terleme, midriyazis
- Nöromüsküler anomaliler: Tremor, klonus, hiperrefleksi, rijidite
SSRI monoterapisiyle nadirdir; en sık sebep, birden fazla serotonerjik ilacın kombinasyonu veya MAOI ile etkileşimdir. Tedavi, suçlanan ilaçların kesilmesi, destekleyici bakım ve şiddete göre sedasyon (ör. benzodiazepinler) ve yoğun bakım müdahalelerini içerir.
11.2. SSRI kesilme sendromu
Özellikle kısa yarı ömürlü ajanlar (paroksetin, fluvoksamin, kısmen sertralin) ani kesildiğinde:
- “Elektrik çarpması” hissi (“brain zaps”)
- Baş dönmesi, dengesizlik
- Grip benzeri belirtiler
- Duygu durum dalgalanmaları, irritabilite
- Uyku bozuklukları, kabuslar
ile karakterize kesilme sendromu görülebilir. Fluoksetin gibi uzun yarı ömürlü ajanlarda risk daha düşüktür. Bu tabloyu önlemek için kademeli doz azaltımı esastır.
12. Kimyasal Yapı ve Rasyonel Tasarım
SSRI’lar, yapısal olarak 1. nesil antihistaminiklere (ör. difenhidramin, bromfeniramin) benzer fenilpropilamin veya difenilpropanamin iskeletleri üzerine inşa edilmiş moleküllerdir. Zimelidin, fluoksetin ve bromfeniramin arasındaki yapısal benzerlik, bu moleküllerin:
- Bir yandan histaminerjik reseptörlere etki eden antihistaminik atalarından
- Öte yandan monoamin hipotezinin öngördüğü serotonin taşıyıcı hedefinden
yola çıkılarak rasyonel tasarım yaklaşımıyla modifiye edilmesiyle açıklanabilir.
Kimyasal modifikasyonlarla:
- Serotonin taşıyıcısına yüksek afinitenin korunması
- Muskarinik, adrenerjik, histaminerjik reseptörlere afinitenin azaltılması
- Böylece trisiklik antidepresanlara kıyasla daha seçici ve daha iyi tolere edilen bir profil elde edilmesi hedeflenmiştir.
13. Özel Klinik Durumlar
13.1. Gebelik ve laktasyon
Gebelikte SSRI kullanımına ilişkin değerlendirme, her zaman risk–yarar dengesi temelinde yapılır:
- Tedavi edilmeyen ağır depresyon, anne ve fetüs için önemli riskler taşır (yetersiz beslenme, madde kullanımı, prenatal bakımın aksaması, özkıyım riski).
- Bazı SSRI’lar için kardiyak malformasyonlar, persistan pulmoner hipertansiyon, neonatal adaptasyon sendromu gibi riskler tartışılmış; veriler ajana, doza ve zamanlamaya göre değişkenlik göstermektedir.
- Laktasyonda, anne sütüne geçen miktar ve bebekte olası etkiler (sedasyon, kilo alımı, irritabilite) açısından ilaç seçimi dikkatle yapılır.
Bu bağlamda, güncel kılavuzlar genellikle belirli ajanları (örneğin sertralin) gebelik ve emzirme dönemlerinde diğerlerine göre görece daha uygun seçenekler arasında listeler; ancak her olgu bireysel değerlendirme gerektirir.
13.2. Çocuklar ve ergenler
Çocuk ve ergenlerde SSRI kullanımı:
- Belirli endikasyonlarda (majör depresyon, OKB, anksiyete bozuklukları) kanıta dayalıdır.
- Bununla birlikte, bazı çalışmalar başlangıç döneminde intihar düşünceleri ve davranışlarında artış riskine işaret ettiği için bu yaş grubunda yakın klinik izlem ve ebeveyn bilgilendirmesi zorunludur.
14. Günümüzde SSRI’ların Yeri: Avantajlar ve Sınırlılıklar
SSRI’lar, trisiklik antidepresanlar ve klasik MAOI’lerle karşılaştırıldığında:
- Daha iyi tolere edilir
- Antikolinerjik, kardiyotoksik ve sedatif yan etkileri daha düşüktür
- Doz aşımı durumunda mortalite riski genellikle daha azdır
Ancak:
- Klinik yanıt oranları hâlâ sınırlıdır; önemli bir hasta grubunda kısmi yanıt veya tedavi direnci söz konusudur.
- Cinsel işlev bozuklukları, kilo ve duygusal düzleşme gibi yan etkiler, uzun süreli tedaviyi hastalar için zorlayıcı hâle getirebilir.
- Bazı olgularda, psikoterapi ile kombine edilmediğinde, altta yatan psikososyal ve gelişimsel etmenlere nüfuz etmekte yetersiz kalabilir.
Bu nedenle modern psikiyatri pratiğinde SSRI’lar, biyolojik tedavinin temel araçlarından biri olmakla birlikte, bütüncül bir biyopsikososyal yaklaşımın sadece bir bileşeni olarak ele alınmalıdır.
Keşif
Serotoninin insan nörobiyolojisindeki rolünün henüz bilinmediği 1930’lu ve 1940’lı yıllarda, biyokimya laboratuvarlarında damar tonusunu düzenleyen gizemli bir “serum faktörü” üzerinde araştırmalar sürerken, bilim insanları bu maddenin bir nörotransmitter olmadığını, hatta beyinde bir işlevi bulunduğunu dahi düşünmemekteydi. O dönemdeki araştırmacılar –özellikle Maurice Rapport, Arda Green ve Irvine Page– dolaşım sisteminin tonusunu arttıran bu bileşiği saflaştırmayı başardığında ona “serotonin” adını verdiler. Fakat serotoninin yalnızca periferik etkileri olmadığı, merkezi sinir sisteminde de önemli görevler üstlendiği ancak 1950’lerin ortalarında, Brodie, Shore ve Pletscher gibi araştırmacıların katkılarıyla anlaşılmaya başlandı. Bu yıllar, monoaminlerin duygu durum düzenlemedeki rolünü yavaş yavaş görünür kılan bir paradigmanın şekillendiği dönemdi.
Aynı yıllarda klinik psikiyatride bambaşka bir olay gerçekleşiyordu: Tüberküloz tedavisi için kullanılan izoniazid türevleri, beklenmedik şekilde hastaların ruh hâlini “canlandırıyor” ve depresif belirtileri hafifletiyordu. Nathan Kline ve meslektaşlarının bu gözlemi, monoamin oksidaz inhibitörlerinin antidepresan olarak keşfinin yolunu açtı. Ardından, antihistaminiklerden türetilen ilk trisiklik antidepresan olan imipraminin geliştirilmesiyle, serotonin ve noradrenalinin duygu durum düzenlenmesindeki rolüne ilişkin bulgular giderek güçlendi. Artık bilim dünyasında, depresyonun biyokimyasal bir temeli olabileceği düşüncesi yaygın kabul görmeye başlıyordu.
Tam da bu dönemde, antihistaminiklerin kimyasal yapılarının yeniden yorumlanması, farmasötik araştırmalarda yepyeni bir tasarım anlayışı başlattı. Özellikle İsveç’te Astra’nın araştırma laboratuvarlarında çalışan Arvid Carlsson ve ekip arkadaşları, serotonin taşıyıcısını hedefleyebilecek moleküller üzerinde düşünmeye başladı. Antihistaminiklerin fenilpropilamin iskeletindeki yapısal düzenlemelerle yalnızca serotonin taşıyıcısına bağlanabilecek “selektif” bileşiklerin mümkün olabileceği fark edildiğinde, rasyonel ilaç tasarımı artık sezgilere değil, bilimin yönlendirdiği bir mühendisliğe dönüşüyordu.
Bu yaklaşımın ilk somut ürünü, 1970’lerin sonunda geliştirilen zimelidin oldu. Claes Hökfelt ve iş arkadaşlarının katkılarıyla şekillenen bu molekül, serotonin geri alımını “seçici” biçimde engelleyen ilk farmakolojik ajandı. Zimelidin, kağıt üzerinde mükemmel görünüyordu: trisiklik antidepresanlara kıyasla çok daha daha iyi tolere ediliyor, antikolinerjik etkiler göstermiyor, kardiyotoksisite riski taşımıyordu. Klinik uygulamalar umut vericiydi; ancak birkaç yıl sonra nadir fakat ciddi nörolojik komplikasyonlar –Guillain-Barré benzeri sendromlar– nedeniyle geri çekilmek zorunda kaldı. Bununla birlikte zimelidin, bir yolun kapısı kapanırken çok daha geniş bir yolun açılmasını sağlamıştı: serotonin taşıyıcısının yüksek seçicilikle hedeflenebilir olduğu artık tartışmasızdı.
Bu gelişmenin ardından ABD’de Ely Lilly’nin araştırma programında çalışan Bryan Molloy ve David Wong’un öncülüğünde yeni bir molekül ailesi geliştirilmeye başlandı. Kimyasal ismi N-metil-3-fenil-3-[4-(trifluorometil)fenoksi]propilamin olan bileşik, daha sonra Fluoksetin adını alacaktı. Bu molekül, hem SERT’e yüksek afinite gösteriyor hem de antihistaminik veya antikolinerjik etkilere neredeyse hiç sahip olmuyordu. Preklinik çalışmalar tamamlandığında fluoksetin, modern psikofarmakolojinin dönüm noktası olmaya hazırlanıyordu.
1987 yılında fluoksetin ticari adla Prozac olarak onaylandığında, hem klinisyenler hem de hastalar için tamamen yeni bir çağ başlamıştı. Antidepresan tedavi artık ağır sedasyon, kilo alımı, kardiyak risk veya antikolinerjik yük anlamına gelmiyordu. Bu başarı, bilimsel keşfin insan yaşamı üzerindeki dönüşüm gücünün doğrudan bir örneğiydi. Fluoksetinin ardından sertralin, paroksetin, fluvoksamin ve sitalopram gibi yeni jenerasyon ajanlar geliştirildi. Danimarka’da Lundbeck araştırma ekibi, sitalopram molekülünü chirality açısından yeniden değerlendirerek yalnızca aktif S-enantiomerini saflaştırdığında, klinik farmakoloji tarihinde önemli bir adım daha atıldı: escitalopram doğmuştu. Bu molekül, SERT üzerindeki bağlanma kinetiği bakımından önceki tüm SSRI’lardan daha güçlü ve daha temiz bir farmakolojik profil ortaya koyuyordu.
SSRI’ların tarihsel gelişimi yalnızca farmakolojik bir ilerleme değil, aynı zamanda psikiyatrinin evrensel dönüşümünün de bir simgesiydi. 1990’lardan itibaren beyin görüntüleme tekniklerinin ilerlemesiyle SSRI’ların gerçekten neyi değiştirdiği daha net görülmeye başlandı. Fonksiyonel MRI çalışmalarında, SSRI tedavisinin amigdala aktivitesini düzenlediği, prefrontal korteksin kontrol mekanizmalarını güçlendirdiği, limbik sistem–korteks etkileşimini yeniden ayarladığı gösterildi. Aynı dönemlerde hipokampusta nörogenez kavramını güçlendiren araştırmalar, SSRI’ların yalnızca monoamin düzeyini artırmakla kalmadığını, sinaptik plastisite ve nörotrofik faktörleri de etkilediğini ortaya koydu.
2000’li yıllardan itibaren SSRI hikâyesi yeni bir boyut kazandı: Farmako-genetik ve farmako-genomik araştırmalar. CYP2D6 polimorfizmleri, CYP2C19 varyantları, serotonin taşıyıcı genindeki uzun-kısa alel farkları artık klinik yanıtı ve yan etki profilini anlamada belirleyici parametreler hâline gelmişti. Böylece SSRI’ların geleceği, her hastaya aynı molekülün aynı dozda verildiği tekdüze bir uygulamadan, kişiye özgü farmakoterapinin kapılarını araladı.
Günümüzde SSRI’lar, depresyon ve anksiyete tedavisinin temel taşlarından biri olmayı sürdürürken, araştırmalar yalnızca duygu durum değil, aynı zamanda bağırsak–beyin ekseni, immuno-nöromodülasyon, nöroinflamasyon ve mikrobiyota etkileşimleri gibi alanlara da yayılmış durumdadır. Modern nöropsikofarmakoloji, serotonin sisteminin evrimsel köklerinden gelen geniş etkisini daha derin ve daha bütüncül bir çerçevede incelerken, SSRI’lar bu hikâyenin hem tarihsel hem de bilimsel merkezinde yer almaya devam etmektedir. Bu yolculuk, erken antihistaminiklerin beklenmedik özelliklerinden, günümüz genomik analizlerine, beyin ağ dinamiklerinin karmaşık modellerine ve nöroplastisite odaklı tedavi stratejilerine kadar uzanan benzersiz bir bilim serüvenidir.
İleri OKuma
- Leonard, B. E. (1997). The role of 5-HT in the pathology and treatment of depression. Journal of Clinical Psychiatry, 58(Suppl 15), 3–8.
- Blier, P., & de Montigny, C. (1998). Possible serotonergic mechanisms underlying the antidepressant and anti-obsessive–compulsive disorder responses. Biological Psychiatry, 44(5), 313–323.
- Owens, M. J., Knight, D. L., & Nemeroff, C. B. (2001). Second-generation SSRIs: human monoamine transporter binding profile of escitalopram and R-fluoxetine. Biological Psychiatry, 50(5), 345–350.
- Ferguson, J. M. (2001). SSRI antidepressant medications: adverse effects and tolerability. Primary Care Companion to the Journal of Clinical Psychiatry, 3(1), 22–27.
- Zimmerman, M., & Mattia, J. I. (2001). The psychiatrist’s guide to antidepressants. American Journal of Psychiatry, 158(7), 1107-1114.
- Gelenberg, A. J., & Ramaswamy, S. (2003). Selective serotonin reuptake inhibitors in the treatment of depression and anxiety disorders. Journal of Clinical Psychiatry, 64(Suppl 17), 11-16.
- Patel, K. V., & Trivedi, M. H. (2006). SSRIs and SNRIs in the treatment of anxiety disorders. Psychiatric Clinics of North America, 29(3), 503-516.
- Muench, J., & Hamer, A. M. (2010). Adverse effects of antipsychotic medications. Primary Care Companion for CNS Disorders, 12(6), 154-163.
- Stahl, S. M. (2013). Stahl’s Essential Psychopharmacology: Neuroscientific Basis and Practical Applications. Cambridge University Press.
- Fava, M., & Rush, A. J. (2017). SSRI and SNRI treatment in major depressive disorder. Journal of Clinical Psychiatry, 78(2), 139-148.