Etymoloji ve Kavramsal Evrim
Latince compāctiō/compactionem “bir araya getirme, sıkılaştırma” anlamına gelir ve com- (“birlikte”) öneki ile pangere (“tutturmak, bağlamak, sabitlemek”) fiil kökünün geçmiş ortaç biçimi (compāctus) üzerinden türemiştir. Orta Çağ Latincesinden Eski Fransızcaya geçerken “yapma eylemi veya kompakt olma durumu” anlamı korunmuş, İngilizcede 14. yüzyıl sonlarından itibaren “sıkılaşma/sıkıştırma” karşılığında yerleşmiştir. Embriyolojide “kompaksiyon” terimi, morula evresinin erken, gevşek hücresel topluluğunun hücre-hücre temaslarını artırarak tekil, pürüzsüz ve yüzeyi gergin bir kütleye dönüşmesini betimlemek için 20. yüzyıl boyunca giderek daha teknik bir içerikle kullanılmaya başlanmıştır. Ana fikir, “birlikte tutturma” metaforunun hücresel adezyon ve kortikal gerilimle canlandırılmasıdır.
Tanım
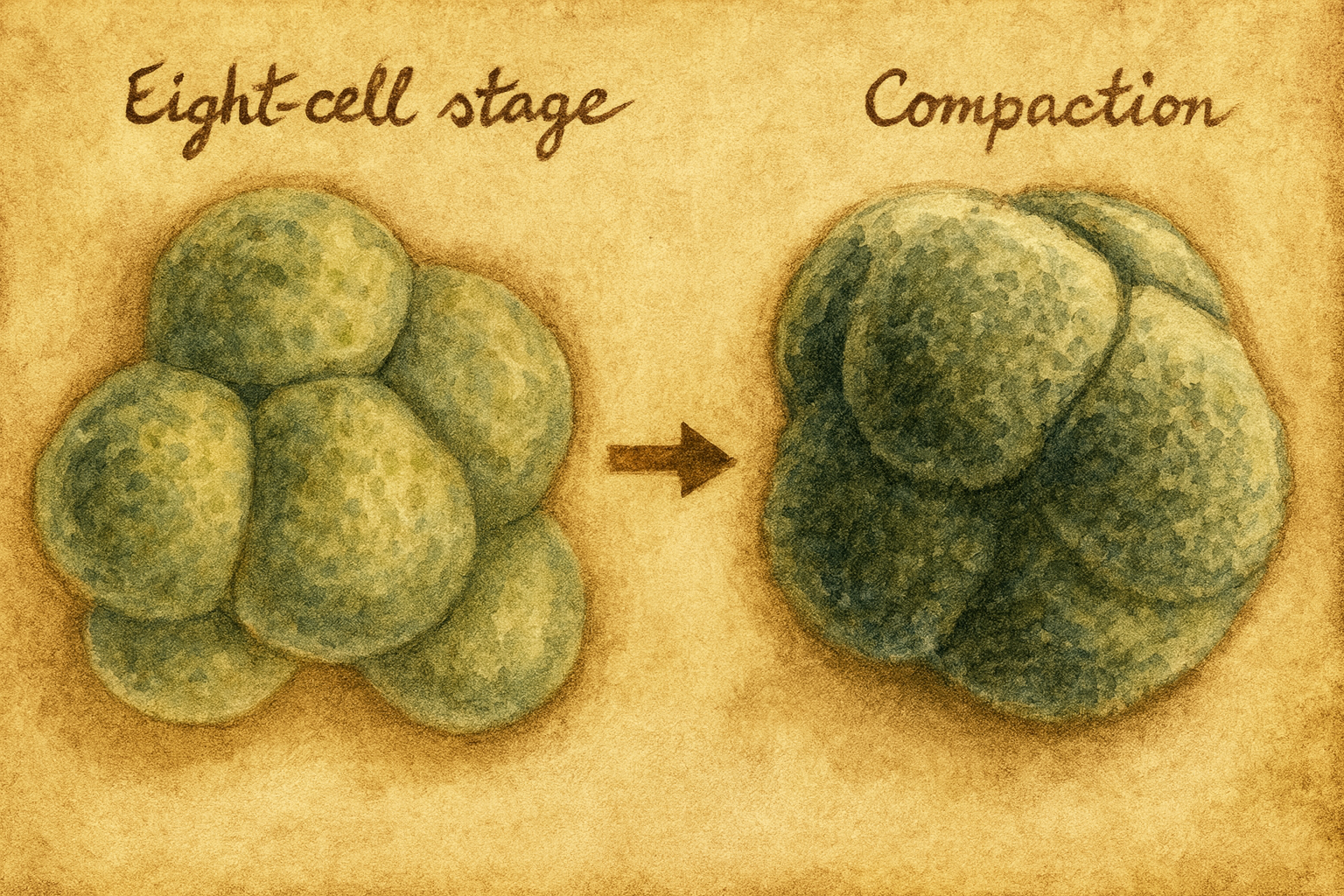
Kompaksiyon, memeli preimplantasyon embriyosunda tipik olarak 8–16 hücre (blastomer) aşamasında gerçekleşen, hücrelerin apikal-bazal polarite kazanımı, adezyon moleküllerinin yeniden dağılımı ve aktomyozin tabanlı kortikal gerilimin artışı ile belirginleşen morfodinamik bir geçiştir. Sürecin sonunda blastomerler arası temas açıları büyür, hücreler daha izodiyametrik bir geometriye yaklaşır, embriyo yüzeyi pürüzsüzleşir ve dış hücrelerde epitel özellikler (sıkı bağlantılar, apikal korteks, mikrovillusların apikal kümelenmesi) belirginleşirken içte bir hücre kitlesi (embriyoblast/inner cell mass, ICM) ayrışmaya başlar.
Zamanlama, Türler Arası Varyasyon ve Evrimsel Perspektif
Fare ve insan embriyolarında kompaksiyon genellikle ilk (fare) veya ikinci (insan) klivaj döngülerini takiben 8–16 hücre civarında gözlenir; sığır ve domuz gibi türlerde zamanlama ve morfoloji farklılıkları gösterir. Eutherian memelilerde blastokist öncesi epitelin (trophectoderm, TE) kökeni bakımından kompaksiyon kritik bir eşiktir; monotrem ve metatherian soylarında preimplantasyon stratejiler farklılaşsa da hücre-hücre adezyonunun artışı ve epitelizasyon ilkesi geniş ölçekte korunmuştur. Evrimsel bakışla kompaksiyon, erken embriyonik ökolojiye (rahim ortamında gelişim, implantasyon stratejileri, besin-gradyanları) uyum sağlayan bir “doku ölçekli kendiliğinden organizasyon” modülüdür.
Hücresel ve Moleküler Mekanizmalar
1) Hücre-Hücre Adezyonu: Kaderini Belirleyen “Tutturmak”
- Klasik kadherinler (özellikle E-kadherin/CDH1): Kompaksiyonun başlatılmasında merkezi rol oynar. Hücre-hücre temaslarıyla kadherin kümelenmesi artar; β- ve α-katenin aracılığıyla aktin korteksine bağlanır. Bu, embriyo yüzey gerilimini ve temas alanını birlikte artırır.
- Katenin kompleksi: Kadherinlerin sitoskelete bağlanmasını stabilize eder; mekanik yük aktarımını mümkün kılar. Adezyon-mekanik geri beslemesi (force-dependent bond strengthening) kompaksiyonu kalıcılaştırır.
- Gap junction’lar (örn. connexin 43) ve adherens junction’lar: İyon ve küçük molekül iletişimi ile metabolik ve elektriksel eşgüdümü kolaylaştırır; adherens junction’lar epitelizasyonun ön koşuludur.
2) Kortikal Gerilim ve Aktomyozin Dinamiği
- Miyozin-II-aktin korteksi: Hücrelerin apikal bölgelerinde pulsatif kasılmalar üretir; bu kasılmaların fazlanmasıyla temas açısı büyür, yüzey pürüzlülüğü azalır. Mekanik simetri kırılması, dış ve iç hücrelerin farklı kaderlerine zemin hazırlar.
- ROCK/RhoA ekseni: Aktomyozin tonusunu düzenler; inhibitörlerle (örn. ROCK inhibitörleri) kompaksiyonun gevşediği deneysel olarak gösterilmiştir.
- Mekanik ölçütler: Temas açısı (contact angle), hücre yüzey eğriliği ve embriyo yüzey gerilimi kompaksiyon derecesini nicel olarak tanımlar.
3) Hücre Polaritesi ve Epitelizasyon
- PAR kompleksi (PAR3/PAR6/aPKC): Dış hücrelerde apikal kubbenin ve mikrovillus alanının belirginleşmesini sağlar. Apikal-bazal eksen, daha sonra sıkı bağlantıların yerleşimi için şablon oluşturur.
- Sıkı bağlantılar (ZO-1, claudin/occludin ailesi): Paracellular sızdırmazlığı kurar; bu, izleyen blastosöl (blastocoel) sıvısının tutulması için şarttır.
- İyon ve su taşınımı (Na⁺/K⁺-ATPaz, aquaporinler): Epitel bariyeri oluştuktan sonra ortaya çıkan transepitelyal gradyan, blastosöl boşluğunun şişmesini mümkün kılar; kompaksiyon bu epitelin ön-şartıdır.
4) Sinyal Ağları ve Kader Kararları
- Hippo-YAP/TAZ yolu: Dış hücrelerde apikal korteks bütünlüğü ve düşük Hippo aktivitesi, YAP/TAZ’ın nükleusa girmesini ve TEAD4 ile birlikte CDX2 gibi trofektoderm belirteçlerinin transkripsiyonunu destekler. İç hücrelerde ise yüksek Hippo aktivitesi YAP/TAZ’ı sitoplazmada tutar, OCT4/NANOG/SOX2 gibi pluripotensi programı güçlenir.
- FGF/ERK ve diğer modüller: Kompaksiyonu takiben ICM içinde epiblast (EPI) ve primitive endoderm (PrE) ayrışmasının tohumlarını atar; böylece morula-blastokist geçişindeki ikinci soy ayrışımı hazırlanır.
Morfodinamik Özellikler ve Nicel Tanımlama
- Yüzey pürüzsüzleşmesi ve küreselleşme: Kompaksiyonun makroskopik işaretidir; zaman atlamalı mikroskopiyle izlenir.
- Temas açısı artışı: 90°’nin üzerine çıkması kompaksiyonun ilerlediğini gösterir.
- Polarite göstergeleri: Apikal aPKC sinyali, mikrovillus zenginleşmesi ve ezonal ZO-1 bantları epitelizasyon metrikleridir.
- Hücresel topoloji: 3B komşuluk sayısı ve Voronoi hücre hacimleri, kompaksiyon ilerledikçe yeniden düzenlenir.
Morula’dan Blastosiste Geçişte Kompaksiyonun Merkezi Konumu
Kompaksiyon, morula kütlesini iki fonksiyonel bölgeye ayırır: dışta sıvı geçirmez bir TE epitel tabakası ve içte pluripotent bir ICM. Kompaksiyon olmaksızın blastosöl oluşumu verimsizdir; TE bütünlüğü zayıflar, implantasyon kompetansı düşer. Bu nedenle kompaksiyon, “mimarî eşik” işlevi görür: yapısal bütünlük (epitel), fizyolojik kapasite (iyon/su akışı) ve kader kararları (TE vs. ICM) aynı süreçte kilitlenir.
Mekanik-Genetik Entegrasyon: Kendiliğinden Örgütlenen Bir Düğüm
Kompaksiyon, diferansiyel adezyon hipotezi (kadherin yoğunluğuna bağlı hücre sıralanması), doku yüzey gerilimi kavramı ve mekanotransdüksiyonun birleşiminde anlaşılır. Adezyon ve kortikal kontraktilite aynı anda değiştikçe, hücreler enerji olarak daha elverişli, temas alanı fazla, yüzey eğriliği düşük bir konfigürasyona yönelir. Bu fiziksel durum, Hippo benzeri sinyallerin alt tabaka düzenlenmesi ve çekirdek lokalizasyonu üzerinden gen ifadesi programlarını farklılaştırır.
İnsan Embriyogenezi Bağlamı ve Klinik/BTÜ (ART) Yansımaları
- Zamanlama ve morfokinetik imzalar: Zaman atlamalı kültür sistemlerinde kompaksiyonun başlangıcı (tC) ve tamamlanma dinamikleri, embriyo kalite indeksleriyle ilişkilendirilir.
- IVF/ICSI’de prognostik değer: Erken, eşgüdümlü ve homojen kompaksiyon genellikle yüksek implantasyon potansiyeliyle ilişkilendirilirken, gecikmiş veya parçalı kompaksiyon kromozomal anöploidi ve zayıf TE/ICM ayrışımıyla birlikte rapor edilmiştir.
- Moleküler göstergeler: CDH1 düzeyleri, ZO-1 bantlarının sürekliliği ve apikal aPKC işareti; insan embriyolarında epitel bütünlük ve blastosist kalitesiyle birlikte değerlendirilir.
- Deneysel/terapötik sınırlamalar: İnsan embriyosunda genetik veya farmakolojik müdahaleler etik ve yasal kısıtlarla sınırlıdır; bu nedenle türler arası çıkarımlar (özellikle fareden insana) dikkatle yapılmalıdır.
Gelişimsel Bozukluklar ve Deneysel Deliller
- Cdh1/E-kadherin kaybı: Preimplantasyon dönemde kompaksiyon başarısızlığı ve TE epitelizasyon kusurları ile ölümcüldür.
- Sıkı bağlantı proteinleri (ZO-1, claudin/occludin) bozuklukları: Blastosöl oluşum bozukluğu ve TE geçirgenlik kusurları oluşturur.
- Hippo bileşenleri (LATS, YAP/TAZ, TEAD4) bozulmaları: TE/ICM kader ayrışmasında belirgin fenotipler ve implantasyon yetmezliği ile seyreder.
- Mekanik manipülasyonlar: Rok inhibitörleri, latrunkulin gibi aktin modülatörleri veya kadherin fonksiyon-blokajları kompaksiyonu gevşetir; mikroaspirasyon ve mikropipet ölçümleri yüzey gerilimi ve kontak açılarını nicel doğrular.
Görüntüleme ve Ölçüm Yaklaşımları
- Canlı hücre zaman atlamalı mikroskopi: Kompaksiyon başlangıcı, süresi ve homojenliğini morfokinetik olarak saptamada altın standarttır.
- Flüoresan belirteçlerle polarite/adezyon haritalama: aPKC, ZO-1, E-kadherin, F-aktin; apikal ve lateral domenlerin eşzamanlı takibi.
- Mikromekanik testler ve nicel morfometri: Hücre yüzey gerilimi, temas açıları ve doku viskoelastisitesinin hesaplanması; yapay zekâ destekli segmentasyonla yüksek geçirgenlikli analiz.
Bütünleştirici Şema
Kompaksiyon; (i) E-kadherin aracılı adezyonun artışı, (ii) aktomyozin kasılmalarının apikal bölgede yoğunlaşması, (iii) PAR/aPKC ile apikal-bazal polaritenin yerleşmesi ve (iv) Hippo-YAP/TAZ ekseni üzerinden transkripsiyonel kader programlarının açılması ile, morula-blastokist geçişinde morfolojik, mekanik ve genetik düzlemleri birbirine “tutturur.” Dış hücrelerde TE epitelinin inşası ve içte ICM’in korunması, implantasyon ve plasentasyonun hazırlığıdır; kavramsal olarak “kompaksiyon,” Latince kökeninin ima ettiği gibi, ilerideki gelişimsel mimarinin kilit taşlarını bir araya bağlayan kurucu eylemdir.
Keşif
Kışın erken saatleri, 20. yüzyıl ortasının küçük bir histoloji odasında başlar hikâye: memeli yumurtasının kültüründe süreklilik sağlamak, hücrenin kendi ısrarcı ritmini laboratuvarda yakalamak pek çok araştırmacı için hem teknik bir meydan okuma hem de teorik bir vaatti. Bu vaatte en güçlü iz, morulanın bir noktasında hücrelerin gevşek kümelenmeden pürüzsüz bir kütleye dönüşmesiydi; camın üzerinde beliren bu kısa sahne, “kompaksiyon” denen o ad vermesi zor ama seyredeni suskun bırakan geçişti. Erken dönem memeli embriyolojisinin büyük isimleri—örneğin chimerik farelerin kurucu deneylerini yapan Andrzej K. Tarkowski ve onu izleyen birçok kurucu kuşak—mikroskobun altında gördüklerini teknik bir dilde toplarken, “bir araya getirme, birlikte tutturma” anlamını taşıyan Latince kökün tarihî mirası da yavaşça terimin çekirdeğine yerleşiyordu: com- (“birlikte”) ve pangere (“tutturmak”)—compactio.
1970’lerin sonu ile 1980’lerin başında, Cambridge’nin, Oxford’un ve North America’daki gelişim biyolojisi merkezlerinin sessiz odalarında kompaksiyonun ilk sistematik çerçevesi çizilmeye başladı. Fare morulasında iki soyun—dış trofoektoderm ile iç hücre kitlesinin—temellerinin hangi fiziksel ve biyokimyasal işaretlerle atıldığı sorusu, Johnson ve Ziomek’in “dış–iç” modeliyle belirginleşti: dışta giderek epitel özellik kazanan bir halka, içte ise pluripotent bir çekirdek. Aynı yıllarda Tim Fleming, trophectoderm ve inner cell mass (ICM) tahsisinin nicel doğasını ölçümlemeye girişti; cam lam üzerine düşen bir embriyonun, hangi hızda, hangi temas açılarıyla, hangi simetri kırılmalarıyla pürüzsüzleştiğini saat ve cetvelle bilimsel cümlelere çevirdi. Bu, kompaksiyonu yalnızca “görülen bir sahne” olmaktan çıkarıp ölçülebilir bir düzen değişimi, bir morfodinamik süreç haline getiren ilk kararlı adımdı.
1980’lerin ikinci yarısında, hücrelerin birbirine “nasıl” tutunduğu sorusu kadherinler sahneye çıktığında yeni bir yoğunluk kazandı. Masato Takeichi’nin kadherin ailesini tanımlayan çalışmaları ve bunu memeli embriyosuna taşıyan pek çok laboratuvar, kompaksiyonun yüzeydeki parıltısının altındaki kimyasal dikişi görünür kıldı: E-kadherin (CDH1) kümeleniyor, katenin kompleksi üzerinden aktin korteksine bağlanıyor, temas bölgeleri güç kazanıyordu. Birkaç yıl sonra, E-kadherin eksikliğinin fare preimplantasyon gelişiminde ölümcül olup TE epitelizasyonunu bozduğunu gösteren genetik kanıtlar, “kompaksiyon = adezyon + sitoskeletal bağ” denklemini deney hayvanının kaderiyle mühürledi. Bu aynı zamanda kompaksiyonu “fenomen” olmaktan çıkarıp “zorunlu mimarî eşik” olarak adlandırabilecek güvendi.
1990’lar ve 2000’lerin başında kompaksiyon haritasına iki geniş cadde daha eklendi: sıkı bağlantılar ve polarite. ZO-1, occludin ve claudin ailesinin trofoektodermde kurduğu bariyer, blastosöl sıvısının tutulması için gerekliydi; bir başka deyişle kompaksiyon, yakın izleğinde epitelin sızdırmazlığını örgütlüyor, blastosistin hidrolik fiziğini mümkün kılıyordu. Aynı dönemde PAR kompleksi (PAR-3, PAR-6, aPKC) dış hücrelerde apikal bir kubbe—mikrovilluslarla bezeli bir kimlik—kurarak polaritenin hücresel signatürünü çizdi. Bu çizgiyi fareden insana genişleten çalışmalar, dış hücrelerin apikal-bazal eksen kazandıkça iç hücrelerden ayrıştığını, bir mikro-epitelin gizli şablonunun kompaksiyon anında döşendiğini gösterdi.
2000’lerin sonu ile 2010’ların başında, kaderin harita kalemi Hippo sinyal yoluna geçti. Nishioka ve arkadaşlarının fare morulasında LATS–YAP/TAZ–TEAD ekseni üzerinden gösterdiği prensip, kompaksiyon sırasında kurulan apikal korteks bütünlüğünün yalnızca mekaniği değil, kaderi de belirlediğini anlattı: dış hücrede apikal alan ve zayıf Hippo etkinliği YAP/TAZ’ı çekirdeğe taşır, TEAD4 ile birleşen bu kompleks CDX2 gibi trofoektoderm belirteçlerini yazar; iç hücrede ise güçlü Hippo etkinliği YAP/TAZ’ı sitoplazmada hapseder, OCT4/NANOG/SOX2 merkezli pluripotensi programı güçlenir. Böylece “tutturmak” yalnızca hücreleri birbirine tutturmak değil, bir hücre yazgısını da genom üzerinde tutturmak anlamına geldi.
Bu biyokimyasal hikâyenin içine, 2010’ların ortasında mekanik şiir döküldü: canlı görüntülemede aktomyozinin apikal kortekste pulsatif—nabız atar gibi—kasılmalar ürettiği ve bu kasılmaların kompaksiyonu ileri ittiği gösterildi. Fare embriyosunun yüzeyinde zamanla genişleyen aktin halkaları, morulanın sanki yakası iliklenir gibi kapanmasını sağlıyor, dış tabakanın dikiş yerlerini “fermuar” gibi çekiyordu. Aynı anda mikroaspirasyon ve yüzey gerilimi ölçümleri, temas açısının nasıl büyüdüğünü, yüzey eğriliğinin nasıl azaldığını sayılarla yakaladı. Diferansiyel adezyon hipotezi ve doku yüzey gerilimi kavramı, bu sayıları teorik bir cümleye dönüştürdü: embriyo, adezyon ve kontraktilitenin ortak artışıyla daha düşük enerjiye sahip bir konfigürasyona akıyor; fizik, kaderin sessiz orta yazarı oluyor.
İnsan embriyolojisi cephesinde, tek hücreli RNA dizileme çalışmaları iç hücre kitlesi ile trofoektodermin transkripsiyonel ayrışmasını haritaladı; SOX2 gibi pluripotensi faktörlerinin bağlanma dinamikleri ve ömrü, dört hücreden itibaren kaderi öngören incelikli ipuçları taşıyordu. Aynı yıllarda, in vitro fertilizasyon kliniklerinde zaman atlamalı görüntüleme (time-lapse) sistemleri kompaksiyonun başlama anını (tC), süresini ve homojenliğini embriyo seçiminde kullanılabilir morfokinetik imzalar haline getirdi. Erken ve eşgüdümlü kompaksiyonun genellikle daha iyi blastosist bütünlüğü ve implantasyon potansiyeliyle ilişkili olduğu; geç, mozaik veya parçalı kompaksiyon paternlerinin ise sıklıkla anöploidi ve zayıf TE/ICM ayrışımıyla seyrettiği yönünde geniş bir klinik literatür birikti. Burada elbette türler arası aktarımın sınırları, etik ve yasal kısıtlar kadar belirleyiciydi; insan embriyosunda moleküler müdahaleye ilişkin pencereler dar, yorumu dikkat gerektiriyordu.
Bugünün laboratuvarında kompaksiyon artık yalnızca “bir sahne” değil, çok ölçekli bir nodo: tek hücreli transkriptom ve epigenom atlasları dış–iç ayrışmayı süreklileşen bir manzara olarak resmederken, süper-çözünürlüklü mikroskopi apikal korteksin dansını molekül yoğunluklarıyla eşliyor; mekanogenomik yaklaşımlar kadherin bağlarının güçlenmesini kuvvet-bağımlı bir kimyaya, Hippo’nun çekirdeğe uzanan parmak izini de şekil-bağımlı bir transkripsiyona çeviriyor. İnsan ve sığır embriyolarında türler arası zamanlama farklarını, farklı implantasyon stratejilerinin nasıl “kompaksiyon çözümleri” geliştirdiğini karşılaştırmalı biyolojiyle okumak artık mümkün. İyon pompalarının (Na⁺/K⁺-ATPaz) ve aquaporinlerin trofoektoderm epitelinde kurduğu gradyan, sıkı bağlantıların çizdiği bariyerle birlikte blastosölün hidrolik genişlemesini yönetirken; yapay zekâ destekli görüntü analizi, temas açılarını, hücresel Voronoi hacimlerini ve pürüzsüzleşme kinetiğini bir tıkla ölçüyor.
Kompaksiyonun güncel araştırma başlıkları üç eksende yoğunlaşıyor: (i) dış hücre apikal alanının nanometre ölçeğindeki örgüsünü—PAR kompleksi, aPKC kümelenmesi, mikrovillus topolojisi—canlı ve uzun vadeli izleme; (ii) Hippo-YAP/TAZ sinyallemesinin mekanik girdilerle anlık bağını gösterebilen raporlayıcı sistemler ve çekirdek-sitoplazma trafik hızının kader kararlarına etkisi; (iii) insan embriyosunda etik sınırları gözeten, çoğunlukla gözlemsel ama istatistiksel gücü yüksek morfokinetik çalışmalar ile tek hücreli -omiklerin birlikte kullanımı. Bu üç eksen, kompaksiyonu “Latince kökünün vaadi”ne uygun biçimde, gelişimin mimarîsini bir arada tutan dikiş olarak yeniden tanımlar: birlikte tutturmak yalnızca hücrelerin değil, fizik ile genetiğin de.
Ve lam üzerine düşen o ilk ışık hâlâ aynı sahneyi açar: blastomerler birbirine yaklaşır, yüzey pürüzsüzleşir, dış hücrelerin kenarında görünmez bir fermuar çekilir; içte küçük bir gölge yoğunlaşır. Birkaç on yıl önce bu gölgenin “ne” olduğuna dair cümleler eksikti, bugün ise her cümlenin arkasında bir sayı, her sayının arkasında görkemli ama hassas bir moleküler koreografi var. Kompaksiyonun keşfi, dolayısıyla, tek bir anın değil; Johnson ve Ziomek’in çiziğiyle başlayan, Fleming’in ölçüleriyle derinleşen, kadherinin dikişiyle sıkılaşan, Hippo’nun imzasıyla nizam bulan ve aktomyozinin nabzıyla ileri taşınan bir bilim tarihinin adıdır.
İleri Okuma
- Johnson, M. H., & Ziomek, C. A. (1981). The foundation of two distinct cell lineages within the mouse morula. Developmental Biology, 87(1), 248–256. https://doi.org/10.1016/0012-1606(81)90179-8
- Fleming, T. P. (1987). A quantitative analysis of cell allocation to trophectoderm and inner cell mass in the mouse blastocyst. Development, 100(2), 307–314. https://doi.org/10.1242/dev.100.2.307
- Larue, L., Ohsugi, M., Hirchenhain, J., & Kemler, R. (1994). E-cadherin null mice. Development, 120(7), 2161–2172. https://doi.org/10.1242/dev.120.7.2161
- Plusa, B., Frankenberg, S., Chalmers, A., Hadjantonakis, A.-K., Moore, C. A., Papalopulu, N., & Zernicka-Goetz, M. (2005). Downregulation of Par3 and aPKC function directs early mouse embryo development. Development, 132(8), 1987–1998. https://doi.org/10.1242/dev.01806
- Yagi, R., Kohn, M. J., Karavanova, I., Kaneko, K. J., Vullhorst, D., DePamphilis, M. L., & Honda, B. M. (2007). Transcription factor TEAD4 specifies the trophectoderm lineage at the beginning of mammalian development. Genes & Development, 21(16), 2082–2096. https://doi.org/10.1101/gad.1554107
- Rossant, J., & Tam, P. P. L. (2009). Blastocyst lineage formation, early embryonic asymmetries and axis patterning in the mouse. Development, 136(5), 701–713. https://doi.org/10.1242/dev.019117
- Nishioka, N., Inoue, K., Adachi, K., Kiyonari, H., Ota, M., Ralston, A., Yabuta, N., Hirahara, S., Stephenson, R. O., Ogonuki, N., et al. (2009). The Hippo signaling pathway components Lats and Yap pattern Tead4 activity to distinguish mouse trophectoderm from inner cell mass. Developmental Cell, 16(3), 398–410. https://doi.org/10.1016/j.devcel.2009.02.037
- Stephenson, R. O., Yamanaka, Y., & Rossant, J. (2010). Sox2 is required for maintenance of pluripotency and lineage specification in the preimplantation mouse embryo. Developmental Biology, 341(2), 246–257. https://doi.org/10.1016/j.ydbio.2010.02.037
- Dupont, S., Morsut, L., Aragona, M., Enzo, E., Giulitti, S., Cordenonsi, M., Zanconato, F., Le Digabel, J., Forcato, M., Bicciato, S., et al. (2011). Role of YAP/TAZ in mechanotransduction. Nature, 474(7350), 179–183. https://doi.org/10.1038/nature10137
- Rubio, I., Kuhlmann, R., Agerholm, I., Kirk, J., Herrero, J., Escribá, M. J., Bellver, J., Meseguer, M., & Remohí, J. (2012). Limited implantation success of embryos with delayed compaction patterns. Fertility and Sterility, 98(6), 1452–1457.e1. https://doi.org/10.1016/j.fertnstert.2012.08.019
- Wicklow, E., Blij, S., Frum, T., Hirate, Y., Lang, R. A., Sasaki, H., & Ralston, A. (2014). HIPPO pathway members restrict SOX2 to the inner cell mass where it promotes ICM fates in the mouse blastocyst. PLoS Genetics, 10(10), e1004618. https://doi.org/10.1371/journal.pgen.1004618
- Frum, T., & Ralston, A. (2015). Cell signaling and transcription factors regulating cell fate during formation of the mouse blastocyst. Current Topics in Developmental Biology, 113, 1–37. https://doi.org/10.1016/bs.ctdb.2015.06.001
- Petropoulos, S., Edsgärd, D., Reinius, B., Deng, Q., Panula, S. P., Codeluppi, S., Plaza Reyes, A., Linnarsson, S., Sandberg, R., & Lanner, F. (2016). Single-cell RNA-seq reveals lineage and X chromosome dynamics in human preimplantation embryos. Cell, 165(4), 1012–1026. https://doi.org/10.1016/j.cell.2016.03.023
- Maître, J.-L., Turlier, H., Illukkumbura, R., Eismann, B., Niwayama, R., Nédélec, F., & Hiiragi, T. (2016). Pulsatile cell-autonomous contractility drives compaction in the mouse embryo. Nature Cell Biology, 18(6), 590–596. https://doi.org/10.1038/ncb3357
- White, M. D., Angiolini, J. F., Alvarez, Y. D., Kaur, G., Zhao, Z. W., Mocskos, E., Bruno, L., Bissiere, S., Levi, V., & Plachta, N. (2018). Long-lived binding of Sox2 to DNA predicts cell fate in the four-cell mouse embryo. Cell, 173(6), 1424–1437.e17. https://doi.org/10.1016/j.cell.2018.03.067
- Zenker, J., White, M. D., Gasnier, M., Alvarez, Y. D., Lim, H. Y. G., Bissiere, S., Biro, M., & Plachta, N. (2018). Expanding actin rings zipper the mouse embryo for blastocyst formation. Cell, 173(6), 1405–1419.e17. https://doi.org/10.1016/j.cell.2018.03.060
- Gerri, C., McCarthy, A., Alanis-Lobato, G., Demtschenko, A., Bruneau, A., Loubersac, S., Setti, A., Somaiah, M., Khazim, M., Warburton, A., et al. (2020). Initiation of human zygotic genome activation is independent of maternally derived oocyte factors. Molecular Cell, 79(6), 1031–1044.e5. https://doi.org/10.1016/j.molcel.2020.07.013