Uridilasyon, bir uridin monofosfat (UMP) grubunun, uridin 5′-trifosfattan (UTP) transfer ve buna eşlik eden pirofosfatın (PPi) ayrılması yoluyla hedef proteine kovalent olarak bağlandığı bir translasyon sonrası modifikasyondur. Bu reaksiyon, mekanik olarak adenilasyona (AMP’nin ATP’den transferi) benzerdir, ancak UMP’ye özgüdür ve uridiltransferazlar olarak bilinen enzimler tarafından katalize edilir. Azot metabolizmasında yer alanlar gibi çeşitli prokaryotik sistemlerde, bu modifikasyon kritik bir düzenleyici rol oynar.
Mekanik ve Kimyasal Yönler
UMP’nin enzimatik transferi, alıcı proteindeki belirli bir kalıntının (genellikle bir serin veya tirozin üzerindeki bir hidroksil grubu) UTP’nin α-fosfatına yaptığı nükleofilik saldırıyı içerir. Bu, kovalent bir fosfodiester bağının oluşumu ve PPi’nin salınmasıyla sonuçlanır. Reaksiyon mekanizması, substratın (burada protein) aktivasyonunun, modifiye edilmiş proteinin aktivitesini veya etkileşim profilini değiştiren bir nükleotid monofosfat transferi yoluyla elde edildiği adenilasyonun mekanizmasını yansıtır.
Enzimoloji ve Kataliz
Enzim uridiltransferaz (hem uridililtransferaz hem de uridilil-çıkarma veya desuridililasyon aktivitelerine sahip olduğunda genellikle bifonksiyonel bir bağlamda UTase/UR olarak anılır) bu modifikasyonun merkezinde yer alır. Örneğin, azot düzenlemesi bağlamında, bu enzim hem UMP gruplarının eklenmesinden hem de çıkarılmasından sorumludur. Bu aktiviteler arasındaki denge, özellikle allosterik bir efektör görevi gören glutamin olmak üzere hücre içi metabolit seviyeleri tarafından düzenlenir. Düşük glutamin koşulları altında, uridiltransferaz aktivitesi baskındır ve düzenleyici proteinlerin uridilasyonuyla sonuçlanır. Bunun tersine, glutamin seviyeleri yüksek olduğunda, enzim desuridilasyona doğru kayar ve böylece UMP kısmını ortadan kaldırır. Bu çift yönlü kontrol, hücrenin azot asimilasyon yollarının besin bulunabilirliğine yanıt olarak hassas bir şekilde ayarlanmasını sağlar.
Azot Düzenlemesinde Biyolojik Rol
Uridilasyonun en çok incelenen örneklerinden biri, azot asimilasyonunda önemli bir enzim olan glutamin sentetazın (GS) düzenlenmesini içerir. GS’nin kendisi kovalent modifikasyonların (bazı organizmalarda adenililasyon gibi) karmaşık bir etkileşimi yoluyla düzenlenmesine rağmen, düzenleyici devre ayrıca uridilasyona tabi olan tipik olarak PII ailesinden küçük sinyal ileten proteinleri de içerir. Uridillenmiş PII proteinlerinin, AMP gruplarını bağlayarak veya kaldırarak GS’yi değiştiren enzim olan adenililtransferazın aktivitesini etkilediği bilinmektedir. Böylece, uridylation, PII proteinleri ile adenililtransferaz arasındaki etkileşim dinamiklerini değiştirerek, hücrenin azot durumuyla ilgili sinyalleri entegre ederek GS aktivitesini dolaylı olarak düzenler.
Desuridylation: Ters Reaksiyon
Desuridylation, modifiye edilmiş proteinden UMP kısmının enzimatik olarak uzaklaştırılmasıdır; bu işlem aynı iki işlevli enzim (UTase/UR) tarafından katalize edilir. Uridilasyonun tersine çevrilmesi, düzenleyici sistemin yeniden ayarlanması ve hücrenin metabolik durumdaki değişikliklere hızla yanıt vermesi için çok önemlidir. Glutaminin hücre içi konsantrasyonu arttığında, enzimin desuridylation aktivitesi uyarılır ve bu da UMP grubunun düzenleyici proteinlerden uzaklaştırılmasına yol açar. Bu uzaklaştırma, bunların konformasyon ve etkileşim yeteneklerini değiştirir ve böylece aşağı akış düzenleyici olayları değiştirir; en önemlisi, GS aktivitesinin adenylilasyon durumu aracılığıyla modülasyonu.
Düzenleyici ve Yapısal Hususlar
Uridilasyon ve desuridililasyon arasındaki dinamik denge, azot metabolizmasının hassas kontrolü için esastır. İki işlevli enzim UTase/UR, metabolik ipuçlarını (örneğin glutamin seviyeleri) algılar ve ikili katalitik rolleri arasında geçiş yapar. Yapısal çalışmalar, metabolit bağlanmasıyla indüklenen enzim içindeki konformasyonel değişikliklerin, UMP eklenmesi veya çıkarılması için aktif bölgelerin erişilebilirliğini ve reaktivitesini belirlediğini öne sürmektedir. Bu ikili işlevsellik, hücresel metabolik duruma yanıt veren hızlı ve geri dönüşümlü bir translasyon sonrası modifikasyon mekanizmasına olanak tanır ve glutamin sentaz gibi enzim aktivitelerinin organizmanın fizyolojik taleplerini karşılamak için gerçek zamanlı olarak ayarlanmasını sağlar.
Keşif
RNA moleküllerine uridin nükleotidleri ekleme süreci olan uridilasyon, son birkaç on yıldır RNA metabolizmasında ve düzenlenmesinde kritik bir mekanizma olarak ortaya çıkmıştır.
İçindekiler
1960’lar–1970’ler: Nükleotid Modifikasyonlarının Temelleri
- 1960’lar: RNA modifikasyonlarının keşfi tRNA ve rRNA üzerindeki çalışmalarla başladı. Uridilasyon henüz tanımlanmamışken, Mahlon Hoagland, Paul Zamecnik ve diğerlerinin nükleotid transfer reaksiyonları üzerine temel çalışmaları temel oluşturdu.
- 1970’ler: Mary Edmonds ve meslektaşları poliadenilasyonu (RNA’ya adenin eklenmesi) karakterize ederek dolaylı olarak daha geniş nükleotid eklemeleri kavramını vurguladılar. Bu arada, Gottfried Schatz‘ın Saccharomyces cerevisiae‘deki mitokondriyal RNA üzerindeki çalışması, daha sonra uridilasyonla ilişkilendirilen alışılmadık RNA işleme mekanizmalarına işaret etti.
1980’ler: RNA Düzenlemesinde İlk İpuçları
- 1986: Larry Simpson ve UCLA’daki ekibi, çerçeve kaymalarını düzeltmek için mitokondriyal mRNA’lara uridin kalıntılarının eklendiği kinetoplastid protozoalarda (örn. Trypanosoma) RNA düzenlemesini keşfetti. Henüz “uridilasyon” olarak adlandırılmasa da, bu UTP’ye bağlı RNA modifikasyonunun ilk doğrudan kanıtıydı.
- 1980’lerin sonu: Kenneth Stuart tripanosomlarda RNA düzenlemesini genişletti ve uridin eklemelerini şablonlayan kılavuz RNA’ları (gRNA’lar) belirledi. Bu çalışma uridin eklemesini programlanabilir bir süreç olarak belirledi.
1990’lar: Üridilasyon Ana Akıma Giriyor
- 1991: Elaine M. Byrne ve Jeffrey D. Boeke, E. coli‘de tRNA uridilasyonunu tanımladı ve tRNA öncüllerine uridin eklenmesinin bozunma için bir kalite kontrol sinyali olduğunu gösterdi.
- 1990’ların ortası: Tetsuro Okada da dahil olmak üzere bitki virologları, RNA’yı bozunmaya işaretlemek için bir konak savunma mekanizması olarak viral RNA genomlarının (örn. Tütün mozaik virüsü) uridilasyonunu gözlemledi.
- 1998: Marvin Wickens‘in Wisconsin Üniversitesi’ndeki laboratuvarı, Xenopus oositlerinde mRNA poli(A) kuyruklarının uridilasyonunu keşfetti ve bunu translasyonel baskılama ve RNA dönüşümüne bağladı.
İlk Temeller (2000’lerden Önce): RNA Modifikasyon İpuçları
Uridilasyon açıkça tanımlanmadan önce, RNA işlemeyle ilgili temel araştırmalar temelleri attı. 1970’lerde ve 1980’lerde, poliadenilasyon (adenin nükleotidlerinin eklenmesi) gibi RNA modifikasyonlarını inceleyen bilim insanları, RNA kuyruklarında başka nükleotid eklemeleri fark etmeye başladılar. Poliadenilasyon erken dönemdeki ilgiye hakim olsa da, adenozin olmayan eklemeler hakkında ince ipuçları ortaya çıktı.
- 1970’ler: James Darnell ve Aaron Shatkin gibi öncüler, ökaryotik hücrelerde RNA kuyruğunu araştırdı ve poli(A) kuyruklarına odaklandı. mRNA stabilitesi üzerine yaptıkları çalışmalar, uridilasyonu henüz keşfedilmemiş olmasına rağmen, diğer olası değişikliklere işaret etti.
- 1990’lar: Phillip Zamore ve David Bartel gibi araştırmacıların önderlik ettiği küçük RNA’lar ve RNA bozunumu üzerine yapılan çalışmalar, çeşitli RNA işleme yollarını ortaya çıkarmaya başladı. Bu çabalar, RNA kuyruklarının sadece adenin içermeyebileceğini öne sürerek daha sonraki keşifler için zemin hazırladı.
2000’ler: Uridilasyon Gündemde
Milenyumun başlangıcı, bilim insanlarının uridilasyonu doğrudan tespit etmelerine olanak tanıyan yüksek verimli dizileme gibi teknolojik ilerlemeler getirdi. Bu on yıl, uridilasyonun ayrı bir süreç olarak resmi keşfini işaret etti.
- 2002: MikroRNA’lar (miRNA’lar) üzerindeki çalışmalarıyla tanınan Victor Ambros ve Gary Ruvkun, Caenorhabditis elegans‘ta alışılmadık nükleotid eklemeleri tespit ettiğinde bir atılım gerçekleşti. Let-7 miRNA üzerindeki araştırmaları, şablonsuz uridinleri ortaya çıkardı ve yeni bir düzenleyici mekanizma önerdi. Bu gözlem, uridilasyonun küçük RNA işlevindeki rolüne dair erken bir ipucuydu.
- 2007: Alan, Güney Kore’deki V. Narry Kim ve ekibinin çalışmalarıyla ivme kazandı. İnsan hücrelerindeki miRNA biyogenezini incelerken, bir terminal uridil transferaz (TUTase) enzimi tarafından pre-miRNA’ların uridilasyonunun onları bozunmaya işaret ettiğini keşfettiler. Bu bulgu, uridilasyonu RNA işlemede bir kalite kontrol mekanizması olarak belirledi.
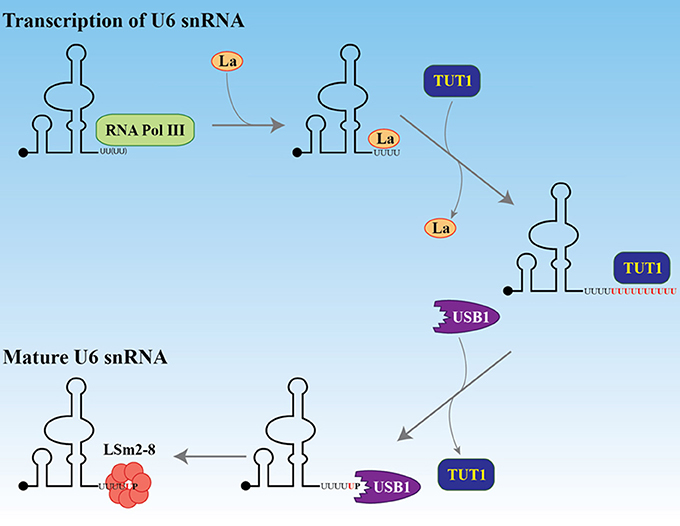
- 2009: Sandra Wolin ve Carol Wilusz, uridilasyonu RNA dönüşümüne bağlayarak bağımsız olarak anlayışı derinleştirdiler. Memeli hücrelerindeki U6 snRNA ve histon mRNA’ları üzerindeki çalışmaları, uridilasyonun RNA bozunmasını tetikleyebileceğini göstererek bunun sadece bir miRNA fenomeni değil, daha geniş bir düzenleyici süreç olduğu fikrini ortaya koydu.
2010’lar: Mekanizmalar ve Enzimler Açığa Çıktı
2010’lar, bilim insanlarının belirli enzimleri tanımlaması ve uridilasyonun RNA tipleri ve organizmalar arasındaki rollerini genişletmesiyle bir araştırma patlamasına tanık oldu.
- 2010: Richard Gregory’nin grubu, TUT4 enzimini (ayrıca ZCCHC11 olarak da bilinir) uridilasyonun kilit oyuncusu olarak belirledi. Fare embriyonik kök hücreleriyle çalışarak, TUT4’ün pre-let-7 miRNA’larını uridilleyerek bunların stabilitesini düzenlediğini ve hücre farklılaşmasını etkilediğini gösterdiler. Bu keşif, uridilasyonu gelişime bağladı.
- 2011: Elena Conti ve Elisa Izaurralde, RNA bozunmasında uridilasyonun yapısal ve işlevsel yönlerini aydınlattı. Çalışmaları, uridillenmiş RNA’ların ekzosom kompleksi gibi bozunma makinelerini nasıl devreye soktuğunu ve uridillenmenin RNA homeostazındaki rolünü nasıl pekiştirdiğini ortaya koydu.
- 2013: Marvin Wickens ve meslektaşları kapsamı mRNA’ya genişleterek, insan hücrelerindeki histon mRNA’larının uridillenmesinin DNA replikasyonundan sonra gerçekleştiğini ve bunların hızlı bir şekilde yenilenmesini sağladığını gösterdi. Bu bulgu, uridillenmenin küçük RNA’ların ötesindeki önemini genişletti.
- 2015: Helge Großhans ve İsviçre’deki ekibi, uridillenmeyi C. elegans gelişimine bağladı. TUT2’yi (Poli(U) polimeraz) bir uridillenme enzimi olarak tanımladılar ve larval aşamalarda miRNA aktivitesini düzenlemedeki rolünü göstererek uridillenmenin evrimsel korunumunu güçlendirdiler.
- 2017: Joshua Mendell’in laboratuvarı, uridillenme ile kanser arasında bir bağlantı keşfetti. İnsan hücrelerinde TUT4 ve TUT7 düzensizliğinin miRNA profillerini değiştirebileceğini ve tümör oluşumunu teşvik edebileceğini buldular. Bu dönüm noktası, uridilasyonun klinik önemini vurguladı.
2020’ler: İyileştirme ve Yeni Sınırlar
Son yıllarda uridilasyonun moleküler ayrıntılarına ilişkin anlayışımız iyileştirildi ve terapötik potansiyeli araştırıldı.
- 2020: Schraga Schwartz ve meslektaşları, insan hücrelerinde genom çapında uridilasyonu haritalamak için gelişmiş dizileme kullandılar. Çalışmaları, lncRNA’lar ve tRNA’lar dahil olmak üzere çeşitli RNA türlerinde yaygınlığını ortaya koyarak, daha önce düşünülenden daha yaygın bir rol olduğunu öne sürdü.
- 2022: F. Gregory Wulczyn’in ekibi, uridilasyonu farelerde nöronal RNA’nın bir modülatörü olarak tanımladı ve bunu beyin gelişimi ve esnekliği ile ilişkilendirdi. Bu, nörobilim araştırmalarında yeni yollar açtı.
- 2024: Wendy Gilbert liderliğindeki araştırma, uridylation’ın p gibi diğer RNA modifikasyonlarıyla etkileşimini araştırdı.
İleri Okuma
- Blauwkamp, T. A., & Ninfa, A. J. (2002). UTase/UR: A bifunctional enzyme that controls the uridylylation state of the PII proteins. Molecular Microbiology, 43(3), 839–851.
- Ninfa, A. J. (1999). Glutamine synthetase: Structure, function, and regulation. Microbiology and Molecular Biology Reviews, 63(2), 373–390.
- Reitzer, L. (2003). Nitrogen assimilation and global regulation in Escherichia coli. Annual Review of Microbiology, 57, 155–176.