Halk arasında zayıflama iğnesi olarak da bilinir.
- Liraglutide, 2009 yılında önceden doldurulmuş bir kalemde (Victoza®) enjeksiyon için bir çözüm olarak onaylandı.
- 2014 yılında, insülin degludec ile sabit bir kombinasyon piyasaya sürüldü (Xultophy®).
- 2016 yılında Saxenda®, aşırı kilo ve obezite tedavisi için tescil edildi.
- Saxenda®, inkretin mimetik liraglutid içeren deri altı kullanıma yönelik bir enjeksiyon çözeltisidir. Saxenda® bazı ülkelerde aşırı kilo ve obezite tedavisi için onaylanmıştır. Liraglutide orijinal olarak geliştirildi ve bir anti-diyabetik ilaç olarak kullanılıyor.
- İlgili halefi → semaglutide, liraglutide’den farklı olarak, sadece haftada bir kez enjekte edilmelidir.
- Liraglutide, tip 2 diyabet tedavisinde kullanılan GLP-1 reseptör agonistleri grubundan bir antidiyabetik ilaçtır. Ayrıca aşırı kilo ve obezite tedavisi için serbest bırakılır.
- Liraglutide, uzun etkili bir inkretin GLP-1 analoğudur ve diğer şeylerin yanı sıra, beta hücrelerinden insülinin sentezini ve salınmasını teşvik eder ve mide boşalmasını geciktirir.
- Etki mekanizması ve yan etki profili eksenatidinkine benzer. Çalışmalarda liraglut, diğerlerine kıyasla daha fazla kilo kaybına neden olur. diğer GLP-1 analoglarını içerir ve bu nedenle bazı ülkelerde diyabeti olmayan obez hastalarda obezitenin tedavisi için halihazırda daha yüksek dozlarda kullanılmaktadır.
- İlaç günde bir kez deri altından enjekte edilir. Yarılanma ömrü 11 ila 15 saat arasındadır.
- En yaygın olası yan etkiler
- mide bulantısı,
- ishal,
- kusma,
- kabızlık,
- karın ağrısı,
- dispepsi,
- baş ağrısı,
- üst solunum yolu enfeksiyonları
- ve özellikle sülfonilürelerle kombine edildiğinde hipoglisemidir.

Kimyasal
yapı & özellikler
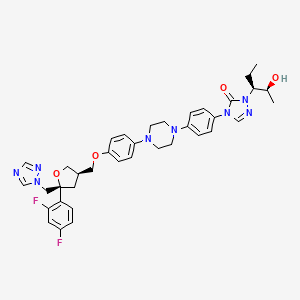
Liraglutide veya P-L-glutamoil (N-a-heksadekanoil) -Lys26, Arg34-GLP-1 (7-37), deneysel formül C172H265N43O51 ve moleküler ağırlığı 3751.2 Da olan dallı zincirli bir peptittir.
GLP-1 artışının bir analogudur. Dizi homolojisi % 97’dir. Lys 34, Arg ile değiştirildi ve bir C16 yağ asidi, bir Glu aralayıcı aracılığıyla Lys 26’ya eklendi. Bu modifikasyonlar, GLP-1’in yarı ömrünü (2 dakika) 13 saate kadar uzatmayı mümkün kıldı. Yağ asidi albumin’e bağlandığı için kullanıldı ve bu da plazmada tutulma süresini arttırdı.
(7) His-Ala-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Val-Ser-Ser-Tyr-Leu-Glu-Gly-Gln-Ala-Ala-Lys- (Glu-yağlı asit) -Glu -Phe-Ile-Ala-Trp-Leu-Val-Arg-Gly-Arg-Gly (37

İşlev
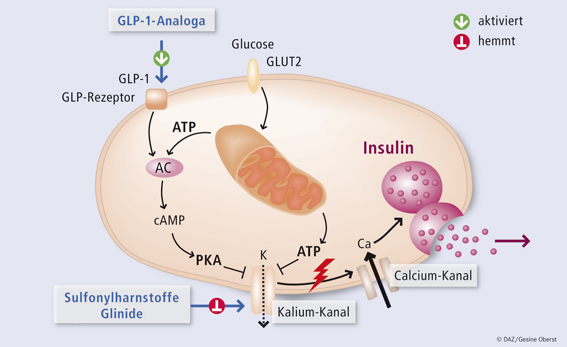
- Liraglutide kan şekeri düşürücü ve anti-diyabetik özelliklere sahiptir. Etkiler, bir GPCR (G proteinine bağlı reseptör) olan GLP-1 reseptörüne bağlanmaya dayanmaktadır. Bu reseptör ayrıca GLP-1’i arttırarak aktive edilir.
- GLP-1 reseptör agonistleri:
- pankreasın beta hücrelerinden insülin salgılanmasını teşvik eder.
- alfa hücrelerinden glukagon salgılanmasını azaltır ve böylece karaciğer tarafından glikoz salınımının azalmasına yol açar (glukoneogenezde azalma).
- insülin duyarlılığını artırır.
- mide boşalmasını yavaşlatır, böylece glikozun kan dolaşımına girme hızını azaltır.
- tokluğu arttırır (merkezi), açlık hissini azaltır ve kilo kaybına katkıda bulunabilir.
- GLP-1 reseptör agonistleri daha az hipoglisemiyi tetikleme eğilimindedir çünkü etkileri yalnızca glukoz seviyesi yükseldiğinde ortaya çıkar.

Endikasyon
- Tip 2 diabetes mellitus (Victoza®, Xultophy®) tedavisi için.
- Fazla kilo ve obezite tedavisi için (Saxenda®).
Uzman bilgilerine göre dozajlanır. Enjeksiyonluk çözelti, öğünler ne olursa olsun günde bir kez kalemle deri altına enjekte edilir.
Kontrendikasyon
- Aşırı duyarlılık
- İhtiyati tedbirlerin tamamı ürün bilgilerinde bulunabilir.
Liraglutide, sitokrom P450 ile etkileşime girmiyor gibi görünmektedir. Mide boşalmasını biraz geciktirdiği için, eşlik eden ilaçların emilimini etkileyebilir.
Yan etkiler
En yaygın olası yan etkiler mide bulantısı, ishal, kusma, kabızlık, karın ağrısı, dispepsi, baş ağrısı, üst solunum yolu enfeksiyonları ve özellikle sülfonilürelerle kombine edildiğinde hipoglisemidir.

























Yorum yazabilmek için oturum açmalısınız.