“İdioventriküler ritim” terimi, Yunanca “kendine ait” veya “benzersiz” anlamına gelen “idio-” ön ekinden ve “küçük oda” anlamına gelen Latince “ventrikül” kelimesinden oluşur. Tıbbi terminolojide idiyoventriküler ritim, kalbin ventriküllerinden kaynaklanan özel bir kalp ritmi tipini ifade eder.
İdioventriküler ritim, genellikle kalbin normal elektrik yolları bozulduğunda acil bir mekanizma olarak ortaya çıkan spesifik bir kalp ritmidir. Bu ritim, çok düşük bir kalp atış hızıyla (genellikle dakikada 20 ila 40 atım arasında) karakterize edilir ve ventriküler “yedek ritim” biçimi olarak kabul edilir. Sıklıkla ciddi kalp hastalığı olan hastalarda veya resüsitasyon sonrası görülür.
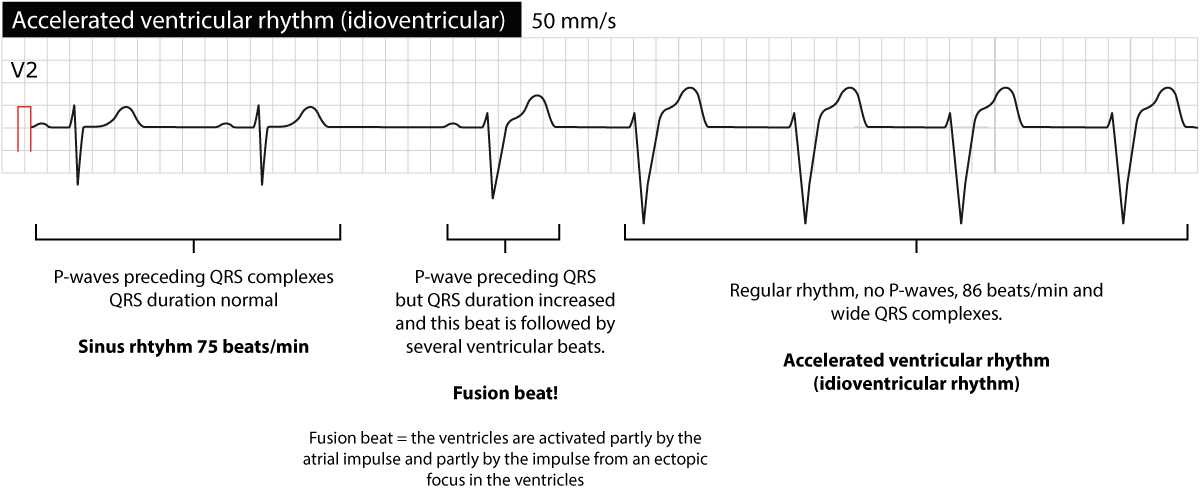
Özellikleri ve teşhis kriterleri:
- Geniş QRS kompleksleri: Elektrokardiyogramda (EKG) geniş ve tuhaf QRS kompleksleri görülür.
- Düşük kalp atış hızı: Genellikle dakikada 20 ila 40 atım arasındadır.
- P dalgalarının yokluğu: Normalde atriyal kalp pilinin etkilenmediğini gösteren hiçbir P dalgası yoktur.
- Düzensiz hız: Özellikle aynı anda başka aritmiler de varsa ritim düzensiz olabilir.
İdioventriküler Ritim ve Ventriküler Ritimler: Farklılıklar ve Benzerlikler
İdioventriküler Ritim
- Kökeni: İdioventriküler ritimler ventriküler miyokarddan kaynaklanır.
- Hız: Yavaş, genellikle dakikada 20 ila 40 atım arasındadır.
- QRS Kompleksi: Geniş ve anormal.
- P dalgaları: Genellikle yoktur; atriyal aktivitenin ventrikülleri yönlendirmediğini gösterir.
- Durum: Çoğunlukla ciddi hastalıklı kalplerde veya resüsitasyondan sonra görülür. Bu genellikle daha yüksek kalp pillerinin arızalanması durumunda oluşan bir yedek ritimdir.
- Tedavi: Altta yatan nedenlerin tanımlanmasını gerektirir ve tedavi genellikle acildir.
Ventriküler Ritim (Ventriküler Taşikardi, Ventriküler Fibrilasyonda görüldüğü gibi)
- Kökeni: Ayrıca ventriküllerden de kaynaklanır.
- Hız: Özellikle ventriküler taşikardide (dakikada 100’ün üzerinde) genellikle çok daha hızlıdır.
- QRS Kompleksi: Ayrıca geniş ve anormal.
- P dalgaları: Tipik olarak yoktur veya QRS kompleksleriyle ilişkili değildir.
- Durum: Daha az hastalıklı kalplerde ortaya çıkabilir ancak sıklıkla ciddi kalp hastalığının belirtisidir.
- Tedavi: Genellikle farmakolojik veya elektriksel kardiyoversiyon olmak üzere acil tedavi gereklidir.
Ortak noktalar
- Her iki ritim de ventriküllerden kaynaklanır.
- Her ikisi de geniş QRS kompleksleri görüntüler.
- Her ikisinde de tipik olarak P dalgaları yoktur, bu da atriyal tutulumun olmadığını gösterir.
İdyoventriküler Ritmin Nedenleri
Patofizyolojik Nedenler
- Sinoatriyal Düğümün Başarısızlığı: SA düğümü kalbin birincil kalp pilidir. Başarısız olursa veya bastırılırsa, ventriküller yedek olarak kendi ritmini oluşturabilir.
- Atriyoventriküler Düğümün Başarısızlığı: AV düğümü ikinci “hat içi” kalp pilidir ve hem SA hem de AV düğümleri başarısız olursa, ventriküller görevi devralabilir.
- İskemi veya Enfarktüs: Kalbin bazı kısımlarına kan akışının olmaması normal iletim sistemini bozabilir ve idiyoventriküler ritimlere yol açabilir.
- Elektrolit Dengesizliği: Potasyum ve magnezyum gibi anormal elektrolit seviyeleri idiyoventriküler ritimlere neden olabilir.
- İlaç Toksisitesi: Beta blokerler, kalsiyum kanal blokerleri ve antiaritmikler gibi ilaçlar, yüksek kalp pillerini baskılayarak ritmi başlatmak için ventrikülleri bırakabilir.
- Ameliyat Sonrası: Kalp ameliyatı veya kateter ablasyon prosedürlerini takiben ortaya çıkabilir.
- Metabolik Bozukluklar: Hipoksi veya asidoz gibi durumlar kalbin elektrik sistemini etkileyebilir.
- Tromboliz Sonrası Reperfüzyon: Bir pıhtıdan sonra kan akışının yeniden sağlanması bazen ani bir yanıt olarak idiyoventriküler ritimlere yol açabilir.
- Bulaşıcı Nedenler: Miyokardit, perikardit ve diğer enfeksiyonlar bazen kalbin elektrik sistemini etkileyerek idiyoventriküler ritimlere neden olabilir.
Çevresel faktörler
- Travma: Göğüs veya kalpteki fiziksel yaralanma bu ritme yol açabilir.
- Elektrik Çarpması: İdioventriküler ritimler de dahil olmak üzere anormal ritimleri tetikleyebilir.
Belirtileri
İdyoventriküler ritim sıklıkla altta yatan kardiyak patolojinin bir işaretidir ve semptomatik sunumu, ritmin hızı, altta yatan kardiyak durum ve hastanın aritmilere toleransı gibi çeşitli faktörlere bağlı olarak değişebilir. Yaygın semptomlar şunları içerir:
- Yorgunluk: Kalp atış hızının azalması nedeniyle hastalarda yorgunluk ve genel halsizlik yaşanabilir.
- Baş dönmesi veya Bayılma: Daha yavaş bir kalp atış hızı, kalp atışının azalması anlamına gelir, bu da baş dönmesine ve hatta bayılma nöbetlerine (senkop) yol açar.
- Nefes Darlığı: Hastalar dolaşımın zayıf olması nedeniyle nefes almada zorluk yaşayabilir.
- Göğüs Ağrısı veya Rahatsızlık: İdyoventriküler ritim sıklıkla miyokard enfarktüsü veya iskemi ile ilişkili olduğundan göğüs ağrısı yaygın olarak görülen bir semptomdur.
- Çarpıntı: Hastalar kalplerinin çok yavaş veya düzensiz attığını hissedebilirler.
- Soğuk Ekstremiteler: Kan akışının azalması el ve ayakların soğumasına neden olabilir.
- Karışıklık veya Değişen Zihinsel Durum: Azalan kalp debisi aynı zamanda serebral perfüzyonu da etkileyerek kafa karışıklığına veya zihinsel durumun değişmesine neden olabilir.
- Hipotansiyon: Azalan kan akışı hızı düşük kan basıncına yol açabilir.
- Kalp Yetmezliği Belirtileri: Ağır vakalarda ödem, şahda toplardamar basıncında yükselme ve akciğerlerde tıkanıklık gibi kalp yetmezliği belirtileri görülebilir.
Tarih
İdioventriküler ritmin (IVR) tarihi 1900’lü yılların başına kadar uzanır. 1925 yılında İngiliz kardiyolojisinin öncülerinden Sir Thomas Lewis, “Kalp atışının mekanizması ve grafik kaydı” adlı kitabında ilk IVR vakasını anlattı. Ancak Lewis IVR’yi bağımsız bir aritmi olarak tanımlamadı.
1950’li ve 1960’lı yıllarda araştırmacılar IVR’nin altında yatan mekanizmaları ve bunun klinik sonuçlarını araştırmaya başladı. 1956’da Scherf ve Cohen, normal kalp pili arızalandığında kalpteki ektopik odaklardan kaynaklanan aritmiler olan “kaçış ritimleri” kavramını tanımladılar. IVR bir tür kaçış ritmidir.
1970’lerde IVR üzerine araştırmalarda bir artış yaşandı. 1975’te Castellanos ve arkadaşları digitalis kaynaklı ilk IVR vakasını bildirdi. Scheinman ve arkadaşları, akut miyokard enfarktüsü (MI) sırasında atropinin IVR’yi baskılamadaki etkinliğini bildirdi. Basy ve Scheinman, aşağı düzeyde MI geçiren yaşlı bir hastada sürekli IVR formunu bildirdi. Castellanos ve arkadaşları ayrıca “çift ektopik akselere ventriküler ritim” olarak adlandırdıkları iki farklı odaktan gelen bir IVR bildirmişlerdir.
1980’lerde ve 1990’larda araştırmacılar IVR’nin çeşitli kalp rahatsızlıklarındaki rolünü araştırmaya devam etti. IVR’nin akut MI, kalp yetmezliği ve kardiyomiyopati hastalarında yaygın bir bulgu olduğunu keşfettiler. Ayrıca IVR’nin ventriküler fibrilasyon gibi daha ciddi aritmilerin habercisi olabileceğini de buldular.
Günümüzde IVR, önemli klinik etkileri olan önemli bir aritmi olarak geniş çapta kabul edilmektedir. Kardiyak iskeminin, kalp hastalığının ciddiyetinin ve ani kalp ölümü riskinin bir belirteci olarak kullanılır. IVR ayrıca beta blokerler, kalsiyum kanal blokerleri ve amiodaron dahil olmak üzere çeşitli ilaçlarla tedavi edilir.
IVR’nin tarihi, bilimsel keşif ve ilerlemenin hikayesidir. Araştırmacılar IVR’nin mekanizmaları, klinik sonuçları ve tedavisine ilişkin anlayışımızda önemli ilerlemeler kaydetti. Bu araştırma, bu aritmisi olan hastalar için daha iyi sonuçlara yol açmıştır.
Kaynak:
- Chou, T. (2016). Electrocardiography in Clinical Practice: Adult and Pediatric. Saunders.
- Zipes, D. P., Jalife, J., & Stevenson, W. G. (2018). Cardiac Electrophysiology: From Cell to Bedside. Elsevier Health Sciences.
- Goldberger, A. L. (2012). Clinical Electrocardiography: A Simplified Approach. Elsevier Health Sciences.
- Alzand, B. S. N., & Crijns, H. J. G. M. (2011). Diagnostic criteria of broad QRS complex tachycardia: decades of evolution. Europace, 13(4), 465–472.
- Josephson, M. E. (2008). Clinical Cardiac Electrophysiology: Techniques and Interpretations. Lippincott Williams & Wilkins.
- Waldo, A. L., & Camm, A. J. (2011). Atrial Fibrillation Therapy. CRC Press.
- Antman, E. M., & Josephson, M. E. (2002). ST-segment elevation myocardial infarction: Pathology, pathophysiology, and clinical features. In Braunwald’s Heart Disease: A Textbook of Cardiovascular Medicine (pp. 1141-1161). Saunders.
- Kusumoto, F. M., Schoenfeld, M. H., Barrett, C., Edgerton, J. R., Ellenbogen, K. A., Gold, M. R., … & Slotwiner, D. J. (2018). 2018 ACC/AHA/HRS guideline on the evaluation and management of patients with bradycardia and cardiac conduction delay. Circulation, 140(8), e382-e482.
- Goldberger, A. L. (2012). Clinical Electrocardiography: A Simplified Approach. Elsevier Health Sciences.
- Mangrum, J. M., & DiMarco, J. P. (2000). The evaluation and management of bradycardia. New England Journal of Medicine, 342(10), 703-709.
- Brignole, M., Auricchio, A., Baron-Esquivias, G., Bordachar, P., Boriani, G., Breithardt, O. A., … & Deharo, J. C. (2013). 2013 ESC Guidelines on cardiac pacing and cardiac resynchronization therapy. European heart journal, 34(29), 2281-2329.
- Moya, A., Sutton, R., Ammirati, F., Blanc, J. J., Brignole, M., Dahm, J. B., … & Gajek, J. (2009). Guidelines for the diagnosis and management of syncope (version 2009). European heart journal, 30(21), 2631-2671.