Sinonim: fourth ventricle, ventriculus quartus cerebri, 4.(vierte) Hirnventrikel.
- Dördüncü beyin karıncığı anlamına gelir. (bkz: Ventrik-ulus ) (bkz: kuartus ) (bkz: serebri)
- Rombensefalonda yer alır.
- Alt tarafı, fossa romboideya’yı oluşturur.

Tıp terimleri sözlüğü
Sinonim: Neurology, Neurologie.
1680’de bu isim ilk defa kullanıldığında, ‘Sinir sisteminin şekil ve fonksiyonunun bilimsel olarak incelenmesi’, Modern Yunancada ve Latincedeki neurologia kelimesine dayanmıştır.
Sinonim: fourth ventricle, ventriculus quartus cerebri, 4.(vierte) Hirnventrikel.

Sinonim: subarachnoid space (subarachnoid cavity), Subarachnoidalraum,Subarachnoidealraum, Spatium subarachnoideum, Cavitas subarachnoidea, Cavum subarachnoideale, Cavum hyparachnoidicum, Cavum leptomeningicum

Beyin zarında araknoid zarının altında piya zarı ile oluşturduğu boşluktur. (bkz: Sub–arakn–oid–al )
Sinonim: Kalkarin oluk, Sulcus calcarinus, calcarine sulcus, calcarine fissure

Sulcus calcarinus, beynin medyan sagital bölümünde makroskopik olarak görülebilir. Parietooksipital sulkus ile birlikte sınırladığı lingual gyrus ve cuneus arasında anatomik bir sınır yapısı olarak çalışır. Medial oksipital arterin ramus kalkarinusu içinde seyir eder.

Sulcus calcarinus’u çevreleyen korteks alanları, öncelikle görsel kortekse (V1), Brodmann bölgesi 17’ye, makroskopik ve histolojik olarak çarpıcı Gennari şeridine (Vicq-d’Azyr şeridi) aittir.

1800’lerin son çeyreği, nörolojinin henüz yeni bir disiplin olarak şekillendiği bir dönemdi. Mikroskobik patoloji hızla ilerliyor, klinik semptomlarla beyindeki lezyonların topografik olarak eşleştirilebileceği düşüncesi güç kazanıyordu.
Bu ortamda, bazı akut nörolojik tabloların hem ani hem de ölümcül olabileceği, hem de beyin lezyonlarının simetrik ve özgül bölgeleri tutabileceği dikkat çekiyordu.
Carl Wernicke (1848–1905), dönemin genç ama keskin gözlem yeteneğiyle tanınan bir Alman nörologdu. Aslında daha önce de 1874’te Wernicke afazisini tanımlayarak adını duyurmuştu.
1880’lerin başında, Breslau’da (bugünkü Wrocław, Polonya) nörolojik vakaları hem klinik hem de patolojik olarak inceleyen bir sistem kurmuştu.
1881’de yayımladığı raporda üç ayrı hastayı tanımladı. Hepsinde göz hareketlerinde felç, yürüme ataksisi ve zihinsel bulanıklık birlikteydi.
Wernicke, ölüm sonrası beyinleri dikkatle inceledi.
Wernicke, bu üç vakanın ortak semptomlarını bir sendrom olarak tanımladı. Fakat o dönemde tiamin eksikliği kavramı bilinmediği için, nedenini “merkezi sinir sisteminde spesifik inflamasyon” olarak yorumladı.
Sergei Sergeievich Korsakoff (1854–1900), Moskova’da çalışan bir Rus psikiyatristti. Özellikle alkolizme bağlı ruhsal ve nörolojik bozukluklar üzerinde çalışıyordu.
1887–1891 arasında yayımladığı makalelerde, alkolik hastalarda gözlenen belirgin hafıza kaybı ve sıklıkla eşlik eden periferik nörit arasındaki ilişkiye dikkat çekti.
İlginç şekilde, ne Wernicke ne de Korsakoff iki tablonun tek bir hastalık sürecinin farklı evreleri olduğunu fark etmedi.
Ancak patolojik düzeyde bu birliktelik çok daha sonra netleşti; özellikle 20. yüzyıl ortalarında, otopsi serilerinde hem ventrikül çevresi hem de medial talamus lezyonlarının aynı hastada görüldüğü kanıtlandı.
Wernicke ve Korsakoff, kendi adlarını taşıyan sendromun farklı uçlarını tanımlamış ama ortak patofizyolojik zinciri görememişti.
Bu durum, 19. yüzyılın bilim ortamında klinik gözlemlerin patofizyolojik yorumdan daha hızlı ilerlediğini gösterir.
Klinik olarak gözlemlenen “göz felci + ataksi + konfüzyon” ile “şiddetli amnezi” tablosu, ancak yıllar sonra tek bir beslenme faktörünün eksikliği ile açıklanabildi.
İç kapsül. (bkz: capsula) (bkz: interna)
İç kapsül beş parçadan oluşur. Bunlar iç kapsül 1,2’nin ön uzuv, genu, arka uzuv, retrolentiform ve sublentiform parçalarıdır:
Sinonim: Gli-, Gliyo-, Gliya hücreleri, Glial cells, neuroglia, glia, Gliazelle.
Kaynak: http://test.classconnection.s3.amazonaws.com/127/flashcards/373127/jpg/glial_cells.jpg

Kaynak: http://cdn.differencebetween.net/wp-content/uploads/2014/06/glioma_combined_bmc_1008-285×300.jpg
Astrositler, merkezi sinir sisteminin (MSS) en önemli glia hücre tiplerinden biri olup, hem gelişimsel hem de işlevsel düzeyde nöronlarla ayrılmaz bir bütünlük içindedir. Nöral ağları “taşıyan” pasif destek hücreleri olmaktan ziyade, güncel nörobilim anlayışında bilgi işlenmesine aktif katılan, metabolik, iyonik ve sinaptik mikroçevreyi ince ayarla düzenleyen dinamik hücreler olarak kabul edilirler.
“Astrosit” terimi, Yunanca “astron” (ἄστρον, yıldız) ve “kytos/sitos” (κύτος, hücre, boşluk) sözcüklerinden türetilmiştir; kelime anlamı itibarıyla “yıldız hücre” veya “yıldız biçimli hücre” anlamına gelir. Bu adlandırma, hücre gövdesinden çok sayıda, farklı yönlere uzanan ince ve kalın uzantıların (processus) çıkması sonucu ortaya çıkan tipik yıldızsı morfolojik görünümü yansıtır.
Astrositler, sinir sistemindeki glia hücrelerinin bir alt grubunu oluşturur. Glia, nöronların aksine aksiyon potansiyeli iletimi için özelleşmemiştir, ancak nöral devrelerin yapısal, metabolik ve işlevsel bütünlüğü için vazgeçilmezdir. Astrositler, oligodendrositler, mikroglia ve ependim hücreleri ile birlikte MSS glia spektrumu içinde yer alır.
Önemli bir terminolojik karışıklığa da işaret etmek gerekir: “yıldız hücre” ifadesi karaciğerdeki Kupffer hücreleri veya perisinüzoidal “hepatic stellate cells” ile karıştırılabilmektedir. Kupffer hücreleri, retiküloendotelyal sistemin parçası olan, mononükleer fagosit serisine ait makrofajlardır; embriyolojik kökenleri, fonksiyonları ve doku dağılımları astrositlerden tamamen farklıdır. Astrositler, nöral tüp kökenli glial hücrelerdir ve yalnızca MSS’de bulunurlar.
gibi çok daha kompleks işlevleri ortaya çıkarılmıştır. Böylece astrositler, pasif destek hücresi değil, nöral ağın aktif, sinyal işleyen ve bütünlüğünü sağlayan bir bileşeni olarak yeniden konumlandırılmıştır.
Embriyolojik olarak astrositler, nöronlar gibi nöral tüpün radyal glia hücrelerinden türemektedir. Radyal glia, gelişim sırasında hem nöronların hem de olgun glia tiplerinin öncülü olarak görev yapar; nöronal göç için “iskelet” rolü üstlenir ve daha sonra önemli bir kısmı olgun astrositlere farklılaşır.
Evrimsel açıdan bakıldığında:
Böylece astrositler, hem gelişimsel açıdan nöronal ağların şekillenmesine katılan, hem de evrimsel süreçte bilişsel kapasitenin artışıyla birlikte morfolojik ve fonksiyonel yönden özelleşmiş hücreler olarak değerlendirilebilir.
Astrositler genellikle 10–20 µm çapında nispeten küçük bir hücre gövdesine (soma, perikaryon) sahiptir. Bu gövdeden çok sayıda sitoplazmik uzantı (processus astrocytici) çıkar.
Bu uzantılar, komşu nöronların soma ve dendrit yüzeylerini, sinapsları ve özellikle kapiller damarların duvarlarını sararak, karmaşık bir mikro-anatomik ağ oluşturur.
Astrositlerin uzantıları, MSS’nin belirli yüzeylerinde yoğunlaşarak özel glial sınır zarları (membranae limitantes gliae) oluşturur:
Bu yapılar, beyin parankimini mekanik travmaya, dış mikroçevre değişikliklerine ve kontrolsüz sıvı geçişine karşı koruyan bir “glial zarf” gibi düşünülebilir.
Astrositler, birbirleriyle ve kısmen diğer glial hücrelerle özel hücresel bağlantılar aracılığıyla elektriksel ve mekanik bağlanma gösterirler:
Astrosit sitoplazmasında, özellikle intermediate filamentlerce zengin bir iskelet sistemi bulunur:
Bu filamentler, hücre iskeletinin stabilitesini sağlar, hücre uzantılarının şekillenmesinde rol oynar ve glial hücrelerin mekanik strese dayanıklılığını arttırır.
MSS’de astrositler, özellikle morfoloji ve lokalizasyona göre birkaç ana tipte incelenir:
Ayrıca, belirli beyin bölgelerinde özel astrosit benzeri glial alt tipler tanımlanmıştır:
Bu alt tipler, morfolojik olarak astrositlerle akraba olup, bölgeye özgü fonksiyonlar üstlenirler.
Astrositler, belirli protein ve taşıyıcıların ekspresyonu ile nöronlardan ve diğer glialardan ayırt edilebilir:
Bu moleküler donanım, astrositlerin hem iyonik hem metabolik hem de sinaptik düzeyde çok yönlü bir regülasyon kapasitesine sahip olmasını mümkün kılar.
Astrositler, MSS’de nöronlar için bir tür “iskele” ve tampon ortam sağlar:
Özellikle astroglia-nöron laktat şantı (astrocyte–neuron lactate shuttle) kavramına göre, astrositler glikozu alıp glikolizle laktata dönüştürür; laktat daha sonra nöronlara taşınarak oksidatif fosforilasyonda kullanılabilir. Böylece astrositler, nöronların enerji metabolizmasında dolaylı ama kritik bir ara halka görevi görür.
Astrosit uzantılarının kapiller duvarlarını sarması sonucu oluşan perivasküler endfeet yapıları, KBB’nin glial bileşenini oluşturur. KBB, üç ana yapı bileşeniyle işlev görür:
Astrositler:
Böylece astrositler, “nöronal aktivite – enerji gereksinimi – kan akımı” üçgeninde aktif bir çevirmen olarak işlev görür.
Nöronal aktivite sırasında aksiyon potansiyelleri ve postsinaptik potansiyellerle birlikte ekstrasellüler alana önemli miktarda K⁺ iyonu salınır. Bu iyonların birikmesi, membran potansiyellerinin bozulmasına ve aşırı uyarılabilirliğe yol açabilir. Astrositler:
Ayrıca aquaporin-4 üzerinden su geçişini düzenleyerek beyin dokusunun hacim homeostazına da katkı sağlarlar. Nöronal aktivitenin arttığı bölgelerde oluşan ozmotik değişiklikler, astrositlerin büzüşmesi veya şişmesi ile dengelenebilir. İn vitro çalışmalar, nöral aktivitedeki değişimlere bağlı olarak astrosit soma ve süreçlerinde hacim değişiklikleri (şişme-büzüşme) olduğunu göstermiş; bu biçimsel adaptasyon bazı yazarlar tarafından “infotropizm” olarak adlandırılmıştır.
Astrositler, sinaptik iletimin sonlanmasında ve yeniden şekillenmesinde kritik rol oynar:
Bununla birlikte astrositler, kendi başlarına da sinaptik çevreye sinyal molekülleri salabilir; bu süreç gliotransmisyon olarak adlandırılır:
Özellikle D-serin, birçok glutamaterjik sinapsta N-metil-D-aspartat (NMDA) reseptörlerinin koagonisti olarak görev yapar. Bazı sinaptik bağlantılarda, NMDA reseptörünün etkinleşebilmesi için hem glutamat hem de D-serin gereklidir; D-serin’in önemli bir kısmı astrosit kaynaklıdır. Bu mekanizma, sinaptik plastisite (örneğin uzun süreli potansiyasyon, LTP) süreçlerinde astrositlerin doğrudan rol almasına zemin hazırlar.
Astrosit uzantıları, sinaptik kontakların çevresini neredeyse tamamen sarabilir. Böylece:
Bu bağlamda sinaps artık sadece “presinaptik nöron – postsinaptik nöron” ikilisinden oluşan ikili bir yapı değil, astrosit sürecinin de aktif katıldığı üçlü bir yapı, yani “tripartit sinaps” olarak tasvir edilir. Astrositler, tripartit sinapsta hem “okuyucu” hem “yazıcı” rol üstlenir: nöronal aktiviteyi algılar, buna göre Ca²⁺ sinyalleri üretir ve ardından nöromodülatörler salarak sinaptik iletimi ve plastisiteyi şekillendirir.
Beyinde kolesterol sentezi büyük ölçüde glial hücrelerde, özellikle astrositlerde gerçekleşir. Astrositler:
Kolesterol ve lipid temini, sinaptik membranların yenilenmesi, reseptör ve kanal kümelenmesi, sinaptogenez ve sinaptik stabilite için gereklidir. Ayrıca astrositler, nöronlara BDNF (Brain-Derived Neurotrophic Factor) ve GDNF (Glial cell line-Derived Neurotrophic Factor) gibi trofik faktörler sağlayarak sinaps oluşumunu, bakımını ve nöronal sağkalımı destekler.
Astrositler, çevrelerindeki nöral aktiviteyi “okuyan” ve bu aktiviteye bağlı olarak biçimsel ve fonksiyonel özelliklerini uyarlayan hücrelerdir. Deneysel çalışmalar:
Bu aktiviteye bağlı morfolojik yönelim ve süreç oluşumu, literatürde bazı yazarlar tarafından “infotropizm” olarak adlandırılmaktadır. Bu kavram, astrositlerin yalnızca pasif bir ortam değil, nöral aktivite desenlerini “takip eden” ve onlara göre yeniden şekillenen dinamik bir hücresel ağ olduğunu vurgular.
Beynin belirli bölgelerindeki astrositler, özellikle erişkin nörogenezin sürdüğü alanlarda (örneğin subventriküler bölge, dentat girus) kök hücre veya progenitör hücre özellikleri gösterebilir. Bu astrosit benzeri kök hücreler:
Deneysel olarak, örneğin Neurogenin-2 (Ngn2) gibi nörogenezi yönlendiren transkripsiyon faktörleri kültürdeki astrositlere aktarıldığında, bu hücrelerin kısa süre içinde nöron benzeri morfoloji kazandıkları ve fonksiyonel sinapslar oluşturabildikleri gösterilmiştir. Bu bulgular, astrositlerin belirli koşullarda “yeniden programlanabilir” ve nöronal fenotipe yönlendirilebilir hücreler olduğunu düşündürmektedir.
MSS’de çeşitli patolojik süreçler (iskemi, travma, enfeksiyon, inflamasyon, demiyelinizasyon, nörodejeneratif hastalıklar) karşısında astrositler reaktif bir fenotipe geçebilir. Bu süreç astrogliyoz (astrogliozis) olarak adlandırılır ve şu özelliklerle karakterizedir:
Astrogliyoz, başlangıçta doku bütünlüğünü koruyucu, zararlı molekülleri sınırlayıcı, ödemi azaltıcı, metabolik tamponlayıcı bir yanıt olarak değerlendirilebilir. Ancak kronik veya aşırı astrogliyoz, sinaptik bağlantıların ve aksonal büyümenin engellenmesine, “glial skar” oluşumuna ve fonksiyonel iyileşmenin kısıtlanmasına yol açabilir. Bu nedenle astrogliyoz, hem koruyucu hem de potansiyel olarak zararlı ikili bir fenomendir.
Reaktif astrositlerin bir alt formu olan gemistositik astrositler, eozinofilik ve geniş bir sitoplazmaya, belirgin bir çekirdeğe sahip, şişmiş görünümlü hücrelerdir. Bu hücreler:
Histolojik olarak astrositlerden türediği düşünülen beyin tümörlerinin genel adı astrositomdur. Dünya Sağlık Örgütü (WHO) sınıflamasına göre:
gibi alt gruplar tanımlanır.
Bu tümörlerde GFAP pozitifliği, immünohistokimyasal tanıda önemli bir ipucu sağlar; tümör hücrelerinde glial filament varlığını gösterir. Ancak tümörün malignite derecesini belirlemede ek moleküler marker’ler, genetik değişiklikler ve histolojik kriterler de kullanılır.
Multipl skleroz ve diğer demiyelinizan hastalıklarda, myelin kaybına yanıt olarak astrositler reaktif hâle gelir. Bu bölgelerde:
gibi patolojik bulgular gözlenebilir. Bu glial yanıt, başlangıçta miyelin artıkları ve inflamatuvar medyatörlerin sınırlandırılmasına yardımcı olurken, kronikleştiğinde aksonal rejenerasyon ve remiyelinizasyonu zorlaştırabilir.
Astrosit fonksiyon bozukluğu, çeşitli nörolojik ve psikiyatrik hastalıklarla ilişkilendirilmiştir:
Bu örnekler, astrositlerin klinikte yalnızca “arka plandaki hücreler” değil, hastalık seyrini belirgin ölçüde etkileyebilen aktif aktörler olduğunu gösterir.
Astrositlerin sitoplazmasında yer alan GFAP, nöropatolojide yaygın olarak kullanılan bir tümör ve hasar marker’ıdır:
Gemistositik astrositler, demiyelinizan veya neoplastik süreçlerde GFAP açısından zengin, eozinofilik sitoplazmalı hücreler olarak histolojik kesitlerde dikkat çeker ve patoloğa, altta yatan sürecin doğası hakkında bilgi verir.
Bu yıllar, sinir dokusunun karmaşık bir orkestra olduğunu sezen ama henüz enstrümanları ayırt edemeyen bir dönemin başlangıcıydı.
Terminolojik temel, 1856’da Rudolf Virchow’un “neuroglia” kavramını ortaya koymasıyla atıldı. Virchow, gliaları nöronları “bir arada tutan bağlayıcı madde” olarak tanımlamıştı. Bu, elbette hatalı bir indirgemeydi; fakat glianın ayrı bir hücre sınıfı olarak kabul edilmesini sağladı.
Aynı dönemde, Albert von Kölliker ve diğer histologlar glia ve nöron ayrımını anatomik düzeyde güçlendirdiler. yine de glia, uzun süre “sinir sisteminin çimentosu” gibi pasif bir destek yapı olarak yorumlanacaktı.
Astrositlerin yıldız şeklindeki morfolojisinin fark edilmesini sağlayan asıl kırılma, 1870’lerden itibaren yeni boyama yöntemlerinin geliştirilmesiyle yaşandı. Buna rağmen, glial hücrelerin ayrıntılı görünümü hâlâ tam olarak seçilemiyordu.
Bu dönemde Otto von Bütschli, Rudolf Heidenhain ve diğerleri hücrelerin protoplazmik yapılarıyla ilgili çalışmalar yaparken, astrositlerin uzantıları hâlâ mikroskop camı altında bulanık bir sis perdesi gibiydi.
Bilim dünyası, yıldızların varlığını biliyor ama henüz ışıklarını tam seçemiyordu.
Astrositlerin keşfi, sinir biliminin iki devi olan Camillo Golgi ve Santiago Ramón y Cajal arasındaki ünlü rekabetle iç içe geçmiştir.
Camillo Golgi, 1873’te geliştirdiği gümüş nitrat bazlı boyama sayesinde nöronların tüm morfolojisini ortaya koymuştu. Fakat yöntem, nöronları olağanüstü ayrıntıyla gösterirken gliaları ancak sınırlı biçimde görünür kılıyordu. Yine de, yıldız biçimli glial hücrelere dair ilk net görüntüler bu dönemde elde edildi.
Santiago Ramón y Cajal, Golgi metodunu geliştirerek ve modifiye ederek astrositleri daha iyi seçebilir duruma geldi. Cajal, glia hücrelerinin nöral ağla yakın temasını, damarları saran uç ayakçıklarını ve sinapslar arasındaki konumlarını dikkatle tasvir etti.
Ona göre glia, pasif bir dolgu maddesi değil, “nöronal iletişimin sessiz ortakları”ydı. Astrositlerin yıldız biçimli yapısı Cajal’ın çizimlerinde ilk kez etkileyici bir netlikle ortaya çıktı.
Bu çizimler, astrositlerin bilim tarihinde ilk kez kendi kimliğiyle sahneye çıkışını temsil eder.
Astrositler elektriksel aktivite göstermediği için uzun süre nörofizyolojinin dışında bırakıldı. Bu dönemde yalnızca patoloji alanında –özellikle tümörlerin sınıflandırılmasında– glial yapılar üzerine çalışmalar yoğunlaştı.
Glia yeniden arka koltuğa itilmiş, sahnedeki ışık tamamen nöronlara çevrilmişti.
Elektron mikroskopisinin keşfi, sinir dokusunun mimarisini benzeri görülmemiş bir ayrıntıyla görünür kıldı.
Araştırmacılar, astrositlerin:
ilk kez ultrastrüktürel düzeyde inceleyebildi.
1950’lerin sonunda, astrositlerin sinaptik ortamı düzenlediği ve iyon dengesine katkı verdiği görülmüş; fakat bu süreçlerin davranış ve biliş üzerindeki etkileri henüz anlaşılamamıştı.
Astrositlerin yeniden görünür olmasıyla, sahne arkasının mimarları gibi çalıştıkları fark edilmeye başlamıştı.
1970’lerde glial fibrillary acidic protein (GFAP) adlı ara filament proteini tanımlandığında, astrositler ilk kez özgün bir moleküler imzaya sahip olmuş oldular.
GFAP immünboyamaları, nöropatologlara şu kapıları açtı:
Bu dönem, astrositlerin patolojideki öneminin ortaya koyulduğu bir dönemdi. Fakat asıl devrim henüz gelmemişti.
1990’lardan itibaren kalsiyum görüntüleme tekniklerinin gelişmesiyle birlikte, astrositlerin elektriksel değil ama kalsiyuma dayalı sinyal dalgaları aracılığıyla kendi iletişim ağlarına sahip olduğu anlaşıldı.
Bu keşif, bilim dünyasında paradigmayı kökten değiştirdi:
“Gliotransmisyon” kavramı doğdu.
“Tripartit sinaps” modeli ortaya atıldı.
Artık sinaps, yalnızca iki nöronun değil, aynı zamanda bir astrosit sürecinin de dahil olduğu üçlü bir etkileşim merkezi olarak tasvir ediliyordu.
Bu, astrositlerin modern sinir biliminin merkezine doğru hızla yükselişini simgeliyordu.
Son on yılın araştırmaları, astrositlerle ilgili daha da çarpıcı bulgular ortaya çıkardı:
İnsan korteksindeki protoplazmik astrositler, birçok memeli türüne kıyasla çok daha fazla dallanma ve daha büyük “domain” alanı sergiler. Bu yapı, daha fazla sinapsı düzenleyebileceği anlamına gelir.
Deneysel çalışmalarda, insan kaynaklı astrosit progenitörlerinin fare beynine yerleştirilmesiyle hayvanların öğrenme ve bellek performansında artış gözlenmiştir. Bu bulgu, insan bilişinin yalnızca nöronal özelliklere değil, glial karmaşıklığa da bağlı olabileceğini düşündürür.
Astrositler, beyin kan akımının nöral aktiviteye göre ayarlanmasında kilit oyuncu olarak görülmekte; bu mekanizmanın bozulması migren, Alzheimer, inme ve demans gibi hastalıklarla ilişkilendirilmektedir.
Son yıllarda fibroblastlardan ve hatta olgun astrositlerden nöron elde etmeye yönelik çeşitli yöntemler geliştirildi.
Nörojenin-2 gibi faktörlerin astrositlere aktarılması, bu hücrelerin nöronal fenotipe dönüşmesini sağlayabiliyor.
Tek hücreli RNA dizileme teknolojisi, astrositlerin sanıldığı gibi homojen olmadığını, bölgeye özgü birçok alt tipe ayrıldığını ortaya koydu.
Her alt tipin:
Bu bulgular, astrositlerin incelikli bir hücresel orkestrasyon içinde çalıştığını gösteriyor.
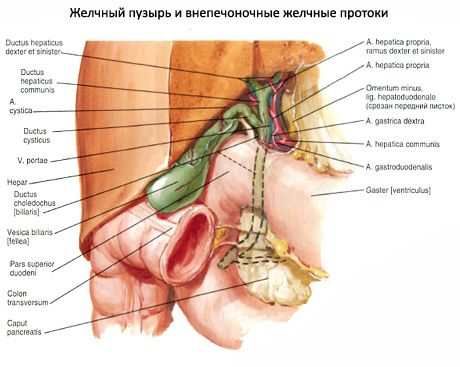

Safra kesesinin boynunda ve kistik kanalda, bir kapatma cihazı olarak hizmet eden ve safranın dışarı akmasını önleyen, pliksi spiralis (Heister valf) bir spiral mukoza zarı vardır.
Safra kesesi, kistik arter (Arteria cystica) tarafından arteryel olarak beslenir. Bu Arteria hepatica propria‘dan Ramus dexter’dan geliyor. Aynı isimdeki damarlar hepatoduodenal ligamentte portal ven içine akar.

Safra kanalları ve safra kesesi, çölyak pleksusundan beslenen hepatik pleksus tarafından vejetatif olarak innerve edilir. Safra kesesi kaslarının hormonal olarak kasılması ve oklüzyon aparatının gevşemesi, safra kesesi veya safra yollarının otonom uyarımı ile arttırılır. Hepatik pleksus ayrıca afferent ağrı lifleri içerir. Ek olarak, servikal pleksustan sağ frenik sinirdeki safra kesesinin üzerindeki peritondan daha fazla ağrı referansı vardır. Safra kesesi bölgesindeki ağrının da sağ omuza (dermatom C4) çıkmasının nedeni de budur.

Karaciğerde oluşan safra, ortak hepatik kanal ve ortak safra kanalı yoluyla duodenuma ulaşır. Kavşak sfinkter ampullae hepatopankreatik kas tarafından kapatılırsa, safra bağırsağa akamaz ve kistik kanal yoluyla safra kesesine yönlendirilir ve orada saklanır. Safra kesesi, duvar kaslarının kasılması ile boşaltılır. Kasılma, bağırsak duvarının endokrin hücreleri tarafından üretilen kolesistinin hormonu (CKK) ve vagus sinirin parasempatik liflerinden asetilkolin tarafından uyarılır.
Safra kesesinin en yaygın hastalığı safra taşı hastalığıdır (kolelitiazis). Kolesterol metabolizmasındaki bir bozukluktan kaynaklanır ve yetişkinlerin yaklaşık% 15’inde görülür. Safra taşları safra kolikine neden olabilir.
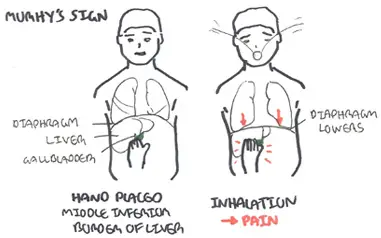
Safra kesesi büyütüldüğünde palpe edilebilir. Karaciğerin kenarının altında, klaviküler çizginin medialinde bulunur ve nefese bağlı olarak sağ kosta kemerinin altından ortaya çıkar.
Öğünlerden sonra (postprandiyel) çıkan üst karın ağrısı genellikle safra kesesi ile ilişkilidir.
Safra kesesi sorunlarının ultrasonla teşhis edilmesi, safra kesesinin durumunu doğru bir şekilde değerlendirmek için çeşitli araç ve teknikleri içerir. Ultrason, noninvazif yapısı, iyonize radyasyon içermemesi ve safra yapılarının görüntülenmesindeki etkinliği nedeniyle safra kesesi hastalıklarında tercih edilen bir tanı yöntemidir. Safra kesesi ultrasonunda kullanılan temel hususlar ve araçlar şunlardır:
Bilirubin (Toplam ve Direkt):
Bilirubin terimi “safra” ve Latince “kırmızı” anlamına gelen “ruber” kelimesinden türemiştir. 19. yüzyılda safra ve sarılık serumunda bir pigment olarak keşfedilmiştir.
Yüksek bilirubin seviyeleri safra kesesi veya kolestaz veya safra kanalı tıkanıklığı gibi karaciğer sorunlarını gösterebilir. Bilirubin, hem’in parçalanma ürünüdür ve kırmızı kan hücrelerinin aşırı parçalanması, karaciğer hasarı veya safra kanalının tıkanması durumunda kandaki seviyeleri artar.
Alkalen Fosfataz (ALP):
20. yüzyılın başlarında tanımlanan alkalin fosfataz, alkalin optimum pH’ı ve fosfat gruplarının moleküllerden uzaklaştırılmasını katalize etme yeteneği nedeniyle bu şekilde adlandırılmıştır.
ALP çeşitli dokularda bulunan, karaciğerde, safra kanallarında ve kemikte yüksek konsantrasyonlarda bulunan bir enzimdir. Yüksek seviyeler safra kanalı tıkanıklığını veya karaciğer hasarını gösterebilir.
Alanin Aminotransferaz (ALT) ve Aspartat Aminotransferaz (AST):
ALT ve AST, transaminazlar olarak bilinen enzimlerdir. 20. yüzyılda keşfedilen bu enzimler amino asit metabolizmasını kolaylaştırır.
Bunlar tipik olarak karaciğerde bulunan enzimlerdir. Yüksek seviyeler karaciğer hasarını veya iltihabı gösterebilir.
Gama-Glutamil Transferaz (GGT):
20. yüzyılın ortalarında keşfedilen GGT, amino asitlerin aktarımında ve peptit metabolizmasında rol oynayan bir enzimdir.
Bu enzim özellikle karaciğer ve safra kanalı fonksiyonlarındaki değişikliklere duyarlıdır. Yüksek seviyeler karaciğer hastalığı, alkol tüketimi ve safra kanalı tıkanıklığı ile ilişkilidir.
Amilaz ve Lipaz:
Bu enzimler 19. yüzyılda keşfedilmiştir ve sırasıyla karbonhidratların ve yağların sindiriminde çok önemlidir.
Tipik olarak pankreas fonksiyonuyla ilişkili olan bu enzimler, safra yolu hastalıklarında da yükselebilir.
Tam Kan Sayımı (CBC):
Klinik Önemi: Safra kesesine özgü olmasa da, tam kan sayımı safra kesesi hastalığıyla ilişkili olabilecek enfeksiyon veya inflamasyonu gösterebilir.
C-Reaktif Protein (CRP):
Klinik Önemi: CRP vücuttaki inflamasyonun bir göstergesidir ve safra kesesi iltihabı durumunda yükselebilir.
Dönüştürücü Probu: En önemli araç, görüntü oluşturmak için ses dalgaları yayar ve yankıları alır. Safra kesesi görüntülemesi için genellikle 2-5 MHz frekans aralığına sahip eğrisel veya sektör dönüştürücü kullanılır.
Hasta Hazırlığı:
Açlık: Mide ve bağırsaklardaki gazı azaltmak ve safra kesesinin şişkinliğini sağlamak ve değerlendirmeyi kolaylaştırmak için hastaların genellikle muayeneden önce 6-8 saat aç kalmaları gerekir. Eğer hasta aç değillse üç katmanlı olması beklenir.
Standart Görünümler: Safra kesesini uzunlamasına ve enine kesitlerde görselleştirmek için sağ üst kadran görünümlerini içerir.
Pozisyonlandırma: Bağırsak gazını hareket ettirmek ve daha iyi görselleştirme sağlamak için hasta sıklıkla çeşitli pozisyonlarda (sırtüstü, sol lateral dekübit, dik) muayene edilir.
Valsalva Manevrası: Bazen safra taşlarının hareketliliğini değerlendirmek için kullanılır.
Bazı durumlarda, özellikle safra kesesi iskemisi veya vaskülit şüphesi olan vakalarda kan akışını değerlendirmek için kullanılır.
Kontrastı Arttırılmış Ultrason:
Bazı durumlarda lezyonların ve vasküler yapıların daha iyi görüntülenmesini sağlamak için kontrast maddeler kullanılabilir.

Yorum yazabilmek için oturum açmalısınız.