1) Arayışın sahnesi: Antikolinerjik fikrinin yükselişi (1940’ların sonu–1950’ler başı)
İkinci Dünya Savaşı sonrasında sinir sistemi farmakolojisi, “denge” kavramını merkeze alan hipotezlerle ivme kazanırken, striatal dopamin–asetilkolin ekseni Parkinsonizm için yeni bir kapı aralıyordu. Belladon alkaloidlerinin kaba ve geniş spektrumlu etkilerinden daha seçici, daha iyi tolere edilen, yapısal olarak “işlenebilir” analoglar arayan Avrupa endüstrisi, piperidin türevlerine ve bicyclic (norbornen) iskeletlere yöneldi. Klinik hedef açıktı: Tremor ve rijiditede belirgin rahatlama sağlayacak, merkezi sinir sistemine iyi penetrasyon gösteren, sentetik bir antimuskarinik. Bu entelektüel iklim içinde, Almanya’nın Ludwigshafen–Wiesbaden hattında Ar-Ge yapan Knoll AG’nin laboratuvarlarında, piperidin halkasını bicyclo[2.2.1]hepten çekirdeğiyle “kilitleyen” yeni bir amino-alkol sınıfı üzerinde yoğunlaşılmıştı.
2) Keşif ve isimler: Klavehn ve işbirlikçileri (1953 başvurusu; 1957 ABD patenti)
Dr. Wilfried (W.) Klavehn, Knoll AG adına yürüttüğü sentez programında, piperidin–propil zincirine fenil ve norbornen (bicyclo[2.2.1]hept-5-en-2-il) fragmanlarını stratejik olarak yerleştirerek bugün Biperiden diye bildiğimiz bileşiğe ulaştı. Mart 1953’te Almanya’da öncelik alan patent başvurusu yapıldı; izleyen yıllarda farklı ülkelerde aile patentleri açıldı ve 16 Nisan 1957 tarihli ABD patenti (US 2,789,110) verildi. Dönemin kimya literatüründe Klavehn ismine, biperiden kimyasının erken dönem atıflarında (örneğin kısa süre sonra yayımlanan Alman kaynak ve özetlerde H. Haas ile birlikte) rastlanır; bu da ürünün salt bir “tekil dahinin” değil, kurumsal bir sentez ekolünün ürünü olduğunu gösterir.
3) Markaya dönüşüm: Akineton® adıyla erken klinik yolculuk (1953–1959)
Knoll AG, keşiften kısa süre sonra ürünü Akineton® markasıyla ticarileştirme stratejisini benimsedi; 1950’lerin ortasında Avrupa’da sahaya verilen bu isim, sonraki on yıllarda birçok ülkede biperidenle özdeşleşti. Bu yıllar, triheksifenidil ve prokiklidin gibi diğer sentetik antikolinerjiklerle göğüs göğüse rekabetin yaşandığı, aynı zamanda klinik endikasyonların (Parkinsonizm ve ilaca bağlı akut distoni) ayıklanmaya başlandığı bir dönemdi.
4) Atlantik’in öte yakası: ABD’de ruhsat ve erken yayınlar (1959–1961)
Biperiden’in ABD’de tıbbi kullanıma onayı 1959 yılında kayda geçti; 1960–1961 arasında Washington ve Boston çevresinden çıkan klinik raporlar, Parkinsonizmde tremor ve kas tonusundaki iyileşmeleri, ayrıca akinetik–rijid tabloda orta şiddette bir etkiyi betimliyordu. Bu yayınlar, Akineton®’un sahadaki perfilini güçlendirdi ve “antikolinerjikler = özellikle tremor için iyi” eşlemesini nöroloji pratiğine yerleştirdi.
5) Levodopa çağı ve rol değişimi: Birincil aktörden “niş uzman”a (1970’ler–1990’lar)
1960’ların sonundan itibaren levodopa ve ardından dopamin agonistleri sahneye çıktığında, antikolinerjikler Parkinson tedavisinde başrolü devrettiler. Klinik akıl yürütme, biperidenin tremor baskın fenotipte hâlâ işe yaradığı, fakat bradikinezi/rijidite üzerindeki etkisinin sınırlı olduğu yönünde billurlaştı. Psikiyatri cephesinde ise, nöroleptiklere bağlı akut distoni ve akatizi ataklarında parenteral biperiden, acil servisin “pragmatik kurtarıcıları” arasına girdi; buna karşın tardif diskinezi için antikolinerjiklerin yarar sağlamadığı, hatta tabloyu kötüleştirebildiği anlaşıldı. Bu ayrım, sonraki kılavuzların diline de yerleşti.
Klinik pratiği şekillendiren iki eksen belirginleşti: (i) Uzatılmış salımlı (retard) tabletlerle gün içi dalgalanmaları yumuşatma ve (ii) parenteral (İM/İV) formlarla akut distoniyi hızlı söndürme. Erkenden “düşük dozla başla, yavaş titre et” heuristiği standartlaştı; yaşlı ve bilişsel rezervi düşük hastada ihtiyat, göz içi basınç–idrar retansiyonu gibi alanlarda dikkat, reçete yazımının ayrılmaz parçası oldu. Avrupa otoritelerinin özet ürün bilgilerindeki doz aralıkları ve titrasyon ilkeleri bu kültürü kodifiye etti.
7) Endikasyon mimarisi: Nelerin içinde, nelerin dışında?
Biperiden, Parkinson hastalığı ve ilaçla ilişkili ekstrapiramidal sendromlar (özellikle akut distoni, akatizi, ilaca bağlı parkinsonizm) içinde yer aldı; buna karşılık tardif diskinezi için önerilmedi. “Huzursuz bacaklar” (RLS) gibi tablolar, antikolinerjik mekanizmanın fizyolojiyle uyumsuzluğu nedeniyle biperiden alanının dışında kaldı; modern kılavuzlar RLS’de dopaminerjik agonistler, alfa-2-delta ligandı vb. yaklaşımları öne çıkarırken antikolinerjikleri sahadan uzak tuttu.
8) Güvenlilik ve toplum sağlığı tartışmaları: Antikolinerjik yük (2000’ler–günümüz)
Yaşlanan nüfusla birlikte antikolinerjik yük kavramı, geriatrik farmakoterapinin merkezî denetim noktalarından biri hâline geldi. Biperiden gibi tersiyer aminler, kognitif etkilenme, deliryum, düşme riski ve idrar retansiyonu üzerinden giderek daha dikkatli reçetelenir oldu. 2024–2025 döneminde yayımlanan klinik ve toplum eczanesi temelli çalışmalar, antikolinerjik yükün hafif bilişsel bozulma ve davranışsal-psikolojik semptomların şiddetiyle bağlantısına dair yeni veriler sundu; bu literatür, “en düşük etkili doz—en kısa süre” ve düzenli yeniden değerlendirme ilkelerini güçlendirdi.
9) Kılavuzların dili: Seçili kullanımdan hedefe odaklı reçeteye (2010’lar–2020’ler)
Nöroloji ve psikiyatri kılavuzları, biperidenin hedefe yönelik kullanımını benimsedi:
- Parkinsonizmde tremor baskın olgular ve dopaminerjik tedavilere ek “semptomatik” ihtiyaç.
- Antipsikotiklerin tetiklediği akut distoni ve akatizi için kısa süreli, hızlı müdahale.
- Tardif sendromlar ve kognitif kırılganlıkta kaçınma.
Bu dil, Almanya’daki 2023 DGN Parkinson kılavuz metinleri ile hareket bozuklukları alanındaki delil derlemelerinde açık biçimde izlenebilir.
10) Jeopolitik–regülatuvar dipnot: Pazarlama, varlık–yokluk
Biperiden birçok ülkede jenerik statüde bulunmayı sürdürse de, ABD pazarında 2010’ların sonu itibarıyla artık pazarlanmadığı notu çeşitli kaynaklara yansıdı; buna karşın Avrupa’da (örneğin Almanya, Avusturya, İrlanda) farklı ruhsat sahipleriyle Akineton® adı yaşamaya devam ediyor. Tarihsel çizgide 1959 ABD onayı ve 1950’ler Avrupa lansmanı gibi dönüm noktaları, bugün ülke-ülke farklılaşan erişilebilirlik tablolarına evrildi.
- İmalat ve saflık: Endo/ekzo oranı ve Grignard kademesi gibi sentez ayrıntıları, modern patent literatüründe verim–saflık optimizasyonu üzerinden işlenmeye devam ediyor.
- Klinik yerleştirme: 2020’ler literatürü, DIP (drug-induced parkinsonism) ve akut distoni için antikolinerjiklerin yeri–dozu–süresini delil tabanlı olarak yeniden çerçeveledi; TD (tardif diskinezi), NMS ve akatizi için ise net sınırlamalar getirildi.
- Geriatrik optimizasyon: Antikolinerjik yükü azaltma, reçete sadeleştirme ve depreskripsiyon algoritmaları; toplum eczanelerinde tarama–danışmanlık modelleri.
İsimler, tarihler ve kavşaklar: Kısa kronoloji
- 1953 (Almanya): W. Klavehn (Knoll AG) adına biperiden için öncelik alan patent başvurusu; Avrupa’da Akineton® markasıyla piyasaya çıkış süreci.
- 1957 (ABD): Biperiden kimyasıyla ilgili US 2,789,110 patenti (amino-alkollerin bicycloalkil sübstitüsyonlu serisi içinde).
- 1959 (ABD): Biperiden’in tıbbi kullanıma onayı; ardından 1960–61 yayınları klinik yerini pekiştirir.
- 1970’ler: Levodopa çağı; biperiden niş bir role çekilir, psikiyatrik acillerde akut distoni birincil hedef hâline gelir.
- 2000’ler–2020’ler: Antikolinerjik yük ve kognitif güvenlik araştırmaları; modern kılavuzlarda seçici ve kısa süreli kullanımı vurgulayan dil.
Klinik kültüre kazınan dersler (hikâyenin bugüne bıraktığı iz)
Biperiden’in yolu, bir kimyasal iskeletten bir klinik araca dönüşümün nasıl bilim, sanayi ve kılavuzların ortak diliyle yoğrulduğunu gösterir:
- Laboratuvarın molekül tasarımı (Klavehn–Knoll) → erken klinik coşku → levodopa sonrası yeniden konumlanma.
- Tremor ve akut distoni odağında hedefe isabet, fakat tardif diskinezi ve kognitif kırılganlık alanlarında bilinçli geri çekilme.
- 2020’lerin pratiğinde, antikolinerjik yükü düşünüp en düşük etkili doz/ en kısa süre mantığıyla, özellikle yaşlı ve polifarmasili hastada keskin bir farmakovijilans.







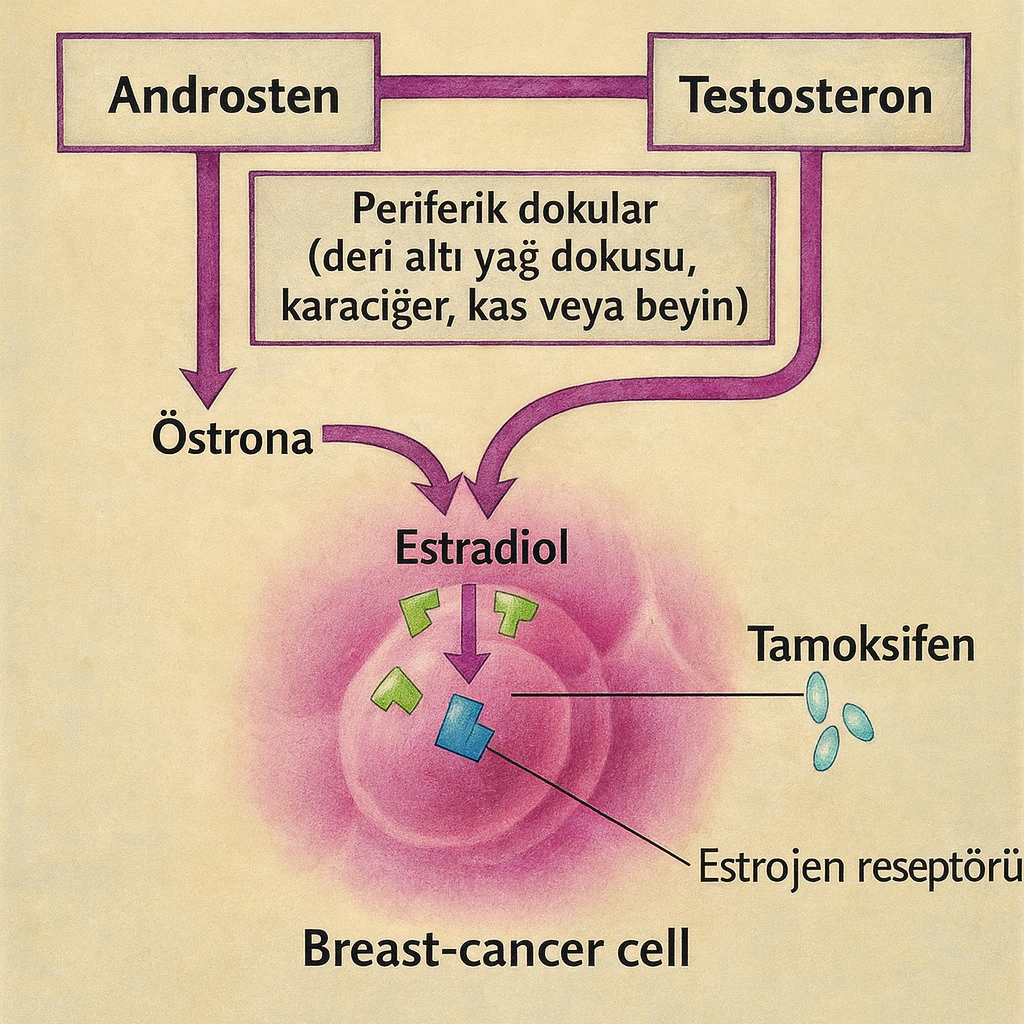

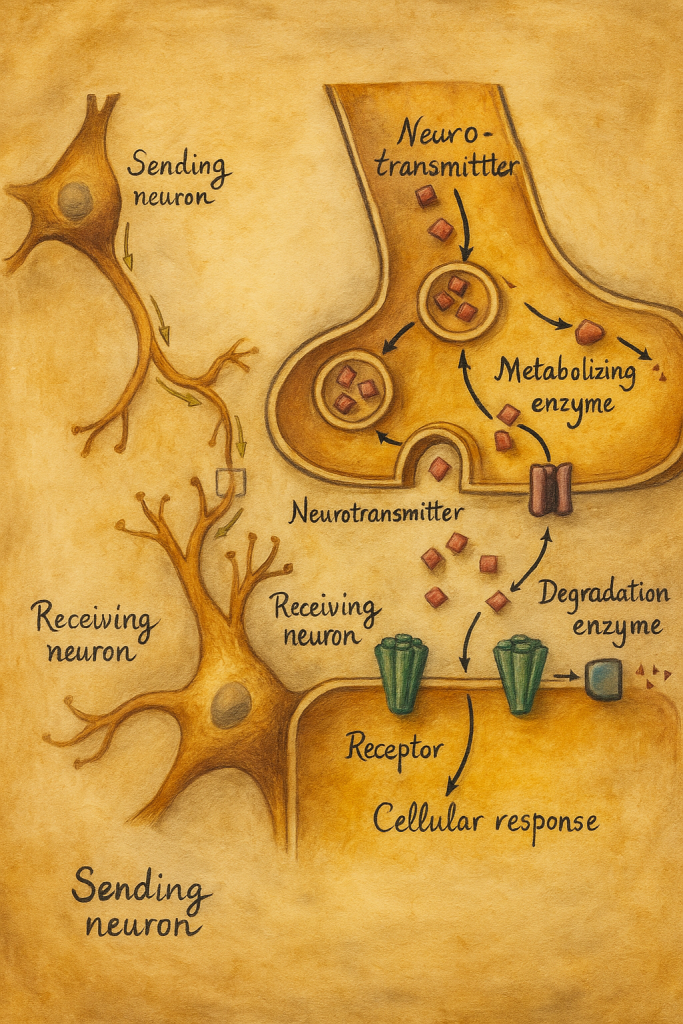








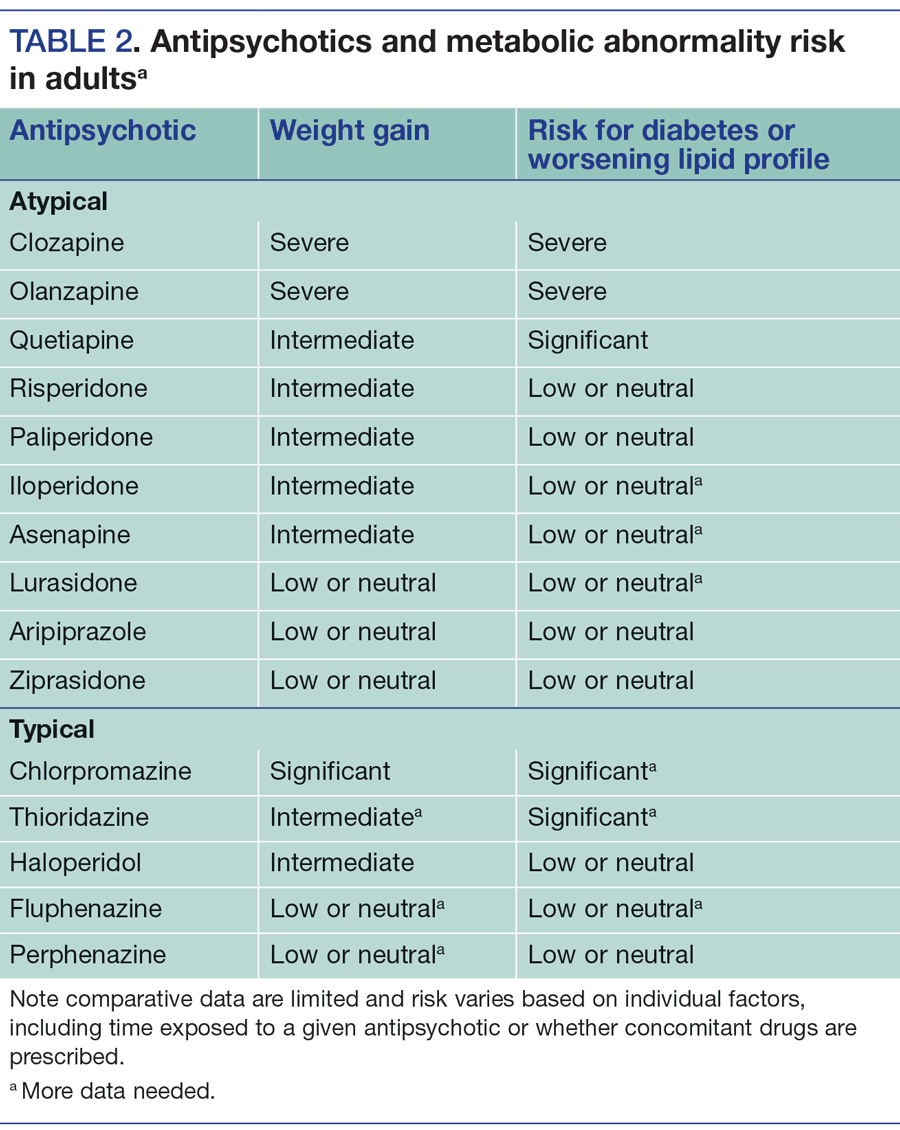







Yorum yazabilmek için oturum açmalısınız.